玉米雄性不育资源的发掘与利用
时子文,何青,赵卓凡,刘孝伟,张鹏,曹墨菊
综 述
玉米雄性不育资源的发掘与利用
时子文,何青,赵卓凡,刘孝伟,张鹏,曹墨菊
四川农业大学玉米研究所,农业农村部西南玉米生物学与遗传育种重点实验室/西南作物基因资源发掘与利用国家重点实验室,成都 611130
植物雄性不育是指植物雄性生殖器官不能产生正常有功能花粉的现象。玉米(L.)是重要的粮食作物之一,也是较早利用杂种优势的作物之一。当前,生产上广泛种植的玉米品种类型主要是单交种。我国玉米杂交种的播种面积常年稳定在6.2亿亩左右,年用种量10亿公斤以上,常年制种面积高达250多万亩。利用传统的人工去雄或机械去雄的制种方式进行杂交种子的生产,通常需要投入大量的人力、物力和财力。我国玉米制种基地具有明显的区域性,而玉米制种基地对劳动力的需求具有较强的季节性,当前伴随着大量农村劳动力的城市化转移,玉米制种基地出现了严重的用工慌,制种基地的租地费用和人工成本不断提高,使得种子生产成本不断升高。利用植物雄性不育系进行杂交种子的规模化生产,不仅能有效保证杂交种纯度,而且可以大大降低杂交种子的生产成本,同时还可避免极端天气条件下的人工去雄或机械去雄的田间操作困难等问题。因此利用雄性不育进行不育化制种是玉米种业发展的必然趋势。本文综述了我国玉米细胞质雄性不育以及包含光温敏雄性不育在内的细胞核雄性不育资源的发掘及创制进程、植物雄性不育资源从自然群体中获得到有目的性创制的发展过程及玉米雄性不育的研究进展,分析了玉米雄性不育的应用现状及存在的问题。基于我国玉米种业的发展趋势和雄性不育的研究及应用现状,提出了7个需要加强的方面,为玉米雄性不育的创制、研究和利用提供参考。
玉米;雄性不育;杂种优势;应用现状
植物雄性不育现象在自然界普遍存在。雄性不育对植物自身是一种不利性状,但因其可接受正常花粉受精结实,在杂种优势利用上具有重要的应用价值。利用雄性不育系进行杂交种子生产,不仅可以免去人工去雄,降低劳动成本,又能保证种子纯度。植物细胞质雄性不育(cytoplasmic male sterility, CMS)是研究花粉发育、细胞质遗传以及核质互作等的宝贵资源材料,利用其雄性不育、雌性可育的特性,作为一种遗传工具广泛应用于作物杂种优势利用和群体改良等。雄性不育长期以来一直是杂种优势利用的重要研究内容。
不同的雄性不育类型有着不同的败育表现,基于败育发生早晚的差异,雄性不育主要有几下几种表型:(1)雄蕊退化。这种类型几乎观察不到小穗、小花等,属于败育最早的一类;(2)无花粉粒形成的完全败育型。该类型花药瘦小干瘪,花药不开裂、不外露,花药内无花粉粒;(3)小孢子退化或花粉功能缺陷。这种类型花药近于正常,有时可外露,但内含败育的花粉,有时候花粉形态正常,也能染色,但正常条件下不能萌发;(4)花粉发育正常,雄花颖壳不开裂。这种类型花药形态正常,有花粉粒形成,可被碘化钾染色,花粉有活性,人工剥颖取粉,可完成正常的授粉结实过程。
雄穗退化通常受多种因素影响,既有遗传因素的作用,又受环境因素的影响,通常从表型上很难区分环境效应和遗传效应。对于花粉发育正常,而雄花颖壳不开裂,因其花粉粒具备正常授粉结实功能,并非严格意义上的雄性不育。因此,通常情况下的雄性不育并未包含雄穗退化和雄花闭颖突变。
玉米(L.)是最早成功利用CMS进行规模化杂交种子生产的作物。20世纪60年代末至70年代初,美国大面积推广利用玉米T型不育细胞质生产杂交种,并取得了巨大的经济和社会效益。但因大面积使用单一的T型不育胞质杂交种,致使玉米小斑病T小种爆发流行,给美国玉米生产带来巨大的经济损失。美国玉米不育化制种的应用,在短短的几年里从辉煌走向宁静。这一惨痛的教训为其他作物利用雄性不育进行规模化种子生产敲响了警钟。此后,关于CMS遗传多样性以及细胞核雄性不育(genic male sterility, GMS)的研究逐渐受到重视。
玉米GMS早期因为找不到完全保持系,因此只能从其杂交或姊妹交后代分离群体中获得不育株,GMS系的繁殖问题一直是制约其在不育化制种上应用的首要问题。随着分子生物学技术的不断发展和完善,以及人们对基因结构和功能认知的不断加深,利用遗传操作技术对种子进行荧光标记,对于正常可育及不育种子的区分变得简单易行。近几年随着种子生产技术(seed production technology, SPT)[1]、玉米多控不育技术(multi-control sterility, MCS)[2,3]以及显性核不育技术系统(dominant genic male-sterility system, DGMS)[4]的出现,玉米核不育的研究及应用重现曙光。
玉米是我国第一大作物,是确保国家粮食安全的重要支撑。我国不是玉米原产国,玉米种质资源相对匮乏。因此,加强优异种质资源的挖掘与鉴定,同时做好优异基因资源的利用与知识产权的保护,就显得尤为必要。本文总结了我国玉米雄性不育资源的发掘过程及创制方法以及玉米雄性不育的研究进展及应用现状,分析了玉米雄性不育在发掘、研究和利用过程中需要加强的方面,以期为玉米雄性不育的研究及应用提供参考。
1 玉米雄性不育资源的发掘及创制
1.1 玉米CMS资源的发掘及创制
玉米是世界上最早利用雄性不育性生产杂交种的作物之一。玉米CMS材料的发掘及创制为其在杂交制种中的应用奠定了基础。早期,玉米CMS来源于自然群体的天然雄性不育株,即从天然自交、杂交后代或者自然突变获得。1932年苏联科学家在苏联黄硬粒地方品种中发现了M型CMS材料,1937年在苏联又发现的另外一些CMS材料,后经美国农业部定名为USDA。1944年从美国得克萨斯州墨西哥的六月地方品种后代“金色六月”中也发现了T型CMS。美国是较早利用玉米T型CMS材料进行不育化制种的国家,20世纪40~60年代,美国大面积推广利用玉米T型不育胞质生产杂交种,并取得了巨大的经济和社会效益。但20世纪70年代因大面积使用单一的T型不育胞质杂交种,致使玉米小斑病T小种爆发流行,给美国玉米生产带来巨大的经济损失。此后,对T胞质败育及感病机理的研究逐渐展开,同时关于不育胞质遗传多样性的研究愈发受到关注。
我国早期著名的作物遗传育种学家杨允奎先生是利用CMS系配制玉米杂交种的开拓者,在他的影响和带领下四川省较早开展了玉米雄性不育的利用研究[5,6]。四川农业大学数量遗传研究室(四川农业大学玉米研究所的前身)于20世纪80年代中后期通过地里远缘杂交选育出G、类2、类3玉米CMS新材料。G胞质是从正常可育群体G与正常可育自交系合二杂交后代选育而成。用其配制的杂交组合川农三交2号和G合三单交,已在生产上推广应用。类2、类3是从栽培玉米与其近缘属大刍草(ssp.L.)的远缘杂交后代选育而成。杨俊品等[7]、李晚忱等[8]和荣廷昭等[9]分别从不同方面对G、类2、类3进行了系统的观察和分析,最终将其归为玉米CMS-C型不育。20世纪90年代中期,汪静等[10]对从“川单9号”与玉米近缘属远缘杂交后代中选育出的R1、R2两份雄性不育新材料进行研究,经过恢保关系测定及特异分子标记的PCR扩增,明确两者均为玉米CMS-C型不育。与此同时,徐小逊等[11]和荣凤军等[12]对从优良转基因受体18红的组织培养后代获得的两份雄性不育新材料A1、A2进行系统的分类鉴定,同样将其归为玉米CMS-C型不育。2006年四川农业大学玉米研究所选送08-641、18-599和SCML203 (RP125) 3份优良自交系进行航天搭载试验,从这些材料的处理后代中陆续选育出5份雄性不育材料,经过正反交试验结合恢保关系鉴定,明确了这5份不育材料均为CMS,其中是从搭载处理的08-641中选育而来,、是从搭载处理的18-599后代中选育而来,、是从搭载处理的SCML203 (RP125)中选育而来。经过多年多点的育性鉴定,结合玉米CMS-C、CMS-T以及CMS-S的特异引物分析,最后明确了、、为玉米CMS-C型不育[13],和为玉米CMS-T型不育[14]。这5份玉米CMS材料的成功选育充分证明了航天诱变不仅可以导致核基因组遗传信息发生改变,也可诱发细胞质基因组线粒体DNA的重排。
华中农业大学也是我国较早开展玉米CMS研究的主要单位之一。李建生等[15]先后从玉米地方品种资源中选育出一批雄性不育系,如远徐cms-小黄、恩二激cms-大黄,通过分类研究将它们归为玉米CMS-S型不育。江苏农学院秦泰辰等[16]早期利用恢复系细胞质为基础,采用核置换筛选法获得新型不育系YⅡ-1,研究表明YⅡ-1不属于玉米T型和S型,与C型也存在一定差别,认为YⅡ-1的不育胞质归组尚需进一步研究。辽宁省农业科学院玉米研究所陈庆华[17]从钴60处理的自选杂交组合(开24×替423)后代中选育出一份CMS材料,研究表明该不育系不同于T、S、双及C型,定名为L2(辽2)型。李小琴等[18]对华中农业大学利用我国地方玉米品种“巫溪”与美国群体BSSSC9、热带种质“墨黄九”等组配的人工合成群体中发现的玉米细胞质雄性不育材料“WBMs”进行胞质分类研究,将其归为玉米CMS-S型不育。山西省农业科学院高粱研究所侯爱斌等[19]在试验地发现一份玉米CMS材料JnA,通过鉴定将其归为玉米CMS-S型不育。陈伟等[20]对中国农业大学从爆裂玉米种质中发现的玉米CMS材料CMS-P进行分类研究,结果表明CMS-P为玉米CMS-S型不育。湖南农业大学罗红兵等[21]从杂种后代分离出一份细胞质雄性不育GDS,通过鉴定将其归为玉米CMS-C型不育。山东农业大学郭宝健等[22]利用钴60处理玉米自交系昌7-2,从中选育出一份不育系Ta-CMS,经鉴定为玉米CMS-T型不育。山东农业大学张增川等[23]对新选不育材料泰玉D2s进行研究,但最终未能将其明确归组,有可能为不同于T、S、C型不育胞质的新材料。河北农业大学祝丽英等[24]对从杂交、回交后代选育的雄性不育材料928CMS-Q1261进行研究,同样将其归为玉米CMS-S型不育。北京市农林科学院宋伟等[25]选育了综合性状优良、不育性稳定且败育彻底的CMS-S系MD32,后经过回交转育结合分子标记辅助背景选择将不育性状转移到自交系京724遗传背景中。黑龙江八一农垦大学孙丽芳等[26]通过化学诱变获得玉米CMS材料85218A,经胞质不育特异引物PCR扩增将其归为玉米CMS-C型不育;与此同时,徐莹莹[27]从外源总DNA导入玉米骨干自交系后代中选育了两份雄性不育新材料DT-合344和ZT-合344,经鉴定这两个不育系均为玉米CMS-T型不育。宁夏农林科学院佘奎军等[28]对育成的玉米CMS系“PH6WCcms-LK18”进行研究,将其归为玉米CMS-C型不育。安徽农业大学王洁等[29]对从C7-2与PH4CV杂交后代中获得的雄性不育材料CF3进行分析,并将其归为玉米CMS-S型不育。山西农业大学张欢欢等[30]对昌7-2与郑58杂交,然后以郑58作为受体连续回交后代选育的晋玉1A雄性不育材料进行研究,最后将其归为玉米CMS-S型不育。现将我国自主选育的玉米CMS资源进行汇总,见表1。
1.2 玉米GMS资源的发掘及创制
玉米GMS的发现早于CMS。早在1921年Eyster[31]发现了雄性不育株,经鉴定是核不育类型,具有隐性遗传特征。1930年Singleton和Jones[32]也发现了雄性不育株并命名为,经连锁关系测交鉴定,定位在玉米第6染色体上。1931年Eyster[33,34]命名了核不育基因和,分别定位在第9染色体和第3染色体上。20世纪70年代,由于玉米小斑病T小种的爆发流行,T型不育系被迫停止使用,自此人们对细胞质雄性不育的遗传多样性研究逐渐重视,而且加强了对细胞核雄性不育的研究,此后又命名了一大批核不育基因[35,36]。
玉米GMS因缺乏完全保持系限制了其在农业生产上的利用。随着作物分子设计育种时代的到来,产生了集转基因、荧光蛋白筛选和花粉失活等多种技术为一体的SPT技术,该技术的诞生有效解决了玉米GMS保持和繁殖问题[1]。随后,相继出现了玉米核不育应用的MCS技术和DGMS技术[2~4],这些技术为利用玉米GMS进行规模化杂交种子生产提供了可能。玉米GMS的研究从此备受关注,截止目前,全世界已有26个包含光温敏核不育(photo- thermo sensitive genic male sterile, PTGMS)在内的玉米GMS基因被克隆,其中我国科学家克隆了14个,分别是[37]、/[38]、[2,4]、/[39]、/[40]、[41]、[3]、[42]、[43]、[44]、[45]、[46]、[47]和[48]。其中有5个玉米GMS突变体(/、、、和)是我国自主创制,其余9个均来自美国玉米种质中心。作为玉米种植大国,我国自主创制的玉米GMS资源仍十分有限(表2),有待于进一步加强。
四川农业大学玉米研究所在国内较早开展玉米航天诱变育种研究,1997年从卫星搭载川单9号后代获得一份雄性不育突变材料,经鉴定为GMS,定名为。利用分子标记技术将其定位在玉米第3染色体上,多年多点的种植观察发现还具有降低植株高度的作用[43,49~52]。另外,本课题组从2006年“实践8号”搭载处理的18-599和RP125诱变处理后代中获得了两份雄性不育材料,分别是和。经过多年多点的鉴定及遗传分析,发现两份不育突变体均为GMS,且均受一对隐性核基因控制,利用分子标记技术分别将控制的不育基因定位在第6染色体上,控制的不育基因定位在第7染色体上,花粉败育彻底,为无花粉型不育,而可形成花粉粒,但无淀粉积累(未发表)。之后,我们采用甲基磺酸乙酯(ethyl methanesulfonate, EMS)处理优良骨干自交系RP125的花粉,成功选育出多份GMS新材料。其中不育突变体是从EMS处理RP125后代中选育而来,目前已被定位在玉米第4染色体上,明确了控制该不育性状的基因是转录因子bHLH51[44],雄性不育突变体X358选自EMS处理RP125后代,现已被定位在玉米第1染色体上(未发表)。另外,四川农业大学农学院对选自钴60照射自交系K305后代的GMS突变材料进行了遗传分析及精细定位,将核不育基因定位在玉米第2染色体上[53]。

表1 我国自主创制的玉米CMS资源
“–”表示来源未知。
河南农业大学李玉玲等[54,55]从“神舟4号”搭载的昌7-2和郑58种子后代选育出2份GMS突变体,并进行了遗传分析和基因定位研究,分别将来自于郑58和昌7-2太空诱变后代的雄性不育基因定位于第1和第4染色体上。山东省农业科学院玉米研究所徐相波等[56]从太空搭载玉米鲁原3624后代选育出一份GMS突变体,并对该不育突变体进行了遗传分析和定位,初步将控制该不育性状的基因定位在第2染色体上。中国科学院遗传与发育生物学研究所陈化榜课题组在育种过程中也发现了一份天然GMS突变体,并对其进行了遗传分析及图位克隆,明确了目的基因/位于玉米第10染色体长臂上,编码一个细胞色素P450单氧酶[39]。海南波莲水稻基因科技有限公司通过钴60辐射诱变京科糯2000创制了一个糯玉米突变体库,从中鉴定出71个不同类型的雄性完全不育的突变体,通过连锁分析和候选基因分析,从中鉴定到一个无花粉突变体和一个花药缺失突变体[57]。北京市农林科学院利用EMS处理京科968的母本京724,获得一份隐性玉米GMS突变体,经过遗传分析和BSR-seq分析,初步确定该不育基因可能是玉米第4染色体上的()[58]。
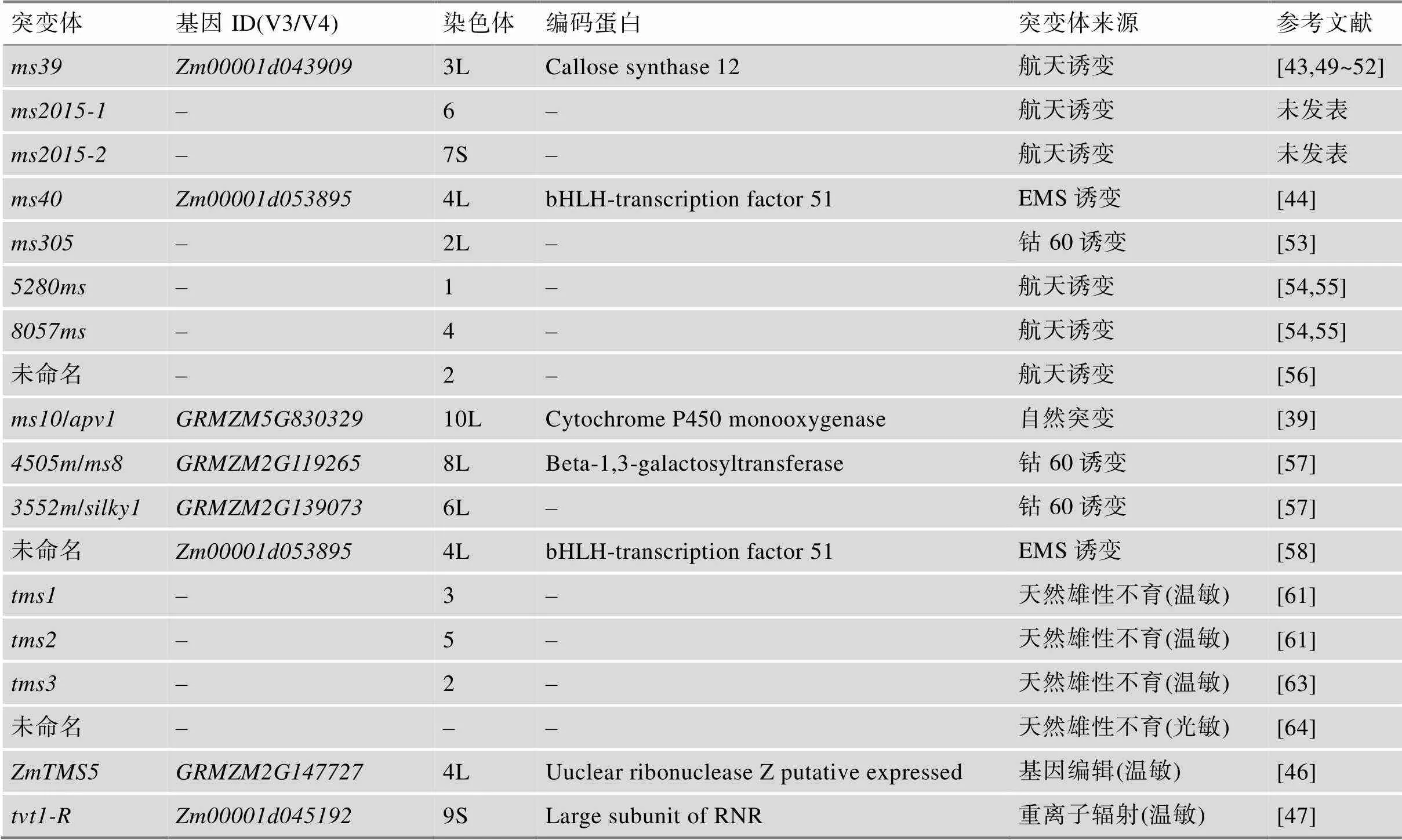
表2 我国自主创制的玉米GMS资源
“–”表示未报道。
1.3 玉米光、温敏雄性不育资源的发掘及创制
玉米光敏雄性不育(photoperiod sensitive genic male sterility, PGMS)和温敏雄性不育(thermo sensitive genic male sterile, TGMS)的发现均晚于水稻。1992年海南省农业科学院郝忠友等[59]在玉米自交系繁种田发现了雄性不育材料琼6Qms,经多年多代研究,发现该不育材料为TGMS。河南农业大学汤继华等[60]通过对育性转换机制的研究,发现日最高温度是育性转换的主要因子,表现为低温可育,高温不育,育性转换的温度区间为27℃~31℃;同时日照长度对育性转换也有一定的影响,表现为长日照不育,短日照可育。琼6Qms是最早报道的玉米TGMS系,其育性由两对重叠基因控制,受温度和日照长度的共同影响,其中花药的育性主要受温度的影响,而颖壳的开裂则受日照长度的影响。该材料在不育阶段内具有少数可育的花粉,在剥颖授粉时仍然能得到部分种子,故在生产上利用存在一定的潜在风险[60]。付志远等[61]将控制琼6Qms育性的基因和分别定位在第3和第5染色体上。另外,汤继华等[62]对玉米TGMS材料琼68ms进行生态学、形态学和遗传学分析,发现琼68ms是一种花药败育型的TGMS系,表现为高温不育、低温可育,育性转换的敏感时期是雄穗发育的小穗分化期,临界温度为30℃~33℃,其育性由一对隐性核基因控制。并将控制琼68ms雄花败育的温敏不育基因定位在第2染色体上[63]。
1994年冬季,中国农业科学院作物育种栽培研究所周洪生等[64]在海南省三亚南宾发现玉米自交系CA507共2行38株全部不散粉,雄花闭颖不开裂,花药内无正常花粉粒,表现为完全雄性不育。多年多点的种植发现,该不育材料在短日照条件下表现为雄性不育,在长日照条件下表现为可育,是一个短日光周期敏感型雄性不育材料。进一步研究发现育性转换的临界日照长度是14~15小时,该PGMS材料受隐性基因控制,基因对数较多。2017年,中国科学院遗传与发育生物学研究所高彩霞课题组利用CRISPR/Cas9系统编辑基因得到了一份玉米TGMS材料[46]。中国农业大学金危危课题组从重离子辐射自交系N17后代中选育出一份玉米温敏无雄穗突变体并对其进行了图位克隆、等位测验和互补测验,确定了位于第9染色体短臂上的基因()为控制温敏无雄穗表型的目的基因,其编码核糖核酸还原酶大亚基(large subunit of ribonucleotide reductase, RNRL)[47]。
玉米PGMS和TGMS资源的发现,为“两系法”杂种优势利用开辟了一条新的途径。玉米PGMS和TGMS其实质属于GMS,只是这种雄性不育受生态条件控制,所以人们又称之为生态不育。生态雄性不育的发现为深刻认识和探究环境因素与遗传因素在雄花发育中的相对作用提供了宝贵的资源。
1.4 雄性不育材料的来源
关于植物雄性不育基因资源,可以将其来源概括为以下几个方面:(1)自然群体的天然雄性不育。早期发现的许多有重要应用价值的雄性不育类型均为天然雄性不育类型。例如1932年苏联科学家在苏联黄硬粒地方品种中发现的M型CMS材料,1937年发现的一些CMS材料,后经美国农业部定名为USDA。自然群体中的天然不育株,一方面可能来自于天然自交、杂交后代,另一方面也可能来自于自然突变。(2)远缘杂交。CMS的实质是核质不协调。因此,任何可导致核质不协调的杂交或其他遗传操作均可产生CMS。所以,CMS可经由种间杂交、种内杂交以及品种间杂交而产生。例如油菜()不育材料nap-CMS来自于品种间杂交后代,向日葵()不育材料PET1-CMS来自于与种间杂交后代,四川农业大学玉米研究所从“川单9号”与玉米近缘属远缘杂交后代中选育出R1、R2两份雄性不育新材料[10]。实践证明种属间核质置换也是培育CMS的重要途径。小麦的T-CMS、K-CMS、V-CMS等均是通过核质置换选育而来。并且这种途径是早期培育CMS的重要途径。(3)原生质体融合。原生质体融合可以使双亲的核、质重新组合,从而为通过胞质杂种培育CMS开辟了一条新途径。例如,Prakash等[65]用白菜型油菜()和芥菜型油菜()分别与刺油菜()融合,在杂种后代中得到了新的Oxy CMS类型。Mikhajlo等[66]用2个可育的烟草亲本进行融合,结果也得到了CMS的胞质杂种。(4)组织培养。植物组织培养过程中有可能会产生体细胞无性系变异,因此利用这种体细胞无性系来培育CMS在多种植物中已有报道。四川农业大学玉米研究所从优良转基因受体18红的组织培养后代获得两份雄性不育新材料A1、A2,通过分类鉴定将其归为玉米CMS-C型不育[11,12]。凌定厚等[67]从水稻幼穗、幼胚培养再生植株中获得48个雄性不育突变体,其中有CMS,也有GMS。(5)理化诱变。电离辐射、烷化剂等传统的理化因素处理都能诱发植物雄性不育突变的产生,这种雄性不育既可能是CMS,也可能是GMS,通常以隐性核不育突变类型居多。当前,一些新的诱变技术如航天诱变、超声波处理以及等离子诱变等不断涌现,极大丰富了人工诱变的手段,这为创制更多的雄性不育材料奠定技术基础。已发现的玉米GMS资源多数来自于理化诱变(表2),CMS材料中有少部分资源来自理化诱变(表1)。(6)转座子和T-DNA插入诱变。转座子或T-DNA插入有可能引发植物雄花发育相关基因的功能丧失,从而导致雄花败育。国内外曾广泛利用转座子插入或T-DNA插入构建玉米突变体库。这些突变体库中蕴藏着大量已被发现或者未被发现的雄性不育突变体。当前,在对雄性不育基因进行克隆时,诸多研究者选择通过购买候选基因的突变体,并对其进行表型观察与鉴定,从而明确候选基因的功能。(7)基因编辑。随着基因编辑技术的不断完善和成熟,加之植物全基因组学与比较基因组学的深入发展,人们利用基因编辑技术定点敲除目标基因,已变得切实可行。例如,水稻TGMS基因第71位碱基由C到A的转换导致了水稻TGMS[68],中国科学院遗传与发育生物学研究所高彩霞课题组通过同源比对分析了基因,并利用基因编辑技术CRISPR/Cas9系统编辑成功得到了一份玉米TGMS材料[46];中国农业科学院作物科学研究所谢传晓课题组利用CRISPR/Cas9编辑技术对玉米基因进行编辑,并获得了由该基因控制的不育系[69,70]。
2 玉米雄性不育研究进展
2.1 玉米CMS研究进展
根据育性恢复专效性,玉米CMS大体上可分为CMS-T、CMS-S和CMS-C三大类。其中,玉米CMS-T和CMS-C属于孢子体不育,玉米CMS-S属于配子体不育。CMS主要是由于线粒体基因的突变和重组导致[71],属于母系遗传。细胞核中的恢复基因(restorer of fertility,)能够使CMS植株的育性恢复正常,CMS的育性恢复可能发生在基因组水平,也可能发生在转录水平或转录后水平,或者翻译水平等[72]。
玉米CMS-T的不育基因是,该基因编码一个13 kDa跨膜毒蛋白URF13,能够导致线粒体的功能紊乱从而引起花粉败育[73]。与其育性恢复相关的基因有[74,75]、[74,76~78]、[79]和[79],他们都是通过降低URF13蛋白在不育植株中的积累,从而影响CMS-T植株的育性恢复。玉米CMS-S的败育与一个由线粒体基因组线性末端转录的长1.6 kb的-转录本有关[80~83],与其育性恢复相关的基因有[84,85]、[83]和[85]。其中,是通过切割-转录本使其降解,从而解除其毒性作用,使玉米CMS-S植株的育性得以恢复[82,83]。Xiao等[86]进一步证实了是玉米CMS-S的不育基因,进一步通过酵母单杂交技术鉴定到了一个在花药中特异表达的转录因子,该转录因子能够直接结合启动子并促进其转录。Orf355是一个具有强烈细胞毒性的蛋白,基因的表达能够显著增强线粒体逆向(线粒体到细胞核)信号,而能快速响应这种信号。另外,基因启动子区域存在一定数量的UPR motif (unfolded protein response motif),该motif的存在对于响应线粒体逆向信号非常重要。在没有存在的情况下,基因启动子缺失UPR motif的单倍型能够部分恢复玉米CMS-S的育性,表明是玉米CMS-S的弱恢复基因。另外,Qin等[87]克隆了玉米CMS-S主要恢复基因,该基因编码三角状五肽重复蛋白K2 (pentatricopeptide repeat protein K2, PPRK2),研究表明PPRK2靶向线粒体,与结合并抑制的编辑和降解,并通过未知机制加速的降解,从而使CMS-S的育性得到恢复。的作用是减少由环形亚基因组与CMS-S特异线性质粒重组产生的含有/的线粒体线性亚基因组的数量,从而影响CMS-S植株的育性恢复,其与相比育性恢复效果较差,且的表达同时受核背景和温度的影响[83]。玉米CMS-C的败育可能与基因、、的重排有关,Dewey等[88]发现、和可能是引起玉米CMS-C败育的候选基因。但目前为止,关于引起CMS-C败育的关键因子及分子机制尚不清楚。玉米CMS-C的育性恢复由两个主效恢复基因和控制,分别被定位在第8和第5染色体上[89]。的功能受基因的抑制,仅能在没有基因存在的情况下恢复玉米CMS-C的育性[90]。相对于,的恢复力强,恢复范围更加广泛,目前已完成的克隆[91]。Liu等[92]发现A619中可能存在两个主效恢复基因和,且与不等位。CMS-C的育性恢复除了受主效恢复基因控制外,也可能存在一些微效作用位点。例如,Kohls等[93]在研究C型不育胞质弱恢复材料时,定位了3个贡献率较高的育性恢复相关QTL位点,分别位于bin2.09、bin3.06和bin7.03;Zheng等[94]也发现一个与玉米CMS-C育性恢复相关的QTL位点。另外,关于玉米CMS-C育性恢复机制的研究也取得了一定的进展。赵卓凡等[95]发现同一测验系对玉米CMS-C同质异核不育系的恢保关系不同,暗示不育系的核背景参与调控育性恢复表现,还发现环境对恢复系A619恢复后代的育性表现有影响,并推测C48-2、C478核背景中存在微效恢复基因,这些微效基因与18白、自330中的微效恢复基因通过杂交聚合后能使C478、C48-2的育性恢复,暗示玉米CMS-C的育性恢复呈现一定的剂量效应。牟碧涛等[96]发现自交系7250-14-1对C胞质亚组材料C48-2、G48-2、ES48-2、EC48-2表现为育性部分恢复,但却不能恢复C胞质亚组不育系RB48-2和类48-2的不育性状;Z16能够部分恢复C48-2,但不能恢复48-2核背景下其他亚组材料如G48-2、ES48-2、EC48-2、RB48-2和类48-2,暗示不育系线粒体基因组对CMS-C育性恢复也有一定影响;Zhang等[97]通过对玉米CMS-C型不育系Cr87-1和其对应的恢复系CR87-1(含有恢复基因)花药四分体及单核时期的小孢子进行单细胞转录组测序,差异表达分析显示共有3379个差异表达基因(differential expression gene, DEG),其中277个DEG可能与线粒体功能相关,226个DEG为转录因子,467个DEG可能是调控的靶基因。KEGG (Kyoto Encyclopedia of Genes and Genomes)分析表明,四分体时期的DEG主要参与碳代谢、氨基酸合成和代谢,而四分体向单核早期过渡期的DEG主要与蛋白质代谢的调节、脂肪酸代谢和结构形态发生相关。综合分析发现恢复基因同时影响绒毡层功能及小孢子发育,可能参与小孢子细胞内氧化还原动态平衡的调控及细胞重建。近年来虽然在玉米CMS败育及恢复机制的研究上取得了一些进展,但仍需进一步加强和深入。
2.2 玉米GMS研究进展
目前在玉米中已经鉴定出许多GMS相关突变体或基因。据不完全统计,已完成克隆和功能分析的包含PGMS和TGMS在内的玉米GMS基因至少有26个(表3)。根据核不育基因的功能可分为以下5类:

表3 已经克隆的玉米核雄性不育基因
原报道中基因ID的版本均对应替换成B73_V4版本。
(1)参与脂质代谢的基因有9个,分别是[37]、[38]、/[39]、/[40]、[69]、[3]、[42,104]、[105]和[45]。其中,编码一个ATP结合盒转运体蛋白,其功能缺失会导致玉米花药中脂质和蜡质成分减少,从而影响花药发育[37];()和均编码一个GDSL脂肪酶,功能的缺失导致了突变体中脂质代谢发生异常,尤其是C16/C18脂肪酸以及相关衍生物含量的显著下降,引起花药绒毡层和中间层细胞的延迟降解,花药角质层和花粉外壁发育异常[38]。参与花粉外壁形成和花药角质层发育所需的脂肪代谢途径,该基因功能的缺失会引起花药角质层和花粉外壁正常发育所需脂类物质的不足,最终导致彻底的雄性不育[3];()和均编码一个细胞色素P450家族蛋白,分别是拟南芥和的同源基因。参与形成孢粉素前体和角质单体的合成,在花药角质层和花粉外壁发育中起重要作用[39]。编码的蛋白质属于长链脂肪酸ω-羟化酶,该酶参与花粉发育过程所需的孢粉素和一些生物大分子单体物质的合成,该基因功能的缺失会引起长链脂肪酸合成受阻,从而导致花粉外壁发育异常[69];()编码一个Glucose-methanol-choline (GMC)氧化还原酶,参与C16/C18 ω-羟基脂肪酸的氧化途径,与、共同参与调控花药角质层和花粉外壁的合成[40];编码一个甘油-3-磷酸酰基转移酶(-2 glycerol-3-phosphate acyltransferase, GPAT),该酶催化甘油脂合成途径的第一步。的作用是通过介导绒毡层细胞脂质的生物合成来维持花药内层叶绿体正常的结构和功能[42,104];是一个显性细胞核雄性不育基因,编码一个脂质转移蛋白,该基因功能的缺失不仅能够引起显性核雄性不育的产生,而且可以提高玉米的氮利用率,在玉米生产中具有重要应用价值[105];编码一个定位于质体的脂肪酰基载体蛋白还原酶,该基因是在花药角质层和花粉外壁发育中必不可少的[45]。
(2)参与糖代谢的基因有2个,分别是[98]和[43,49~52]。其中,编码一个β-1,3-半乳糖基转移酶,Ms8与阿拉伯半乳糖蛋白、生物素2、生物素4、线粒体外膜孔蛋白以及ATP酶复合体第1亚基等蛋白都存在相互作用关系,推测可能参与花药早期发育的生物合成、细胞程序性死亡以及线粒体代谢等途径,功能的缺失可以直接或间接地导致花粉母细胞发育异常,并最终导致不育的发生[98];编码一个胼胝质合成酶12,该基因功能的缺失不仅能够导致玉米花粉败育,而且具有降低植株高度的作用[43,49~52]。
(3)作为转录因子调控花发育的基因有6个,分别是[2,4]、[99]、[102]、[103]、[44]和[108]。这6个基因归为4类转录因子。其中,属于PHD-finger转录因子;属于R2/R3 MYB类转录因子;、和属于bHLH转录因子;()属于LBD (LOB domain)转录因子。与拟南芥和水稻同源[2],该基因作为转录激活因子在绒毡层发育和花粉外壁形成中起关键作用。利用花药异性启动子提前表达能导致玉米显性雄性不育,的提前表达引起了下游基因的提前表达从而导致绒毡层发育异常和花粉外壁形成异常。同样,在转基因水稻和拟南芥的植株也表现出类似的显性雄性不育[4];作为植物特异的R2/R3 MYB类转录因子,参与调控玉米花粉发育[99];和在减数分裂前期的花药中特异表达,主要调节花粉发育过程中绒毡层细胞和中层细胞的分裂和分化[102,103]。有趣的是,同时也是玉米CMS-C的主效恢复基因[91];编码转录因子bHLH51,该基因功能的缺失导致绒毡层降解延迟,进而阻碍正常小孢子的形成[44];功能的缺失导致玉米雄性不育的产生[108],但具体的分子机制尚不清楚。
(4)通过sRNA (small RNA)介导调控花发育的基因有3个,分别是[41]、[109,110]和[111~115]。其中,编码ARGONAUTE (AGO)家族蛋白ZmAGO5c,该基因功能的缺失能够导致绒毡层细胞在减数分裂早期表现出提前空泡化,研究表明可能通过sRNA介导的表观遗传调控途径来调控绒毡层细胞发育[41];编码一个HD-ZIP类转录因子,研究发现该基因对于减数分裂前玉米花药中21 nt phasiRNAs的生物合成是必需的[109,110];编码Dicer-like 5蛋白,研究表明该基因是形成24 nt phasiRNAs所必需的,24 nt phasiRNA直接调控绒毡层细胞分化,并会影响减数分裂过程[111~115]。
(5)具有其他功能的基因有6个,分别是/[100,101]、[106]、[107]、[46]、[47]和[48]。其中,()编码一个谷氧还蛋白,突变体缺乏孢原细胞,花药细胞形态分化成类似于叶片细胞[100,101];编码一个异胡豆苷合成酶类似蛋白,可能参与生物碱合成途径,该基因功能的缺失会导致花粉外壁不能正常形成,最终引起花粉败育[106];编码一个小的分泌蛋白,是拟南芥和水稻的同源基因,主要调控花药发育早期细胞的分裂增殖[107];玉米TGMS突变体是通过与水稻TGMS基因同源比对并利用CRISPR/Cas9系统编辑得到的[46,68],具体的分子机制尚不清楚;突变体的温敏无雄穗表型是由编码蛋白第277位精氨酸(Arg277, CGU)替换为组氨酸(His277, CAU)的G-A位点的突变导致的,该基因功能的缺失影响了其与3个RNRSs (ZmRNRS1、ZmRNRS2和ZmRNRS3)的互作,从而影响RNR全酶的形成和dNTP的供应,进而影响顶端分生组织(shoot apical meristem, SAM)的DNA复制和细胞增殖[47];玉米花序发育缺陷突变体()的突变受一个半显性基因控制,控制该突变性状的基因可能是一个转录调控因子。进一步分析发现的异位表达抑制了多个花发育基因调控通路,从而导致突变体花序复杂的突变表型[48]。
3 玉米雄性不育在制种中的应用
3.1 玉米CMS的应用
玉米是较早利用CMS进行不育化制种的作物。自20世纪50年代,美国在玉米生产上开始推广使用T型不育胞质杂交种,正是因为利用T型胞质进行不育化制种,给玉米生产带来可观的经济效益,使T型不育胞质杂交种的推广面积持续攀升,到1970年,美国玉米生产上T型胞质杂交种的种植面积占玉米总面积的80%左右[116]。但是T型胞质杂交种的大面积推广利用,也直接导致玉米小斑病T小种在美国爆发流行,使美国玉米生产遭受巨大的经济损失,T型胞质的利用被迫停止。之后,不育胞质杂交种在美国玉米生产上的种植面积骤然下降。据Darrah等[117]报道,1979年美国利用各类CMS系配制的杂交种占种子生产量的17.5%,其中T型1.3%、C型14.1%、S型2.1%;1984年美国玉米不育系制种已占种子生产量的11.6%,其中C型8.3%、S型3.3%。据陈国平[118]报道,1991年美国采用CMS系制种的已占到33.9%。近几年国际上有关CMS杂交种的应用情况还未见报道。
我国自20世纪70年代后期开始研制利用C型、S型雄性不育材料,陆续有一些单交种如华玉2号、豫农704、中单2号、农大3138、华玉4号、成单19、川单9号、豫玉22号等利用C或S型的CMS系制种[119]。20世纪90年代,中国农业大学采用掺和法对农大3138的不育胞质杂交种进行推广利用,河南农业大学利用掺合法对豫玉22号的不育胞质杂交种进行推广应用,并且形成了一定的推广面积[120]。2003年,豫玉22号制种面积达866.67 hm2,可供16.67万hm2生产使用,累计推广面积约573万hm2[119,121]。2011年,我国CMS玉米杂交种面积不到玉米总面积的15%,在河南、湖北、四川等地有少量种植,且大面积应用的仅EL、唐徐、双等3种胞质型[120]。近几年我国有关CMS杂交种的应用情况尚未见报道。
不育系、保持系和恢复系“三系”配套是玉米CMS应用于生产的首要条件。目前我国在玉米生产上利用“三系”配套技术生产的杂交种占比不高,推广面积也很有限。主要原因在于:(1) CMS不育胞质杂交种的单一化大面积推广,具有潜在的遗传脆弱性,存在病菌专化侵染的风险;(2) CMS不育胞质的强恢复基因资源缺乏,且传统的恢复基因转育方法繁琐复杂,周期长。
3.2 玉米GMS的应用
玉米GMS因找不到完全保持系,GMS的保持和繁殖问题得不到有效解决,致使其在玉米杂交制种中应用受限。针对这一问题,人们先后提出和尝试了许多方法,例如利用与调控胚乳颜色基因的紧密连锁[32]性以及与控制黄绿苗基因的紧密连锁特性[122]解决可育植株与不育植株的区分问题,也有人提出利用黄白子粒以及黄绿苗标记性状与不育基因连锁,借助这些标记性状实现对不育株和可育株进行早期鉴定区分等,但这些方法都因存在这样或者那样的问题而未能在生产上应用。近几年随着SPT技术、玉米MCS技术和DGMS技术的相继出现,为解决GMS的保持和繁殖问题带来了契机[1~4]。SPT技术和玉米MCS技术属于隐性不育技术,在杂交种的生产过程中利用荧光蛋白筛选标签实现了不育和可育种子的分离,该方法虽然利用了转基因技术,但最终生产的杂交种子却不含转基因成分。DGMS技术属于显性不育技术,同样可以通过荧光蛋白筛选标签来区分含转基因成分和不含转基因成分的杂交种子,利用该技术生产的杂交种子中有50%含有转基因成分。这些技术虽然为玉米GMS系的大量繁殖和保持提供了有效策略,但是对于不育化制种的规模化生产和产业化运作仍然存在一些短板和不足。首先,在利用隐性核不育技术生产杂交种的过程中存在转基因花粉致死不彻底的情况,会造成转基因花粉漂移从而影响生态环境;其次,利用显性核不育技术生产的杂交种仍有50%含有转基因成分,对于转基因受限制的国家来说有一半杂交种不能投入市场,造成资源的浪费。截止目前,在国内外还没有成功利用玉米GMS进行大规模不育化制种的报道。
4 结语与展望
我国作为玉米生产大国,玉米种植面积由建国初期的1.65亿亩增长到现在的6.2亿亩左右,年用种量10亿公斤以上,常年制种面积250多万亩。当前,人工去雄的制种方式已经无法满足大面积制种的需求,迫切需要寻求一种新的制种方式加以推广利用。利用植物的雄性不育特性开展不育化制种,不仅能够有效保证杂交种子的纯度,而且可以大大降低种子生产成本,是一种费省效宏的玉米种子生产方式。我国地域辽阔,玉米种植区域纵跨寒温带、暖温带、亚热带和热带生态区,分布在平原、丘陵和高原山区等不同自然条件下,为满足不同生态条件下的玉米生产需求,挖掘和创制适宜于不同生态条件的玉米雄性不育资源,应用于玉米种子生产将是未来发展的趋势。随着人们对植物花发育调控网络的深入了解,以及以CRISPR/Cas9为代表的第三代基因编辑技术的迅速发展,植物雄性不育资源的获得方式有望从传统的自然突变、人工诱变等突变频率低、突变方向不确定发展到利用基因编辑技术有目的、高效的人为创制。利用基因编辑技术有望实现玉米雄性不育材料的高通量定向创制。
面对我国玉米种业的发展趋势和雄性不育的研究及应用现状,今后需加强以下7个方面的工作:(1)进一步挖掘创制新的胞质不育资源,丰富不育胞质资源的遗传多样性。创制对玉米T小种不敏感的玉米CMS-T型不育新材料;(2)对不育胞质的恢复资源开展广泛深入的研究。“三系”配套是CMS应用于不育化制种的前提。CMS的恢复基因资源短缺,并且传统的恢复基因转育方法周期长,过程繁琐复杂。这些已成为制约“三系”配套不育化制种应用的主要因素。目前已经克隆的玉米CMS恢复基因有[76]、[87]和[91],其中只有是由我国科学家克隆。因此,急需发掘、创制和克隆更多具有自主知识产权的玉米CMS恢复基因;(3)对玉米CMS花粉败育及育性恢复机制的深入研究;(4)对GMS不育材料的精准鉴定、深入挖掘和有效利用。一因多效且对生产有利的核不育基因将是未来研究和利用的重点。据报道,玉米核不育基因不仅雄花败育彻底、育性表现稳定,而且还能提高玉米对氮肥的利用率[105];玉米核不育基因同样表现出雄花败育彻底育性表现稳定,并且伴随株高的降低[43,49~52];(5)对知识产权的保护。自20世纪90年代以来,拥有“基因专利”已成为发达国家及其跨国公司垄断生物技术产业的集中表现,知识产权之争是今后生物产业发展的焦点[123]。对优质种质资源保护的同时,还需加强对优良性状基因的产权保护,将种质资源优势和基因优势同时建立起来,避免“种中国豆侵美国权”的类似情况再次发生;(6)对GMS利用相关技术的完善。加强对核不育基因、花粉致死基因、种子标记基因等的克隆,解决杂交种子生产过程中转基因花粉致死不彻底、种子标记基因类型单一化等问题;(7)核不育与现代育种技术的结合。将GMS系与包含转基因育种和分子设计育种在内的现代育种技术相结合,充分发挥核雄性不育在育种中的应用。
[1] Wu YZ, Fox TW, Trimnell MR, Wang LJ, Xu RJ, Cigan AM, Huffman GA, Garnaat CW, Hershey H, Albertsen MC. Development of a novel recessive genetic male sterility system for hybrid seed production in maize and other cross-pollinating crops., 2016, 14(3): 1046–1054.
[2] Zhang DF, Wu SW, An XL, Xie K, Dong ZY, Zhou Y, Xu LW, Fang W, Liu SS, Liu SS, Zhu TT, Li JP, Rao LQ, Zhao JR, Wan XY. Construction of a multicontrol sterility system for a maize male-sterile line and hybrid seed production based on thegene encoding a PHD-finger transcription factor., 2018, 16(2): 459–471.
[3] An XL, Dong ZY, Tian YH, Xie K, Wu SW, Zhu TT, Zhang DF, Zhou Y, Niu CF, Ma B, Hou QC, Bao JX, Zhang SM, Li ZW, Wang YB, Yan TW, Sun XJ, Zhang YW, Li JP, Wan XY.encoding a novel GDSL lipase is essential for male fertility and valuable for hybrid breeding in maize., 2019, 12(3): 343–359.
[4] An XL, Ma B, Duan MJ, Dong ZY, Liu RG, Yuan DY, Hou QC, Wu SW, Zhang DF, Liu DC, Yu D, Zhang YW, Xie K, Zhu TT, Li ZW, Zhang SM, Tian YH, Liu C, Li JP, Yuan LP, Wan XY. Molecular regulation ofrequired for maize male fertility and development of a dominant male-sterility system in multiple species., 2020, 117(38): 23499–23509.
[5] 杨允奎, 杜世灿, 段光辉. 利用玉米雄性不育特性制造杂种的研究. 作物学报, 1962, 1(1): 35–42.
[6] Yang YK, Du SC, Duan GH, Yang LG. Further studies on the utilization of male-sterility in producing maize hybrids., 1963, 2(3): 297–302.
杨允奎, 杜世烂, 段光辉, 杨令贵. 利用雄性不育特性制造玉米杂交种的研究续报. 作物学报, 1963, 2(3): 297–302.
[7] Yang JP, Gao ZR, Rong TZ. Comparative studies of cytology on isonuclear allopbasmic male-sterile lines in maize., 1990, 8(3): 238–242.
杨俊品, 高之仁, 荣廷昭. 同核异质玉米细胞质雄性不育系的细胞学比较研究. 四川农业大学学报, 1990, 8(3): 238–242.
[8] Li WC, Rong TZ, Lei BM, Cao MJ, Hu CY. Breeding and classification of three cytoplasmic male sterile inbreds in maize., 2001, 27(3): 308–312.
李晚忱, 荣廷昭, 雷本鸣, 曹墨菊, 胡长远. 3个玉米细胞质雄性不育系的选育及分组鉴定. 作物学报, 2001, 27(3): 308–312.
[9] Rong TZ, Li WC, Cao MJ, Hu CY. Study on identification in group of cytoplasmic male sterile in maize., 2002, 35(9): 1055–1059.
荣廷昭, 李晚忱, 曹墨菊, 胡长远. 玉米细胞质雄性不育分组鉴定研究. 中国农业科学, 2002, 35(9): 1055–1059.
[10] Wang J, Rong TZ, Cao MJ. Preliminary identification and analysis of two new male sterile maize materials., 2009, 27(4): 415–418.
汪静, 荣廷昭, 曹墨菊. 两个新选玉米雄性不育材料的初步鉴定和分析. 四川农业大学学报, 2009, 27(4): 415–418.
[11] Xu XX, Rong TZ, Cao MJ. Discovery and genetic study of new male sterile in maize., 2006, 14(1): 55–58.
徐小逊, 荣廷昭, 曹墨菊. 一个新的玉米雄性不育材料的发现及其初步遗传分析. 玉米科学, 2006, 14(1): 55–58.
[12] Rong FJ, Cao MJ, Tang QL, Pan GT, Rong TZ. Genetic analysis of a new type of maize CMS obtained from the offspring of transgenic Bt maize., 2007, 25(1): 29–33.
荣凤军, 曹墨菊, 唐祈林, 潘光堂, 荣廷昭. 转Bt基因后代玉米新不育胞质A的遗传分析. 四川农业大学学报, 2007, 25(1): 29–33.
[13] Zhang CB, Yuan GZ, Wang J, Pan GT, Rong TZ, Cao MJ. Genetic analysis of maize cytoplasmic male sterile mutants obtained by space flight., 2011, 33(2): 175–181.
张采波, 袁国钊, 汪静, 潘光堂, 荣廷昭, 曹墨菊. 空间环境诱发玉米细胞质雄性不育突变体的遗传分析. 遗传, 2011, 33(2): 175–181.
[14] Yi HY, Zhang CB, Li C. Wang J, Yu T, Liu YM, Cao MJ. Identification and genetic analysis of two maize CMS-T mutants obtained from out-space-flighted seeds., 2021, 68(5): 1–11.
[15] Li JS, Xu SZ, Lai JR, Zheng YL, Xiong XZ, Liu JL. Cytoplasmic classification of two male sterile lines of maize., 1993, 19(2): 156–164.
李建生, 徐尚忠, 赖菁茹, 郑用琏, 熊秀珠, 刘纪麟. 对两个玉米雄性不育系的细胞质分类研究. 作物学报, 1993, 19(2): 156–164.
[16] Qin TC, Chen JG, Xu ML, Deng DX, Bian YL. Investigation on male sterility inⅧ. A preliminary study on identification the group of YⅡ-1type male sterile cytoplasm., 1994, 20(6): 677–684.
秦泰辰, 陈建国, 徐明良, 邓德祥, 卞云龙. 玉米雄性不育性研究Ⅷ.玉米YⅡ-1型不育胞质归群初报. 作物学报, 1994, 20(6): 677–684.
[17] Chen QH. Breeding of the L2-type cytoplasmic male sterility in maize and its use in production., 1997, 5(2): 1–4.
陈庆华. 玉米“辽2(L2)”型细胞质雄性不育性的选育与利用. 玉米科学, 1997, 5(2): 1–4.
[18] Yi XQ, Wang BH, Liu JL, Li JS, Xu SZ, Zheng YL. Classification of male sterile cytoplasms of WBMs in maize(L)., 2004, 30(4): 304–307.
李小琴, 万邦惠, 刘纪麟, 李建生, 徐尚忠, 郑用琏. 玉米细胞质雄性不育材料WBMs的胞质分类研究. 作物学报, 2004, 30(4): 304–307.
[19] Hou AB, Liu QS, Dong LL, Li TY, Hou XD Liang D, Duan B. Application and classification of cytoplasmic male sterile inbred JnA in maize., 2006, 21(1): 31–34.
侯爱斌, 柳青山, 董良利, 李团银, 侯旭东, 梁笃, 段冰. 玉米细胞质雄性不育系JnA的分组鉴定及利用. 华北农学报, 2006, 21(1): 31–34.
[20] Chen W, Liu ZX, Er LZ, Yang H, Dai JR. Classification of male sterile cytoplasm of CMS-P in maize ()., 2007, 33(2): 196–200.
陈伟, 刘占先, 鄂立柱, 杨会, 戴景瑞. 玉米细胞质雄性不育材料CMS-P的胞质分类研究. 作物学报, 2007, 33(2): 196–200.
[21] Luo HB, Huang H, Zhou WX, Tu NM, Luo SQ. Study on classification of cytoplasmic male sterile line GDS in maize., 2008, 16(2): 8–11.
罗红兵, 黄璜, 周文新, 屠乃美, 罗水清. 玉米GDS细胞质雄性不育系的分类研究. 玉米科学, 2008, 16(2): 8–11.
[22] Guo BJ, Zhang ZX, Chen BT, Liu BS. Genetic analysis of male sterile cytoplasm of Ta-CMS in maize., 2008, 6(3): 491–494.
郭宝健, 张振兴, 陈丙堂, 刘保申. Ta型玉米细胞质雄性不育材料的遗传分析. 分子植物育种, 2008, 6(3): 491–494.
[23] Zhang ZC, Dong ST, Gao RQ, Sun QQ, Cui LN, Zhang HL. The morphological studies on pollen abortion of a new cytoplasmic male sterile material-taiyu D2 in maize., 2009, 17(3): 76–79.
张增川, 董树亭, 高荣岐, 孙庆泉, 崔丽娜, 张华利. 新型玉米细胞质雄性不育材料泰玉D2花粉败育的细胞学研究. 玉米科学, 2009, 17(3): 76–79.
[24] Zhu LY, Chen JT, Huang YQ, Zhao YF, Song ZQ. Identification and genetic analysis of a cytoplasmic male sterile line in maize (L)., 2012, 45(9): 1676–1684.
祝丽英, 陈景堂, 黄亚群, 赵永锋, 宋占权. 一个玉米细胞质雄性不育系的鉴定及遗传分析. 中国农业科学, 2012, 45(9): 1676–1684.
[25] Song W, Su AG, Xing JF, Wu JF, Zhao JR. Study on breeding of new S-type cytoplasmic male sterile material from maize inbred line Jing724 with molecular marker assisted selection., 2016, 24(1): 33–36, 42.
宋伟, 苏爱国, 邢锦丰, 吴金凤, 赵久然. 京724玉米自交系S型细胞质雄性不育系分子标记辅助选育研究. 玉米科学, 2016, 24(1): 33–36, 42.
[26] Sun LF, Deng J, Wang X, Zhao W, Yang KJ, Miao XF, Gao SR. Type identification of cytoplasmic male sterile line and study of pollen abortion in maize., 2016, 32(3): 27–32.
孙丽芳, 邓杰, 王霞, 赵伟, 杨克军, 苗兴芬, 高树仁. 玉米细胞质雄性不育系胞质类型鉴定及花粉败育研究. 作物杂志, 2016, 32(3): 27–32.
[27] Xu YY, Deng J, Wang QX, Yu J, Wang X, Zhao W, Sun LF. Identification of cytoplasmic male sterile line in maize., 2016, 28(5): 19–26.
徐莹莹, 邓杰, 王秋雪, 于杰, 王霞, 赵伟, 孙丽芳. 玉米细胞质雄性不育系的鉴定. 黑龙江八一农垦大学学报, 2016, 28(5): 19–26.
[28] She KJ, Liu YJ, Chen JL, Yang GH, Liu YN. ldentification and analysis of one maize cytoplasmic male sterile line ‘PH6WCcms-LK187’., 2017, 26(12): 1797–1802.
佘奎军, 刘永进, 程晋龙, 杨国虎, 刘艳妮. 玉米胞质雄性不育材料‘PH6WCcms-LK18’的鉴定及分析. 西北农业学报, 2017, 26(12): 1797–1802.
[29] Wang J, Zhao Y, Wang L. Obtaining and identification of a novel cytoplasmic male sterile line from maize., 2019, 21(3): 28–33.
王洁, 赵阳, 王磊. 一个新的玉米胞质雄性不育系的获得及鉴定. 中国农业科技导报, 2019, 21(3): 28–33.
[30] Zhang HH, Cui GM, Wang ZB, Wang XQ, Hao YS, Du JZ, Wang YX, Sun Y. Breeding and characteristics of a new male sterile line of maize, Jinyu1A., 2020, 53(21): 4322–4332.
张欢欢, 崔贵梅, 王长彪, 王晓清, 郝曜山, 杜建中, 王亦学, 孙毅. 玉米雄性不育系晋玉1A的选育及其特性. 中国农业科学, 2020, 53(21): 4322–4332.
[31] Eyster LA. Heritable characters of maize. VII. Male sterile., 1921, 12(3): 138–141.
[32] Singleton WR, Jones DF. Heritable characters of maize. XXXV. Male sterile., 1930, 21(6): 266–268.
[33] Eyster WH. Heritable characters of maize. Male sterile., 1931, 22(3): 99–102.
[34] Eyster WH. Heritable characters of maize. XXXIX. Male sterile-3., 1931, 22(4): 117–119.
[35] Albertsen MC, Phillips RL. Developmental cytology of 13 genetic male sterile loci in maize., 1981, 23(2): 195–208.
[36] Skibbe DS, Schnable PS. Male sterility in maize., 2005, 50(3): 367–376.
[37] Xu QL, Yang L, Kang D, Ren ZJ, Liu YJ. Maizeencodes an ATP-binding cassette transporter that is essential for anther development., 2021, 9(6): 1301–1308.
[38] Huo YQ, Pei YR, Tian YH, Zhang ZG, Li K, Liu J, Xiao SL, Chen HB, Liu J.encodes a GDSL lipase essential for male fertility in maize., 2020, 184(3): 1438–1454.
[39] Somaratne Y, Tian YH, Zhang H, Wang MM, Huo YQ, Cao FG, Zhao L, Chen HB. ABNORMAL POLLEN VACUOLATION1 (apv1) is required for male fertility by contributing to anther cuticle and pollen exine formation in maize., 2017, 90(1): 96–110.
[40] Chen XY, Zhang H, Sun HY, Luo HB, Zhao L, Dong ZB, Yan SS, Zhao C, Liu RY, Xu CY, Li S, Chen HB, Jin WW. IRREGULAR POLLEN EXINE1 is a novel factor in anther cuticle and pollen exine formation., 2017, 173(1): 307–325.
[41] Li YF, Huang YM, Pan LL, Zhao Y, Huang W, Jin WW.encodes an ARGONAUTE family protein essential for male fertility in maize., 2021, 29(2): 189–201.
[42] Xie K, Wu SW, Li ZW, Zhou Y, Zhang DF, Dong ZY, An XL, Zhu TT, Zhang SM, Liu SS, Li JP, Wan XY. Map-based cloning and characterization of() gene, encoding a glycerol-3- phosphate acyltransferase., 2018, 131(6): 1363–1378.
[43] Zhu YH, Shi ZW, Li SZ, Liu HY, Liu FX, Niu QK, Li C, Wang J, Rong TZ, Yi HY, Cao MJ. Fine mapping of the novel male-sterile mutant genein maize originated from outer space flight., 2018, 38: 125.
[44] Liu XW, Yue YJ, Gu ZC, Huang Q, Pan ZJ, Zhao ZF, Zheng MM, Zhang ZM, Li C, Yi HY, Yu T, Cao MJ. The characterization and candidate gene isolation for a novel male-sterile mutantin maize., 2021, 40(10): 1957–1970.
[45] Tian YH, Xiao SL, Liu J, Somaratne Y, Zhang H, Wang MM, Zhang HR, Zhao L, Chen HB. MALE STERILE6021 () is required for the development of anther cuticle and pollen exine in maize., 2017, 7(1): 16736.
[46] Li J, Zhang HW, Si XM, Tian YH, Chen KL, Liu JX, Chen HB, Gao CX. Generation of thermosensitive male-sterile maize by targeted knockout of thegene., 2017, 44(9): 465–468.
[47] Xie SY, Luo HB, Huang YM, Wang YX, Ru W, Shi YL, Huang W, Wang H, Dong ZB, Jin WW. A missense mutation in a large subunit of ribonucleotide reductase confers temperature-gated tassel formation., 2020, 184(4): 1979–1997.
[48] Luo HS, Meng DX, Liu HB, Xie MJ, Yin CF, Liu F, Dong ZB, Jin WW. Ectopic expression of the transcriptional regulatorcauses pleiotropic meristem and sex determination defects in maize inflorescences., 2020, 32(12): 3750–3773.
[49] Liu FX, Cao MJ, Rong TZ, Pan GT. Locating maize male sterility gene induced by space flight using microsatellite markers., 2005, 32(7): 753–757.
刘福霞, 曹墨菊, 荣廷昭, 潘光堂. 用微卫星标记定位太空诱变玉米核不育基因. 遗传学报, 2005, 32(7): 753–757.
[50] Wang J, Chen J, Cao MJ. Genetic analysis and gibberellins treatment effects on dwarfism of maize genic male sterile mutant induced by space flight., 2016, 36(6): 707–712.
汪静, 程江, 曹墨菊. 太空诱变玉米核不育突变体矮化的遗传及外施赤霉素分析. 广西植物, 2016, 36(6): 707–712.
[51] Li SZ, Cao MJ, Rong TZ, Pan GT, Zhu YG. SSR mapping of maize genetic male sterile gene induced by space flight., 2007, 17(8): 869–873.
李式昭, 曹墨菊, 荣廷昭, 潘光堂, 朱英国. 太空诱变玉米核不育基因的SSR作图. 高技术通讯, 2007, 17(8): 869–873.
[52] Niu QK, Yang C, Shi ZW, Cao MJ. QTL mapping of dwarf-associated traits in the maize male sterile mutant obtained by space flight., 2018, 36(4): 429–435, 480.
牛群凯, 杨聪, 时子文, 曹墨菊. 玉米太空诱变核不育突变体矮化性状的QTL定位及分析. 四川农业大学学报, 2018, 36(4): 429–435, 480.
[53] Wang Y, Gu RH, Chen HW, Shi HC, Yu XJ, Zhang HJ, Zhao CY, Sun Q, Ke YP. Characterization and genetic mapping of a novel recessive genic male sterile genein maize (L)., 2015, 62(3): 208–214.
[54] Li YL, Yu YL, Liu YX, Li XH, Fu JF. Genetic study on two maize male sterile mutants obtained by space mutagenesis., 2007, 29(6): 738–744.
李玉玲, 余永亮, 刘艳霞, 李学慧, 付家锋. 两份太空诱变玉米雄性不育突变体的遗传研究. 遗传, 2007, 29(6): 738–744.
[55] Li YL, Yu YL, Liu YY, Zhang XH, Fu JF, Zhang ZW, Chen HQ. Mapping on two maize nuclear male sterile genes by space mutagenesis using SSR markers., 2008, 42(3): 245–249.
李玉玲, 余永亮, 刘艳阳, 张学慧, 付家锋, 张中伟, 陈欢庆. 太空诱变玉米核不育基因的微卫星标记. 河南农业大学学报, 2008, 42(3): 245–249, 254.
[56] Xu XB, Yin WJ, Xin YJ, Xu LH, Zhou ZH, Han JL, Ding Y. Genetic analysis of maize male sterile mutant obtained by space flight., 2013, 45(4): 28–31.
徐相波, 阴卫军, 邢燕菊, 徐立华, 周柱华, 韩金龙, 丁一. 太空诱变玉米雄性不育突变体的遗传分析. 山东农业科学, 2013, 45(4): 28–31.
[57] Li XP, Li JL, Chen XP, Zeng X, Long T, An BG, Zhang W, Wu YZ, Huang JP. Screening and molecular characterization of corn male sterile mutants., 2018, 26(3): 12–16, 21.
李新鹏, 李京琳, 陈小朋, 曾翔, 龙湍, 安保光, 张维, 吴永忠, 黄培劲. 玉米突变体库创制及雄性不育突变体鉴定. 玉米科学, 2018, 26(3): 12–16, 21.
[58] Shi Z, Ren W, Zhao YX, Wang XQ, Zhang RY, Su AG, Wang S, Li CH, Wang JR, Wang SS, Zhang YX, Ji YL, Song W, Zhao JR. Identification of a locus associated with genic male sterility in maize via EMS mutagenesis and bulked-segregant RNA-seq., 2021, 9(6): 1263–1269.
[59] 赫忠友, 李元秉, 谭树义, 林力, 洪德开. 温敏核雄性不育玉米的发现及初步研究. 作物杂志, 1995, 11(2): 1–2.
[60] Tang JH, He ZY, Tan SY, Chen WC, Hu YM, Liu ZH, Li ML. Study on the fertility conversion mechanism of the temperature-sensitive genic male-sterile line in maize., 2000, 34(1): 4–6.
汤继华, 赫忠友, 谭树义, 陈伟程, 胡彦民, 刘宗华, 李永亮. 玉米温敏型核雄性不育系育性机制转换研究. 河南农业大学学报, 2000, 34(1): 4–6.
[61] Fu ZY, Zhao GY, Tang JH, Hu YM, He ZY, He J. Comparison about traits related to fertility between two maize thermo-sensitive genic male sterile (TGMS) lines and primary mapping the genes for TGMS., 2004, 2(5): 633–636.
付志远, 赵广远, 汤继华, 胡彦民, 赫忠友, 赫晋. 两种玉米温敏不育系的育性相关性状的比较及不育基因的初步定位. 分子植物育种, 2004, 2(5): 633–636.
[62] Tang JH, Hu YM, Fu ZY, He ZY, He J, Chen WC. Developmant, identification and genetic analysis of a new thermo-sensitive genic male sterile line in maize., 2007, 40(5): 889–894.
汤继华, 胡彦民, 付志远, 赫忠友, 赫晋, 陈伟程. 一种新型玉米温敏核雄性不育系的发现、鉴定及遗传分析. 中国农业科学, 2007, 40(5): 889–894.
[63] Tang JH, Fu ZY, Hu YM, Li JS, Sun LL, Ji HQ. Genetic analyses and mapping of a new thermo-sensitive genic male sterile gene in maize., 2006, 113(1): 11–15.
[64] Zhou HS, Tian ZG, Wu JF, Deng YH. Discovery and primary study on the photoperiod sensitive male sterility in maize., 1997, 5(3): 1–3.
周洪生, 田志国, 吴景锋, 邓迎海. 玉米光敏雄性不育的发现及初步研究. 玉米科学, 1997, 5(3): 1–3.
[65] Prakash S, Chopra VL. Male sterility caused by cytoplasm ofinand.., 1990, 79(2): 285–287.
[66] Zubko MK, Zubko EI, Patskovsky YV, Khvedynich OA, Fisahn J, Gleba YY, Schieder O. Novel 'homeotic' CMS patterns generated invia cybridization withand., 1996, 47(8): 1101–1110.
[67] Ling DH, Liang CY, Ma ZR, Chen MF, He BS. Somaclonal male-sterile mutants and their expressions inrice., 1990, 4(1): 15–21.
凌定厚, 梁承邺, 马镇荣, 陈梅芳, 何炳森. 籼稻体细胞无性系雄性不育变异及其表现. 中国水稻科学, 1990, 4(1): 15–21.
[68] Zhou H, Zhou M, Yang YZ, Li J, Zhu LY, Jiang DG, Dong JF, Liu QJ, Gu LF, Zhou LY, Feng MJ, Qin P, Hu XC, Song CL, Shi JF, Song XW, Ni ED, Wu XJ, Deng QY, Liu ZL, Chen MS, Liu YG, Cao XF, Zhuang CX. RNase ZS1processesUbmRNAs and controls thermosensitive genic male sterility in rice., 2014, 5: 4884.
[69] Djukanovic V, Smith J, Lowe K, Yang MZ, Gao HR, Jones S, Nicholson MG, West A, Lape J, Bidney D, Carl Falco S, Jantz D, Alexander Lyznik L. Male-sterile maize plants produced by targeted mutagenesis of the cytochrome P450-like gene () using a re-designed I-I homing endonuclease., 2013, 76(5): 888–899.
[70] Qi XT, Zhang CS, Zhu JJ, Liu CL, Huang CL, Li XH, Xie CX. Genome editing enables next-generation hybrid seed production technology., 2020, 13(9): 1262–1269.
[71] Chen ZW, Zhao N, Li SS, Grover CE, Nie HS, Wendel JF, Hua JP. Plant mitochondrial genome evolution and cytoplasmic male sterility., 2017, 36(1): 55–69.
[72] Chen LT, Liu YG. Male sterility and fertility restoration in crops., 2014, 65: 579–606.
[73] Dewey RE, Timothy DH, Levings CS. A mitochondrial protein associated with cytoplasmic male sterility in the T cytoplasm of maize., 1987, 84(15): 5374–5378.
[74] Wise RP, Schnable PS. Mapping complementary genes in maize: positioning theandnuclear-fertility restorer loci of Texas (T) cytoplasm relative to RFLP and visible markers., 1994, 88(6–7): 785–795.
[75] Wise RP, Dill CL, Schnable PS. Mutator-induced mutations of thenuclear fertility restorer of T-cytoplasm maize alter the accumulation of T-mitochondrial transcripts., 1996, 143(3): 1383–1394.
[76] Cui XQ, Wise RP, Schnable PS. Thenuclear restorer gene of male-sterile T-cytoplasm maize., 1996, 272(5266): 1334–1336.
[77] Liu F, Cui XQ, Horner HT, Weiner H, Schnable PS. Mitochondrial aldehyde dehydrogenase activity is required for male fertility in maize., 2001, 13(5): 1063–1078.
[78] Liu F, Schnable PS. Functional specialization of maize mitochondrial aldehyde dehydrogenases., 2002, 130(4): 1657–1674.
[79] Dill CL, Wise RP, Schnable PS.andmediate unique T--transcript accumulation, revealing a conserved motif associated with RNA processing and restoration of pollen fertility in T-cytoplasm maize., 1997, 147(3): 1367–1379.
[80] Zabala G, Gabay-Laughnan S, Laughnan JR. The nuclear geneaffects the expression of the mitochondrial chimeric sequence R implicated in S-type male sterility in maize., 1997, 147(2): 847–860.
[81] Wen LY, Chase CD. Pleiotropic effects of a nuclear restorer-of-fertility locus on mitochondrial transcripts in male-fertile and S male-sterile maize., 1999, 35(5): 521–526.
[82] Xiao HL, Zhang FD, Zheng YL. The 5' stem-loop and its role in mRNA stability in maize S cytoplasmic male sterility., 2006, 47(6): 864–872.
[83] Gabay-Laughnan S, Kuzmin EV, Monroe J, Roark L, Newton KJ. Characterization of a novel thermosensitive restorer of fertility for cytoplasmic male sterility in maize., 2009, 182(1): 91–103.
[84] Zhang ZF, Wang Y, Zheng YL. AFLP and PCR-based markers linked to, a fertility restorer gene for S cytoplasmic male sterility in maize., 2006, 276(2): 162–169.
[85] Qin XE, Zhang WL, Dong X, Tian SK, Zhang PP, Zhao YX, Wang Y, Yan JB, Yue B. Identification of fertility-related genes for maize CMS-S via bulked segregant RNA-Seq., 2020, 8: e10015.
[86] Xiao SL, Zang J, Pei YR, Liu J, Liu J, Song W, Shi Z, Su AG, Zhao JR, Chen HB. Activation of mitochondrialgene expression by a nuclear-encoded DREB transcription factor causes cytoplasmic male sterility in maize., 2020, 13(9): 1270–1283.
[87] Qin XE, Tian SK, Zhang WL, Zheng Q, Wang H, Feng Y, Lin YN, Tang JH, Wang Y, Yan JB, Dai MQ, Zheng YL, Yue B. The main restorerof maize S type cytoplasmic male sterility encodes a PPR protein that functions in reduction of the transcripts of., 2021, 14(12): 1961–1964.
[88] Dewey RE, Timothy DH, Levings CS. Chimeric mitochondrial genes expressed in the C male-sterile cytoplasm of maize., 1991, 20(6): 475–482.
[89] Tang JH, Liu ZH, Chen WC, Hu YM, Ji HQ, Ji LY, Xie HL, Huang XL. Mapping major restore genes for C-type cytoplasmic male sterility in maize with SSR marker., 2002, 1(3): 269–273.
[90] Hu YM, Tang JH, Yang H, Xie HL, Lu XM, Niu JH, Chen WC. Identification and mapping ofan inhibitor of therestorer gene for CMS-C in maize (L.)., 2006, 113(2): 357–360.
[91] Jaqueth JS, Hou ZL, Zheng PZ, Ren RH, Nagel BA, Cutter G, Niu XM, Vollbrecht E, Greene TW, Kumpatla SP. Fertility restoration of maize CMS-C altered by a single amino acid substitution within thebHLH transcription factor., 2020, 101(1): 101–111.
[92] Liu YM, Zhao ZF, Lu YL, Li C, Wang J, Dong BX, Liang B, Qiu T, Zeng WB, Cao MJ. A preliminary identification of, a novel restorer gene for CMS-C in maize (L.)., 2016, 4: e2719.
[93] Kohls S, Stamp P, Knaak C, Messmer R. QTL involved in the partial restoration of male fertility of C-type cytoplasmic male sterility in maize., 2011, 123(2): 327–338.
[94] Zheng MM, Yang T, Liu XW, Lü GH, Zhang P, Jiang B, Zhou SF, Lu YL, Lan H, Zhang SZ, Li C, Rong TZ, Cao MJ., a novel QTL for the fertility restoration of maize CMS-C identified by QTL-seq., 2020, 10(7): 2457–2464.
[95] Zhao ZF, Huang L, Liu YM, Zhang P, Wei G, Cao MJ. Genetics of fertility restoration in the isocytoplasm allonuclear C-group of cytoplasmic male sterility in maize., 2018, 40(5): 402–414.
赵卓凡, 黄玲, 刘永明, 张鹏, 魏桂, 曹墨菊. 玉米CMS-C 同质异核不育系育性恢复的遗传研究. 遗传, 2018, 40(5): 402–414.
[96] Mou BT, Zhao ZF, Yue L, Li C, Zhang J, Li ZB, Shen H, Cao MJ. Identification of fertility restoration and molecular mapping of restorer genes in two maize restore lines of CMS-C., 2019, 45(2): 225–234.
牟碧涛, 赵卓凡, 岳灵, 李川, 张钧, 李章波, 申汉, 曹墨菊. 两份玉米CMS-C恢复系的育性恢复力测定及恢复基因的分子标记定位. 作物学报, 2019, 45(2): 225–234.
[97] Zhang HS, Yang HL, Hu DS, Li B, Lin YN, Yao W, Guo ZY, Li HC, Ding D, Zhang ZH, Hu YM, Xue YD, Tang JH. Single-cell RNA sequencing of meiocytes and microspores reveals the involvement of thegene in redox homeostasis of CMS-C maize., 2021, 9(6): 1237–1247.
[98] Wang DX, Skibbe DS, Walbot V. Maize(), a putative β-1,3-galactosyltransferase, modulates cell division, expansion, and differentiation during early maize anther development., 2013, 26(4): 329–338.
[99] Albertsen MC, Fox TW, Leonard AL, Li BL, Loveland BR, Trimnell M. Cloning and use of thegene from maize. US patent US20160024520A1, 2016.
[100] Chaubal R, Anderson JR, Trimnell MR, Fox TW, Albertsen MC, Bedinger P. The transformation of anthers in themutant of maize., 2003, 216(5): 778–788.
[101] Albertsen MC, Fox T, Trimnell M, Wu YZ, Lowe K, Li BL, Faller M.nucleotide sequences impacting plant male fertility and method of using same. US patent US20090038027A1, 2009.
[102] Nan GL, Zhai JX, Arikit S, Morrow D, Fernandes J, Mai L, Nguyen N, Meyers BC, Walbot V. MS23, a master basic helix-loop-helix factor, regulates the specification and development of the tapetum in maize., 2017, 144(1): 163–172.
[103] Moon J, Skibbe D, Timofejeva L, Wang CJR, Kelliher T, Kremling K, Walbot V, Cande WZ. Regulation of cell divisions and differentiation by MALE STERILITY32 is required for anther development in maize., 2013, 76(4): 592–602.
[104] Zhu TT, Li ZW, An XL, Long Y, Xue XF, Xie K, Ma B, Zhang DF, Guan YJ, Niu CF, Dong ZY, Hou QC, Zhao LN, Wu SW, Li JP, Jin WW, Wan XY. Normal structure and function of endothecium chloroplasts maintained by ZmMs33-mediated lipid biosynthesis in tapetal cells are critical for anther development in maize., 2020, 13(11): 1624–1643.
[105] Fox T, DeBruin J, Haug Collet K, Trimnell M, Clapp J, Leonard A, Li BL, Scolaro E, Collinson S, Glassman K, Miller M, Schussler J, Dolan D, Liu L, Gho C, Albertsen M, Loussaert D, Shen B. A single point mutation inresults in dominant male sterility and improves nitrogen use efficiency in maize., 2017, 15(8): 942–952.
[106] Cigan AM, Unger E, Xu RJ, Kendall T, Fox TW. Phenotypic complementation ofmaize requires tapetal expression of MS45., 2001, 14: 135–142.
[107] Wang CJR, Nan GL, Kelliher T, Timofejeva L, Vernoud V, Golubovskaya IN, Harper L, Egger R, Walbot V, Cande WZ. Maize(), an ortholog of rice, modulates cell proliferation and identity in early anther development., 2012, 139(14): 2594–2603.
[108] Evans MMS. The indeterminate gametophyte1 gene of maize encodes a LOB domain protein required for embryo sac and leaf development., 2007, 19(1): 46–62.
[109] Vernoud V, Laigle G, Rozier F, Meeley RB, Perez P, Rogowsky PM. The HD-ZIP IV transcription factor OCL4 is necessary for trichome patterning and anther development in maize., 2009, 59(6): 883–894.
[110] Yadava P, Tamim S, Zhang H, Teng C, Zhou X, Meyers BC, Walbot V. Transgenerational conditioned male fertility of HD-ZIP IV transcription factor mutant: impact on 21-nt phasiRNA accumulation in pre-meiotic maize anthers., 2021, 34(2): 117–129.
[111] Teng C, Zhang H, Hammond R, Huang K, Meyers BC, Walbot V.deficiency confers temperature- sensitive male sterility in maize., 2020, 11(1): 2912.
[112] Margis R, Fusaro AF, Smith NA, Curtin SJ, Watson JM, Finnegan EJ, Waterhouse PM. The evolution and diversification of Dicers in plants., 2006, 580(10): 2442–2450.
[113] Zhai JX, Zhang H, Arikit S, Huang K, Nan GL, Walbot V, Meyers BC. Spatiotemporally dynamic, cell-type- dependent premeiotic and meiotic phasiRNAs in maize anthers., 2015, 112(10): 3146–3151.
[114] Nonomura KI. Small RNA pathways responsible for non-cell-autonomous regulation of plant reproduction., 2018, 31(1): 21–29.
[115] Ono S, Liu H, Tsuda K, Fukai E, Tanaka K, Sasaki T, Nonomura KI. EAT1 transcription factor, a non-cell- autonomous regulator of pollen production, activates meiotic small RNA biogenesis in rice anther tapetum., 2018, 14(2): e1007238.
[116] 刘纪麟. 玉米育种学. 北京: 农业出版社, 1991, 383.
[117] Darrah LL, Zuber MS. 1985 United States farm maize germplasm base and commercial breeding strategies., 1986, 26(6): 1109–1113.
[118] 陈国平. 美国玉米生产及考察后的反思. 作物杂志, 1992, 8(2): 1–4.
[119] Shi ML, Chen QG, Peng CJ, Sun QX, Cheng YJ, Xue L, Lu HH, Huang XL, Hao DR, Mao YX, Hu JR, Chen XH. Study on type, heredity mechanism and trends of breeding utilization method in male sterility of maize (L.)., 2013, 20(1): 21–27.
石明亮, 陈国清, 彭长俊, 孙权星, 程玉静, 薛林, 陆虎华, 黄小兰, 郝德荣, 冒宇翔, 胡加如, 陈小晖. 玉米雄性不育类型、遗传机理及育种利用方法研究动态. 天津农学院学报, 2013, 20(1): 21–27.
[120] 侯玮, 陈举林, 王国胜, 闫保罗, 李平海. 细胞质雄性不育在玉米育种及生产中的应用概述. 安徽农学通报, 2011, 17(1): 64–66.
[121] Ma CH, Li JY, Cui CX, Hao GQ, Zheng JD, Chen X, Li GM. Progress and analysis of CMS in maize., 2006, 14(1): 46–49.
马春红, 李九云, 翟彩霞, 郝桂琴, 郑积德, 陈霞, 李广敏. 玉米细胞质雄性不育(CMS)的研究进展及分析. 玉米科学, 2006, 14(1): 46–49.
[122] Deng YH, Zhou HS. The utilization of genic-male sterility genes in maize., 1998, 6(2): 1–5.
邓迎海, 周洪生. 玉米雄性不育基因的利用. 玉米科学, 1998, 6(2): 1–5.
[123] Jia JZ, Li Y. Plant genomics and gene discovery in germplasm resources., 2004, 37(11): 1585–1592.
Exploration and utilization of maize male sterility resources
Ziwen Shi, Qing He, Zhuofan Zhao, Xiaowei Liu, Peng Zhang, Moju Cao
Male sterility refers to the defective development of male reproductive organs, which led to plants incapable of producing normal and functional pollens. Maize (L.) is one of the most important food crops, as well as one of the earliest crops to utilize heterosis in breeding. Single cross hybrid has been the main type of maize heterosis utilization for a long time. The planting area of maize hybrid in China has been stable at about 620 million mu. More than one billion kilograms of commercial hybrid seeds are needed each year, and the annual seed production area has been stable at about 2.5 million mu in recent years. So far, manual emasculation has been the major way of maize hybrid seed production in China, which is laborious and time consuming. Generally, spatial isolation is necessary for maize hybrid seed production, this requirement results in only some regions in the country suitable for maize hybrid seed production. Manual emasculation requires seasonal demand of labors. At present, with the urbanization of a large number of rural laborers, the seed production regions experience a serious labor shortage. Accordingly, the cost of seed production increases with the rising of land rent and labor costs. In addition, it is difficult to guarantee the seed purity with manual or mechanical emasculation for hybrid seed production. However, incorporating male sterility into maize hybrid seed production could reduce its cost and ensure hybrid seed purity. It can also avoid the difficulties of manual or mechanical emasculation in field operation under extreme weather conditions. Therefore, it is the inevitable trend of development in the maize seed industry. In this review, we summarize the exploitation and creation of maize cytoplasmic male sterility (CMS), maizegenic male sterility (GMS) resources in China, and the developing process from natural discovery to targeted creation of male sterility resources in plants, and the research progress of maize male sterility. We then analyze the application status and existing problems of maize male sterility, based on the development trend of maize seed industry, as well as the research and application status of male sterility in China. We also identify seven aspects that need to be further strengthen, thereby providing the reference for the creation, research and utilization of maize male sterility in the future.
L.; male sterility; heterosis;application status
2021-09-08;
2021-11-09;
2022-01-17
国家自然科学基金项目(编号:31771876)资助[Supported by the National Natural Science Foundation of China (No. 31771876)]
时子文,在读博士研究生,专业方向:作物遗传育种。E-mail: ziwen_shi@163.com
曹墨菊,教授,博士生导师,研究方向:玉米雄性不育。E-mail: caomj@sicau.edu.cn
10.16288/j.yczz.21-327
(责任编委: 宋任涛)

