1株奶牛源约翰逊不动杆菌的分离鉴定
田秋丰,张 红,尹珺伊,史同瑞,张 军,刘秋瑾,王 岩,秦平伟,王 欢,白长胜,陈楠楠,朱庆贺,苗 艳
(黑龙江省农业科学院畜牧兽医分院,齐齐哈尔 161005)
不动杆菌属(Acinetobacterspp.)最早是由荷兰微生物学家Beijerinck于1911年从土壤中分离出来,不动杆菌典型特征是无芽胞、无鞭毛、无动力,生存能力强,广泛分布于土壤、水塘等自然界中[1-3],并且具有广泛的耐药性[4]。约翰逊不动杆菌引起畜禽动物感染发病的报道极少,仅有少量报道从白额雁脏器[5]、肉牛鼻腔拭子[6]、草鱼肠道[7]等分离到约翰逊不动杆菌。本研究从奶牛垫料中分离到1株约翰逊不动杆菌,并进行了生物学特性的研究,研究结果可为奶牛源约翰逊不动杆菌病的防治提供一定的参考依据。
1 材料与方法
1.1 材料
1.1.1 样品 从齐齐哈尔市某奶牛场,随机无菌采集奶牛垫料,低温运输至实验室。
1.1.2 主要试剂及培养基 革兰染色试剂盒购自比克曼生物科技有限公司;基因组DNA抽提试剂盒购自天根生化科技(北京)有限公司;细菌微量生化反应管和药敏纸片购自杭州滨和微生物试剂有限公司。营养琼脂、肉汤培养基、鲜血琼脂培养基购自青岛海博生物技术有限公司。
1.1.3 实验动物 选用健康的9周龄、体重约25 g的雌性 BALB/c 小鼠10只,购自齐齐哈尔医学院实验动物中心。
1.2 方法
1.2.1 分离菌纯化及革兰染色 在超净台内将采集的垫料用无菌生理盐水稀释,混匀后吸取稀释液100 μL涂布于高压灭菌后的营养琼脂平板、血平板,37 ℃恒温需氧培养24 h,挑取平板上的典型单菌落进行纯化培养。将3次划线传代纯培养后的分离菌命名为HLJBDJ-1,挑取纯化后的菌落进行革兰染色,在1 000倍光镜下观察细菌形态。
1.2.2 生化试验 按照《伯杰细菌鉴定手册》进行鉴定,对纯培养分离菌株在超净台内无菌接种到微量生化管进行精氨酸双水解酶、精氨酸脱羧、葡萄糖、乳糖、蔗糖、木糖醇、半乳糖、麦芽糖、果糖、甘露醇、葡萄糖磷酸盐、硫化氢、动力试验、尿素等生化试验,观察并记录结果。
1.2.3 16S rDNA序列测定及同源性分析 不动杆菌的鉴定采用PCR方法进行判定,选用细菌16S rDNA通用引物扩增,引物序列为 27F: 5′-AGAGTTTGATCCTGGCTCAG-3′,1492R: 5′-GGYTACCTTGTTACGACTT-3′。25 μL PCR反应体系:DNA模板1 μL,上、下游引物各0.5 μL(引物浓度为10 μmol·L-1),2×TaqPCR Master Mix 12.5 μL,加超纯水至25 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s, 72 ℃延伸1 min,共30个循环;72 ℃延伸20 min, 4 ℃保存。反应结束后,取7 μL进行1%琼脂糖凝胶电泳,对阳性PCR产物进行测序分析。将测序结果与NCBI数据库中参考菌株进行Blast同源比对分析,并利用MEGA6.0软件中邻接法(Neighbor-joining)构建系统进化树。
1.2.4 动物致病性试验 将纯化后分离菌接种于营养肉汤培养基中,37 ℃ 培养12~24 h,将分离菌用生理盐水调整浓度至6.9×108CFU·mL-1。将10只健康BALB/c 小鼠,随机分为试验组、对照组,每组5只,试验组每只腹腔注射0.2 mL菌液,对照组腹腔注射等体积无菌生理盐水。接种后分开饲养,观察记录小鼠死亡及发病情况。无菌剖检死亡小鼠,观察组织器官病变情况,无菌采取心、肝等组织,按照“1.2.1”方法分离细菌。
1.2.5 药敏试验 本分离菌药敏试验采用K-B纸片琼脂扩散法。取100 μL新鲜菌液均匀涂布在营养琼脂平板上,待菌液稍干后无菌操作贴上药敏片,置37 ℃温箱培养18~24 h,使用游标卡尺测量抑菌圈直径(mm),记录菌株的敏感程度,参照美国临床实验室标准化协会(CLSI 2019)抗菌药物敏感性标准,判断分离菌对不同抗生素的敏感性。
2 结 果
2.1 细菌的培养特征及镜检
该分离菌在营养琼脂平板上需氧培养生长良好,培养12 h菌落呈露珠状,菌落表面光滑、灰白色、半透明,直径1~2 mm(图1A);在血琼脂平板上可见圆润、半透明、不溶血的白色菌落(图1B)。挑取已纯化菌落进行革兰染色,镜下可见分离菌为阴性,可见菌体多为短杆状,常双排列,偶见单个零散排列(图1C)。
2.2 生化鉴定
该分离菌对精氨酸双水解酶和精氨酸脱羧酶呈阳性,对葡萄糖、乳糖、蔗糖、木糖醇、半乳糖、麦芽糖、果糖、甘露醇、葡萄糖磷酸盐、硫化氢、硝酸盐还原反应、动力试验、尿素、枸橼酸盐、丙二酸盐呈阴性。参照《伯杰氏系统细菌学手册》,分离菌HLJBDJ-1与不动杆菌属标准生化试验结果基本一致。

A.营养琼脂培养基;B.绵羊血琼脂培养基;C.革兰染色镜检(1 000×)A. Nutrient agar medium; B.Sheep blood agar medium; C. Gram staining morphology(1 000×)图1 分离菌培养特性及形态观察Fig.1 Culture characteristics and morphological observation of isolated bacteria
2.3 PCR检测与测序分析
分离菌16S rDNA基因PCR扩增后条带大小约1 300 bp(图2)。测序结果显示,分离菌16S rDNA核苷酸序列长为1 283 bp,将其进行Blast对比分析,结果显示,该分离菌与不动杆菌属同一分支,与GenBank收录的约翰逊不动杆菌KJ806475(福建株)相似性最近,相似性为99.45%,与溶血不动杆菌、琼氏不动杆菌等亲缘性较远(图3)。
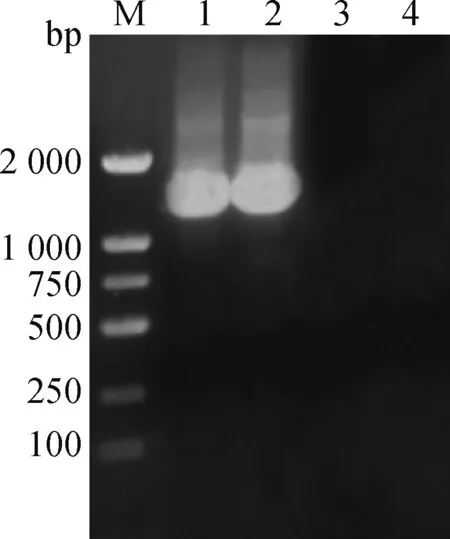
M. DNA相对分子质量标准;1~2. 分离菌株 16S rDNA PCR扩增产物;3~4. 阴性对照N. DL2000 DNA marker;1-2.16S rDNA PCR amplication products of isolated strain;3-4. Negative control图2 分离菌株16 S rDNA的PCR扩增Fig.2 PCR amplification of 16S rDNA of isolated strains
2.4 动物致病性试验
接种后3 h内,试验组全部开始表现出精神萎顿、腹式呼吸、畏寒抱团,濒死小鼠张口呼吸等症状,8 h内死亡4只小鼠,死亡率为80%(4/5),剩余1只 小鼠于48 h后恢复正常状态。对照组小鼠无死亡,一切正常。剖检死亡小鼠可见肠壁变薄积气积液,肝充血肿大,呈暗红色。从死亡小鼠的肝和肠道进行细菌分离,经鉴定均分离出HLJBDJ-1,证明HLJBDJ-1对小鼠具有较强的致病性。
2.5 药敏试验
HLJBDJ-1对链霉素、复方新诺明、阿米卡星、卡那霉素、妥布霉素、庆大霉素敏感,对头孢噻肟、头孢呋辛中度敏感,对青霉素、克林霉素、红霉素、氨苄西林耐药,具体见表1。
3 讨 论
目前,对不动杆菌属的研究多数被集中在鲍曼不动杆菌上,很少人研究属内其他菌种[8]。像鲍曼不动杆菌一样,约翰逊不动杆菌广泛分布于医院内和自然环境中[9-10],在医院器具、患者痰和血液标本、土壤、海洋等均可分离到[11-13]。约翰逊不动杆菌具有较强的外界抵抗力,在一些杀菌剂或者高磷高盐环境下依然能够生存[14]。此外还具有光修复机制,在3 931 J·m-2的紫外线强度照射下,依然可以存活36 h,一段时间内能够修复受损的DNA[15]。
本研究发现,分离菌除精氨酸双水解酶、精氨酸脱羧酶试验为阳性外,糖发酵、硝酸盐还原动力试验均为阴性,基本符合不动杆菌“三阴”的生化特性,说明对糖类成分分解利用能力极低。但与奉鉴金等研究并不完全一致,表明细菌生化试验仅作为未知细菌鉴定的初步判定方法,再结合核酸扩增或基因测序等分子生物学检测方法,可以进一步分型。不动杆菌具有广泛的耐药性,耐药性与其复杂的耐药机制有关。本研究中,分离菌对链霉素等6种药物敏感,对青霉素、氨苄西林等耐药,与奉鉴金等报道的主要对磺胺类和四环素类抗生素耐药的结果不一致,可能是不同动物来源的细菌地域差异性所导致。
4 结 论
从奶牛垫料中分离到1株约翰逊不动杆菌,该菌对链霉素等6种药物高度敏感,用6.9×108CFU·mL-1剂量的分离菌攻毒健康BALB/c小鼠,小鼠死亡率达80%,提示该分离菌株具有较强的毒力。
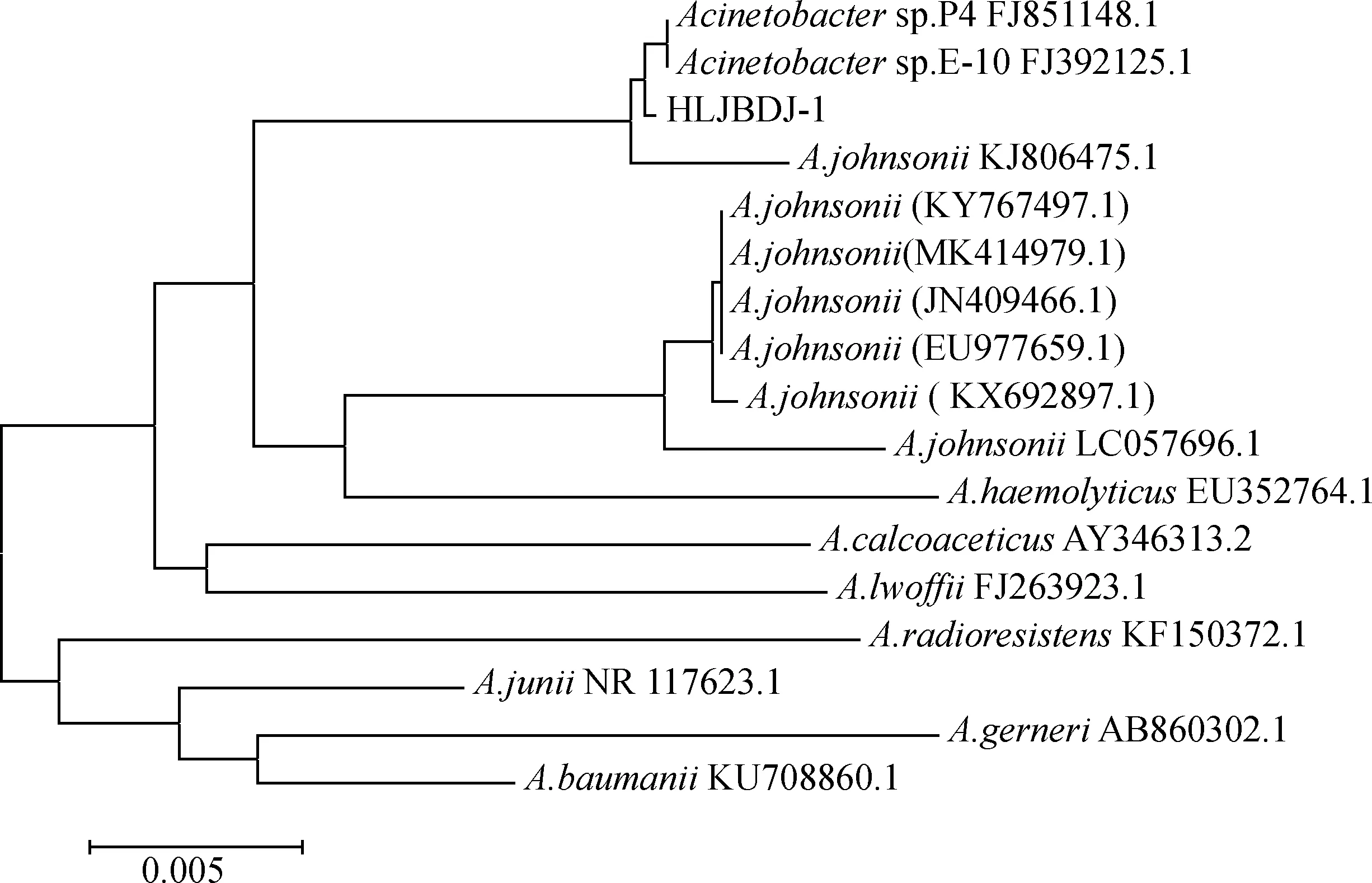
图3 分离菌株16 S rDNA的系统进化树Fig.3 Phylogenetic tree of isolated strains based on 16S rDNA
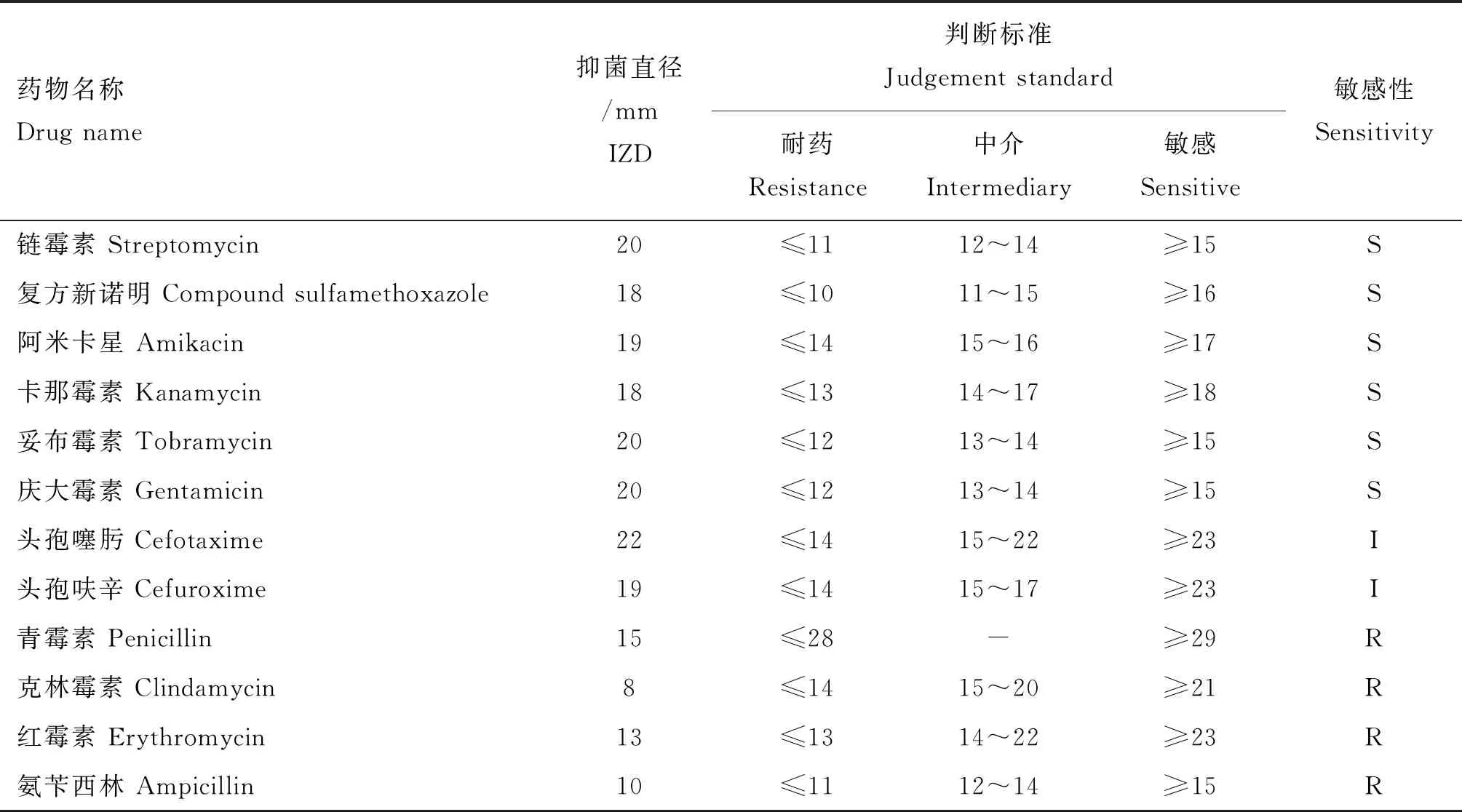
表1 药敏试验结果

