前噬菌体对猪链球菌毒力、环境适应性、耐药性及代谢活动的影响
韩雪姣,李 亮,占松鹤,段倩倩,崔丽荣,刘雪兰,孙 裴,魏建忠,李 郁*
(1. 安徽农业大学动物科技学院,合肥 230036; 2. 安徽省动物疫病预防与控制中心,合肥 230091)
猪链球菌(Streptococcussuis,SS)是世界范围内引起猪链球菌病最主要的病原,同时也可造成人类感染并发病,给食品安全和公共卫生带来威胁。SS的致病机制复杂,众多毒力因子在SS不同的致病阶段发挥作用,最终导致疾病的发生。发病猪临床表现为败血症、脑膜炎、关节炎或急性死亡等[1]。SS抗原结构复杂,临床上使用的疫苗交叉保护力较弱。因此在实际生产中使用抗生素是对猪链球菌病进行防控的主要手段,这也造成了SS对抗生素的耐药性日趋增强。此外,形成生物被膜(bacterial biofilms,BF)是细菌或真菌为了适应自然环境而采取的一种生存方式。相对于BF外的细菌,BF内的细菌对抗生素的敏感性要低很多,对于酸有更强的抵抗力且具有更强的抗饥饿能力[2]。已知SS也具有形成BF的能力,BF的形成不可避免地增强了SS对外界环境的适应性。
噬菌体是能够感染细菌、放线菌、螺旋体、霉形体以及蓝细菌等微生物的病毒,也称为细菌病毒[3]。整合到细菌DNA上或以质粒形式存在的噬菌体基因叫前噬菌体,含有前噬菌体的细菌称为溶原菌。前噬菌体与细菌性病原的毒力关系紧密,其编码多种毒力因子,并对溶原菌的环境适应性和耐药性具有一定影响。大肠杆菌O157:H7中由于存在两个编码志贺毒素的前噬菌体,而具备了产生志贺毒素的能力[4]。SS分离株SsUD由于整合了携带有四环素耐药基因的前噬菌体,从而产生了对四环素的耐药性[5]。此外,前噬菌体还具有调节BF形成的能力。在放线杆菌和粪肠球菌中,相比不含前噬菌体的菌株,前噬菌体存在的菌株具有更强的BF形成能力[6-7]。
本研究前期对199株分离自临床发病猪的SS进行了前噬菌体解旋酶基因和末端酶基因的鉴定,鉴定结果显示199株SS分离株中前噬菌体阳性菌有39株(解旋酶基因和末端酶基因均为阳性的有31株,解旋酶基因阴性末端酶基因阳性的有7株,解旋酶基因阳性末端酶基因阴性的有1株),其余160株为前噬菌体阴性菌。为了探究前噬菌体与SS毒力、环境适应性、耐药性及代谢活动之间的关系,本研究以39株前噬菌体阳性菌为试验菌株,依照单一变量原则,根据前噬菌体阳性菌的血清型、毒力基因型、多位点序列分型(multilocus sequence typing,MLST)结果和溶血性等背景信息选取7株前噬菌体阴性菌为对照菌株,共计46株SS进行研究。以期为SS 致病机制的研究提供科学依据,为探究前噬菌体对SS生理活动及遗传进化的影响奠定基础。
1 材料与方法
1.1 受试菌株
39株前噬菌体阳性菌及7株前噬菌体阴性菌均由安徽农业大学动物传染病实验室分离鉴定并保存,具体信息见表1。
1.2 质控菌株
肺炎链球菌标准株ATCC49619,由安徽农业大学动物传染病实验室保存。
1.3 实验动物
体重18~22 g,6~8周龄清洁级雌性昆明小鼠购于安徽医科大学动物实验中心。
1.4 主要试剂
含0.6%酵母浸膏胰酪胨大豆琼脂培养基(TSA-YE)、含0.6%酵母浸膏胰酪胨大豆肉汤培养基(TSB-YE)、水解酪蛋白琼脂培养基(MHA)、MH肉汤培养基购自绍兴天恒生物科技有限公司;小牛血清购自上海羽朵生物科技有限公司;SuperReal PreMix Plus(SYBR Green)和FastKing RT Kit(With gDNase)购自天根生化科技有限公司。
1.5 药敏纸片和抗生素粉剂
17种抗生素的药敏纸片和10种抗生素粉剂购于绍兴天恒生物科技有限公司。
1.6 致病性试验
将39株前噬菌体阳性菌和7株前噬菌体阴性菌进行复苏、培养并调整菌液浓度为6.3×109CFU·mL-1。 试验组小鼠腹腔注射菌液(每组5只), 0.3 mL·只-1。对照组小鼠注射等体积生理盐水。观察7 d,记录小鼠死亡情况。
根据致病性试验结果,筛选出使小鼠死亡率≥80%的菌株,每株菌设置5个剂量组(108~1010CFU·mL-1), 各剂量组配置10只小鼠,腹腔注射菌液,0.3 mL·只-1。另取10只小鼠注射等体积生理盐水,作为阴性对照。攻毒后观察7 d,采用累积法(Reed-Muench)计算菌株对小鼠的LD50。
1.7 组织荷菌数测定和组织病理学观察
根据LD50测定结果,结合分离株的背景信息,选择4株前噬菌体阳性菌(BB15-4、FY13-4、HF13-21和BZ17-2)和1株前噬菌体阴性菌(BB14-5)进行组织荷菌数测定和组织病理学观察。试验组小鼠腹腔注射SS菌液,浓度为1/5LD50[8-10],0.3 mL·只-1;阴性对照组注射等体积生理盐水。攻毒36 h后每组取3只小鼠,采集不同脏器(肺、肝、脾、肾、心和脑)测定组织荷菌数。操作如下:将脏器置于1.5 mL研磨管中,称重并记录,按照一定比例加入灭菌PBS和磁珠,使用全自动研磨仪进行研磨。研磨液10倍递增稀释后取稀释度为100、10-1、10-2的组织悬液均匀涂布于含5%小牛血清的TSA培养基,37 ℃静置培养24 h,统计活菌数;每组另取2只小鼠,采集上述不同脏器常规制作组织切片,经HE染色后观察病理变化。
1.8 BF形成能力的测定
利用结晶紫染色法[11-12]测定39株前噬菌体阳性菌和7株前噬菌体阴性菌的BF形成能力。判断标准:将空白对照组平均OD600 nm值加上其3倍标准差(s),作为细菌BF形成的临界值(ODc),OD600 nm≤ODc判为无BF形成能力(-),ODc
1.9 药敏试验
1.9.1 纸片扩散法(K-B法) 以肺炎链球菌ATCC49619为质控菌株,根据美国临床实验室标准委员会(CLSI)推荐的K-B纸片法测定39株前噬菌体阳性菌和7株前噬菌体阴性菌对9类17种常见抗生素的敏感性。药敏试验结果参照CLSI(2020)标准和药敏纸片说明书进行判定。
1.9.2 微量肉汤稀释法 参照CLSI抗菌药物敏感性试验操作标准,采用微量肉汤稀释法测定4株前噬菌体阳性菌(BB15-4、FY13-4、HF13-21和BZ17-2)和1株前噬菌体阴性菌(BB14-5)对抗菌药物的MIC并判断菌株对各种药物的敏感程度。
1.10 转录组测序及测序结果的验证
对4株前噬菌体阳性菌(BB15-4、FY13-4、HF13-21和BZ17-2)和1株前噬菌体阴性菌(BB14-5)进行培养,并在对数生长期进行菌体采集,采集的菌体送至基迪奥生物科技有限公司进行RNA提取及转录组测序。根据测序结果对差异表达基因进行分析,并随机选取部分差异表达基因设计引物,见表2。以16S rRNA为内参基因,采用SYBR Green I法进行mRNA表达量分析,每个基因做3次重复,数据采用2-△△Ct处理。

表2 qPCR引物序列
1.11 数据处理
本试验所有数据的差异性统计均采用SPSS 20.0软件进行分析,数据绘图均使采用Graphpad.7.0软件进行绘制。
2 结 果
2.1 致病性试验
前噬菌体阳性菌和阴性菌攻毒后,发病小鼠均表现出食欲不振、扎堆聚集、被毛粗乱、眼分泌物增多的症状,部分发病小鼠除出现上述临床症状外,还在攻毒3 d左右出现神经症状(转圈,共济失调)。对死亡的小鼠进行剖检,可见大脑充血;肺出现出血点,肿大;肝明显淤血,质地易碎;脾肿大,边缘钝圆,有明显淤血;肾充血肿大。空白对照组小鼠剖检无异常变化。39株前噬菌体阳性菌中对小鼠致死率为100%的有4株,占比10.2%;致死率为80%的有7株,占比17.9%;致死率≤60%的有28株,占比71.9%。7株前噬菌体阴性菌中对小鼠致死率为100%的有1株,占比14.3%;致死率为80%的有1株, 占比14.3%;致死率≤60%的有5株,占比71.4%。
选取使小鼠死亡率≥80%的11株前噬菌体阳性菌和2株前噬菌体阴性菌测定LD50。前噬菌体阳性菌BB15-4、HF10-1、HF13-24、FY13-4、HF13-32、LA16-2、HF09-2、HF13-21、BZ17-2、XC14-1和BZ10-3的LD50分别为8.4×108、1.07×109、1.53×109、1.56×109、1.66×109、1.76×109、1.81×109、1.84×109、2.09×109、2.24×109、和2.36×109CFU·只-1。前噬菌体阴性菌HF13-16和BB14-5的LD50分别为1.88×109和2.72×109CFU·只-1。统计学分析结果显示,前噬菌体阳性菌和阴性菌之间LD50差异不显著(P>0.05)。
2.2 组织荷菌数测定及病理切片观察
2.2.1 组织荷菌数测定 结果见表3。BB15-4(LD50为8.4×108CFU·只-1)攻毒组小鼠肺、肝、心中的载菌量显著高于其余4株攻毒组(P<0.05);BB15-4和FY13-4(LD50为1.56×109CFU·只-1)攻毒组小鼠脑组织中的载菌量均显著高于其余3株攻毒组(P<0.05);虽然BB15-4、FY13-4和HF13-21(LD50为1.84×109CFU·只-1)攻毒组在小鼠脾中的载菌量差异不显著(P>0.05),但BB15-4攻毒组的载菌量显著高于BZ17-2(LD50为2.09×109CFU·只-1)和BB14-5(LD50为2.72×109CFU·只-1)攻毒组(P<0.05)。
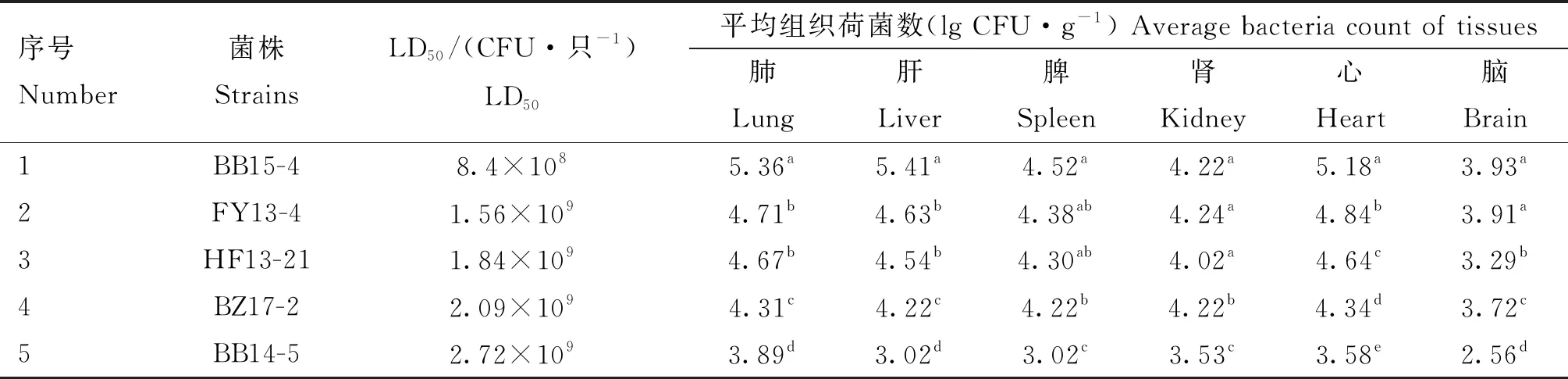
表3 组织荷菌数测定结果
2.2.2 病理变化 BB15-4攻毒后小鼠心肌纤维坏死,空泡变性;肝细胞固缩坏死;脾组织白髓区淋巴细胞稀疏,脾小结萎缩;肺泡壁增厚,轻微实质化;肾间质血管充血扩张;脑组织海马区神经元排列稀疏紊乱;心、肝、脾、肾和脑组织均可见炎症细胞浸润。详见图1。FY13-4攻毒后小鼠心肌纤维间隙增宽;脾组织白髓区淋巴细胞稀疏;肺组织可见支气管淋巴结细胞;肾小球明显萎缩,肾小管上皮细胞轻微疏松水肿;心、肝、脾和脑组织均可见炎症细胞浸润。详见图2。HF13-21攻毒后小鼠肝细胞水肿;少量肾小球明显萎缩;心、肝、脾和肾组织均可见炎症细胞浸润;肺和脑组织基本正常。详见图3。BZ17-2攻毒后小鼠心肌纤维间质充血扩张;肝细胞轻微水肿;脾小结萎缩;脑组织海马区神经元排列稀疏;肝、脾和肾组织均可见炎症细胞浸润;肺组织基本正常。详见图4。BB14-5攻毒后小鼠心肌组织仅心肌纤维间隙增宽;肝细胞轻微水肿;脑组织血管轻微充血扩张;脾和肾组织少量炎症细胞浸润;肺组织基本正常。详见图5。阴性对照组小鼠各脏器结构正常,详见图6。
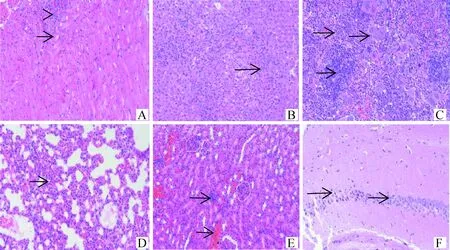
A.心;B.肝;C.脾;D.肺;E.肾;F.脑。下同A. Heart; B. Liver; C. Spleen; D. Lung; E. Kidney; F. Brain. The same as below图1 BB15-4组小鼠组织病理变化(HE染色,200×)Fig.1 Histopathological changes of mice in BB15-4 group (HE staining, 200×)

图2 FY13-4组小鼠组织病理变化(HE染色,200×)Fig.2 Histopathological changes of mice in FY13-4 group (HE staining, 200×)
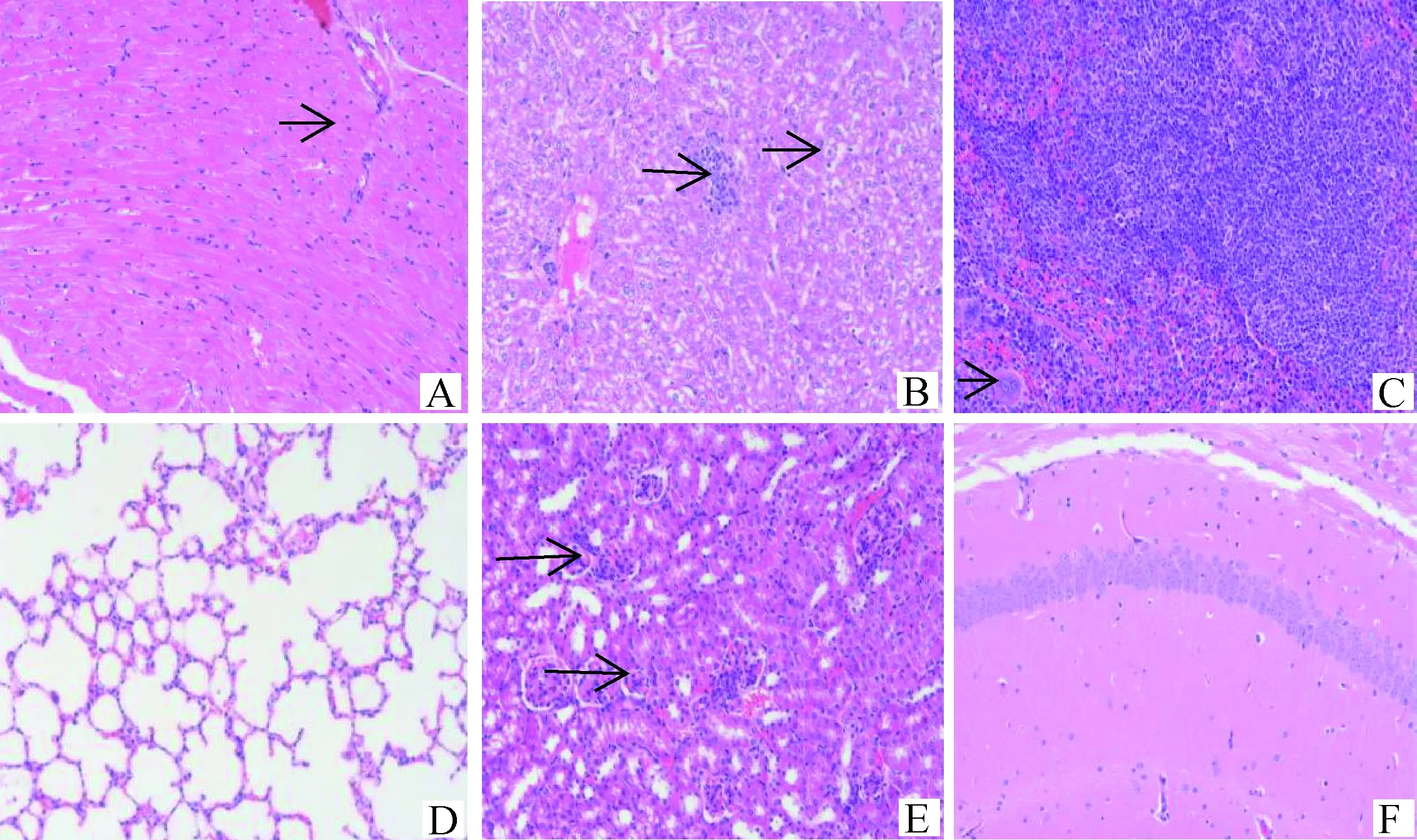
图3 HF13-21组小鼠组织病理变化(HE染色,200×)Fig.3 Histopathological changes of mice in HF13-21 group (HE staining, 200×)
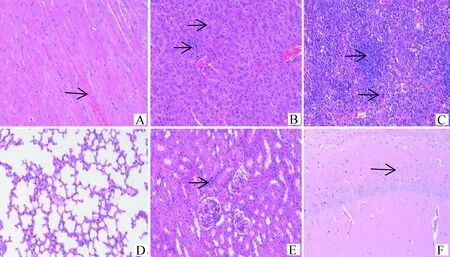
图4 BZ17-2组小鼠组织病理变化(HE染色,200×)Fig.4 Histopathological changes of mice in BZ17-2 group (HE staining, 200×)
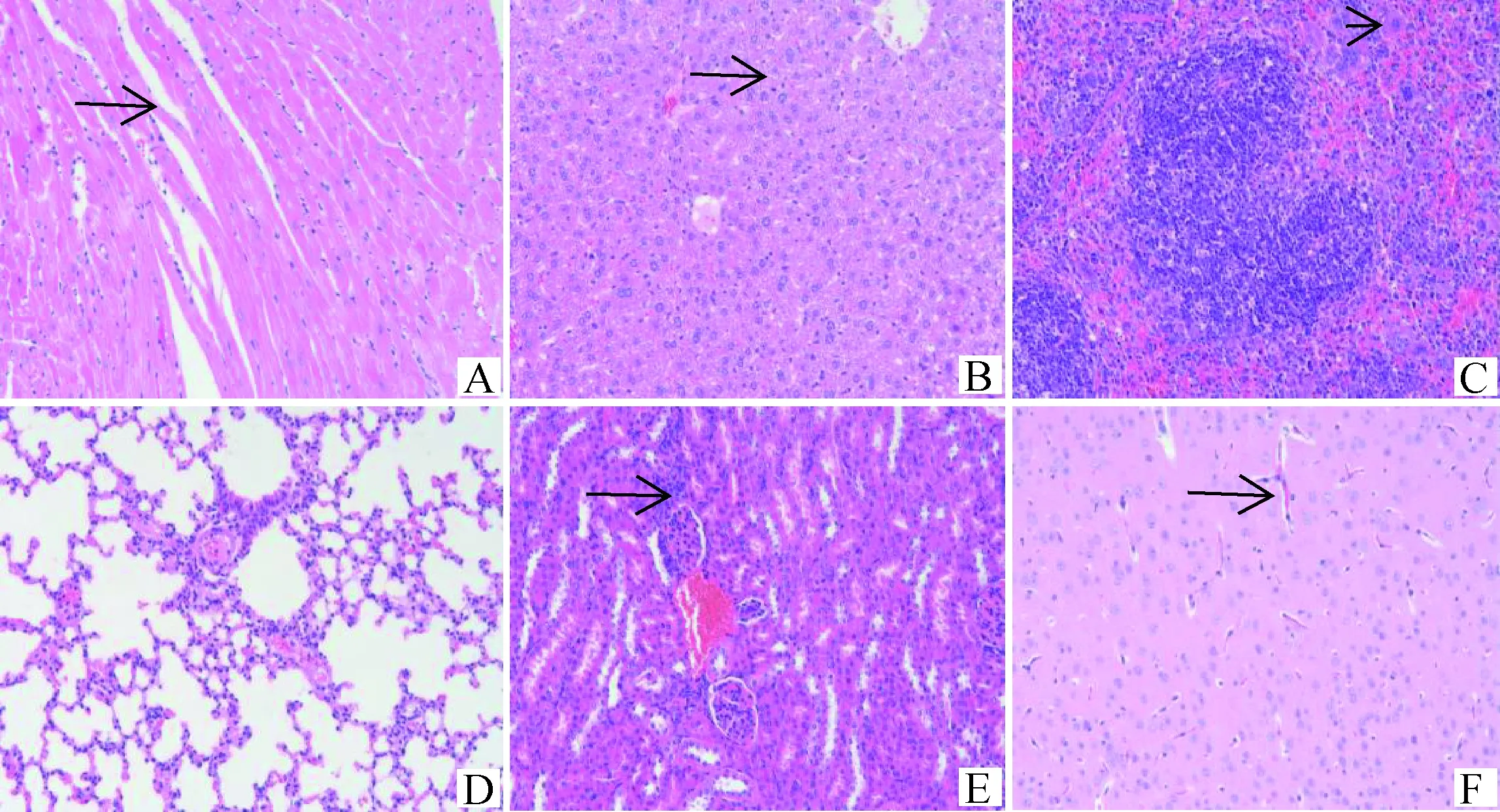
图5 BB14-5组小鼠组织病理变化(HE染色,200×)Fig.5 Histopathological changes of mice in BB14-5 group (HE staining, 200×)
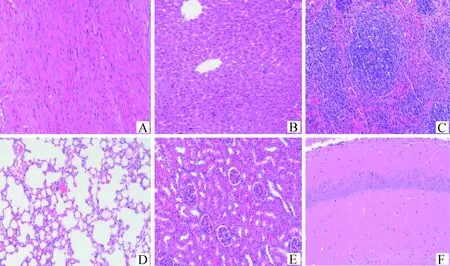
图6 阴性对照组小鼠组织病理变化(HE染色,200×)Fig.6 Histopathological changes of mice in negative control group (HE staining, 200×)
2.3 BF形成能力的测定结果
39株前噬菌体阳性菌BF形成阳性率为97.4%(38/39),其中,成膜力强(3+)的15株,占比38.4%;成膜力中等(2+)的14株,占比35.8%;成膜力弱(1+)的9株,占比23.0%;阴性(-)的1株,占比2.5%。7株前噬菌体阴性菌BF形成阳性率为100%,其中成膜力强(3+)的5株,占比71.4%;成膜力中等(2+)的株2株,占比28.5%。选取成膜力强(3+)的HF13-11和阴性(-)的HN16-1,通过扫描电镜进行BF形态观察,见图7。HF13-11(3+)为球型,菌体周围充满黏液等分泌物并将其相互粘连,形成致密的立体结构,几乎覆盖整个爬片。HN16-1(-)呈椭圆形,菌体周围无黏液等分泌物存在,密度小,在爬片上呈短链或散在分布。
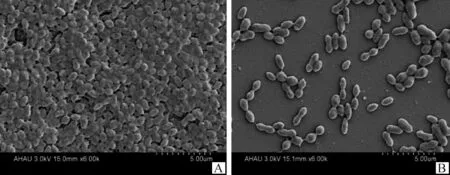
A. HF13-11 (3+); B. HN16-1 (-)图7 扫描电镜下SS的BF(6 000×)Fig.7 SS biofilm under scanning electron microscope(6 000×)
2.4 药敏试验
K-B法结果显示,39株前噬菌体阳性菌和7株前噬菌体阴性菌对万古霉素、头孢吡肟、氨苄西林的敏感率均高,其次为氧氟沙星;对四环素、红霉素、克林霉素、阿奇霉素的耐药率均高,其次为头孢曲松和多西环素,见表4。
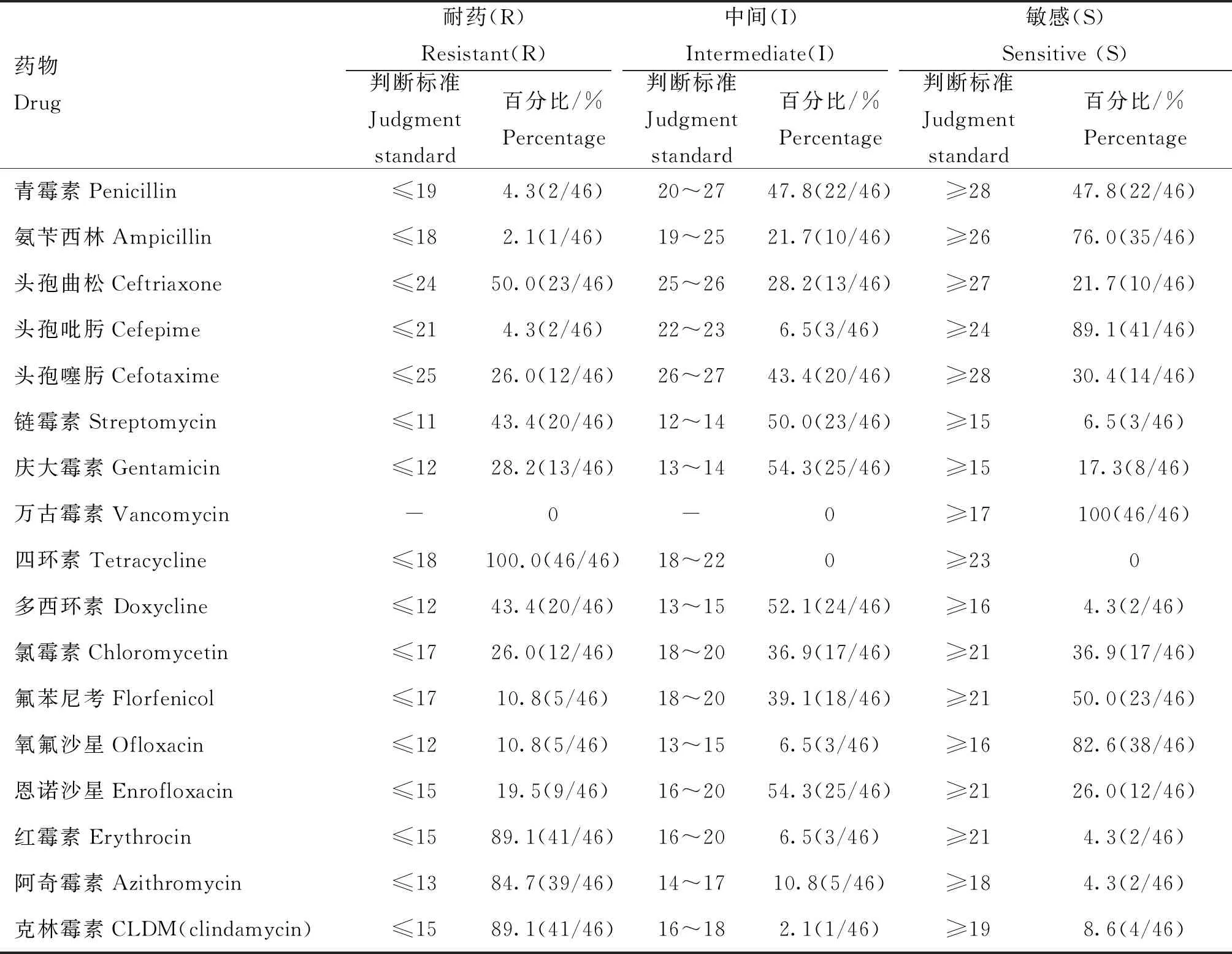
表4 药敏试验结果(K-B法)
微量肉汤稀释法测定10种抗生素对前噬菌体阳性菌BB15-4、FY13-4、HF13-21、BZ17-2和前噬菌体阴性菌BB14-5的MIC,与K-B法的结果整体一致。抗菌药物的MIC值及菌株的敏感性统计结果见表5。
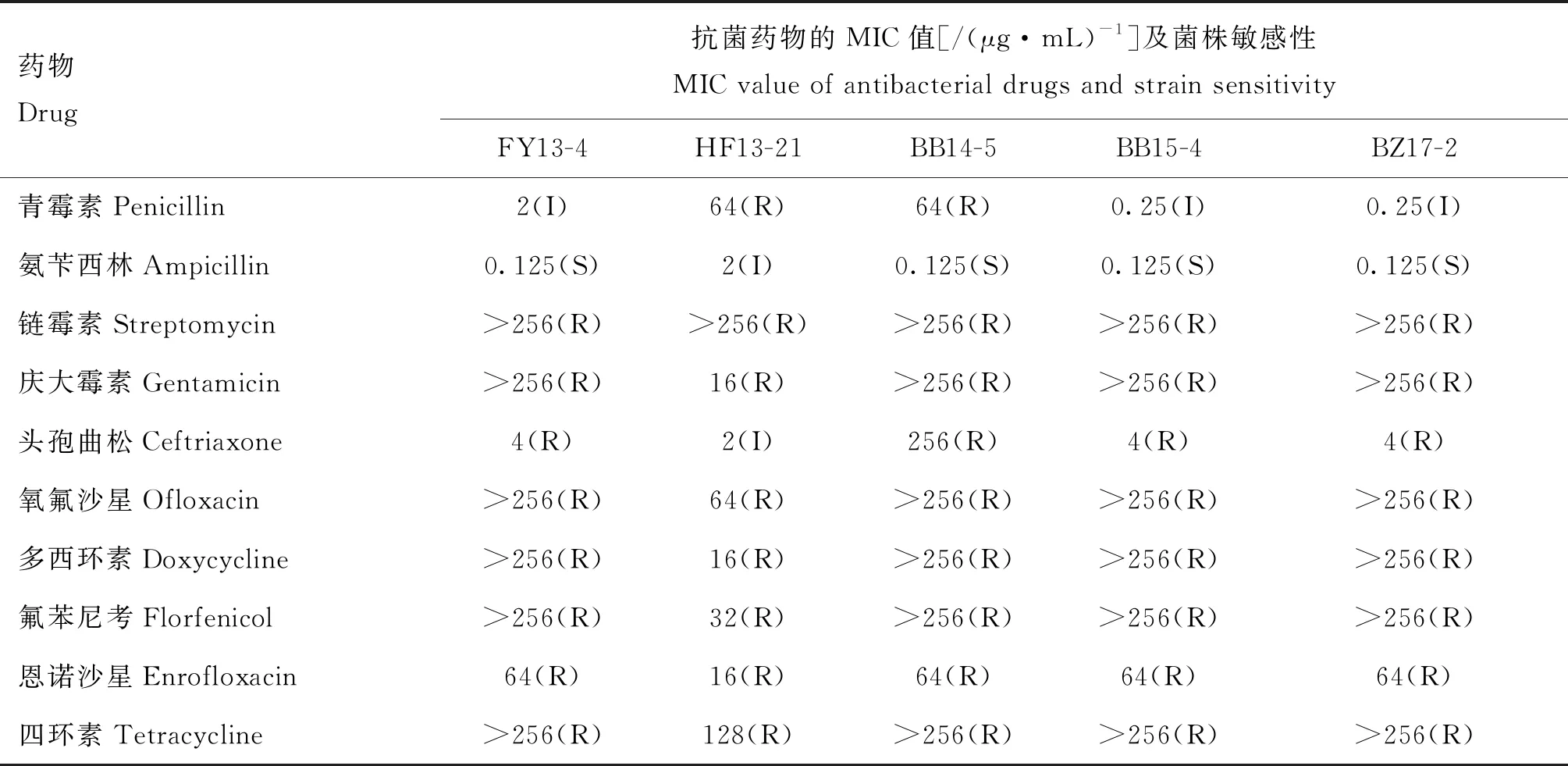
表5 抗菌药物的MIC值及菌株敏感性统计表
前噬菌体阳性菌和阴性菌的多重耐药情况统计见表6。39株前噬菌体阳性菌中92.3%呈现多重耐药,其中3重耐药13株,占比33.3%;4重耐药4株,占比10.3%;5重耐药8株,占比20.5%;6重耐药7株,占比17.9%;7重耐药4株,占比10.3%。7株前噬菌体阴性菌均为多重耐药,其中3、4、6和8重耐药各1株,均占比14.3%;5重耐药3株,占比42.8%。统计学分析结果显示,前噬菌体阳性菌与阴性菌之间在耐药性方面无显著差异(P>0.05)。
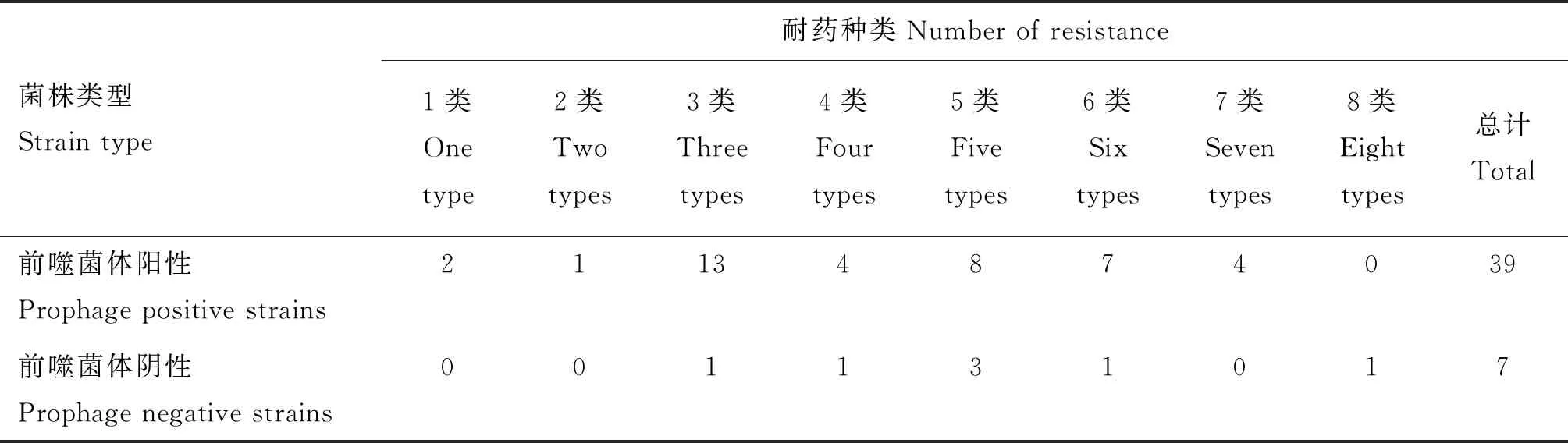
表6 前噬菌体阳性菌和前噬菌体阴性菌耐药情况统计表
2.5 转录组测序结果及测序结果的验证
2.5.1 转录组测序结果 将5株SS株(BB15-4、FY13-4、HF13-21、BZ17-2、BB14-5)分为3个比较组进行差异表达基因分析。比较组AvsC中,A组为前噬菌体阳性组,由前噬菌体解旋酶和末端酶基因均为阳性的BB15-4、FY13-4、BZ17-2和仅前噬菌体末端酶基因为阳性的HF13-21组成;C组为前噬菌体阴性组,由前噬菌体解旋酶和末端酶基因均为阴性的BB14-5组成。比较组A1vsC1中,A1组由前噬菌体解旋酶基因和末端酶基因均为阳性的BB15-4、FY13-4和BZ17-2组成;C1组由前噬菌体解旋酶和末端酶基因均为阴性的BB14-5组成。比较组HF13-21vsBB14-5中,HF13-21为前噬菌体解旋酶基因阴性末端酶基因阳性的SS分离株,BB14-5为前噬菌体解旋酶和末端酶基因均为阴性的SS分离株。
比较组AvsC中共有930个基因发生差异表达,见图8。从中筛选出18个毒力相关基因、4个BF形成相关基因、5个耐药基因。相较于A组,C组中毒力相关基因purD、SSUBM407_0143、copA、tpx、pepT、fhs、neuC、cpsE、cpsB、msmK和gtfA为上调表达,divIVA、ppc、ldh、nox、sodA、oatA和tig为下调表达;BF形成相关基因SSUBM407_1279和SSUBM407_1791为上调表达,SSUBM407_0297 和SSUBM407_0343为下调表达;耐药基因tetO、bcrA、parC、parE和SSUBM407_0293 均为上调表达。
比较组A1vsC1中共有951个基因发生差异表达,见图8。从中筛选出19个毒力相关基因、5个BF形成相关基因、5个耐药基因。相较于A1组,C1组中毒力相关基因purD、SSUBM407_0143、copA、tpx、pepT、fhs、neuC、cpsE、cpsB、msmK和gtfA为上调表达,divIVA、ldh、nox、sodA、tig、spxA2、fba和codY为下调表达;BF形成相关基因SSUBM407_1279、SSUBM407_1342和SSUBM407_1791为上调表达,SSUBM407_0297和SSUBM407_0343为下调表达;耐药基因tetO、bcrA、parC、parE和SSUBM407_0293均为上调表达。
比较组HF13-21vsBB14-5中共有1 151个基因发生差异表达,见图8。从中筛选出19个毒力相关基因、5个BF形成相关基因、6个耐药基因。相较于HF13-21,BB14-5中毒力相关基因purD、SSUBM407_0143、copA、tpx、pepT、fhs、neuC、codY、cpsE、cpsB、msmK、tig和gtfA为上调表达,ldh、ppc、nox、fba、feoB和gdh为下调表达;BF形成相关基因SSUBM407_0908、SSUBM407_1279和SSUBM407_1791为上调表达,SSUBM407_1342和SSUBM407_1520为下调表达;耐药基因tetO、bcrA、parC、parE和SSUBM407_0293为上调表达,pmrA为下调表达。
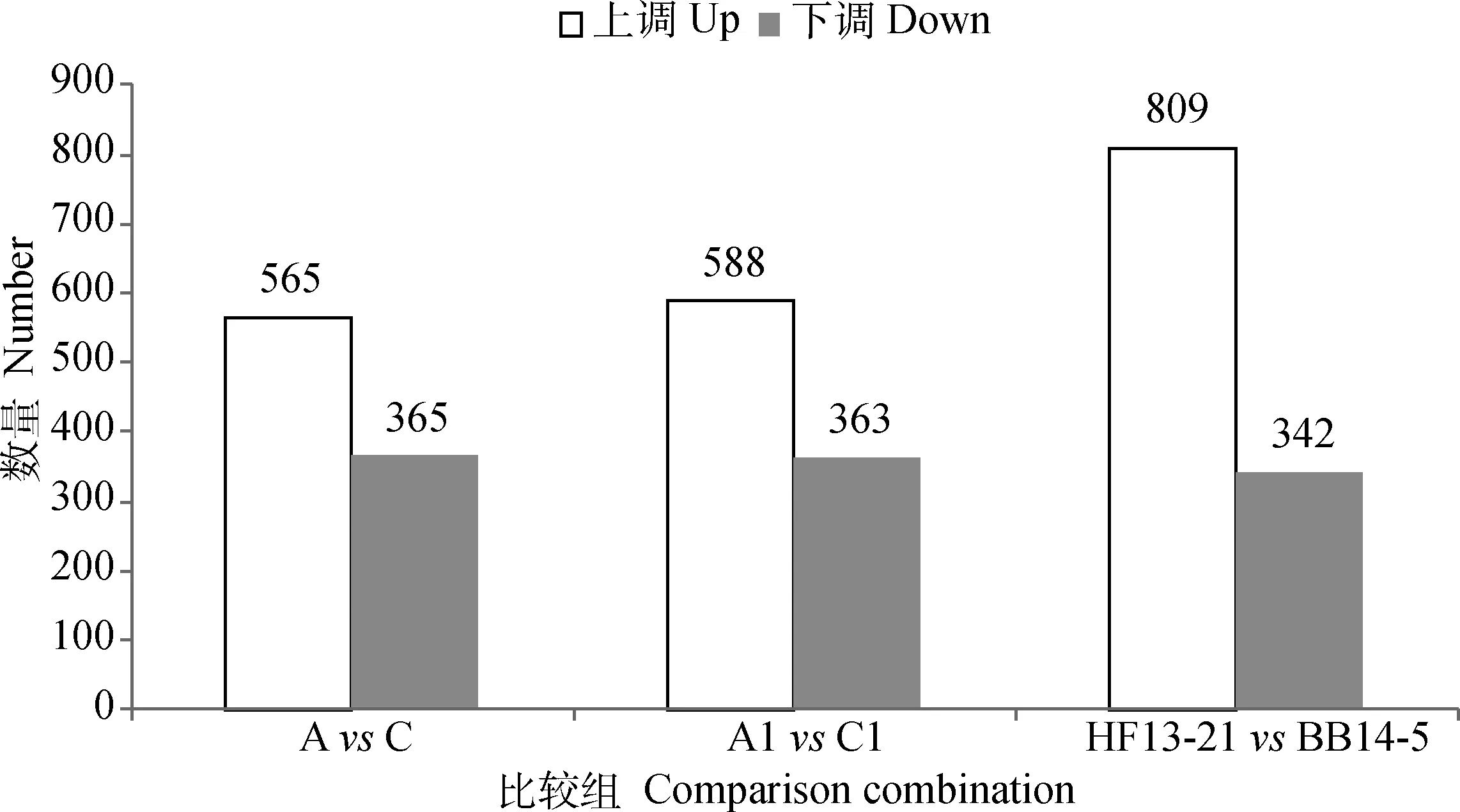
图8 差异基因统计柱状图Fig.8 Statistical histogram of differential genes
此外,3个比较组的测序结果均显示相较于前噬菌体阳性菌,脂肪酸生物合成通路中所涉及到的相关基因SSUBM407_1477、SSUBM407_1676、SSUBM407_1680、SSUBM407_1672、SSUBM407_1670、SSUBM407_1671、SSUBM407_1674、SSUBM407以及精氨酸和脯氨酸代谢通路中所涉及到的相关基因SSUBM407_1304、SSUBM407_1303、SSUBM407_0427、SSUBM407_0274在前噬菌体阴性菌中均为上调表达。
2.5.2 qPCR验证 为验证转录组测序结果的可靠性,本研究以16S rRNA为内参基因,随机选取差异表达基因,进行qPCR检测,见图9。试验结果显示,随机筛选出的差异表达基因在qPCR和转录组测序中变化趋势基本一致,表明测序结果真实可靠。
3 讨 论
前噬菌体与细菌病原体的毒力关系紧密,许多病原菌的毒力因子都是由前噬菌体编码的。在霍乱弧菌中引起严重腹泻的霍乱毒素即由前噬菌体中的ctxAB基因编码[13]。本研究针对39株SS前噬菌体阳性菌及7株前噬菌体阴性菌,通过致病性试验筛选出11株前噬菌体阳性菌和2株前噬菌体阴性菌,对小鼠的LD50测定结果之间没有显著差异(P>0.05)。以此为基础,选择4株前噬菌体阳性菌(BB15-4、FY13-4、HF13-21、BZ17-2)和1株前噬菌体阴性菌(BB14-5)进行组织荷菌数测定及病理组织学观察,其LD50值由小到大依次为BB15-4 细菌为了适应周围环境会吸附于异物或组织表面,分泌大量的胞外聚合物形成BF,从而具有抵御不良环境和抗菌药物的能力。在放线杆菌和粪肠球菌中前噬菌体可以通过调节BF的形成,来增强细菌对不良环境的抵抗力[6-7]。Wang等[14]对大肠杆菌K-12的相关研究发现,前噬菌体e14可以促进宿主菌早期BF的形成。而杜宝中等[15]的研究结果显示,铜绿假单胞菌中的前噬菌体可通过降低该菌中藻酸盐合成相关基因的表达,从而影响BF的形成。本研究结果表明,39株前噬菌体阳性菌BF形成阳性率为97.4%,7株前噬菌体阴性菌BF形成阳性率为100.0%。39株前噬菌体阳性菌中23.0%的成膜力弱(1+),而7株前噬菌体阴性菌均具备强(3+) 或中等(2+)的成膜能力。结果表明前噬菌体的存在与否与SS能否形成BF以及成膜能力之间没有呈现出相关性。 前噬菌体是细菌间基因水平转移的重要载体,Matos等[16]的研究表明,前噬菌体诱导的基因整合事件使白喉棒状杆菌获得对自身进化有用的DNA序列,增强了白喉棒状杆菌的致病性和耐药性;粪肠球菌致病株V583基因组中的多个前噬菌体对该菌的致病性和耐药性有重要贡献,促进了V583对环境的适应性并导致了人类心内膜炎。彭子欣等[17]的研究表明前噬菌体Prophage-p存在于希拉肠球菌R17的质粒中,并携带有红霉素和杆菌肽耐药基因,对R17向耐药菌的进化发挥了重要作用。本研究的39株前噬菌体阳性菌中92.3%呈现多重耐药,而7株前噬菌体阴性菌均为多重耐药。前噬菌体阴性菌均可耐受3种及以上的抗生素,而前噬菌体阳性菌中存在仅耐受1种和2种抗生素的菌株。从表型上看,前噬菌体阴性菌比前噬菌体阳性菌更具有耐药性,但统计学分析结果显示,两者之间在耐药性方面没有显著差异(P>0.05)。 为进一步了解前噬菌体阳性菌和阴性菌间相关基因的表达差异,本研究对4株前噬菌体阳性菌和1株前噬菌体阴性菌进行了转录组测序。3个比较组的测序结果均表明,相较于前噬菌体阳性菌,毒力相关基因purD、SSUBM407_0143、copA、tpx、pepT、fhs、neuC、cpsE、cpsB、msmK和gtfA在前噬菌体阴性菌中均为上调表达;BF形成相关基因SSUBM407_1279和SSUBM407_1791、耐药基因tetO、bcrA、parC、parE和SSUBM407_0293在前噬菌体阴性菌中均为上调表达。此外,脂肪酸生物合成通路中所涉及到的相关基因以及精氨酸和脯氨酸代谢通路中所涉及到的相关基因在前噬菌体阴性菌中同样均为上调表达,这表明前噬菌体阴性菌具有更高的脂肪酸和氨基酸代谢水平。脂肪酸的生物合成是生命体重要的基础代谢途径,对于磷脂合成、细胞膜组装、细胞信号转导、能量储存和基因表达调控必不可少,抑制脂肪酸的生物合成将导致细菌生长及繁殖的停滞。氨基酸作为微生物生长所必需的营养物质,参与胞内ATP的产生、蛋白质和许多生物活性分子的合成,调节体内信号通路和机体代谢。由此可见,前噬菌体的存在会影响SS的生理代谢,具体表现为脂肪酸和氨基酸代谢水平的下降。关于前噬菌体的存在对宿主菌相关基因及其代谢的影响研究报道有限,Veses-Garcia等[18]在大肠杆菌研究中通过转录组测序发现,stx前噬菌体使宿主菌中与三羧酸循环和细菌有氧呼吸过程相关的基因下调表达,从而使宿主菌丙酮酸和能量代谢受到抑制。目前针对SS的研究则侧重于噬菌体对细菌的裂解作用,而基于转录组学探究前噬菌体与SS毒力、环境适应性、耐药性以及代谢活动之间的关系尚未见报道。 作为外源DNA,前噬菌体的插入给细菌带来了额外的代谢负担;同时功能性前噬菌体一旦受到特定因素的诱导,就会使细菌面临被裂解死亡的危险。因此,前噬菌体需要具有一些选择价值,才能在细菌基因组中被更好的保留下来,这些选择价值包括细菌基因组中前噬菌体的存在,可以阻碍其他噬菌体对细菌的感染,使细菌产生对噬菌体的免疫;提高细菌对不良环境的适应性或增强其毒力。本研究试验结果表明,前噬菌体的存在并没有给SS提供毒力、耐药性和形成BF等方面的优势,这并不能说明在SS中,前噬菌体只具有阻碍其他噬菌体感染,使SS产生对噬菌体的免疫这一个选择优势。因为本研究是对前噬菌体阳性菌株及前噬菌体阴性菌株进行分析,并不针对某一株SS或某一个SS前噬菌体。在对SS前噬菌体进行研究的过程中,Harel等[19]发现许多SS强毒株特有的基因与前噬菌体中的一些基因存在同源性;Palmieri等[5]发现一个携带有四环素耐药基因的前噬菌体样元件,导致了SS分离株SsUD对四环素产生耐药性;杜德超[20]发现SS弱毒株中拥有更多的前噬菌体序列,并提出前噬菌体序列的插入将会阻碍SS原有致病性元件发挥正常功能;虞莉等[21]通过检测前噬菌体在101株SS2中的分布,发现前噬菌体与SS代表性毒力因子的分布没有明显相关性。基于本研究的结果结合SS中有关前噬菌体的报道,作者发现在SS中,前噬菌体的存在不是判断菌株毒力强弱的标准,那些序列中存在毒力基因或耐药基因的前噬菌体整合到SS基因组后可以增强SS的毒力或耐药性,但并非所有的前噬菌体序列中都存在这些毒力相关基因或耐药基因,所以并非所有的前噬菌体都可以增强SS的毒力或耐药性。在环境适应性方面,本研究结果仅表明前噬菌体不通过促进SS形成BF这种方式提高SS对不良环境的抵抗力。至于前噬菌体是否可以通过提高SS对酸、碱和低温等不良因素的抗性,进而促进SS对环境的适应性,还需进一步研究。 前噬菌体存在与否与SS的毒力增强或减弱、耐药性的高或低以及BF的形成能力之间未有明显相关性;前噬菌体的存在会引致与SS脂肪酸生物合成以及精氨酸和脯氨酸代谢过程中相关联基因的表达下调,从而造成脂肪酸和氨基酸代谢水平降低。4 结 论

