新疆地区3株驴源马链球菌马亚种新SeM基因型的鉴定与进化分析
杜 宇,蒲小峰,陈晓萌,吕芬芬,汪 丽,张泽华,张宝江,苏 艳
(新疆农业大学动物医学学院,乌鲁木齐 830052)
马链球菌马亚种(Streptococcussubsp.equi,S.equi)可引起的马属动物急性、高度接触性传染病腺疫,主要临床特征为发热、上呼吸道发炎、颌下淋巴结肿胀等[1]。该病呈世界性分布[2-3],已成为危害全球马驴养殖业的典型细菌性传染病,目前流行呈上升趋势,已造成严重经济损失[4]。
由于S.equi的血清型众多且不同血清型菌株之间缺乏有效的交叉保护。M蛋白是S.equi的重要毒力因子之一,研究证实SeM基因的N端存在一个多变区,来自免疫系统的压力使得该区域不断发生突变,该区域进行的遗传进化分析有利于分析菌株的流行动态[5-6]。近年来16S rRNA 及SeM基因分型方法不仅可在全球数据库中进行比对,为该菌进化研究和流行病学研究提供了一种简便可行的方法[7-8],还对促进疫苗研究具有重要的意义。
2018年山东省暴发驴腺疫后鉴定了SeM 136基因型,这是我国对驴腺疫的首次报道[9]。刘延麟[10]对9个省份年采集667份驴腺疫病样证实SeM 136基因型广泛流行于我国8个省。目前我国对驴源马链球菌马亚种SeM基因型报道较少。本研究对新疆地区分离鉴定的3株驴腺疫链球菌,利用16S rRNA序列进行位点多态性及系统发育树聚类分析,其次进行SeM基因型的鉴定和多态性分析,从而了解和掌握新疆地区驴腺疫临床分离株的基因型流行分布及变异特点,为驴腺疫的有效防控提供参考依据。
1 材料与方法
1.1 菌株
测试的样品菌株来自新疆地区某驴场腺疫病驴,采集驴颌下淋巴结组织样本,由新疆农业大学动物医学学院微生物实验室分离、鉴定并保存。
1.2 主要试剂
TaqDNA聚合酶、DL2000 DNA Marker、胶回收试剂盒、E.coliDH5α 均购自天根生化科技(北京)有限公司;琼脂粉、肉汤培养基、蛋白胨、细菌菌生化反应管、营养琼脂、药敏试纸购自杭州滨和微生物试剂有限公司;其他试剂均为国产分析纯。
1.3 分离培养及生化试验
采集的病样划线培养于鲜血培养基,37 ℃培养24 h,观察菌落形态及溶血,将分离纯化的细菌进行革兰染色,在显微镜下观察形态特征。取分离菌的纯培养物接种于细菌微量生化反应管,37 ℃恒温培养18~24 h,记录生化反应结果。
1.4 药物敏感性试验
采用纸片琼脂扩散法:取纯培养菌液均匀涂布于MH平板,将药敏纸片贴于培养基表面,37 ℃恒温培养24 h后,按照国家行业标准(抗菌药物敏感性试验的技术要求WS/T 639—2018)判定标准进行判定(S为敏感,I为中度敏感,R为耐药)。
1.5 细菌16S rRNA基因扩增及序列分析
细菌16S rRNA基因扩增的上游引物16S-F:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物16S-R:5′-ACCTGTCACCCGATGTACCGAA-3′。引物由生工生物工程(上海)股份有限公司合成。以提取的分离株基因DNA为模板进行PCR扩增,设定PCR反应体系:TaqDNA聚合酶0.4 μL,10×TaqPCR缓冲液5 μL,dNTP(2.5 mmol·L-1)8 μL, DNA模板1.5 μL,上、下游引物各1 μL,加ddH2O至25 μL。PCR扩增程序:95 ℃ 5 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 90 s,共35个循环;72 ℃ 延伸10 min。PCR产物经电泳观察后进行测序。测序结果经Blast检索后,将分离菌株的16S rRNA序列与同属不同细菌在GenBank中的相关序列进行比对,选取参考序列,采用MEGA 6.0 中的NJ法构建系统发育树。
1.6 分离菌株SeM基因扩增及序列分析
分离菌SeM基因扩增的上游引物SeM-F:5′-TCTTTGCGTTTAGGAGACA-3′;下游引物SeM-R:5′-AGCATCAGAAAACTAAGTGC-3′。引物由生工生物工程(上海)股份有限公司合成。以提取的分离株基因组DNA为模板进行PCR扩增,反应体系同上;PCR扩增程序:95 ℃ 5 min;94 ℃ 30 s,51 ℃ 45 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。PCR产物经电泳观察后测序。测序后的SeM基因序列与同亚种不同细菌在GenBank中的相关序列进行比对,选取参考序列采用MEGA 6.0中的NJ法构建系统发育树,并根据PubMLST-SEM数据库鉴定分离菌株的基因型。将分离菌株SeM蛋白N端氨基酸序列与GenBank中参考菌株进行对比。
2 结 果
2.1 分离菌株形态与菌落特征
采集的病样分离到3株可疑菌落HTP133、HTP123和HTP232,37 ℃培养18 h后在鲜血培养基上长出半透明、湿润的β溶血型小菌落(图1A)。经革兰氏染色后显微镜下可观察到革兰阳性、椭圆或圆形、链状排列的菌体(图1B)。
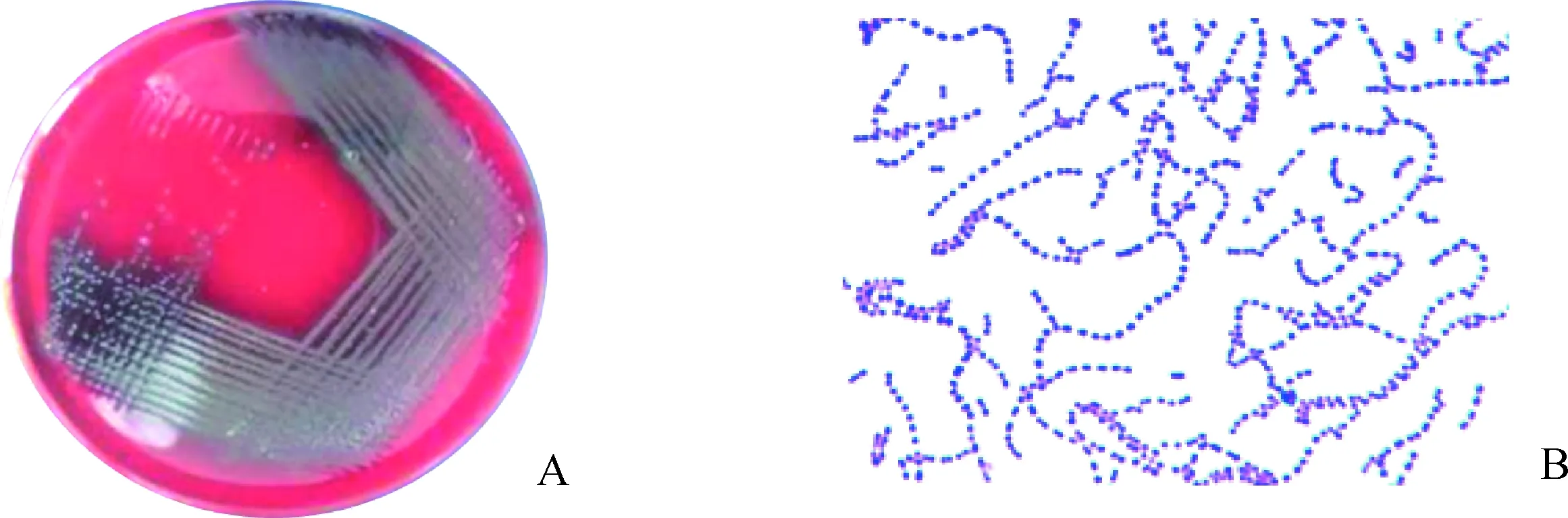
图1 分离菌株菌落形态(A)及革兰染色形态(B)Fig.1 Colony morphology(A) and morphology by Gram staining(B) of isolates
2.2 细菌生化试验
3株分离菌株(HTP232、HT123、HTP133)对吡咯烷酮、曲美他嗪、精氨酸、蔗糖、甲基丙烯酰基和七叶苷试验结果为阳性,对二苯基膦、蕈糖、山梨醇、葡磷、乳糖试验的结果为阴性(表1),3株菌对髓磷脂连接糖和曲美他嗪的试验结果有差异。该结果与已知的马链球菌马亚种的主要生化反应特性相符。

表1 分离菌株生化试验
2.3 药物敏感性
3株分离菌株(HTP232、HT123、HTP133)对21种抗菌药物的药敏试验结果显示(表2),分离菌株均对阿莫西林、氨苄西林、头孢噻呋、头孢西丁、庆大霉素、链霉素、红霉素、克拉霉素、多西环素、左氧氟沙星、诺氟沙星、恩诺沙星、环丙沙星、磺胺异口恶唑、磺胺嘧啶钠、利福平、克林霉素、土霉素、四环素及左氧氟沙星敏感,对头孢呋辛及青霉素耐药。其中HTP123对头孢噻呋及四环素为中度敏感。
2.4 细菌16S rRNA基因扩增
以分离菌株基因组DNA为模板进行16S rRNA基因的PCR扩增,电泳鉴定结果显示扩增到约为1 000 bp(图2)的条带,与预期结果大小一致。
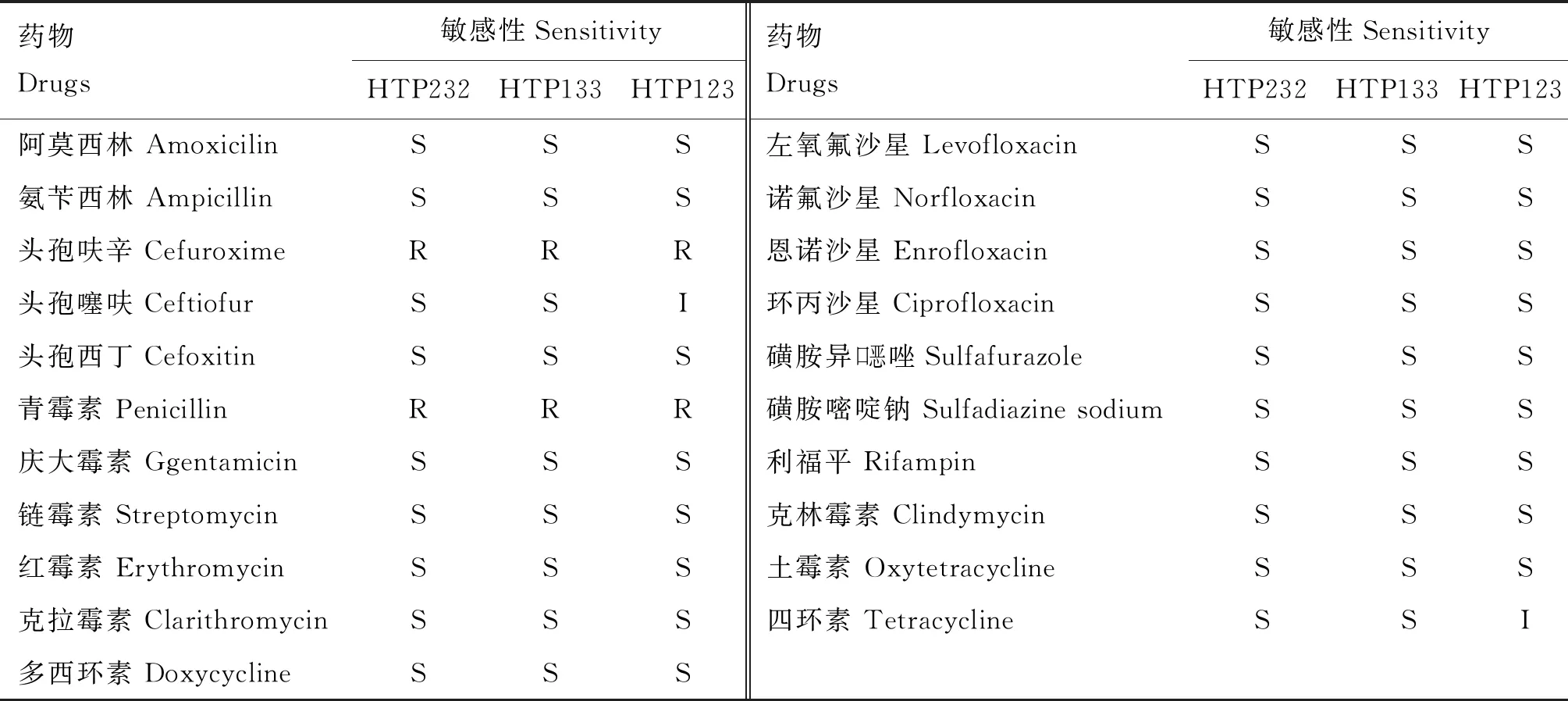
表2 分离菌株药物敏感性试验结果
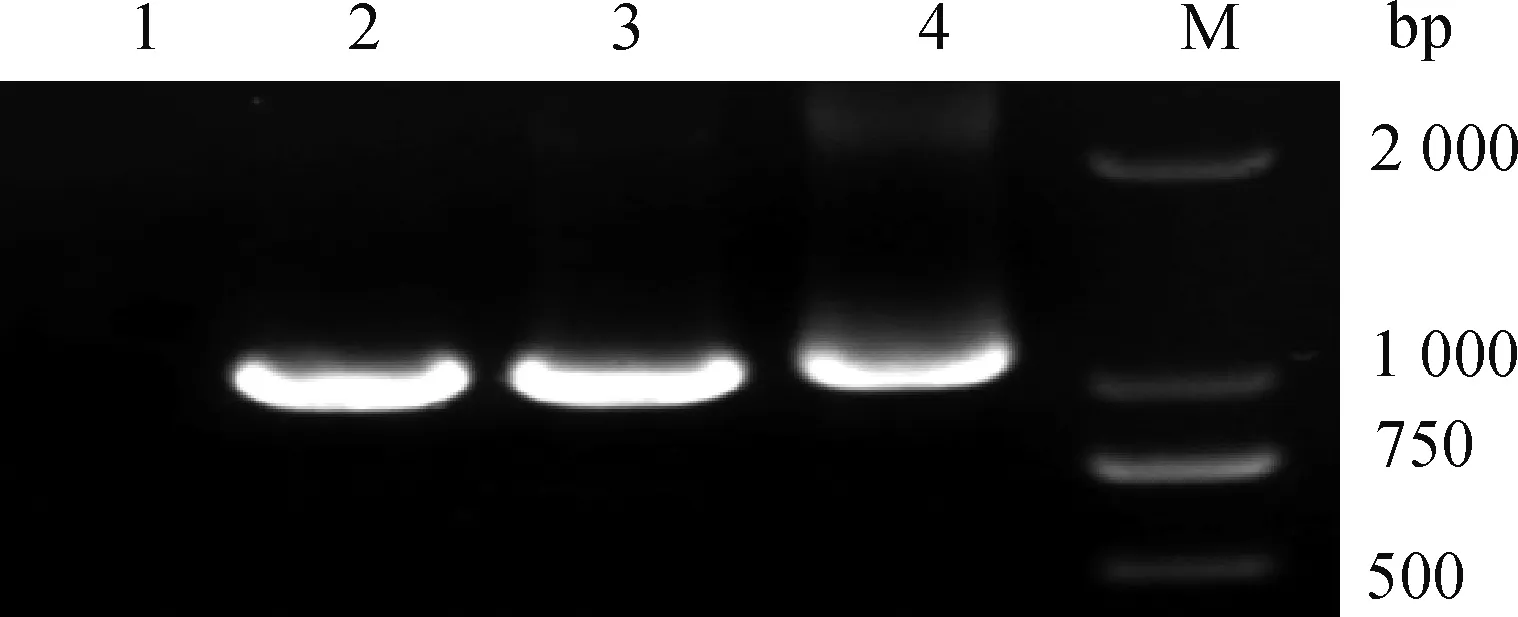
1.阴性对照; 2.HTP133; 3.HT123; 4.HTP232; M. DL2000 DNA相对分子质量标准1.Negative control; 2.HTP133; 3.HT123; 4.HTP232; M. DL2000 DNA marker图2 分离菌株16S rRNA基因PCR扩增结果Fig.2 PCR amplification results of 16S rRNA gene of isolates
2.5 分离菌株16S rRNA序列分析
基于3株分离株16S rRNA基因序列进行的比较和构建的遗传进化树,分离菌及相关参考菌株分为6组(GroupⅠ、GroupⅡ、GroupⅢ、GroupⅣ、GroupⅤ及GroupⅥ),分离菌所归属于第Ⅰ群,马链球菌马亚种(S.equi),第Ⅱ、Ⅲ群为马链球菌兽疫亚种(S.zooepidemicus);第Ⅳ群为犬链球菌(S.canis),第Ⅴ群为猪链球菌(S.suis)和第Ⅵ群为类马链球菌(S.equiuns)(图3),Ⅰ群在V5可变区具有特征性的序列,遗传进化分析发现本研究分离株与中国分离株JQ726493株亲缘关系较近(图4)。
2.6 细菌SeM基因扩增
以分离菌株的基因组DNA为模板进行SeM基因的PCR扩增,检测扩增到大约1 560 bp的条带,与预期结果大小一致(图5)。
2.7 分离菌株SeM基因型及亲缘关系分析
基于SeM基因序列结合SeM数据库鉴定分离的3株菌发现了二个新SeM基因型,分别为SeM 210(HTP232)和SeM 211(HTP133、HTP123)。根据基于SeM基因序列进化树图可发现(图6),分离株SeM基因型与SeM 136、SeM 138、SeM 142、SeM 146、SeM 149、SeM 144遗传进化关系较近,且发现这些基因型菌株均为驴源马链球菌马亚种,提示驴源菌株具有相似的SeM基因进化特征。
2.8 分离株与国际参考菌株SeM N端氨基酸序列的比较
本研究将分离菌株和马链球菌马亚种国内外参考菌株进行SeM N端氨基酸比较分析后发现(表3),3株分离株SeM 210(HTP232)和SeM 211(HTP133、HTP123)与参考菌株相比在SeM蛋白N端44Aa-143Aa之间存在9和10个氨基酸的差异,本研究鉴定的2种基因型SeM 210和SeM 211之间存在着3个氨基酸的差异。本次比较还发现驴源菌株在SeM N端47-127之间存在3个特征性氨基酸位点62位、81位和113Aa具有共同的氨基酸序列特征,不同于马源菌株。
3 讨 论
近年来,新疆地区驴集约化养殖规模发展迅速,驴腺疫的流行呈现明显上升的趋势[10-13],给养驴业带来严重经济损失。S.equi的血清型众多且不同血清型之间缺乏交叉免疫保护[14],SeM进行基因分型是一种基于SeM的N端等位基因的分子流行病学研究方法,可实现跨区域和时间的细菌流行病学分析与监测,弥补传统血清学分型方法的局限性。目前对新疆地区驴腺疫分子流行病学的信息匮乏[15],对地方分离株进行分子水平的遗传进化分析和基因分型分析,可为该病的有效防控提供基础性的依据。

▲表示本次分离菌株▲indicate the isolates in this study图3 分离菌株及参考菌株16S rRNA基因可变区对比结果Fig.3 Sequence alignment of the variable region 16S rRNA gene of isolates and reference strains
16S rRNA基因可以揭示不同细菌种间的差异,该基因V2区可表现较显著的差异[16],本研究对3株新疆地方分离株进行16S rRNA基因为基础的遗传谱系分析。将3株S.equi分离株与兽疫链球菌、猪链球菌、犬链球菌和类马链球菌的16S基因可变区序列进行对比分析,3株分离株与S.equi国际菌株V1-V5区差异不大,归属于进化Ⅰ群(马链球菌马亚种),与新疆石河子2012年鉴定的马源S.equiJQ726493亲缘关系较近。
S.equi可产生具有抗吞噬活性的SeM蛋白,该蛋白位于菌体表面,可以结合纤维蛋白原IgG[17]。由于在进化过程中该菌在外界环境和机体免疫的选择压力下,在该蛋白N端高度可变[6,18-19],其N端第106-166位被认为是其高变区[20]。Ivens等[8]依据该方法对2011年英国的145株S.equi分离株进行分型,确定了该法可准确的评估该菌的分子流行特征。Dong等[9]于2019年报道从山东驴腺疫样品中鉴定了SeM 136基因型,该基因型在2018年于山东省流行时被发现[5],被认为是2018—2019年国内驴腺疫的主要流行基因型。刘延麟对国内多地菌株的分析表明,驴腺疫在国内多地呈现出多种基因型的分布,发现了驴源菌株还存在SeM 138、SeM 142、SeM 144、SeM 145、SeM 146 及SeM 149[10]。
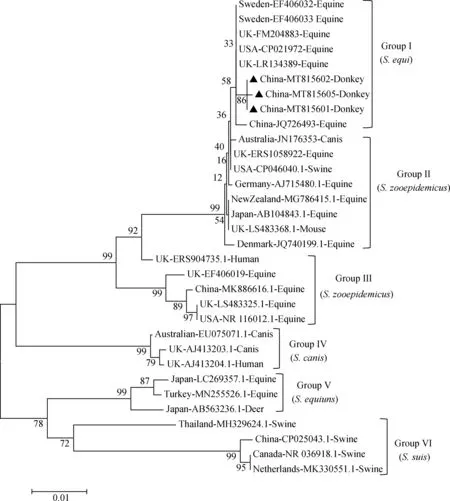
▲ 表示本次分离菌株▲ indicate the isolates in this study图4 分离菌株16S rRNA基因的系统发育树Fig.4 Phylogenetic tree of 16S rRNA gene of isolated strains
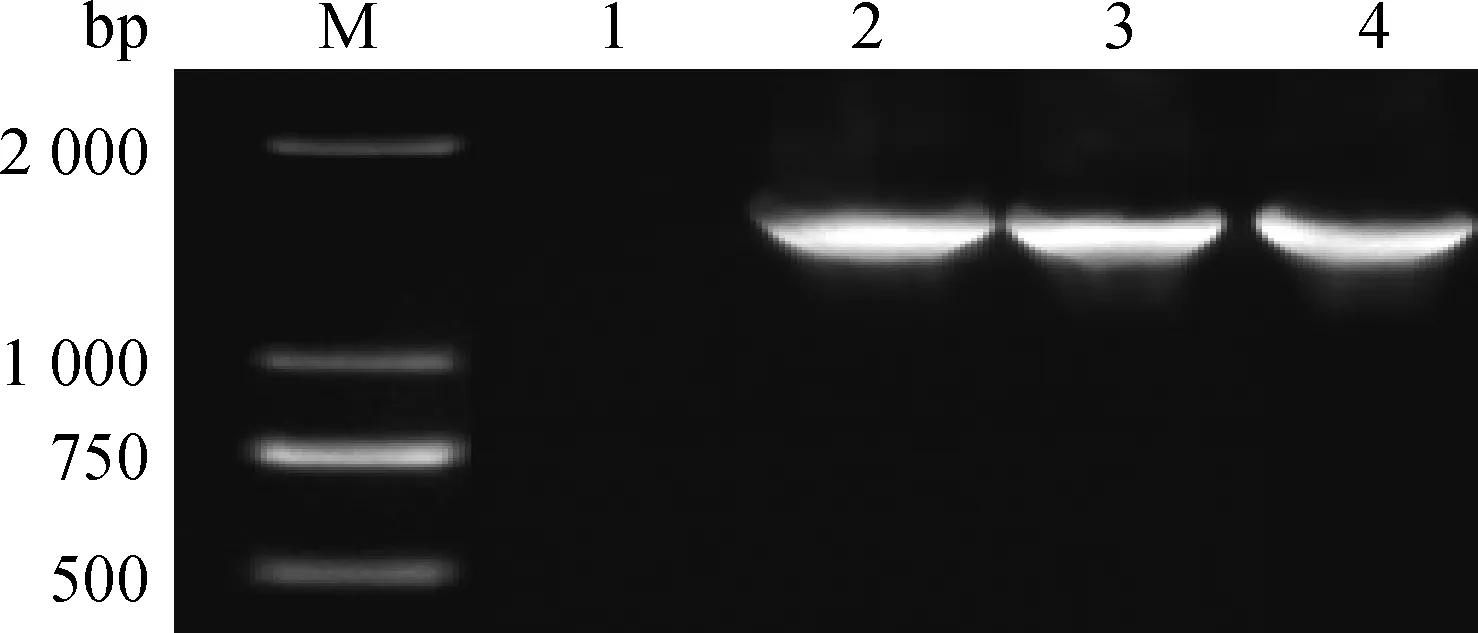
M. DL2000 DNA相对分子质量标准; 1.阴性对照; 2.HTP232; 3.HT123; 4.HTP133M. DL2000 DNA marker; 1.Negative control; 2.HTP232; 3.HT123; 4.HTP133图5 分离株SeM基因PCR扩增结果Fig.5 PCR amplification results of SeM gene of isolates
最近,有学者报道鉴定了4种不同的埃及马源菌株基因型,其中2株(SeM 139和SeM141)与中国驴源菌株归属于相同的进化群,其余2种基因型(SeM 140和SeM 199)与欧洲流行的马源菌株归属于相同遗传进化群[21]。本研究对3株驴腺疫新疆地方株SeM基因进行了测序和分析,确定得到两个新的SeM基因型(SeM 210、SeM 211),不同于国内已发现的驴源菌株的基因型。将本次鉴定得到两种基因型与国内其他地区鉴定的基因型比较发现,这两种驴源基因型与驴源SeM 145遗传距离较远,而与其他国内驴源基因型均亲缘关系较近,这表明驴源S.equi的流行存在着变异与进化的特征,推测随着集约化养殖过程中驴的频繁调运和跨区引种还会导致更多新的基因型出现,今后有必要对不同年份基因型的变化规律和致病特性进行更深入的研究和分析。此外,对SeM基因库中马属动物菌株的比较结果还表明,驴源菌株具有明显的宿主适应的特点,与马源菌株差异较大。
S.equiSeM基因变异不仅产生了新的SeM基因型,因其为该菌主要的抗原分子,因此变异也导致该菌的免疫逃避[18-20]。刘云涛等[22]在分析新疆地区马链球菌马亚种SeM氨基酸N端突变位点时,发现分离的马源腺疫菌株SeM 的部分氨基酸存在较大差异。将驴源分离株与马源分离株SeM氨基酸N端突变位点进行比对,结果显示驴源S.equi菌株可在SeM基因N端62aa、81aa、113aa位点表现出驴源菌株的特征,推测这些位点氨基酸的差异可能是该菌适应不同宿主的基因特征,而我们根据从马分离的与驴源菌株相同基因型的菌株SeM基因比较后未发现具有此特征。对驴源菌株SeM基因比较的结果还表明不同地区流行菌株也在氨基酸的变化方面表现出明显的特征,如SeM基因N端61 aa、64 aa、70 aa、100 aa、103 aa、107 aa和125 aa处与其他驴源菌株不同。因此对分离菌株的基因型进行鉴定的比较分析,是对该菌监测和溯源的重要方法之一。
Dong等[9]SeM 136基因型将SeM蛋白与参考菌株S.equi4047 的N端多变区进行对比,发现该驴源菌株与该马源参考菌株在N端47-127位氨基酸位点之间共有8个氨基酸的差异,本研究分离菌SeM 211(HTP133、HTP123)与参考菌株S.equi4047比较,在N端47-127位氨基酸位点之间共有9个 氨基酸的差异,SeM 210(HTP232)共有10个氨基酸的差异。将驴源菌株SeM 136与本研究的2种 不同基因型驴源菌株SeM 210和SeM 211之间则有6个氨基酸在相同的位点发生变化(Aa 52、62、70、81、113、122),本研究鉴定的2种基因型SeM 210和SeM 211之间存在着3个氨基酸的差异。此外,本次比较还发现驴源菌株在SeM N端47-127的62、81、和113Aa具有共同的氨基酸序列特征,不同于马源菌株,推测由于受到驴运输流动情况和宿主适应性等的影响导致这些驴源菌株SeM基因的变异和不同基因型共存的情况。

腺疫常用抗生素治疗,以往认为青霉素是治疗马链球菌马亚种引起腺疫的治疗药物[23]。本次试验结果表明,分离的3株菌虽然还未出现多重耐药,但均对青霉素和头孢呋辛耐药,对青霉素耐药的结果与2019年周婷婷等[24]报道的马源马链球菌马亚种结果基本一致。
4 结 论
从新疆地区某驴场驴腺疫病例下颌组织中获得了3株S.equi分离株HTP133、HTP123和HTP232,属于该菌16S rRNA进化群中的Ⅰ群,与新疆地区以往分离鉴定的马源S.equi菌株具有较近的进化关系。分离菌株SeM基因型分别鉴定为SeM 210和SeM 211,属于国内外首次报道的驴源S.equi分离株SeM基因型,这2种驴源基因型与驴源SeM 145遗传距离较远,而与其他国内驴源基因型亲缘关系均较近。本研究为驴腺疫发病病例的流行和传播特征的分析提供了分子生物学的基础数据。
——和田盘羊

