慢性重度主动脉瓣反流患者左室心肌纵向分层应变特点及其与左室构型的相关性分析
龚 敏 吴 娟 裴勇凯 王艳丽 曹思奇 吴海波 武 俊
慢性主动脉瓣反流(aortic regurgitation,AR)患者由于长时间受到容量及压力超负荷的影响,左室发生心肌肥厚、心室扩大等形态结构重构。由于机体存在一系列代偿机制,使慢性重度AR患者可以长时间无症状及左室射血分数(left ventricular ejection fraction,LVEF)保留,从而掩盖了由左室重构引发的心肌进行性损伤,如未能及时进行手术干预,患者预后效果会显著下降[1]。二维斑点追踪超声心动图(two-dimensional speckle-tracking echocardiography,2D-STE)能无角度依赖性地追踪心肌组织与超声波之间相互作用产生的“斑点”,从而评价心肌的生理和机械形变(应变),对左室整体和局部收缩功能进行量化评估分析,早期发现心肌收缩功能的细微变化。心肌应变目前已经广泛应用于多种心脏相关疾病心肌功能和预后分析的研究领域,其稳定性、准确性和灵敏性均得到了验证[2]。本研究应用2D-STE评价慢性重度AR患者左室纵向分层应变特征,并探讨其与左室构型间的相关性,旨在为临床选择干预方式及时机提供更有价值的信息。
资料与方法
一、研究对象
前瞻性纳入2019年1月至2021年1月我院慢性重度AR患者43例,男34例,女9例,年龄43~68岁,平均(59.93±12.54)岁。慢性重度AR诊断标准参照欧洲心血管影像协会指南[3]。其中主动脉扩张及瓣叶脱垂28例,主动脉瓣瓣叶畸形10例,主动脉瓣钙化5例。排除急性AR、中至重度的其他瓣膜疾病、严重冠状动脉疾病、心房颤动、心肌病等。另选同期20例健康志愿者为对照组,男12例,女8例,年龄37~83岁,平均(55.10±8.79)岁。本研究经我院医学伦理委员会批准,所有研究对象均签署知情同意书。
二、仪器与方法
1.常规超声心动图检查:使用Philips EPIQ 7C彩色多普勒超声诊断仪,X5-1探头,频率2.5 MHz。患者取左侧卧位,根据美国超声心动图学会指南建议[4]于平静呼吸下测量左室构型参数,即左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、左房前后径(LAD)、室间隔厚度(IVST)、后壁厚度(PWT);根据Devereux公式计算左室质量(LVM);采用双平面Simpson法测量左室舒张末期容积(LVEDV)、左室收缩末期容积(LVESV)和LVEF,计算左室球形指数(SPI)。为排除个体差异,分别将LVEDD、LVESD、LVEDV、LVESV、LVM经体表面积(BSA)标化,得到左室舒张末期内径指数(LVEDDI)、左室收缩末期内径指数(LVESDI)、左室舒张末期容积指数(LVEDVI)、左室收缩末期容积指数(LVESVI)、左室质量指数(LVMI)。
2.2D-STE分析:使用上述同一超声诊断仪及探头,待完整清晰显示左室轮廓及心内膜时留存3个心动周期以下切面图像:心尖四腔、两腔及三腔心切面,以及3个左室短轴切面(二尖瓣、乳头肌和心尖水平)。使用专用分析工作站QLAB-CMQ(Philips Healthcare,3000 Minuteman Road,Andover,MA)自动识别各个切面心内膜边界,必要时分别于左室舒张和收缩末期手动调整勾画心内膜边界以确保与实际心肌区域吻合。分析软件将每个切面分为6个心肌节段,使左室分为18节段模型,自动计算左室整体和节段心内膜下、中层及心外膜下心肌纵向应变(LSendo、LSmid、LSepi),以及整体分层纵向应变跨壁梯度(TG)。所得纵向应变值中的负号表示心肌纵向缩短方向,数值表示缩短程度。
3.重复性检验:分别从两组中随机选取15例研究对象,由同一位检查者间隔10 d重复分析,进行观察者内重复性检验;由另一位检查者分析相同的图像,进行观察者间重复性检验。
三、统计学处理
应用SPSS 19.0统计软件,符合正态分布的计量资料以±s表示,多组比较采用单因素方差分析并通过Bonferroni法进行事后分析;两组比较行独立样本t检验。计数资料以例或率表示,组间比较行χ2检验。符合正态分布的连续型变量相关性分析采用Pearson相关分析法。重复性检验采用组内相关系数(ICC)法。P<0.05为差异有统计学意义。
结 果
一、两组临床资料比较
两组年龄、性别、身高、体质量及BSA比较差异均无统计学意义;与对照组比较,AR组心率增快,收缩压和脉压均增高,舒张压降低,差异均有统计学意义(均P<0.05)。见表1。
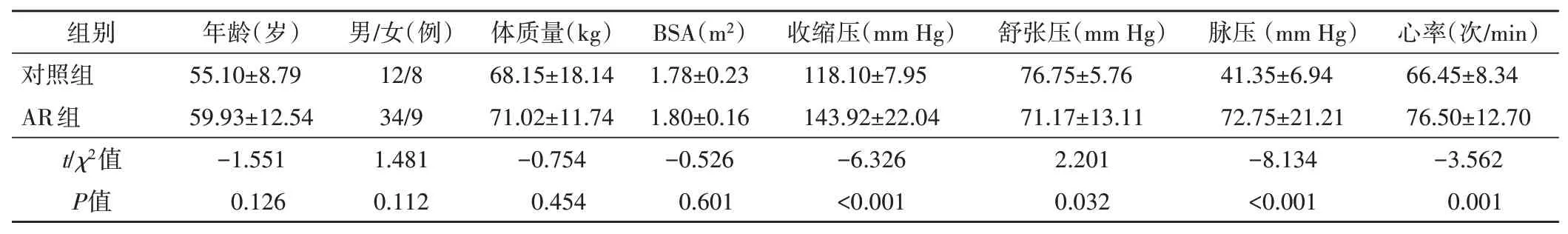
表1 两组临床资料比较
二、两组左室构型参数比较
与对照组比较,AR组LVEDDI、LVESDI、LVEDVI、LVESVI、LAD、PWT、IVST、LVMI、SPI均增大,LVEF降低,差异均有统计学意义(均P<0.001)。见表2。
表2 两组左室构型参数比较(±s)

表2 两组左室构型参数比较(±s)
LVEDDI:左室舒张末期内径指数;LVESDI:左室收缩末期内径指数;LVEDVI:左室舒张末期容积指数;LVESVI:左室收缩末期容积指数;LAD:左室前后径;PWT:后壁厚度;IVST:室间隔厚度;LVMI:左室质量指数;SPI:球形指数
?
三、两组左室整体及各节段纵向分层应变参数比较
1.左室整体纵向分层应变参数比较:与对照组比较,AR组整体LSendo、LSmid、LSepi、TG均明显降低(均P<0.001)。对照组整体LSendo、LSmid、LSepi呈递减趋势,组内比较差异有统计学意义(F=38.967,P<0.001);AR组整体LSendo、LSmid、LSepi比较差异无统计学意义(F=1.422,P=0.246)。见图1,2和表3。
表3 两组左室整体纵向分层应变参数比较(±s) %

表3 两组左室整体纵向分层应变参数比较(±s) %
与LSendo比较,*P<0.05;与LSmid比较,#P<0.05。LSendo:心内膜下心肌纵向应变;LSmid:中层心肌纵向应变;LSepi:心外膜下心肌纵向应变;TG:整体纵向分层应变跨壁梯度
?
图1 对照组(男,38岁)左室心内膜下心肌应变曲线图及牛眼图
2.左室各节段纵向分层应变参数比较:对照组LSendo、LSmid及LSepi从基底段至心尖段均呈递增趋势(F=67.502、36.337、44.673,均P<0.001),且组内两两比较差异均有统计学意义(均P<0.05);AR组LSendo比较差异虽有统计学意义(F=4.730,P=0.011),但递增趋势消失,仅LSmid和LSepi呈递减趋势(F=18.084、62.525、均P<0.001),且组内比较差异均有统计学意义(均P<0.05)。见表4。
表4 两组左室各节段纵向分层应变参数比较(±s) %
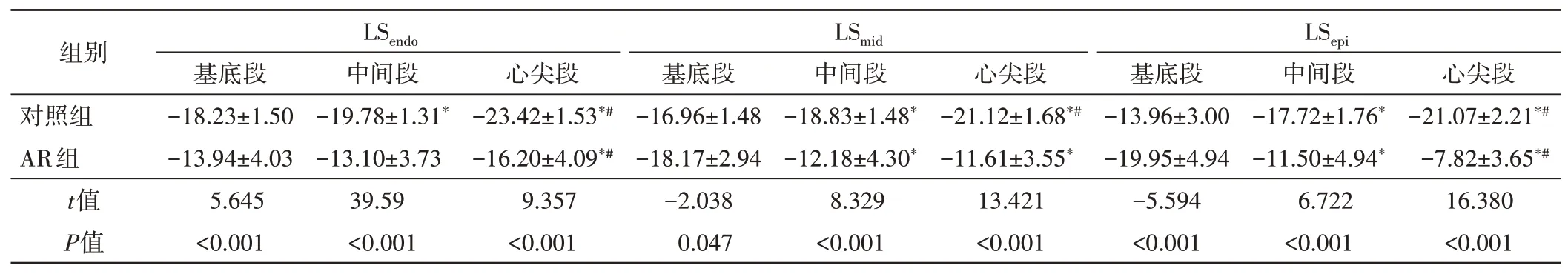
表4 两组左室各节段纵向分层应变参数比较(±s) %
与基底段比较,*P<0.05;与中间段比较,#P<0.05。LSendo:心内膜下心肌纵向应变;LSmid:中层心肌纵向应变;LSepi:心外膜下心肌纵向应变
?
四、AR患者左室整体纵向分层应变参数与左室构型参数的相关性分析
左室整体LSendo、LSmid及LSepi分别与LVEDDI、LVESDI、LVEDVI、LVESVI、PWT、IVST、LAD、LVMI、SPI均呈负相关(均P<0.001)。见表5。
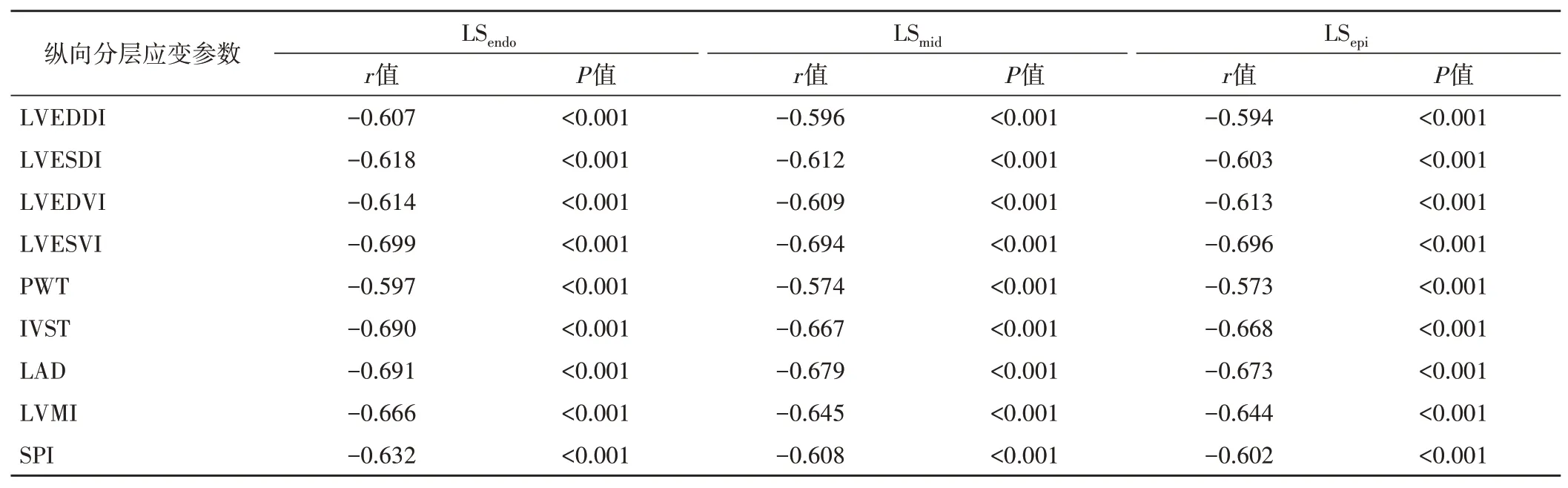
表5 AR患者整体纵向分层应变参数与左室构型参数的相关性分析
五、重复性检验
2D-STE所测左室整体LSendo、LSmid、LSepi在观察者内及观察者间ICC均≥0.75,具有较好的可重复性。见表6。

表6 左室整体纵向分层应变观察者内及观察者间重复性检验结果
讨 论
左室壁由三层交织重叠走行不同的心肌纤维构成:心内膜下心肌在纵轴方向上呈顺时针斜行排列,心外膜下心肌呈逆时针斜行排列,中层心肌呈近似环形排列[5]。这种独特的排列结构形成了心脏的多元化运动,使2D-STE通过解析不同疾病状态下分层心肌动力学特征,从而更好地了解心肌受损及代偿情况。在慢性AR患者的早期阶段,左室在舒张期同时接受来自左房的充盈血液和主动脉瓣的反流血液,使左室容量及压力负荷均增加,继而导致左室心肌肥厚、心室扩大等形态重构改变,由于机体存在一系列的代偿机制,使得患者左室收缩功能保留,长时间不会出现明显的症状。本研究AR组收缩压和脉压均增大,舒张压降低,心率增快,与对照组比较差异均有统计学意义(均P<0.05),表明慢性重度AR患者处于容量及压力超负荷状态。另外,本研究还发现AR组左室内径、容量、室壁厚度等常规超声心动图参数均较对照组明显增加(均P<0.05),表明慢性重度AR患者在同时受到容量及压力超负荷的影响下,左室形态和结构已发生明显改变。随着AR程度的加重,机体已经无法代偿,导致心肌缺氧受损,左室收缩和舒张功能降低,从而会出现心绞痛、疲劳和呼吸困难等症状,甚至最终导致全心衰竭[6]。根据Frank-Starling定律,在早期代偿阶段,由于左室容量负荷增加,肌小节串联增加,导致每个心肌细胞拉长,心肌收缩力代偿增加导致LVEF保留。虽然LVEF是评价左室整体收缩功能最常用的指标,但由于其同时受到心肌收缩力和左室容量的影响,因此并不能准确评价心肌的受损情况。研究[7]证实,虽然当患者出现症状时LVEF保留,但此时心肌已经受到严重甚至不可逆的损伤,导致术后左室重构逆转不良,预后较差。本研究中,尽管AR组LVEF为54.87%±7.97%,属正常范畴,但其左室整体LSendo、LSmid、LSepi及TG均较对照组减低,差异均统计学意义(均P<0.001),表明即使LVEF保留,此时左室各层纵向收缩功能已经明显减低,与以往研究[8]结果一致。
根据拉普拉斯应力公式,当左室进行性扩张和室腔压力增加达代偿最高点,增加的室壁厚度已无法抵消由于心室腔扩张导致的室壁应力增高,心肌耗氧量随之增加。此外,舒张期冠状动脉灌注压减小,心肌氧供不足,则加剧心肌氧供与氧耗的不平衡。因此,左室重构会进一步加重左室心肌的损伤,最终导致左室收缩功能降低,形变能力也就越低[6,9]。更有研究[10]发现左室顺应性下降和室壁应力增加会触发心脏成纤维细胞上调纤维连接蛋白的合成,随后胶原结构和心肌纤维化的变化则会进一步损害左室收缩和舒张功能,从而导致心肌形变能力变差。本研究结果显示,AR患者左室整体LSendo、LSmid及LSepi分别与各构型参数LVEDDI、LVESDI、LVEDVI、LVESVI、PWT、IVST、LAD、LVMI、SPI均呈负相关(均P<0.001),表明慢性重度AR患者随着左室腔逐渐变大及心肌更加肥厚,心肌形变能力也逐渐变差。
本研究还发现,AR组左室整体LSendo、LSmid、LSep比较差异无统计学意义,依次递减趋势消失,表明慢性重度AR患者左室整体纵向分层应变模式发生了显著的变化;AR组TG较对照组降低,差异有统计学意义(P<0.001),表明慢性重度AR患者心内膜下心肌与心外膜下心肌应变绝对值差值减小,意味着心内膜下心肌受损程度较心外膜下心肌可能更加明显。分析原因为:在健康心肌收缩过程中,与心外膜下心肌比较,心内膜下心肌增厚和缩短的变化程度更大,左室肥厚和室壁应力增加会导致心内膜下心肌出现血流分布不均,此时心内膜下心肌纤维对微血管缺血和纤维化更敏感,纵向收缩功能可能最先发生改变[11]。此外,本研究发现AR组各节段心肌纵向分层应变模式也发生改变,从基底段至心尖段,LSendo比较差异虽有统计学意义,但依次递增趋势消失,仅在LSmid和LSepi呈递减趋势(均P<0.001),表明相对于基底段和中间段,心尖段心肌纵向收缩功能受损更加明显。本研究重复性检验分析显示,2DSTE所测左室整体LSendo、LSmid、LSepi在观察者内及观察者间ICC均≥0.75,均具有较好的可重复性,表明2DSTE可广泛应用于临床。
本研究的局限性:①样本量偏小;②仅对重度AR患者与对照组进行分析,未对AR患者进一步分亚组分析;③部分AR患者左室肥厚不均匀,可能会对应变分析造成影响;④不同超声诊断仪器和软件包所测应变值差异性大;均待后期扩大样本进一步探讨。
综上所述,2D-STE能定量评估慢性重度AR患者左室心肌纵向分层应变;且左室纵向分层应变与其构型相关。

