铁线莲属植物ISSR分子标记体系优化及指纹图谱的构建
王鑫,郑妍,刘志杰,张存石,刘冬云
(河北农业大学 园林与旅游学院,河北 保定 071000)
铁线莲属(ClematisL. Sp. Pl.)植物约有300余种,花色丰富,花形多变,花期跨度长,可从早春至深秋,花果均具有较高的观赏性和园林应用价值,同时,药用价值高,又具有较强的抗逆性和耐寒性[1-2]。中国铁线莲属植物约147种,其中约98种为我国特有种,主要分布于华中和西南地区。河北省拥有丰富的野生铁线莲属植物资源,其中不乏观赏性状和适应性优良的类型,但目前国内外对铁线莲的研究主要集中在药理化学、无性繁殖、生理抗性等方面,对其种下分类的研究很少[3-6]。长期以来,由于大面积栽培和人工选择,铁线莲种下分类一直比较混乱,现采用ISSR分子标记技术,建立铁线莲属植物ISSR-PCR最佳反应体系,以期为构建铁线莲属植物亲缘关系及遗传图谱奠定基础。
简单重复间序列 (Inter-simple sequence repeat,ISSR) 标记技术具有操作简单、稳定性好和多态性丰富等特点,广泛应用于植物品种鉴定、基因作图与定位、遗传多样性和系统发育等的研究[7]。和文志等建立了铁线莲ISSR-PCR的反应体系,并且进行了反应体系的优化,但只是建立铁线莲园艺品种的最优体系,试验材料不完善,缺乏铁线莲野生种[8]。余伟军、王楠等分别建立了铁线莲属植物的ISSR最优体系,但是在因素选择方面比较单一,都只优化模板DNA、Taq酶、Mg2+和dNTPs 4个单因素[9-10]。对于Master Mix用量、PCR反应循环数等关键因素优化还未见报道。
本试验先通过单因素试验优化选取模板DNA含量、目标引物浓度、Master Mix、循环数等关键因素,然后使用L9(34)正交设计对铁线莲ISSR-PCR反应体系中的各因素进行优化,建立适宜铁线莲野生种的最优ISSR-PCR反应体系,为进一步利用ISSR分子标记进行河北省野生铁线莲遗传多样性分析、种质资源鉴定、遗传图谱构建等研究提供一定的理论基础[11]。并利用多态性引物构建了遗传指纹图谱,可以对16种野生铁线莲进行有效的区分和鉴定。
1 材料和方法
1.1 试验材料
试验材料为16个类群的野生铁线莲,均采自河北省野外不同地区,引种后种植于河北农业大学试验基地,供试材料见表1。

表1 供试铁线莲信息Table 1 The information of the tested Clematis
1.2 试验方法
采集16种铁线莲新鲜叶片,用70%酒精擦洗叶片表面,放于零下80 ℃冰箱保存。
1.2.1 基因组DNA的提取 本试验DNA的提取采用新型植物基因组DNA提取试剂盒(CW0531S,康为世纪),按照试剂盒说明书提取16个铁线莲样本的DNA,母液电泳图条带明亮清晰。以1 μL的ddH2O为空白对照,用Themro微量紫外分光光度计进行DNA纯度检测,其纯度(OD260/OD280)在1.6~2.0之间,说明DNA杂质少,纯度高可用于后续反应。将DNA母液浓度稀释成40 ng/μL的工作液,1%的琼脂糖凝胶进行电泳检测[12]。
1.2.2 目标引物的确定 从加拿大哥伦比亚大学公布的100条ISSR通用引物中随机挑选20条引物进行初筛,引物序列见表2。
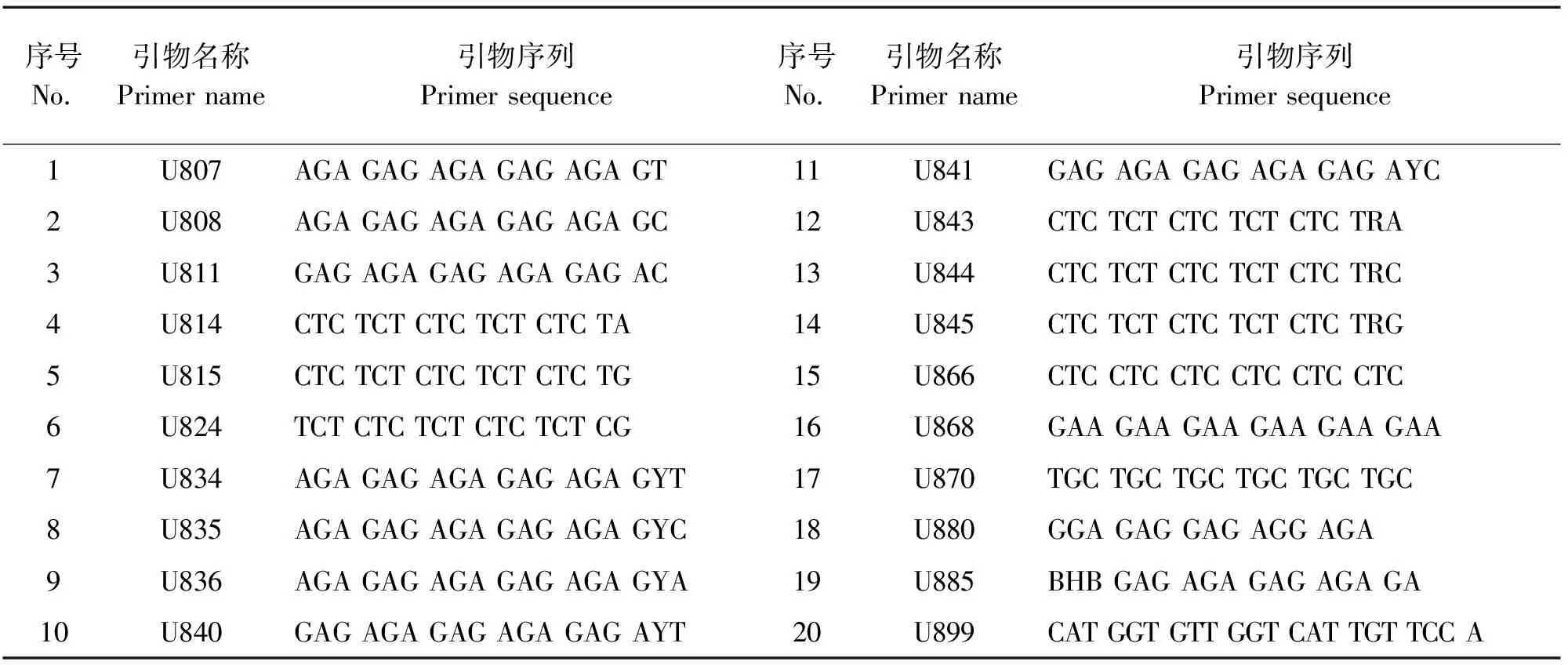
表2 ISSR引物序列信息Table 2 The information of ISSR primer sequence
由表2可知,选取卷萼铁线莲和褐毛铁线莲各2个DNA样本作为模板,选出具有多态性的引物。根据公式:η=1- (1-1/2)n(n为样品数,η为有多态性引物的选中概率),计算选中的有多态性引物的概率为93.8%。
参考和文志的方法,PCR反应体系为25 μL,12.5 μL的2×Es Taq Master Mix PCR反应液,2 μL模板DNA,2 μL引物,加入超纯水使体系达到25 μL[8]。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性50 s,退火(温度取决于引物Tm值)1 min,72 ℃延伸1 min,35个循环;72 ℃延伸10 min,最后4 ℃保存。PCR反应在BIO-RAD基因扩增仪上进行。扩增产物经1%琼脂糖凝胶电泳(1×TAE缓冲液,100 V,0.5 h)检测,6×SuperStain染色,再在紫外透射仪下观察结果,并记录。
1.2.3 ISSR反应体系单因素优化 试验选用1.2.2中初筛出来能扩增出清晰条带的引物U845,ISSR-PCR反应体系中模板DNA含量、目标引物浓度、Master Mix、循环数各设定6个梯度,以单因素优化法进行4组试验,见表3。

表3 ISSR-PCR反应体系的单因素优化Table 3 Single factor optimization of ISSR-PCR reaction system
1.2.4 ISSR-PCR反应体系正交优化 在单因素反应优化的基础上,参考董如何的方法设计L9(34)正交表,对模板DNA含量、目标引物浓度、Master Mix、循环数进行4因素3水平分析(表4)[11]。试验所用引物、Master Mix和2 000 bp DNA marker均购自北京天根生物有限公司。
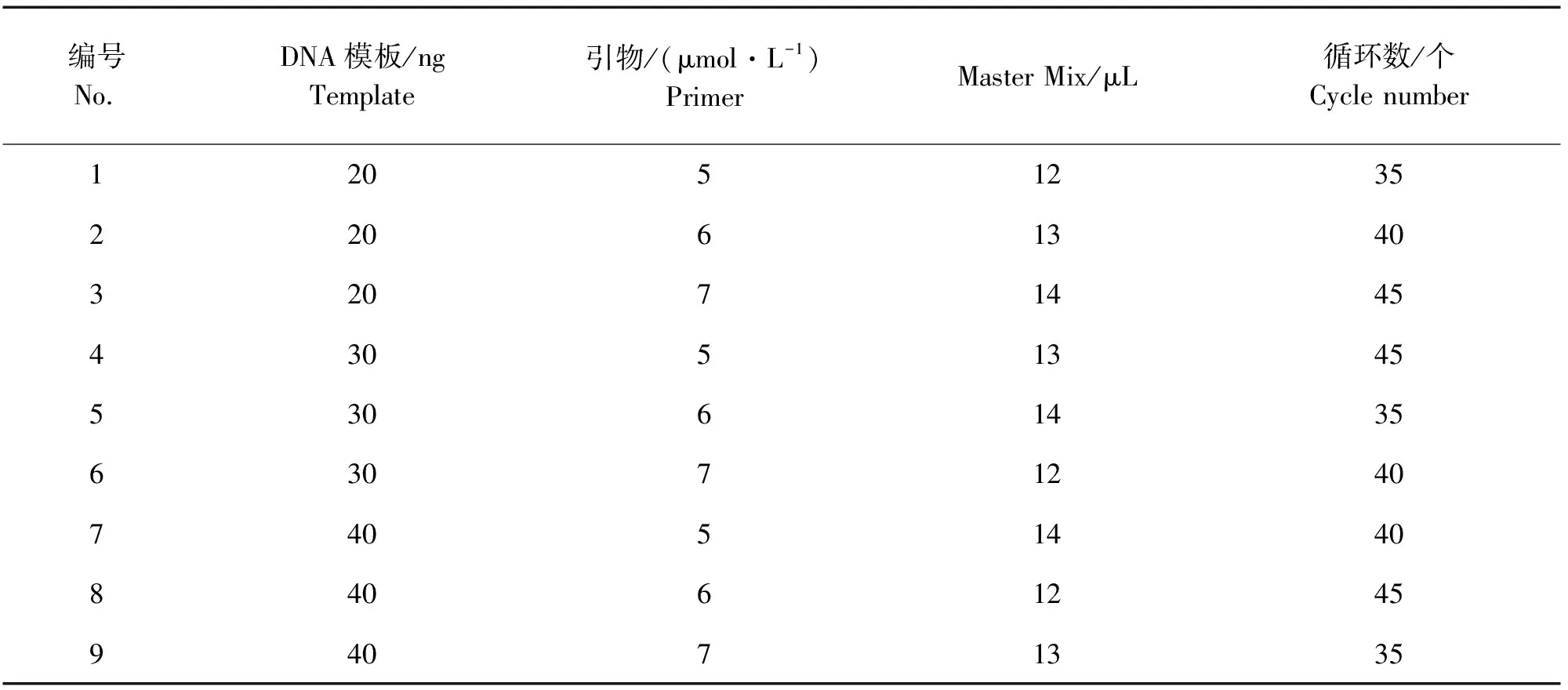
表4 ISSR-PCR反应体系的正交优化Table 4 Orthogonal optimization for ISSR-PCR reaction system
1.2.5 ISSR-PCR正交反应体系优化结果评价 依照ISSR-PCR扩增条带的数目、亮度、清晰度及特异性分别对9个组合评分,条带多、亮、无杂带拖带的得分最高,为6分,条带少、弱、拖带多的得1分,按照评分结果获得平均分及极差,从而确定最优的各因素的水平及最优体系,并明确各因素对体系的影响大小。
1.2.6 ISSR-PCR反应体系正交优化结果验证 使用优化的铁线莲ISSR-PCR反应体系,利用初筛出来的U834、U840、U844、U899这4条引物,随机对黄花铁线莲、芹叶铁线莲、褐毛铁线莲和钝萼铁线莲4份铁线莲样本进行扩增。
1.2.7 引物筛选及退火温度的优化 严格来说,退火温度并不一定等于其Tm值,而在Tm值附近波动,参考不同引物的Tm值,利用梯度PCR确定该引物的最佳退火温度[13]。以引物U815、U843、U840、U811(Tm=41.9 ℃、41.8 ℃、41.8 ℃、41.9 ℃)为例,设定退火温度梯度分别为45.7 ℃、47.7 ℃、50.4 ℃、51.8 ℃、54.0 ℃、55.4 ℃。以大叶铁线莲DNA为模板,最终确定引物各自的退火温度。
2 结果与分析
2.1 DNA模板浓度优化结果
本试验中,设置6个模板梯度,不同DNA浓度对ISSR-PCR扩增结果,见图1。
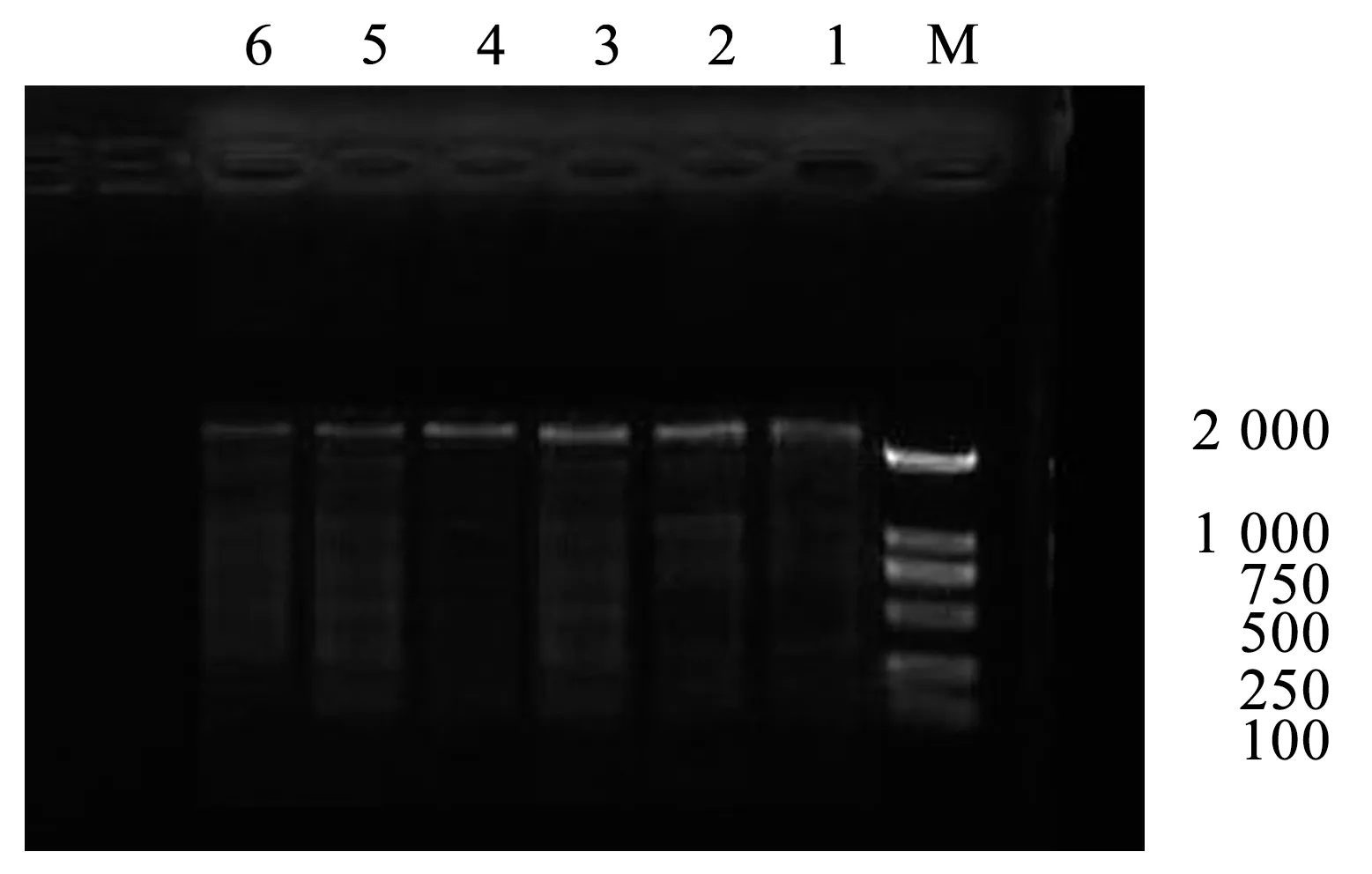
注:1~6 DNA浓度分别为10、20、30、40、50、60 ng。
由图1可知,当模板浓度过高或过低时,扩增得到的条带数较少,且个别条带颜色较淡。当模板浓度处于20~40 ng时,扩增的条带清晰且明亮。
2.2 目标引物浓度优化结果
不同引物浓度对PCR反应影响的结果,见图2。
注:1~6引物浓度分别为3.0、4.0、5.0、6.0、7.0、8.0 μmol/L。
由图2可知,泳道1条带最暗淡且不清晰,引物浓度在5~ 7 μmol/L之间时,能扩增出较为清楚的条带。当引物浓度大于7 μmol/L时,出现拖尾现象,且引物浓度越大,拖尾越为严重,不便于统计条带。
2.3 Master Mix体系用量优化结果
Master Mix具有稳定性好、灵敏度高、快速简便、特异性强等优点[10]。Master Mix用量 ISSR-PCR反应体系的影响,见图3。
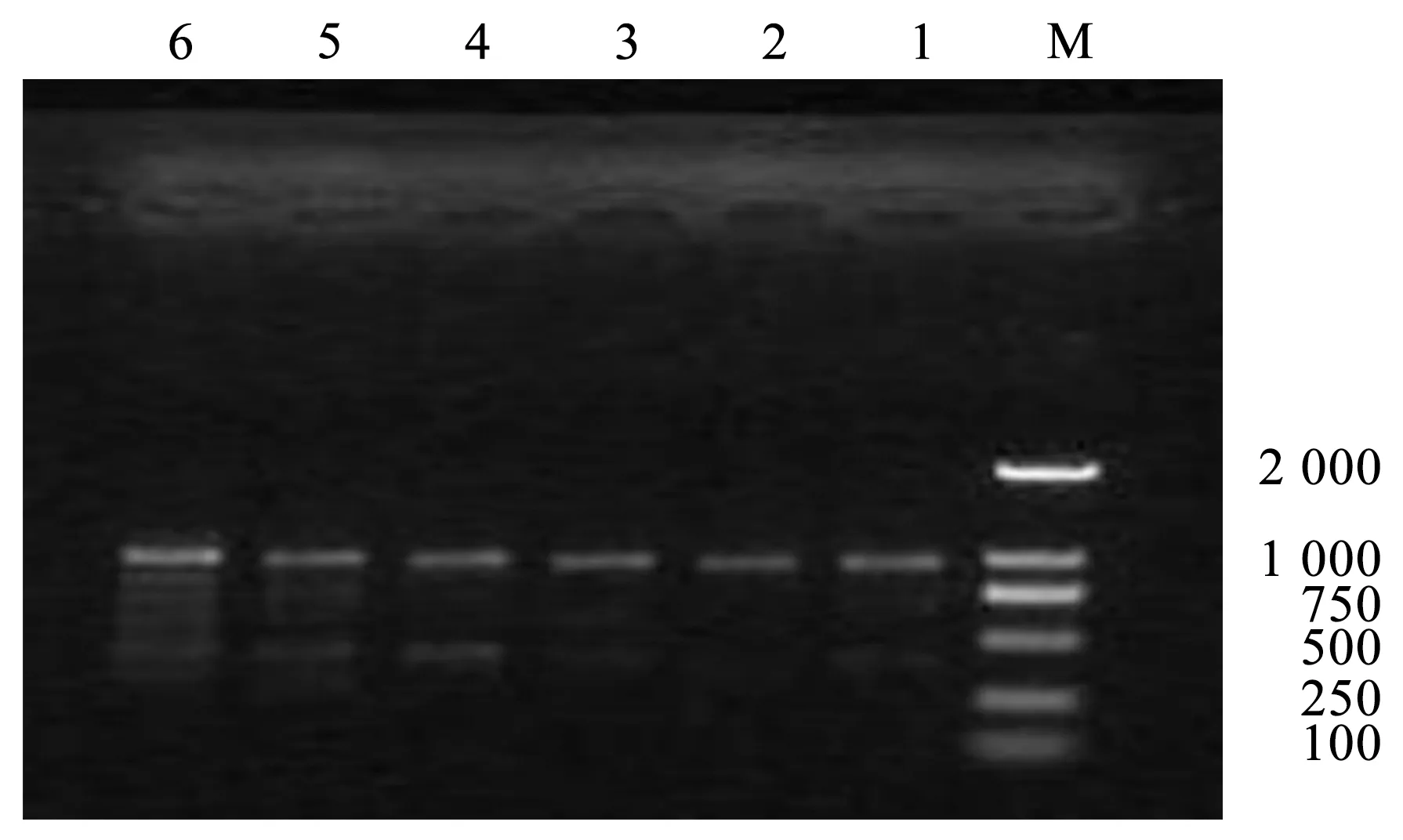
注:1~6 Master Mix用量分别为9、10、11、12、13、14 μL。
由图3可知,随Master Mix加入量增加,扩增条带变亮。当Master Mix加入量小于11 μL时,扩增条带模糊且数量较少。当加入量在12~14 μL时扩增条带变多且稳定清晰。考虑节约成本,12 μL为Master Mix最佳用量。
2.4 ISSR-PCR反应循环数优化结果
PCR反应循环数对扩增影响的结果,见图4。
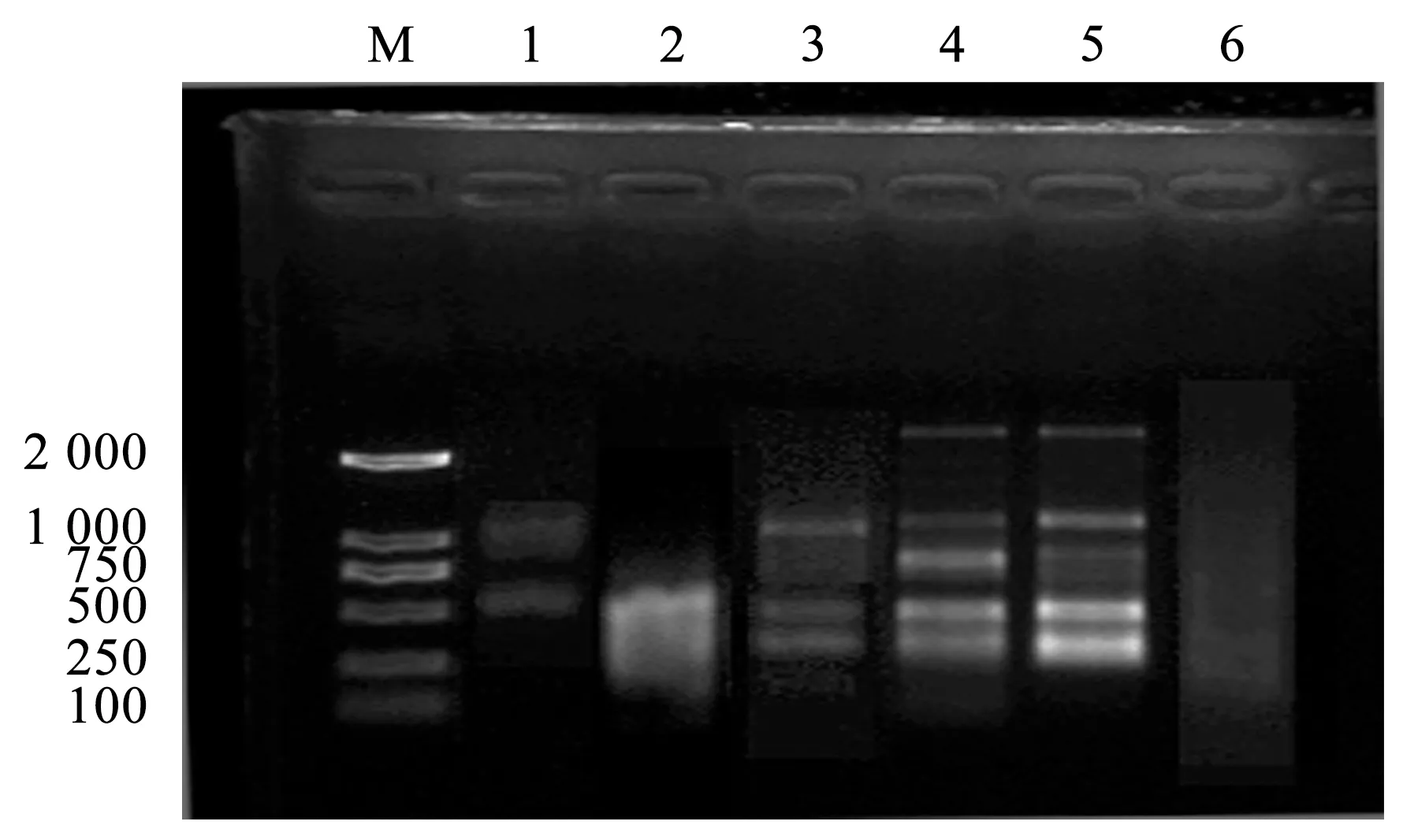
注:1~6 PCR反应循环数分别为25、30、35、40、45、50。
由图4可知,泳道1和泳道6无扩增条带产生,泳道2条带弥散有拖尾现象。35、40和45个循环数能在PCR反应中扩增出条带,但35和45个循环扩增出的条带过浅和过亮,不能将条带很好的区分开,当PCR循环数为40时,条带清晰且稳定,故PCR反应循环数的最佳值为40个循环。
2.5 ISSR-PCR反应体系的正交优化
采用1%琼脂糖凝胶电泳检测铁线莲ISSR-PCR正交优化扩增产物,见图5。
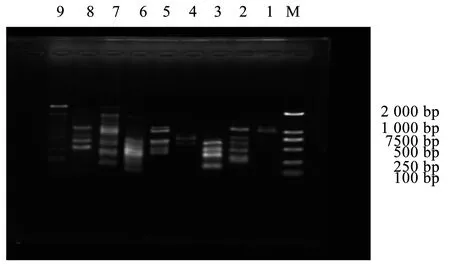
图5 ISSR-PCR反应体系的正交优化Figure 5 Orthogonal optimization of ISSR-PCR reaction system
由图5可知,在9组不同组合中,组合1,4,9扩增条带极少且条带较暗;组合6扩增条带弥散不清晰;组合2,3,5,7,8扩增条带清晰且明亮,其中组合2扩增条带效果最好。参照张丽的方法,依据扩增条带的清晰度、亮度、扩增条带的多少等因素进行评分,条带多、亮、无杂带拖带的得分最高,为6分,条带少、弱、拖带多的得1分,3次重复评分结果,见表5、表6、表7。
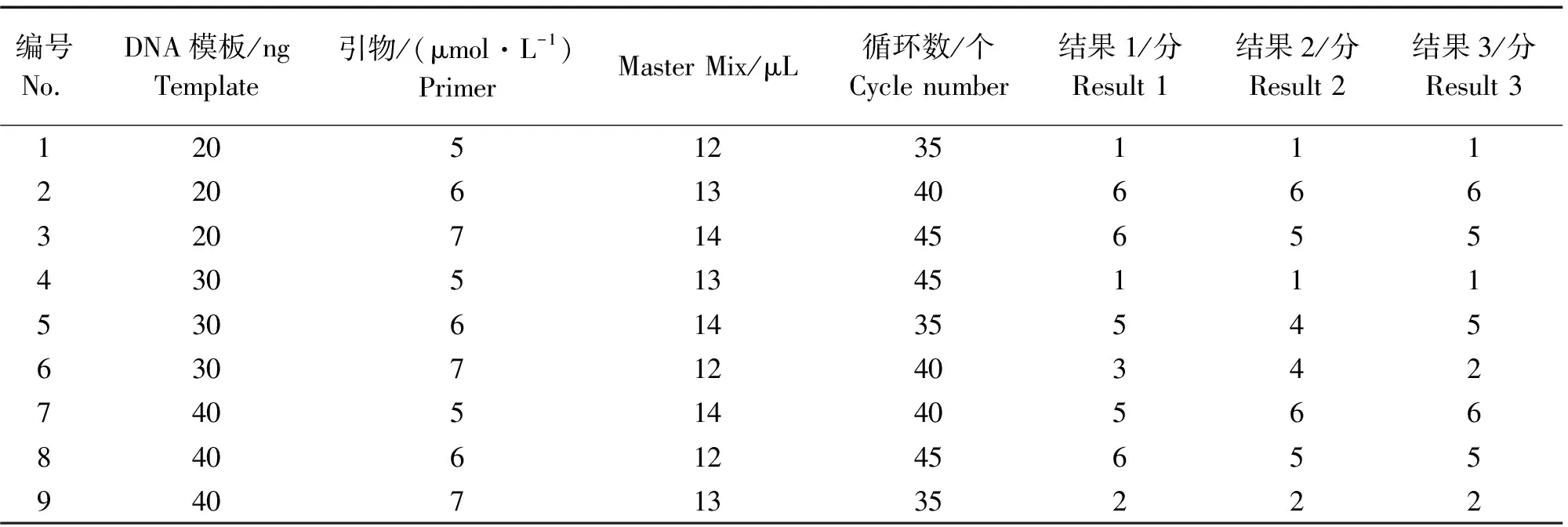
表5 ISSR-PCR扩增评分结果Table 5 The score results of ISSR-PCR reaction
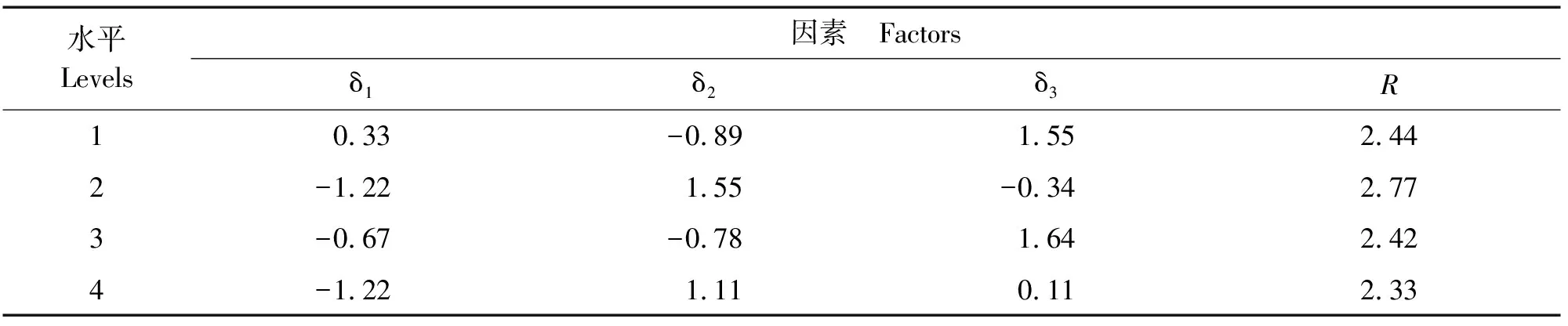
表6 不同试验因子极差分析表Table 6 Range analysis table for different text factors
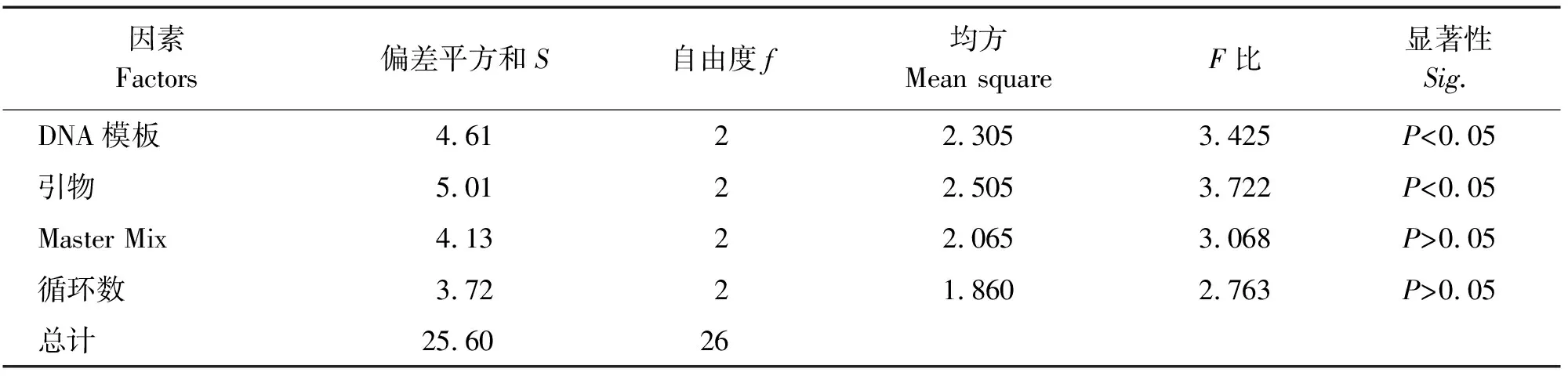
表7 ISSR-PCR正交试验方差分析Table 7 Orthogonal test variance analysis of ISSR-PCR
用SPSS 22.0对评分结果进行分析,由方差分析结果可知(表5),模板DNA和引物浓度对铁线莲ISSR-PCR扩增反应存在显著性影响(P<0.05)。计算各因子在4个试验水平的极差值(R值)。R值越大,说明此因子对ISSR-PCR扩增的影响越大,R值从大到小依次为:引物>模板DNA>Master Mix>循环数(表6)。根据F值可知,各因子浓度水平对ISSR-PCR反应体系体系的影响从大到小依次为:引物>模板DNA>Master Mix>循环数(表7)。因此,正交试验方差分析结果与极差分析结果一致,说明此结果较为可靠。
δ值的大小可以确定对应因素水平组合。由表6可知,δ31>δ11>δ21、δ22>δ31>δ11、δ33>δ13>δ23、δ24>δ34>δ14,因此组合为A3B2C3D2(ABCD表示4个因素,该组合的下标表示该因素所在的水平)得到ISSR-PCR扩增的最优结果。此时反应体系为模板DNA用量40 ng/25 μL,引物浓度6 μmol·L-1,Master Mix用量14 μL/25 μL,循环数40个。
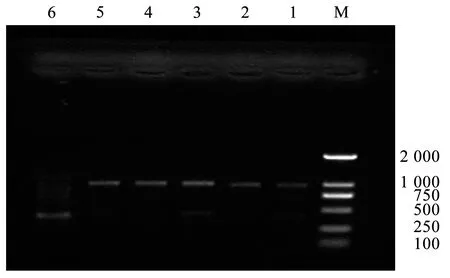
2.6 ISSR-PCR反应体系的验证
使用优化的铁线莲ISSR-PCR反应体系,随机挑选U834、U840、U844、U899这4条引物,对4份铁线莲样本进行扩增,1~4号样本分别为黄花铁线莲、褐毛铁线莲、芹叶铁线莲、钝萼铁线莲。结果见图6。
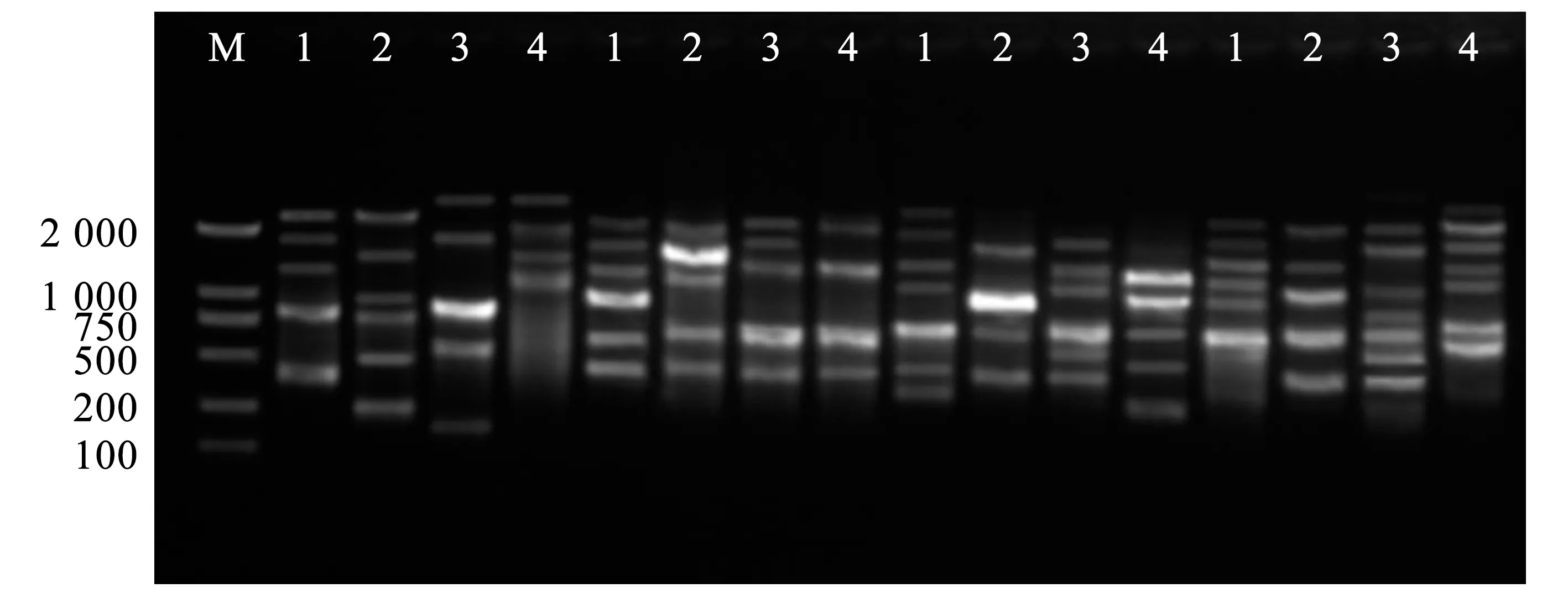
注:M是DL 2 000 DNA Ladder;1是黄花铁线莲;2是芹叶铁线莲;3是褐毛铁线莲;4是钝萼铁线莲。
由图6可知,不同的引物在不同铁线莲样本中均能扩增出清晰、明亮的条带,且不同种扩增出的条带间,均存在多态性条带。因此,本研究所建立的铁线莲ISSR-PCR反应体系是稳定、可靠的,适用于后续铁线莲的ISSR分析。
2.7 ISSR引物筛选及多态性分析
ISSR引物筛选及多态性分析结果见图7、表8、图8。
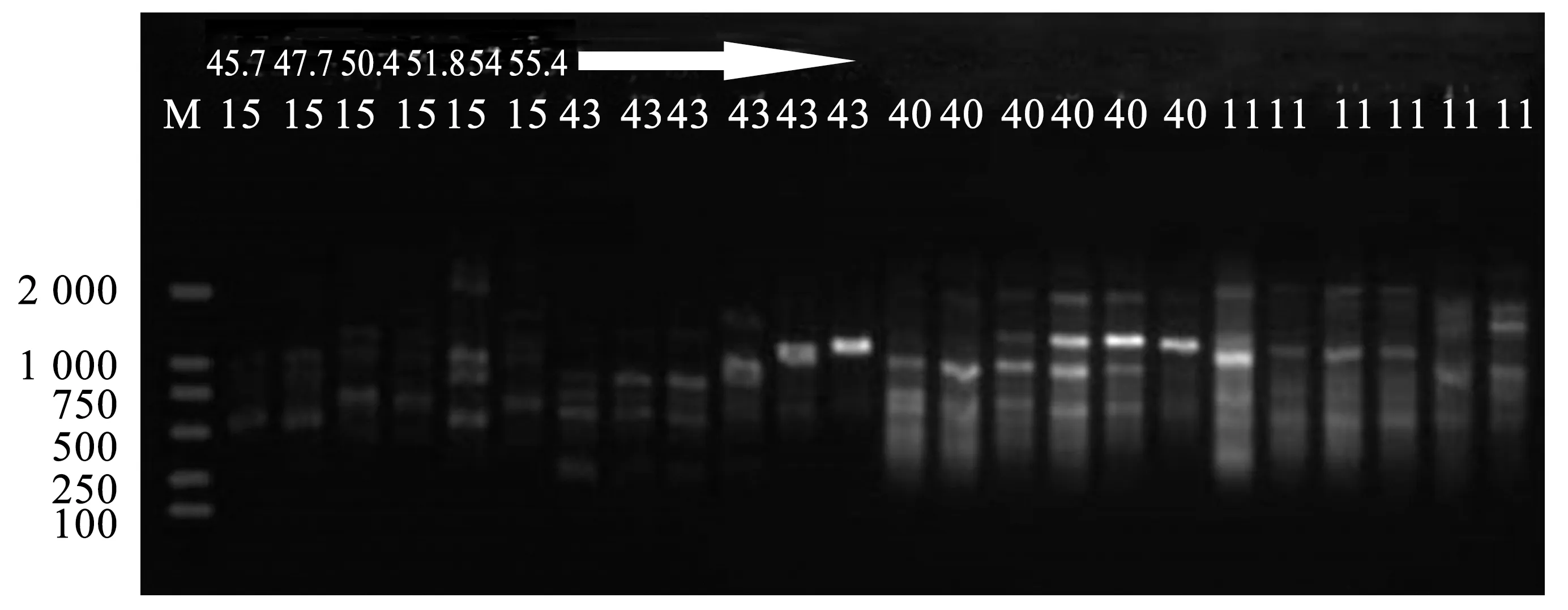
图7 引物U815、U843、U840、U811在不同退火梯度下的筛选结果
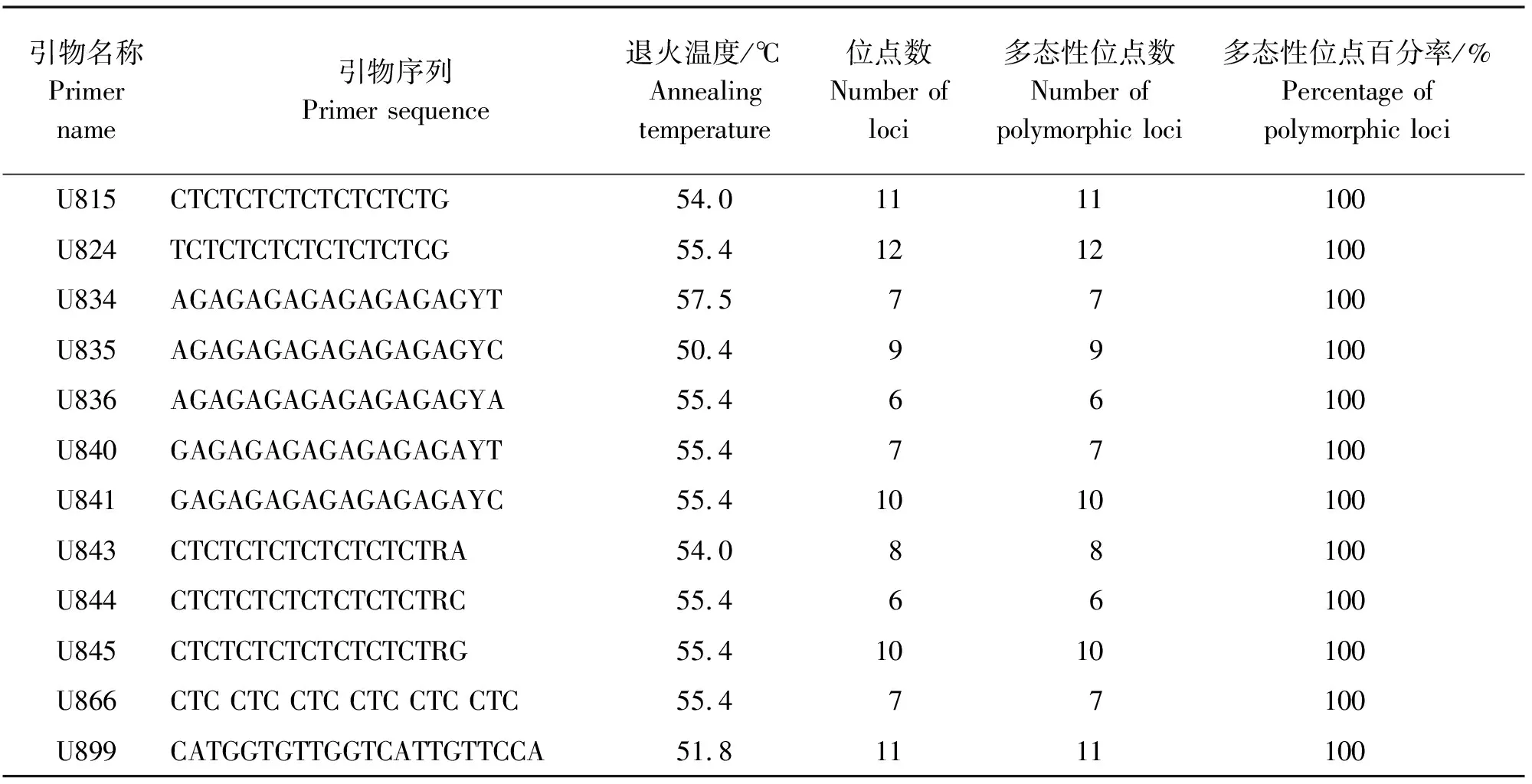
表8 用于16种铁线莲基因组DNA ISSR-PCR反应的引物信息及多态性分析Table 8 Primers information and polymorphism used for ISSR-PCR reaction of genomic DNA from 16 plants of Clematis
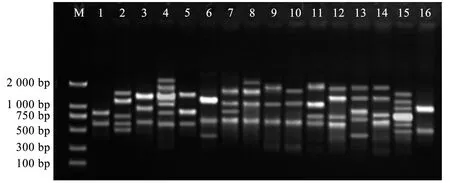
图8 引物U824的PCR扩增电泳图谱
铁线莲所用引物参考加拿大哥伦比亚大学(UBC)公布的第9套ISSR引物100条序列(UBC-801~UBC-900),以铁线莲基因组DNA为模板,部分引物不同退火梯度下筛选结果,见图7。最终筛选出12条能扩增出清晰条带的引物,并确定各自的退火温度。筛选出的12条引物可扩增出104条明亮,无拖带,重复高的谱带。其中共扩增出多态性条带104条,其中特异性条带104条。每个引物平均扩增出8.7个位点,特异性位点为8.7个,多态性百分比为100%(表8)。这12条引物可扩增出6~12条数量不等的条带。扩增条带片段大小为200~2 000 bp。其中,引物U824扩增出的多态性条带最多,为12条(图8)。引物U836和引物U844扩增出的多态性条带数最少,为6条。通过ISSR-PCR扩增体系的12条引物扩增的DNA片段的分子量大部分在200~2 000 bp之间,部分超过2 000 bp。
2.8 16个野生铁线莲的ISSR指纹图谱构建
利用多态性高、条带清晰的ISSR引物UBC815、UBC824和UBC845构建16个野生铁线莲的数字指纹图谱(表9) , 该指纹图谱可以有效地对这些铁线莲野生种进行区分、鉴定[14]。
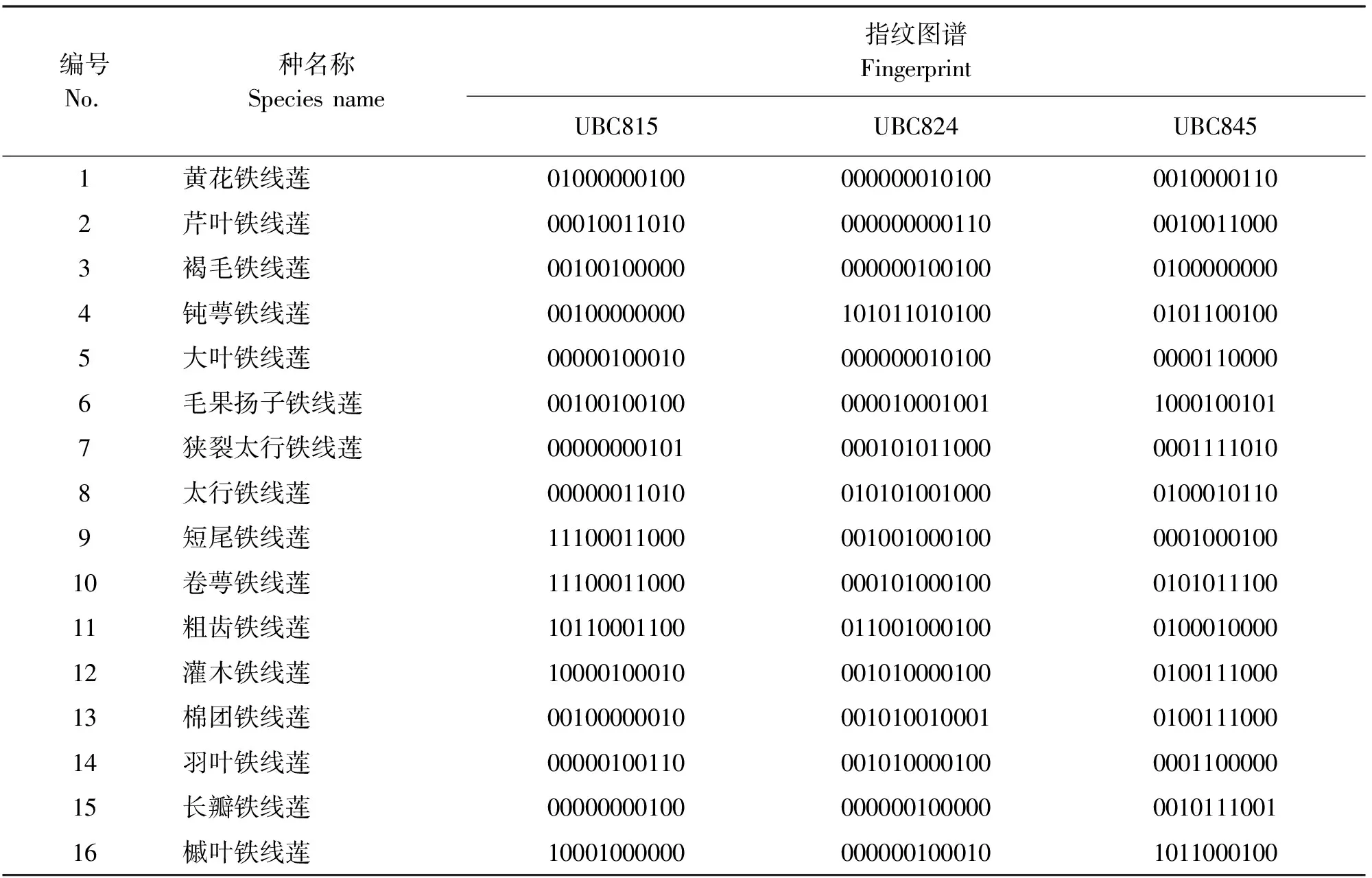
表9 构建16种野生铁线莲的数字指纹图谱Table 9 Constructed digital fingerprint of 16 Clematis
3 讨论与结论
ISSR分子标记以PCR反应为基础,其扩增效果受反应体系中各个因素的影响,前人先后对金莲花(TrolliuschinensisBunge)、枫香(LiquidambarformosanaHance)、桑树(MorusL.)等园林观赏花卉及树木的ISSR-PCR反应体系进行了优化[15-17]。结果显示,不同作物的最优ISSR-PCR反应体系和适用的引物均不同。经优化后的反应体系能够扩增出多态性丰富且清晰度高的条带。
作为正交试验的基本工具,正交表可以确定因子的主次顺序,利用方差分析对试验数据进行分析各因子对试验指标的影响程度,进而找出优化条件和最优组合来实现试验目的[11]。本研究先用单因素试验确定各影响因子的适宜浓度范围,在此基础上,设计正交试验,以确定适合铁线莲的最优ISSR-PCR反应体系。对于不同的植物材料,ISSR-PCR扩增反应体系所用的DNA模板量、引物浓度、Master Mix用量及扩增反应循环数有所不同,各因子浓度大小及用量的水平变化对ISSR-PCR反应体系影响大小也各不相同。本试验研究结果表明,引物浓度对PCR扩增条带影响最大,DNA模板量和Master Mix用量次之,扩增循环数对PCR扩增条带影响最小。
本试验将ISSR分子标记技术应用于铁线莲上,建立了适用于铁线莲的ISSR-PCR反应体系。结果表明,适用于铁线莲的最优反应体系为模板DNA用量40 ng,引物浓度6 μmol/L,Master Mix用量14 μL,循环数40个。并且利用最优体系构建了16种野生铁线莲的遗传指纹图谱。对于种间区分以及鉴定都有重大意义。
本试验将DNA模板量、引物浓度、反应循环数和Master Mix的用量4种单因素作为体系优化的主体,并且对于4种因素的最佳配比及组合也有了明确的结果,该反应体系的建立为铁线莲遗传多样性研究、DNA指纹图谱建立及分子标记遗传育种研究提供了一定的理论基础。

