碱胁迫下内生真菌对布顿大麦光合性能和生理特性的影响
王 凯, 杨宝钰, 陈水红, 席琳乔
(塔里木大学/塔里木盆地生物资源保护利用兵团重点实验室, 新疆 阿拉尔 843300)
布顿大麦(Hordeumbogdanii)在新疆分布较广,沿天山两侧的平原、绿州、草地、盐渍化草甸、路边等均有其野生种的生长[1]。这种草的适应性强,产草量高,盛花期干草产量为6 000~9 000 kg·hm-2;营养丰富,花期干草蛋白质含量为15.44%,适口性好[2]。在pH值为7.8~8.0的盐化草甸土上生长良好,产量较高,具有耐寒性强、耐干早、耐盐碱、再生性强的特点,喜生于较湿润或带微碱性的砂质土壤上,是牧区天然草地上一种重要的野生资源,在作为饲用牧草和改良盐碱地方面有着十分广阔的前景[2-3]。
土壤盐碱化不仅危害植物生长,而且会破坏土地结构,致使大多数植物生长受到不同程度的抑制,甚至会导致死亡[4]。而碱胁迫对布顿大麦的伤害主要表现为:使布顿大麦生长缓慢、新枝生长减少,植株株高降低,叶片枯黄萎蔫,使植株光合作用下降,最终导致产量减低,高浓度碱胁迫甚至会使植株死亡[5]。
禾草内生真菌是指其部分或全部生命周期都在禾草体内完成,而宿主植物外部却不显现任何病害症状的一大类真菌[6]。内生真菌与禾草形成互惠共生体,可以提高宿主植物抵抗生物胁迫和非生物胁迫的能力。例如:内生真菌可以提高寄主的生长能力[7]以及对食草动物[8-10]、昆虫[11-13]、线虫[14]、病原真菌、细菌[15]和竞争性植物[16]等生物胁迫的抗性和对盐碱[17-18]、干旱[19-20]、重金属污染[21]等非生物胁迫的抵抗能力。由于新疆是中国最大的盐土区,拥有大量盐碱地,而布顿大麦又在新疆广泛分布,因此本文研究内生真菌与碱胁迫对布顿大麦光合特性和部分理化指标的影响,进而揭示内生真菌对宿主布顿大麦抗碱性影响及其作用机理,为进一步探究布顿大麦、内生真菌、耐碱性三者之间的关系,提供重要的参考依据;同时为提高盐碱地利用,提高生产力,增加地面植被覆盖率,改善畜牧业的可持续发展和生态环境建设,提供理论参考依据。
1 材料与方法
1.1 种子来源
布顿大麦种子采集于新疆阿克苏地区乌什县(78°23′41″~80°01′09″E,40°43′08″~41°51′12″N,海拔:1 396 m),种植于塔里木大学温室大棚[白天平均温度(28±2)℃;夜间平均温度(12±2)℃]中,待布顿大麦幼苗生长至3~4株分蘖时用苯胺蓝染色法[22]检测布顿大麦植株的内生真菌带菌情况,并将携带内生真菌的植株(E+)培养至成熟收获种子,收集种子后分出一半种子用内吸式杀菌剂(甲基托布津,50%有效浓度)浸泡处理5 h,用清水洗干净残余药后,将种子种植于新疆阿拉尔市塔里木大学温室中,待其生长6周后,对植株进行检菌,确定都为不带内生真菌的植株(E-)后将其培养至成熟收获种子。最后将得到的E+与E-种子种植于实验大田繁殖二代种子,收获的种子用作本试验的种子。
1.2 试验设计
将收取的布顿大麦E+和E-的种子各种植25盆,共50盆于温室大棚中,定期浇Hoaglang营养液使布顿大麦生长至分蘖盛期,对布顿大麦植株进行50,100,150,200 mmol·L-1四种浓度的混合碱(碳酸钠∶碳酸氢钠=1∶1)处理并以未加混合碱的为对照,每个处理重复5次。处理方案:为避免碱冲激效应的发生,浇灌混合碱溶液采用渐近式,即除对照外,第1次浇灌浓度均为25 mmol·L-1,之后每天递增25 mmol·L-1,直至预定浓度。达预定浓度后,根据气温变化进行管理,适量浇灌对应浓度溶液,但每组浇灌溶液体积相同。在处理结束前一天,用Li-6400 测定光合特性相关指标,胁迫21 d收样,鲜样剪成小段称量一定重量用锡箔纸包裹并标记各处理组,液氮速冻后放入-80℃冰箱保存用于后续各项指标测定。
1.3 指标测定方法
1.3.1光合特性相关指标的测定方法 在准备收取样品前,用便携式光合作用测定仪Li-6400,测定不同碱处理浓度下布顿大麦植株的净光合速率、气孔导度、蒸腾速率和胞间CO2浓度等相关指标。测定时选取植株自上而下第三片叶片,同时测其叶面宽度,采用2 cm×3 cm的叶室,LED红蓝光源,光强1 500 μmol·m-2·s-1,参数ΔCO2在±0.5范围之内,温度室温(23±2)℃。
1.3.2生理生化相关指标的测定方法 叶绿素含量的测定采用丙酮和酒精萃取法[23];脯氨酸含量测定采用磺基水杨酸法[24];过氧化氢酶(Catalase,CAT)活性测定采用硫代硫酸钠滴定法[25];过氧化物酶(Peroxidase,POD)活性测定采用愈创木酚法[25];超氧化物歧化酶(Superoxide dismutase,SOD)活性的测定采用氯化硝基四氮唑蓝法[25];可溶性蛋白含量测定采用考马斯亮蓝G-250染色法[25];可溶性糖含量测定采用蒽酮比色法[25];细胞质膜透性测定采用电导仪法;丙二醛(Malondialdehyde,MDA)含量测定采用硫代巴比妥酸法[26]。
1.4 数据处理及分析
利用SPSS(IBM SPSS Statistics 19)软件进行数据分析,图中数据采用平均值±标准误表示。文中图表用SigmaPlot 14.0绘图软件绘制。采用双因素方差分析方法检测碱处理和内生真菌对布顿大麦光合性能和理化指标的影响,其中不同的碱处理浓度对布顿大麦光合性能和理化指标的影响采用单因素方差分析,采用独立样本T检验来检测同一碱浓度下E+和E-每个光合指标和理化指标含量的差异。
2 结果与分析
2.1 碱胁迫下内生真菌对净光合速率、气孔导度、蒸腾速率和胞间CO2浓度影响
由表1可知净光合速率、气孔导度、蒸腾速率和胞间CO2浓度都随碱浓度升高而降低,并且在不同浓度的碱处理的条件下,各组E+植株的净光合速率、气孔导度、蒸腾速率和胞间CO2浓度都高于E-植株,在50 mmol·L-1和100 mmol·L-1碱浓度处理下E+的植株的净光合速率显著高于E-(P<0.05),植株气孔导度和蒸腾速率E+极显著高于E-(P<0.01)。在不同浓度的碱处理条件下,除对照组的胞间CO2浓度E+、E-对比差异不显著外,在50 mmol·L-1时E+植株胞间CO2浓度显著高于E-(P<0.05),其余各组胞间CO2浓度E+植株极显著高于E-植株(P<0.01)。

表1 碱胁迫下内生真菌对布顿大麦植株光合特性的影响Table 1 Effects of endophytic fungi on photosynthetic characteristics of Hordeum bogdanii under alkaline stress
2.2 碱胁迫下内生真菌对叶绿素和类胡萝卜素含量的影响
由图1a和图1b可知布顿大麦植株叶绿素a和叶绿素b含量随碱浓度增加总体呈下降趋势,且E+布顿大麦叶绿素含量均高于E-,在碱浓度为0,150,200 mmol·L-1时,E+植株的叶绿素a和叶绿素b均显著高于E-植株(P<0.05),由图1c可知E-布顿大麦的类胡萝卜素随碱浓度的升高而呈现下降趋势,且各组碱处理E+植株的类胡萝卜素均高于E-植株,除碱浓度为50 mmol·L-1这一处理组外其余各组E+植株的类胡萝卜素都显著高于E-植株(P<0.05)。由表2得出内生真菌、碱处理显著影响叶绿素a,b和类胡萝卜素的含量(P<0.05)。


图1 不同浓度混合碱和内生真菌对布顿大麦植株叶绿素和类胡萝卜素含量的影响Fig.1 Effects of different concentrations of mixed alkali and endophytic fungi on chlorophyll and carotenoid contents in Hordeum bogdanii plants注:不同处理浓度混合碱胁迫条件下,在带内生真菌(E+)组或不带内生真菌(E-)组中,标注不同小写字母者差异显著(P<0.05)。E+和E-在相同处理下,两两差异显著(P<0.05)者用“*”标注,其中“*”标注在较高一组上,下同Note:Significant differences (P<0.05) between groups with endophytic fungi (E+) or without endophytic fungi (E-) under mixed alkali stress conditions with different treatment concentrations,marked with different lowercase letters. E+ and E- are marked with “*” for two significant differences (P<0.05) under the same treatment,where “*” is marked on the higher group,the same as below
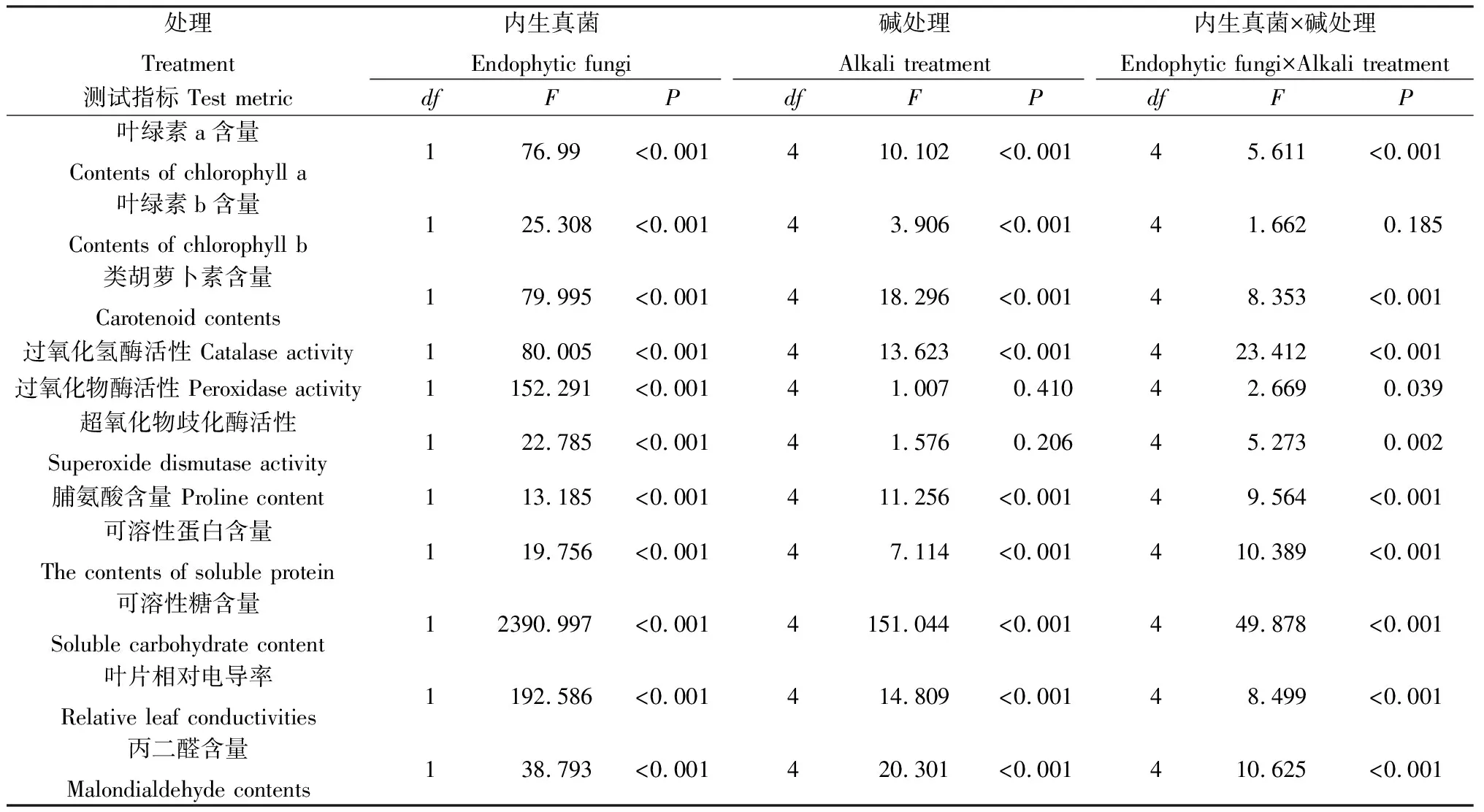
表2 碱胁迫下内生真菌对布顿大麦理化指标影响的双因素方差分析Table 2 Two-factor analysis of variance for the effects of endophytic fungi on physical and chemical indexes of Hordeum bogdanii under alkali stress
2.3 碱胁迫下内生真菌对布顿大麦抗氧化酶活性影响
由图2a 得出E+植株的CAT活性随着碱浓度的升高总体呈下降趋势,并且除200 mmol·L-1这一处理组外其余各组E+植株的CAT活性都高于E-植株,且在0,50,100 mmol·L-1碱浓度下E+植株的CAT活性显著高于E-植株(P<0.05)。E+植株的POD活性随着碱浓度的升高而逐渐降低,并且E+植株的POD活性均显著高于E-植株(P<0.05)(图2b)。除对照组以外其余各组E+植株的SOD活性均高于E-植株,且在碱浓度为50 mmol· L-1时E+植株的SOD活性显著高于E-植株(P<0.05)(图2c)。由表2可知内生真菌和碱处理对植株CAT活性有显著影响,并且两者之间存在交互作用(P<0.05)。内生真菌对植株POD和SOD活性有显著影响(P<0.05),内生真菌和碱处理两者之间存在交互作用(P<0.05)。
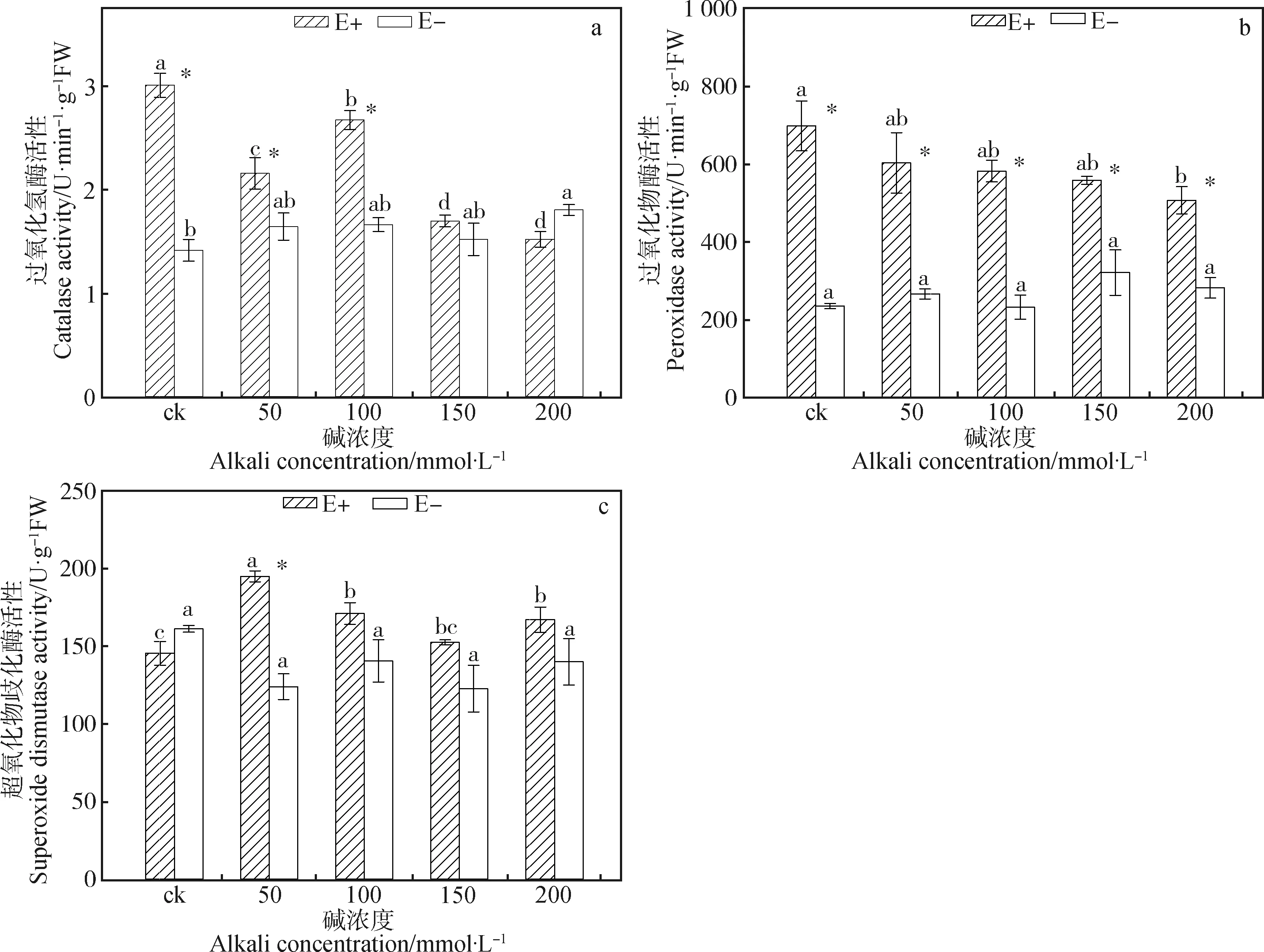
图2 不同浓度混合碱和内生真菌对布顿大麦植株抗氧化酶活性的影响Fig.2 Effects of different concentrations of mixed alkali and endophytic fungi on antioxidant enzyme activities of Hordeum bogdanii plants
2.4 碱胁迫下内生真菌对布顿大麦渗透调节物质的影响
由图3a可知布顿大麦植株的脯氨酸含量随碱浓度的升高而呈现升高状态,除碱浓度为50 mmol·L-1这一处理组外其余各处理组的E+植株的脯氨酸含量都高于E-植株,在50 mmol·L-1时E-植株的脯氨酸含量显著高于E+植株(P<0.05)在碱浓度为150,200 mmol·L-1时E+植株的脯氨酸含量显著高于E-植株(P<0.05)。E+植株的可溶性蛋白含量随着碱浓度的升高而升高,除碱浓度为200 mmol·L-1其余各处理组E-植株的可溶性蛋白含量均高于E+植株,在200 mmol·L-1时E+植株的可溶性蛋白含量显著高于E-(P<0.05)(图3b)。除对照以外E+植株的可溶性糖含量随着碱浓度的升高而升高,并且各组E+植株的可溶性糖含量都显著高于E-植株(P<0.05)(图3c)。由表2可知内生真菌和碱处理显著影响布顿大麦植株脯氨酸、可溶性蛋白、可溶性糖含量,并且两者之间存在交互作用(P<0.05)。

图3 不同浓度混合碱和内生真菌对布顿大麦植株渗透调节物质的影响Fig.3 Effects of different concentrations of mixed alkali and endophytic fungi on osmoregulation substances in Hordeum bogdanii plants
2.5 碱胁迫下内生真菌对布顿大麦膜透性的影响
由图4a 可知,E+植株的叶片相对电导率随着碱浓度的升高呈现先上升后下降的的趋势,而E-植株的叶片相对电导率随着碱浓度的升高而呈现上升趋势(200 mmol·L-1除外),并且E-植株的叶片相对电导率在各处理组(除100 mmol·L-1)均显著高于E+植株(P<0.05)。E-植株的MDA含量随着碱浓度的升高而升高,并且各处理组E-植株的MDA含量均显著高于E+植株(P<0.05,图4b)。由表2可知内生真菌和碱处理对布顿大麦植株的叶片相对电导率和MDA含量有显著影响,并且二者之间存在交互作用(P<0.05)。

图4 不同浓度混合碱和内生真菌对布顿大麦植株细胞膜透性的影响Fig.4 Effects of different concentrations of mixed alkali and endophytic fungi on cell membrane permeability of Hordeum bogdanii
3 讨论
植物抵抗胁迫的方式主要是通过调节细胞渗透势、维持细胞膜系统的完整、增强抗氧化防御系统、调节激素水平等手段来减轻胁迫所带来的伤害[17]。本试验发现来自于新疆阿克苏地区乌什县布顿大麦叶绿素、类胡萝卜素、净光合速率、气孔导度、蒸腾速率、胞内CO2浓度、抗氧化酶活性、渗透调节物质、细胞膜透性都受碱浓度影响,随着碱浓度由低到高而做出相应的变化。通过上述指标我们发现布顿大麦E+植株对不同浓度的混合碱溶液有一定的抗性。
盐碱环境对植物的生长影响很大,植物的光合作用在碱胁迫下被打乱,导致植株的净光合速率降低,并且植株的净光合速率、胞间CO2浓度等指标的降低程度与碱浓度升高之间呈现正相关[27-28]。本试验中随着碱浓度不断加剧布顿大麦植株的净光合速率、气孔导度、蒸腾速率、胞间CO2浓度变化均呈现下降趋势,然而,在碱胁迫下E+植株这4个指标均高于E-植株(表1)。Morse等[29]人发现,在重度水分胁迫下,带内生真菌的亚利桑那羊茅(Festucaarizonica)与不带内生真菌的亚利桑那羊茅比较,带菌植株的净光合速率和胞间CO2浓度都有升高趋势,而胞间CO2浓度的增加可能与内生真菌的呼吸作用相关,间接的增加了E+植株的胞间CO2浓度,与本试验结果一致。Amalric等[30]发现在干旱胁迫下内生真菌可以显著提高黑麦草(Loliumperenne)的气孔导度,本试验中内生真菌极显著提高了布顿大麦的气孔导度。本试验中发现随着碱浓度不断升高叶绿素a、类胡萝卜素和叶绿素b含量变化均总体呈下降趋势(图1)。叶绿素和类胡萝卜素是光合作用相关的主要色素,其含量的变化对布顿大麦植株的耐碱性显得至关重要。本试验发现E+植株的叶绿素和类胡萝卜的含量在各处理组均高于E-植株,任安芝等[31]发现随着干旱胁迫的程度增加,内生真菌促进了黑麦草的叶绿素和类胡萝卜素的产生,本试验结果与之一致。说明在外界碱胁迫达到一定程度,已经开始影响宿主植物的光合作用,内生真菌会发挥其保护作用,维持植物体内的色素平衡,使植株更好的面对胁迫环境。
SOD,CAT和POD等几种酶共同构成了植物体内的抗氧化酶保护系统,这几种酶相互协调作用将直接影响植物对不良环境的抵抗能力[32]。本试验中发现随着碱浓度的增大,E+植株的抗氧化酶的活性均高于E-植株,Zhang等[33]发现水分胁迫下披碱草(ElymusdahuricusTurcz.)E+植株的抗氧化酶活性高于E-植株。王正凤等[34]发现内生真菌感染野大麦(Hordeumbrevisubulatium(Trin.)Link)会提高抗氧化酶的活性从而提高野大麦植株的抗盐性,本研究结果与其一致。有报道指出,内生真菌影响宿主植物的抗逆性是因为内生真菌可以产生活性氧(ROS)刺激植物产生更多的抗氧化剂保护共生体免受氧化胁迫的伤害[35]。由此可见,布顿大麦内生真菌也能刺激宿主产生更多活性氧,进而刺激宿主布顿大麦分泌更多抗氧化剂而帮助其提高耐碱性。
到目前为止,有大量报道证明脯氨酸、可溶性糖、可溶性蛋白等渗透调节物质和植物的抗逆有关[34,36-37]。本试验发现随着碱浓度不断增大布顿大麦植株脯氨酸含量不断升高,并且E+植株的脯氨酸含量高于布顿大麦E-植株(图3a),这一结果与王正凤等[34]内生真菌感染可导致野大麦叶内脯氨酸含量显著增加,从而有效减轻野大麦在高浓度盐胁迫下所受的伤害研究结果一致;随着碱浓度的增大布顿大麦E+植株的可溶性蛋白含量呈上升趋势(图3b),与鲍根生等[38]发现在锈病胁迫下内生真菌感染布顿大麦可以提高其可溶性蛋白的含量结论一致;布顿大麦E+植株的可溶性糖含量随碱浓度增加呈上升趋势,并且E+植株的可溶性糖含量显著高于E-植株(图3c),这一结果与王正凤等[34]内生真菌感染提高了野大麦可溶性糖的含量,进而提高了野大麦叶片的渗透调节能力并增强其耐盐能力相吻合。总的来说内生真菌感染布顿大麦可以使其在碱胁迫下积累更多的渗透调节物质,从而更好的适应胁迫环境。
细胞膜的稳定性可用来判断不同植物的抗逆性,丙二醛和叶片相对电导率是衡量膜脂过氧化作用强弱的重要指标。随着碱浓度不断加剧布顿大麦叶片相对电导率变化呈现出先增后降趋势,并且E+植株的叶片相对电导率显著低于E-植株(图4a)。内生真菌感染降低了布顿大麦植株叶片相对电导率,从而降低了植株细胞膜的通透性,其结果与缑小媛[39]研究结果一致,即盐胁迫下内生真菌感染可以降低醉马草叶片相对电导率进而减轻盐胁迫对细胞膜的伤害;随着碱浓度的增大,布顿大麦E-植株叶片丙二醛的含量逐渐升高,说明碱胁迫下增加了植株体内丙二醛含量,但E+植株叶片丙二醛的含量随着碱浓度的增大总体呈现一个先升后降的趋势,并且E+植株的丙二醛含量显著低于E-植株,试验结果与邹晖等[40]的研究结果相吻合,即干旱胁迫下内生真菌感染铁皮石斛(Dendrobiumofficinale)可以降低其体内丙二醛的积累。说明内生真菌感染宿主植物,可以缓解宿主植物在碱胁迫下的膜脂过氧化作用,维持了细胞膜的完整性。
4 结论
本研究探索了碱胁迫下内生真菌对布顿大麦光合性能和生理特性的影响,通过指标测定发现碱胁迫下内生真菌可以提高布顿大麦的光合能力,并且可以提高宿主抗氧化酶的活性来消除活性氧的伤害,并促进渗透调节物质的积累来调节细胞渗透压,还能降低布顿大麦的叶片相对电导率和丙二醛含量缓解碱胁迫下的膜脂过氧化作用,维持细胞的完整性。综上所述,该布顿大麦内生真菌可以通过改善宿主的理化指标和光合特性指标来提高其抗碱性。

