高能量密度肠内营养乳剂对重症肺部感染患者免疫功能的影响
严 超,林先红
重症肺部感染是ICU 患者的主要死亡原因,也是最常见的感染疾病之一[1]。虽然早期及时进行液体复苏、重要器官功能支持及抗感染治疗已取得较大进步,但重症肺炎患者通常合并急性肺功能损伤甚至急性呼吸窘迫综合征,部分患者或并发脓毒症,病死率升高,对患者的生命健康造成较大的威胁[2]。临床认为,导致重症肺部感染的关键因素为机体脏器的贮备功能低、营养不良、基础免疫功能差、免疫功能失调等[3]。大部分学者认为免疫功能失衡等在重症肺部感染疾病治疗过程中具有至关重要的作用[4-5],因此,提高患者免疫功能对该病的治疗具有积极作用。目前,临床免疫营养支持属于一种治疗危重症患者的关键措施。高能量密度肠内营养(enteral nutrition,EN)乳剂中的链脂肪酸含量较高,实现迅速供能,降低蛋白质的消耗[6]。此外,EN 乳剂以低碳水化合物为主,能为患者提供机体所需之物,继而提升自身免疫功能,改善淋巴细胞亚群失衡[7]。目前,已有研究报道关于EN治疗重症肺部感染患者的免疫调节作用,但仍缺乏对高能量密度EN 乳剂的相关研究,同时免疫功能相关指标的数据并不全面。本研究旨在探讨高能量密度EN 乳剂对重症肺部感染患者的免疫功能的影响,为临床治疗提供依据,现报道如下。
1 资料与方法
1.1 一般资料 收集2017年10月-2021年8月安徽省第二人民医院重症医学科收治的89 例重症肺部感染患者作为研究对象。研究指标的主要终点为热卡达标率,根据相关调查显示,患者伤后EN 7 d热卡达标率只有17%左右[8]。本研究对象采用高能量密度EN 乳剂热卡达标率提升到60%左右,显著水平为0.06,研究组和对照组样本量比为1:1,得出n1=n2=14。脱漏率预期约20%,研究组与对照组的样本量各大于20 例。本研究使用随机数字表法,对照组和研究组分配比例为1:1[9],分为对照组(n=44)和研究组(n=45)。统计患者基线人口统计学和临床基线特征,包括性别、年龄、病程、体质量指数、血红蛋白、血清白蛋白和血清总蛋白。在患者转入ICU 48 h内,利用氧合指数评估患者肺损伤程度,利用急性生理和慢性健康评分系统(acute physiology and chronic health evaluation,APACHE)Ⅱ和序贯器官衰竭(sequential organ failure assess‐ment,SOFA)评分评估患者的病情严重程度。本研究通过医院伦理委员会批准(伦理号:2017-010)。
1.2 纳入和排除标准 纳入标准:参照《中国急诊重症肺炎临床实践专家共识》中的诊断标准[10],当满足下列主要标准1项或次要标准3项以上,诊断为重症肺炎者,主要标准为:①需插管行机械通气维持氧合;②经积极体液复苏后仍使用血管活性药物维持的脓毒症休克;次要标准为:①呼吸频率≥30/min;②氧合指数≤250 mmHg;③血尿素氮≥7.14 mmoL/L;④收缩压<90 mmHg,需要积极的液体复苏;⑤多肺叶浸润;⑥具有定向障碍和(或)意识障碍。年龄在18~70岁之间;对临床研究知情了解,研究对象自己或家属均自愿签署知情同意书。
排除标准:①不符上述诊断标准者;②入院前受试对象均已通过化痰、抗炎等对症治疗者;③伴有免疫功能缺陷者;④肠吸收异常、肠功能紊乱者;⑤入组前3 个月内应用糖皮质激素治疗者;⑥伴有心、肝、肾等脏器疾病严重且未得到有效控制者;⑦伴有精神异常者;⑧合并肺肿瘤、肺间质纤维化以及肺结核等其他肺部疾病;⑨病例资料不全者。
1.3 方法 所有患者住入ICU 即给予静脉输注复方氨基酸注射液补充蛋白,并经鼻胃管给予EN 支持[11]。EN 初始速度为10~25 mL/h,床头升高30°,饲管温度维持在37 ℃左右,按照患者胃排空、耐受程度逐渐添加达到维持量。以相关指南推荐作为根据,满足蛋白与能量的需求量,蛋白需求为1.5~2.0 g/(kg·d),能量需求为22~25 kcal/(kg·d)[12]。复方氨基酸注射液剂量按照EN 制剂来调整蛋白的用量,以保证患者总蛋白摄入量达标,其目的量为80%。EN 治疗期间血糖控制于7.8~10 mmol/L范围,每隔4 h 进行1 次血糖监测,大于该范围,采用普通胰岛素控制血糖。每隔6 h 进行1 次胃残留量监测,其在150~250 mL 之间酌情增加减,以促使胃动力药的疗效[13]。大于250 mL,需暂时停止喂养,再次小剂量进行评估运用。营养有关性腹泻为每日稀便不少于1 次,稀便量>250 mL/d,将饲管或营养液中的污染排除,随后降低注射速率,并且给予益生菌治疗。
对照组采用常规EN 制剂鼻饲(能量密度1.0 kcal/mL)治疗,对患者以多餐少量的方式为主,依次添加,以防止发生腹泻与胃扩张,每日8餐,为了减轻肠胃的压力,不宜饱腹,同时密切观察患者发生腹泻、恶心等并发症与否[14]。研究组采用高能量密度EN 乳剂鼻饲(能量密度1.5 kcal/mL)治疗,高能量密度营养乳剂通过鼻胃管滴注,第1天使用剂量为500 mL。如果无反流等不良症状,第2天增加至1 000 mL,第3天增加至1 500 mL,并且保持,起始滴注速度为20 mL/h,第2天增加至40 mL/h,第3天为60 mL/h,第4天为80 mL/h,第5天为100 mL/h,最大为125 mL/h,营养液维持在37 ℃左右[13]。
1.4 观察指标
1.4.1 营养指标检测 在治疗前和治疗一个月后,两组患者空腹状态下于肘静脉抽取5 mL 外周静脉血,离心分离血清。利用GF-2280型全自动生化分析仪(武汉百斯康医疗设备有限公司)检测血红蛋白、血清白蛋白和血清总蛋白水平。
1.4.2 免疫功能指标检测 比较两组患者体液免疫和细胞免疫指标的差异。细胞免疫:采用流式细胞仪FACSCalibur(BD,美国)对外周血T 淋巴细胞亚群CD3+、CD4+、CD8+T 细胞和CD4+T 细胞/CD8+T 细胞比值进行检测,CD3、CD4 和CD8 抗体购于(赛默飞世尔科技,美国)。体液免疫:采用全自动化学发光免疫分析仪(南京碧波生物科技有限公司)对免疫球蛋白(immunoglobulin,Ig)A、IgM和IgG(南京碧波生物科技有限公司)进行检测。
1.4.3 临床指标的评 比较患者的临床指标,包括ICU 入住时间(反复入住ICU 的患者,计算总时间)、住院时间以及住院期间的病死率等。
1.4.4 并发症的评估 所有患者均随访1 个月。比较患者治疗后并发症发生率,包括胃肠道不适、院内感染以及腹泻、呕吐等。
1.5 统计学处理 应用SPSS23.0软件,分类资料以例数(百分比)表示,再行χ2检验或连续校正的χ2检验获得统计值;计量资料符合正态分布以均数±标准差()表示,再行t检验获得统计值,不符合正态分布则采用Mann-WhitneyU检验多组差异比较经Bonferroni校正确定,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线水平比较 患者基线人口统计学和临床基线特征平衡,无明显统计学差异。在患者转入ICU 48 h 内,患者的病情严重程度,两者组间也无显著差异,具有可比性(P>0.05),表1。
表1 两组患者基线情况比较(±s)

表1 两组患者基线情况比较(±s)
与对照组比较,*P>0.05
组别研究组对照组例数45 44性别(男/女)25/20*21/23年龄(岁)60.91±11.82*60.64±11.76病程(d)25.4±5.5*26.2±5.8体质量指数(kg/m2)22.89±1.38*22.86±1.29血红蛋白(g/L)98.15±9.36*97.23±8.89血清白蛋白(g/L)27.86±2.21*28.10±2.36血清总蛋白(g/L)53.85±5.76*53.91±5.44氧合指数(mmHg)182.42±25.98*184.12±24.56 APACHEⅡ评分(分)18.65±8.26*17.98±8.17 SOFA评分(分)11.78±5.23*11.31±5.11
2.2 两组患者营养指标的比较 治疗后研究组血红蛋白、血清白蛋白和血清总蛋白显著高于对照组,研究组营养指标均优于对照组(P<0.05),进行Bonferroni校正后,组间仍具有差异(P<0.05),表2。
表2 治疗前后两组营养指标的比较(±s)

表2 治疗前后两组营养指标的比较(±s)
与对照组比较,*P<0.05,#P<0.001,▲P<0.01;进行Bonferroni校正后,△P<0.05
组别研究组对照组例数45 44血红蛋白(g/L)112.82±11.56*△108.28±9.27血清白蛋白(g/L)35.69±3.26#△33.48±3.05血清总蛋白(g/L)60.27±6.31▲△56.69±6.28
2.3 两组免疫功能指标的比较 治疗后,研究组的细胞免疫功能指标CD3+、CD4+、CD8+T细胞和CD4+T细胞/CD8+T细胞比值均显著高于对照组,体液免疫指标IgA、IgM和IgG水平也均高于对照组,研究组免疫功能指标优于对照组(P<0.05),上述指标进行Bonferroni校正后,组间仍具有差异(P<0.05),表3。
2.4 两组临床指标的比较 研究组患者住院时间、ICU入住时间均显著低于对照组(P<0.05),进行Bon‐ferroni校正后,组间仍具有差异(P<0.05);两组住院期间的病死率比较,差异无统计学意义(P>0.05),表4。
表3 两组免疫功能指标的比较(±s)

表3 两组免疫功能指标的比较(±s)
与对照组比较,*P<0.01,#P<0.001;进行Bonferroni校正后,▲P<0.01
组别研究组对照组例数45 44 CD3+(%)55.45±3.66*▲51.35±2.87 CD4+(%)27.29±2.07*▲22.45±1.34 CD8+(%)24.15±1.98*▲21.76±1.54 CD4+/CD8+1.12±0.15#▲1.03±0.12 IgA(mg/L)1.84±0.42#▲1.42±0.31 IgM(mg/L)1.56±0.33#▲1.19±0.18 IgG(g/L)12.26±2.36*▲8.09±1.76
表4 两组临床指标的比较(±s)
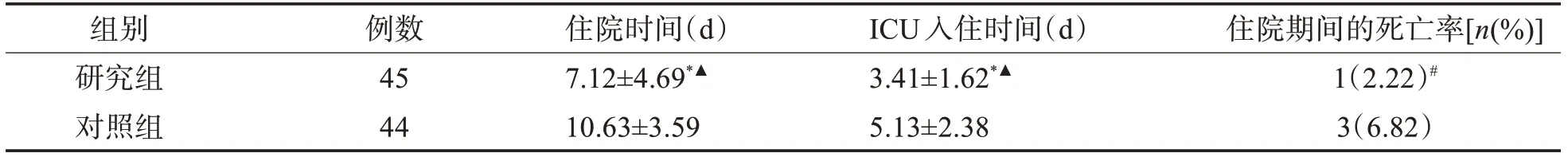
表4 两组临床指标的比较(±s)
与对照组比较,*P<0.001,#P>0.05;住院时间和ICU入住时间进行Bonferroni校正后,▲P<0.01
组别研究组对照组例数45 44住院时间(d)7.12±4.69*▲10.63±3.59 ICU入住时间(d)3.41±1.62*▲5.13±2.38住院期间的死亡率[n(%)]1(2.22)#3(6.82)
2.5 并发症发生率的比较 研究组并发症发生率显著低于对照组(P<0.05),表5。

表5 两组并发症发生率的比较[n(%)]
3 讨论
重症肺部感染患者的机体蛋白质损耗,使免疫功能损伤,病情恶化加速,易发生再次感染及全身衰竭等不良症状[15]。因此,开展营养疗法,改善患者的营养状况,已成为提高危重症患者存活率和生活质量研究的重要课题[16-17]。相关研究显示,科学有效的营养治疗对重型肺部感染患者的治疗、预后效果显著[18]。国内外指南均格外重视EN,指出重型肺部感染患者于伤后1~2 d内宜采用EN支持,蛋白和能量供给尽可能在2~3 d 内达到目标值的80%[19]。如果EN 无法达到营养需求,应于7~10 d 后给予肠外营养补充,不过重型肺部感染患者EN 治疗无法达到目标值是目前临床上最棘手的问题。其原因为此类患者伤后胃电节律紊乱,耐受力差,且持续时间长,导致EN治疗困难增加[20]。如果营养液输注过快过多,会引起呕吐、腹胀、颅内压升高等,从而加重病情[21]。因此,应用EN支持过程中,控制患者EN用量病情达到适宜的营养目标值是临床需考虑的重要问题,因此,部分学者提出高能量密度EN这一概念[22]。高能量密度营养乳剂属于一种高蛋白、高能量(能量密度1.5 kcal/mL,1 kcal=4.184 kJ)、高中链脂肪酸的EN 制剂,可提供大量的能量底物,同时改善患者低蛋白血症,降低重症患者炎症反应[23]。近年来,临床上出现很多探究高能量密度EN对危重患者的预后改善作用,然而,结论存在差异性。
本研究结果显示,应用高能量密度EN 乳剂治疗后,研究组血红蛋白、血清白蛋白和血清总蛋白显著高于对照组,研究组营养指标均优于对照组(P<0.05)。其原因可能为给予EN支持后,可促进胃肠功能恢复,同时预防胃肠黏膜脱落,避免胃肠道损害,达到改善营养状态目的[24]。可见, 高能量密度EN乳剂的EN支持对患者的营养状态具有良好的调节作用,与陈晓等[25]研究结果一致。常规EN制剂鼻饲用量为满足重症肺炎患者营养的基本用量,而研究组为基于基本用量所设置的试验用量,因此,理论上对照组不应产生因低卡供给导致的低蛋白血症及其他营养不良症状。人体免疫主要分为细胞和体液免疫两大类。T 细胞参与机体细胞免疫过程,CD3+是成熟淋巴细胞的标志物,CD4+T 细胞通过分泌细胞因子执行辅助性免疫功能,CD8+T 细胞则直接杀伤靶细胞从而发挥抗炎症作用,CD4+/CD8+T细胞水平直接反应患者的免疫能力[26]。本研究中,治疗后,研究组的细胞免疫功能指标CD3+、CD4+、CD8+T细胞和CD4+/CD8+T细胞水平均显著高于对照组,说明高能量密度EN 乳剂可显著提高患者细胞免疫的功能。IgA、IgG及IgM是由浆细胞分泌的效应物质,介导特异性体液免疫反应[27]。研究组体液免疫指标IgA、IgM和IgG水平均高于对照组,说明高能量密度EN乳剂能显著提升体液免疫应答水平,对减少感染等并发症和改善预后具有积极作用[28]。研究组住院时间、ICU入住时间均显著低于对照组(P<0.05),这与高能量密度EN乳剂改善重症肺部感染的营养状况,提高免疫功能密不可分。此外,在本研究治疗期间,两组患者均未发生严重的并发症,经治疗后明显好转,安全性较高。
综上所述,高能量密度EN 乳剂治疗重症肺部感染患者可以改善患者的营养指标和免疫功能,而且能缩短病程,并发症少,安全性高。同时,本研究结果仍有待多中心临床试验证实。

