基于荧光探针对食物中半胱氨酸的检测方法建立
韩 蕊,吴 琼,赵 昕,毛淑红
(天津科技大学生物工程学院,天津 300457)
半胱氨酸(Cysteine,Cys)是一种天然存在于水果、蔬菜及谷物中的半必需氨基酸[1],具有较强还原亲和能力、抗氧化性和对重金属离子解毒等优良性能,广泛应用于食品、医药等多种领域[2]。此外,Cys在生物体清除自由基、保护酶和蛋白质等重要生命活性物质以及在生命体生化防御体系中起着至关重要的作用[3]。因此,Cys的专一性检测引起了人们广泛关注。目前,Cys检测方法主要包括高效液相色谱法、毛细管电泳法、质谱法、红外光谱法等,大多需要繁琐样品预处理、昂贵仪器,甚至不能区分检测Cys。荧光探针检测技术具有高选择性和高灵敏度,且操作简单,是检测Cys的有效方法。基于特定反应构建的用于Cys检测荧光探针已有报道[4-8]。高胱氨酸(Hcy)和谷胱甘肽(GSH)具有与Cys类似结构和反应活性,往往会干扰荧光探针对Cys特异性识别[5,9-16]。此外,当前已报道Cys荧光探针多用于生物成像分析[6,11,17-19],用于食品中Cys检测研究鲜见报道。
Rosamine是一类光化学性能优良荧光染料,已用于生理活动中具有重要意义的生命活性物质(如H2O2、H2S及Cu2+等)识别与传感研究及生物成像分析[20-22]。但Rosamine类化合物用于Cys荧光探针构建及识别与传感性能研究鲜见报道。本研究基于Rosamine结构特征,在其9位引入能与Cys作用的苯炔基反应位点,构建了具有高选择性、高灵敏性的Rosamine新型荧光探针,揭示其识别与传感机理,并将其应用于水、牛奶、奶粉、白菜、苹果、梨及萝卜中Cys检测。
1 材料与方法
1.1 材料与仪器
苯乙炔、双三苯基膦氯化钯、4-溴苯甲醛、3-二乙氨基酚、碘化亚铜 分析纯,北京百灵威科技有限公司;L-丙氨酸(L-Alanine, Ala)、L-丝氨酸(LSerine,Ser)、L-天冬氨酸(L-Aspartate,Asp)、L-缬氨酸(L-Valine,Val)、L-半胱氨酸(L-Cysteine,Cys)、L-赖氨酸(L-Lysine,Lys)、L-甘氨酸(L-Glycine,Gly)、L-组氨酸(L-Histidine,His)、L-色氨酸(LTryptophane,Try)、L-亮氨酸(L-Leucine,Leu)、L-酪氨酸(L-Tyrosine,Tyr)、L-苏氨酸(L-Threonine,Thr)、L-苯丙氨酸(L-Phenylalanine,Phe)、L-甲硫氨酸(L-Methionine,Met)、L-精氨酸(L-Arginine,Arg)、L-异亮氨酸(L-isoleucine,Ile)、D,L-谷胱甘肽(D,L-Glutathione,Glu)、D,L-高半胱氨酸(D,LHomocysteine,Hcy)、L-脯氨酸(L-Proline,Pro)、L-谷氨酸(L-Glutamate,Glu) 分析纯,上海源叶生物科技有限公司;氯化钠、醋酸钠、硫化钠、乙酸乙酯、石油醚、二氯甲烷、四氯苯醌 分析纯,天津化学试剂六厂;甲醇 光谱纯,天津基准化学试剂有限公司;光谱表征中所用水均为去离子水,经实验室纯化制备;自来水 取自本地供水管网;矿泉水(瓶装,500 mL)购自本地超市。
FS5荧光分光光度计 Edinburgh公司;Tu-1810 PC紫外-可见分光光度计 北京普析通用仪器有限责任公司;Bruker AV 400 核磁共振波谱仪 Bruker公司;PHS-3C pH酸度计 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 探针制备及表征 氩气保护下,将4-溴苯甲醛(6.3 mmol,0.9 g)、Pd(PPh3)2Cl2(0.32 mmol,0.224 g)、
CuI(0.63 mmol,0.95 g)和三乙胺(12 mL)置于三口瓶中,用适量无水DMF溶解,冰水浴搅拌30 min。将含有苯乙炔(6.3 mmol,1.3 g)无水DMF滴加入反应体系,室温搅拌过夜。将反应体系倾入水中,乙酸乙酯萃取,用饱和NH4Cl及NaCl洗涤有机相,无水硫酸钠干燥。经减压除去乙酸乙酯后,用硅胶色谱柱进行纯化,洗脱剂为乙酸乙酯:石油醚(v/v,1:60),得白色固体粉末,为中间体1[23-24],产率为72.5%。
1H NMR(400 MHz, CDCl3): δ 10.02 (s,1H),7.86(d,J=8.0 Hz,2H),7.67 (d,J=8.0 Hz,2H),7.56 (m, 2H),7.37 (m,3H)。
氩气保护下,取化合物1(3.4 mmol,0.72 g)、3-二乙氨基酚(8 mmol,1.322 g)和对甲苯磺酸(1 mmol,0.2 g)于三口瓶中,用70 mL丙酸溶解后,加热至65 ℃,反应过夜。降至室温,向反应体系加入3 mol/L醋酸钠溶液,用二氯甲烷萃取,无水硫酸钠干燥。减压蒸除溶剂后,加入100 mL二氯甲烷/甲醇(v/v=1:1)的混合液,加入四氯苯醌(3.4 mmol,0.836 g),室温搅拌3 h。经硅胶色谱柱进行纯化得紫红色固体粉末,经表征为探针R[25],产率为32.8%。在避光条件下,该探针可稳定存在于空气中。
1H NMR(400 MHz, CDCl3):δ 7.77 (d,J=8.0 Hz,2H),7.59 (m, 2H),7.39 (m,6H), 7.28 (s, 1H), 6.95 (d,J=12.0 Hz,2H),6.86 (s, 1H), 3.67 (q,J=8.0 Hz, 8H),1.34 (t,J=8.0 Hz, 12H)。ESI-MS: 499.2756 ([M-Cl-])。
1.2.2 荧光探针R检测Cys条件优化
1.2.2.1 溶液制备 探针R标准溶液:准确称取0.01070 g探针R用去离子水溶于50 mL容量瓶中,定容,配成4×10-4mol/L母液,操作液为1×10-5mol/L。氨基酸及硫化钠标准溶液:准确称取适量相关试剂(精确至±0.0001 g),用水定容,配成4×10-3mol/L储备液。PBS溶液:100 mmol/L。磷酸缓冲液(Phosphate buffer solution,PBS):pH3~12(pH计测定)。
1.2.2.2 pH对探针R与Cys相互作用的影响 向含有0.4 mL甲醇样品管中加入0.4 mL不同pH的PBS缓冲溶液、0.1 mL 4×10-4mol/L探针R、0.1 mL 4×10-3mol/L Cys及3.0 mL去离子水,平衡35 min,进行光谱测试。考察pH变化引发的测试体系相对荧光强度变化。本文中荧光光谱测试条件均为:激发波长为565 nm,入射狭缝10 nm,出射狭缝10 nm。
1.2.2.3 响应时间对探针R与Cys相互作用的影响向含有0.4 mL甲醇样品管中加入0.4 mL PBS缓冲溶液(pH9.5)、0.1 mL 4×10-4mol/L探针R、0.1 mL 4×10-3mol/L Cys及3.0 mL去离子水,每隔5 min,测试样品相对荧光强度。考察响应时间对测试体系相对荧光强度影响。
1.2.2.4 荧光滴定 向含有0.4 mL甲醇样品管中加入0.4 mL PBS缓冲溶液(pH9.5)、0.1 mL 4×10-4mol/L探针R,不同体积的4×10-3mol/L Cys和适量去离子水,得4.0 mL样品,平衡35 min,进行光谱测试。绘制Cys浓度引起探针R荧光相对强度(F/F0)与Cys浓度关系曲线。据此,得到Cys检测线性关系方程式。根据检出限计算公式:DL=3σ/slop[25],计算Cys检出限。
1.2.2.5 选择性实验和抗干扰实验 向含有0.4 mL甲醇、0.4 mL PBS缓冲溶液(pH9.5)及0.1 mL 4×10-4mol/L探针R试管中,分别加入0.1 mL 4×10-3mol/L 不同氨基酸及3.0 mL去离子水,检测体系荧光强度变化,探讨不同氨基酸对探针R相对荧光强度变化影响。
向含0.4 mL甲醇、0.4 mL PBS缓冲溶液(pH9.5)、0.1 mL 4×10-4mol/L探 针R及0.1 mL 4×10-3mol/L Cys和2.0 mL去离子水的试管中,分别加入1.0 mL其它氨基酸(4×10-3mol/L),测试其荧光强度,评价探针抗干扰性能。
1.2.2.6 重复性、稳定性及重现性实验 配制探针R甲醇/水体系(1×10-5mol/L,v/v,1:9;pH9.5),用荧光分光光度计连续检测其荧光强度;平行配制10个含相同浓度Cys(5×10-5mol/L)和探针R(1×10-5mol/L)甲醇/水体系(v/v,1:9;pH9.5),分别测试其荧光强度,据此确定方法的精密度、稳定性和重现性。
1.2.2.7 加标回收实验 矿泉水与自来水均未处理,直接检测。巴氏杀菌的全脂牛奶(240 mL,纸盒包装)和高钙奶粉(一袋400 g,内装16小袋,25 g/袋),购自本地超市,检测前未过保质期。奶粉:准确称取1.0000 g奶粉,用59.0000 g去离子水溶解,摇匀,备用。牛奶:准确称取1.0000 g 牛奶,加入59.0000 g去离子水,摇匀,备用。称取5.0000 g白菜、苹果、梨、白萝卜后,榨取汁液后,直接用于检测。
向含有1.00 mL甲醇、1.00 mL PBS缓冲溶液(100 mmol/L,pH9.5)、0.2500 g样品(矿泉水、自来水、牛奶或奶粉)的10.00 mL容量瓶中,分别加入适量Cys标准储备液,使其折合成容量瓶中Cys浓度分别为0、20.0、40.0、60.0 μmol/L,加入1.00 mL 4×10-4mol/L探针R,最后用去离子水定容至刻度,平衡35 min后进行荧光测试。每个加标浓度平行配制5个样,根据Cys检测线性方程式,确定Cys浓度,计算相对标准偏差及回收率。
向含有1.00 mL甲醇、1.00 mL PBS缓冲溶液(100 mmol/L,pH9.5)、2.5000 g样品(白菜、苹果、梨或白萝卜)的10.00 mL容量瓶中,分别加入适量Cys标准储备液,加入1.00 mL 4×10-4mol/L探针R,最后用去离子水定容至刻度,平衡35 min后进行荧光测试。每个加标浓度平行配制5个样,根据Cys检测线性方程式,确定Cys浓度,计算相对标准偏差及回收率。
1.3 数据处理
通过Origin2015对实验数据进行分析并作图,每个实验至少重复测量3次,取平均值±标准差。
2 结果与分析
2.1 探针R对Cys选择性识别
对特定底物高选择性识别是探针优良性能之一[2,9],因此,首先考察了探针R(其结构如图1所示)对Cys的选择性识别。如图2所示,在甲醇/水体系中(v/v,1:9;pH9.5,PBS 10 mmol/L),探针R(10 μmol/L)最大发射峰为589 nm,当向其体系中加入100 μmol/L Cys时,探针R荧光光谱明显增强,同时,其最大发射峰蓝移至583 nm;100 μmol/L GSH和Hcy引起探针荧光增强,但变化较小;而其它氨基酸和H2S加入几乎不能引起探针R明显的荧光变化。为进一步证实探针R对Cys选择性识别,研究了Cys和其它氨基酸及H2S共存时,R-Cys荧光变化。如图3所示,当其它底物与Cys共存时,对测试体系相对荧光强度无显著影响(P>0.05)。实验结果表明,探针R可特异性识别Cys。

图1 探针R的合成Fig.1 Synthesis route of probe R
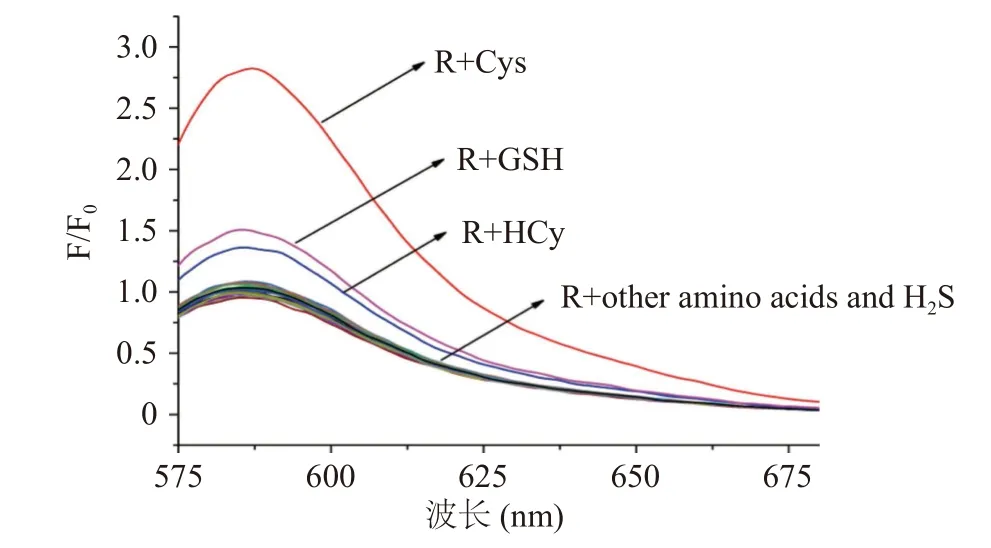
图2 探针R对氨基酸及H2S在甲醇/水体系中的响应Fig.2 Response of probe R to amino acids and H2S in the MeOH/H2O

图3 氨基酸与H2S对探针R-Cys体系荧光的影响Fig.3 Influence of amino acids and H2S on the R-Cys system
2.2 探针R与Cys相互作用最佳pH及响应时间
pH对主客体相互作用起到至关重要作用[10],如图4所示,酸性条件下,随pH增大,F/F0缓慢增强;碱性条件下,荧光强度明显增强,pH9.5时达到最大值。Cys的pKa=8.0,碱性条件有利于Cys巯基氢的解离,便于Cys与探针R相互作用[24]。此外,亦考察了响应时间对主客体相互作用影响。如图5所示,随相互作用时间延长,F/F0逐渐增强,当作用体系达35 min时,F/F0达到最大值,之后迅速降低,可能由于碱性较强破坏了发色团共轭体系所致。
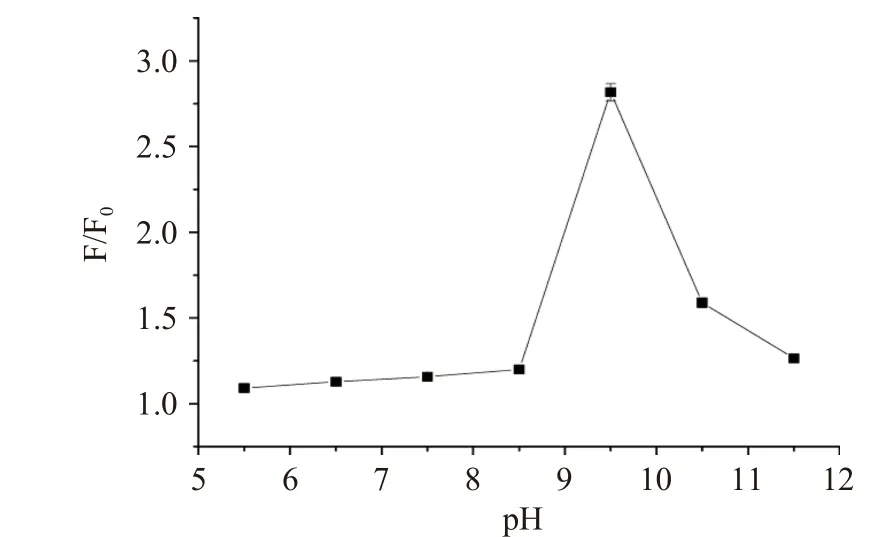
图4 pH对探针R与Cys相互作用影响Fig.4 Effect of pH on the interaction between R and Cys
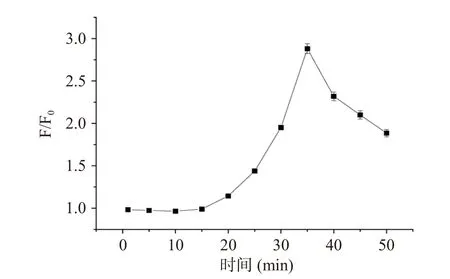
图5 响应时间对探针R与Cys相互作用影响Fig.5 Effect of response time on the interaction between R and Cys
2.3 Cys检测线性范围及检出限
利用荧光滴定技术研究探针R与Cys相互作用,结果如图6所示。随着Cys浓度增大,体系荧光强度比值增大,最大发射峰由589 nm蓝移至583 nm,表明探针与底物发生Michael加成及消除反应。当Cys浓度为70 μmol/L时,F/F0达到最大值,之后,继续增大Cys浓度,F/F0变化不明显,体系达到平衡。据此,绘制了F/F0与Ccys关系曲线,Cys浓度在18~70 μmol/L范围内与F/F0呈线性关系,其线性方程为F/F0=0.01244[Cys]+2.052 (R2=0.992)。根据检测限计算公式:DL=3σ/slop[25],可得出探针R对Cys检测限为0.18 μmol/L,与当前已报道的Cys荧光探针检测限[26-29]相比,本研究检测限略低(表1)。

图6 不同浓度Cys引起的探针R荧光光谱变化及荧光强度比值与[Cys]关系Fig.6 Spectral changes of probe R induced by different [Cys]and the relationship between F/F0 and [Cys]

表1 探针R半胱氨酸识别性能与其他半胱氨酸荧光探针性能比较Table 1 Comparison of the designed probe with other published Cys probes
2.4 重复性、重现性和稳定性
用荧光光谱研究了探针重复性、重现性和稳定性。对探针R(10 μmol/L)的甲醇/水体系(v/v,1:9;pH9.5)进行了10次重复实验,荧光强度相对标准偏差为2.49%,表明探针重复性良好。通过1 h内测定探针R对Cys荧光响应,确定探针稳定性探针荧光响应约为探针初始响应的55%。对10个平行配制溶液进行检测,荧光强度标准偏差为2.61%,证实探针具有重现性。
2.5 探针R对Cys响应机理研究
探针 R 与 Cys 可能作用模式如图7所示,Rosamine骨架具有较强的吸电子能力,其9位上苯炔基具有类似于α、β不饱和醛(酮)的较高反应活性[24],此类化合物可能和巯基发生Michael加成反应。事实上,基于苯乙炔基[24]和苯乙烯基[30]为识别位点荧光探针不仅可与Cys经Michael加成形成硫醇加合物,还可进一步发生分子内retro-aza-aldol反应脱去五元环[24]。探针R与Cys作用体系经ESI-MS研究亦证实了上述反应路径。R-Cys体系的ESI-MS质谱图上存在对应参照物MR([M+])分子离子峰,进一步比对R-Cys体系与参照物MR的荧光光谱,发现二者一致,这表明探针R与Cys反应后生成了MR及P,MR生成使得荧光增强。具有与Cys类似结构的Hcy和GSH虽可与探针R发生Michael加成反应,但因动力学抑制,之后分子内环化反应非常缓慢[6,18,24],不能形成MR发射荧光,不干扰探针R对Cys选择性识别。
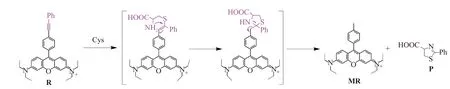
图7 探针R与Cys可能作用模式Fig.7 Possible interaction mode of probe R with Cys
2.6 样品分析
为验证探针R对实际样品中Cys检测的可行性,借助线性回归方程,测定了牛奶、奶粉、矿泉水、自来水样品中Cys含量。为判断测定准确度,向牛奶、奶粉、矿泉水和自来水样中添加适量的Cys标准储备液,测定回收率。如表2所示,矿泉水、自来水、牛奶和奶粉中均未检测到Cys,白菜、苹果、梨及萝卜中Cys浓度分别为4.37、6.56、4.87和4.58 μg/kg,此外,不同样品中Cys回收率介于96.4%和102.8%之间,相对标准偏差在0.1%~2%之间,表明该检测方法测定水、牛奶、奶粉、白菜、苹果、梨及萝卜中Cys具有较好重现性,可用于实际样品分析。
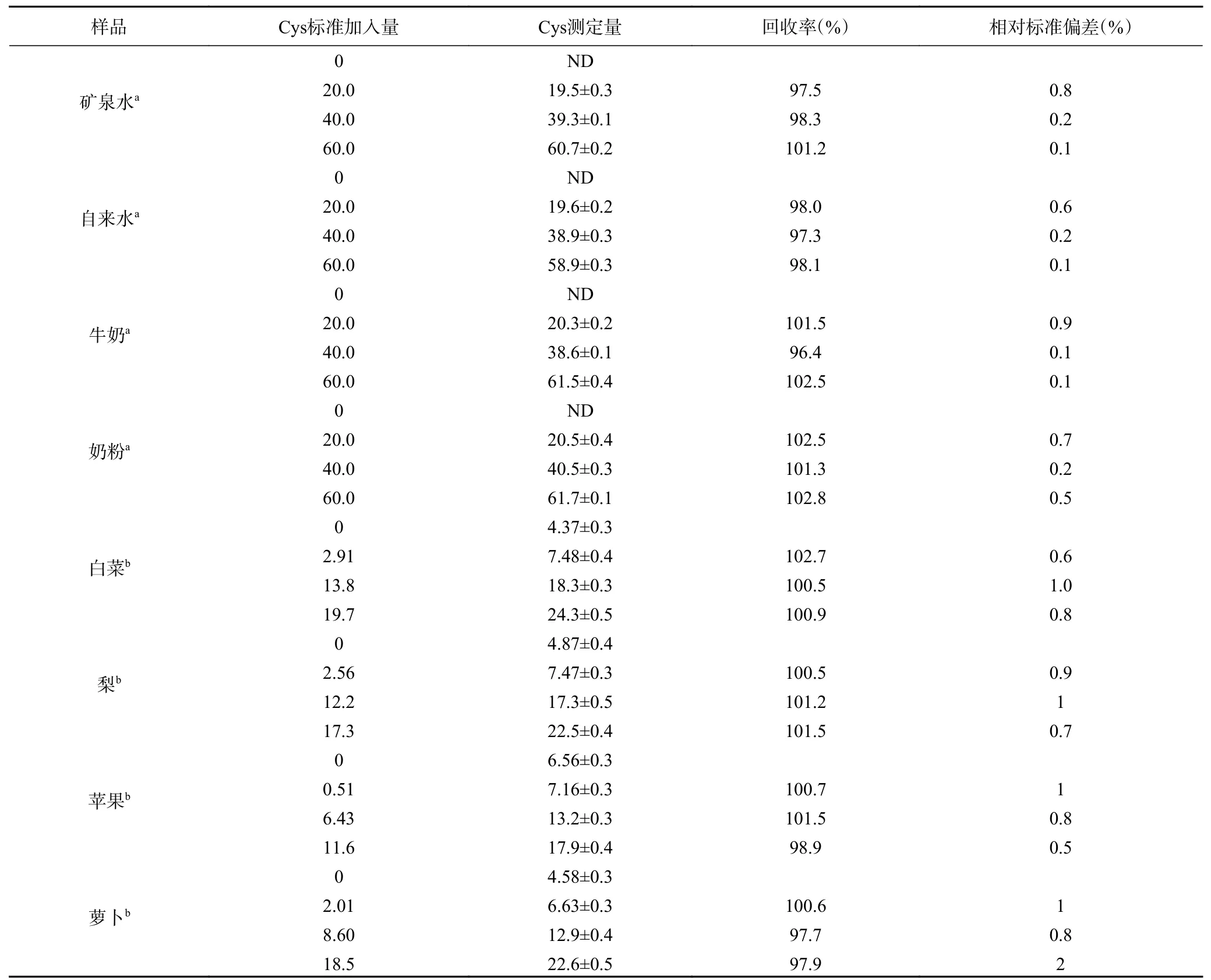
表2 实际样品中Cys测定结果Table 2 Determination of Cys in real samples
3 结论
Cys是重要抗氧化物质,其在食品中含量受到了人们关注。本研究通过在Rosamine荧光团分子骨架引入苯炔基反应位点,构建新型高灵敏、高选择性Cys荧光探针。在pH9.5含水体系中,该探针可通过Michael加成及分子内环化反应实现对Cys选择性检测。实际样品分析表明,该探针可用于天然食品中Cys选择性测定,但其结构有待改进,水溶性有待提高。目前,基于荧光探针检测天然食品中Cys研究甚少,该结果为构建用于Cys检测的高灵敏、高选择的基于Rosamine新型荧光探针提供新思路、新素材。

