固定准直器技术在食管癌根治性放射治疗中的应用
杜傲男,陈宏林,王强
徐州市肿瘤医院放疗科 (江苏徐州 221005)
随着放射治疗技术的发展,调强放射治疗(intensity-modulated radiation therapy,IMRT)已被广泛应用于食管癌的综合治疗中,但食管癌靶区形状不规则,且邻近心脏、肺、脊髓等重要危及器官(organ at risk,OAR),导致放射治疗计划的设计相对困难。固定准直器(fixed collimator,FC)可以人为限定照射野的范围,并可选择性地避开部分正常组织,具有子野数目少、机器跳数(monitor unit,MU)低等优势。既往多项研究显示,FC 技术可以有效降低OAR 的受照射剂量,尤其是可降低低剂量区的受照射体积,同时不降低放射治疗计划的适形指数(conformity index,CI)、均匀性指数(homogeneity index,HI)[1-8]。基于此,本研究将FC 技术应用于食管癌根治性放射治疗中,以期降低肺正常组织的受照射剂量,从而减少放射性肺炎的发生。本研究应用FC 技术和自动准直器(auto collimator,AC)技术对20例食管癌患者进行根治性放射治疗计划的设计,以验证FC 技术应用于食管癌放射治疗中的可行性,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月1日至2020年1月1日于徐州市肿瘤医院进行食管癌根治性放射治疗的20例患者,均为未进行手术治疗的胸中段食管癌患者,其中男12例,女8例;年龄55~84岁,平均(67.95±7.74)岁;病理类型均为食管鳞癌;TNM分期,Ⅱ期4例,Ⅲ期13例,Ⅳ期3例。
1.2 方法
1.2.1 CT 定位
患者取仰卧位,双手抱肘置于额头,采用热塑体膜固定,使用东芝Activion 16排CT进行定位扫描,扫描范围为下颌至肝脏下缘,扫描层厚为5 mm。
1.2.2 靶区及正常组织器官勾画
使用瓦里安Eclipse13.5放射治疗计划系统(treament planning system,TPS)勾画患者的肿瘤靶区(gross tumor volume,GTV)、临床靶区(clinical target volume,CTV)、 计划靶区(planning target volume,PTV)及OAR;GTV 包括食管病灶及阳性淋巴结,CTV 为GTV 三维外放5 mm,上下外放3 cm,并包括纵隔食管气管沟、食管旁及纵隔1、2、4、7、8区的淋巴引流区,PTV 为CTV 三维外放5 mm。
1.2.3 放射治疗计划设计
同一患者的放射治疗计划采用相同的布野方式及约束参数,采用6MV-X线,处方剂量为60 Gy等剂量线包绕95%PTV;采用5野照射,机架角度分别为0°、40°、120°、160°、200°。OAR限量:脊髓最大剂量点Dmax<45 Gy;双肺V5≤55%,V20≤28%,V30≤18%;心脏V30≤40%,V40≤30%。FC组的射野准直器采用手动方式锁定部分肺组织,AC组的射野准直器设为自动。
1.3 观察指标
(1)比较两组计划的PTV剂量学参数,包括D2%、D98%、D50%、CI、HI,其中CI=(VT,ref/VT)×(VT,ref/Vref)[9],式中VT,ref为处方剂量所覆盖的PTV的体积,VT为PTV 的体积,Vref为处方剂量所覆盖的总体积,CI可以客观评价剂量分布体积与PTV 体积大小和形状的适形性,CI越接近1表明靶区适形度越好[10];HI=(D2%-D98%)/D50%[11],式中D2%、D98%、D50%分别为包围2%、98%、50%PTV体积的最小剂量,HI越接近0表明靶区均匀性越好。(2)比较两组计划的OAR剂量学参数,包括脊髓Dmean、Dmax,双肺V5、V10、V15、V20、V30、V40和Dmean,心脏V30、V40、Dmean、Dmax。(3)比较两组计划的执行效率,包括总MU和治疗时间(单次治疗时加速器的出束时间)。(4)比较两组计划的剂量验证通过率,使用MatriXX二维矩阵剂量验证系统对两组计划进行剂量学验证,并按照美国医学物理学家协会(The American Association of Physicists in Medicine,AAPM)53号报告,采用3%/3 mm标准分析两组计划的γ通过率[12]。
1.4 统计学处理
2 结果
2.1 两组计划的PTV 剂量学参数比较
两组计划的PTV 计量学参数比较,差异均无统计学意义(P>0.05),均能满足临床需求,见表1。
表1 两组计划的PTV 剂量学参数比较(±s,20例)
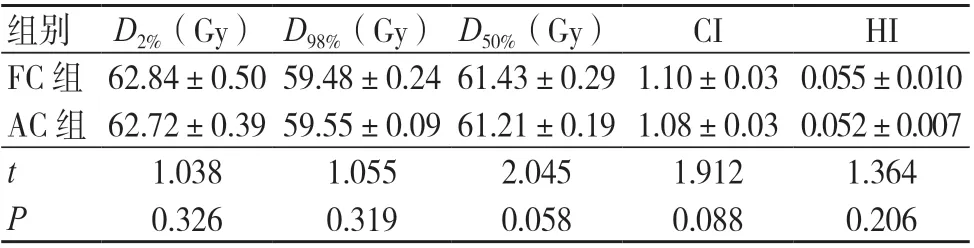
表1 两组计划的PTV 剂量学参数比较(±s,20例)
注:FC 为固定准直器,AC 为自动准直器,CI 为适形指数,HI 为均匀性指数
组别 D2%(Gy) D98%(Gy) D50%(Gy)CIHI FC 组 62.84±0.50 59.48±0.24 61.43±0.29 1.10±0.03 0.055±0.010 AC 组 62.72±0.39 59.55±0.09 61.21±0.19 1.08±0.03 0.052±0.007 t1.0381.0552.0451.9121.364 P0.3260.3190.0580.0880.206
2.2 两组计划的OAR 剂量学参数比较
FC 计划的双肺V5和Dmean均低于AC 计划,差异有统计学意义(P<0.05);两组计划的其他OAR剂量学参数比较,差异均无统计学意义(P>0.05),见表2。
表2 两组计划的OAR 剂量学参数比较(±s,20例)
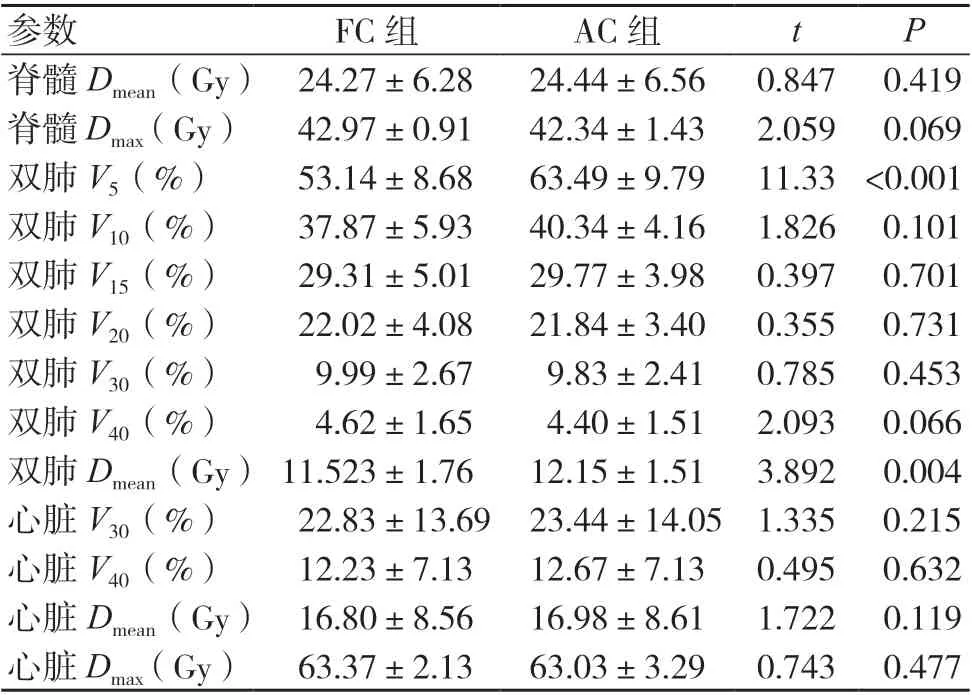
表2 两组计划的OAR 剂量学参数比较(±s,20例)
注:FC 为固定准直器,AC 为自动准直器
参数FC 组AC 组tP脊髓Dmean(Gy) 24.27±6.2824.44±6.56 0.847 0.419脊髓Dmax(Gy) 42.97±0.9142.34±1.43 2.059 0.069双肺V5(%) 53.14±8.6863.49±9.79 11.33 <0.001双肺V10(%) 37.87±5.9340.34±4.16 1.826 0.101双肺V15(%) 29.31±5.0129.77±3.98 0.397 0.701双肺V20(%) 22.02±4.0821.84±3.40 0.355 0.731双肺V30(%) 9.99±2.67 9.83±2.41 0.785 0.453双肺V40(%) 4.62±1.65 4.40±1.51 2.093 0.066双肺Dmean(Gy) 11.523±1.7612.15±1.51 3.892 0.004心脏V30(%) 22.83±13.69 23.44±14.05 1.335 0.215心脏V40(%) 12.23±7.1312.67±7.13 0.495 0.632心脏Dmean(Gy) 16.80±8.5616.98±8.61 1.722 0.119心脏Dmax(Gy) 63.37±2.1363.03±3.29 0.743 0.477
2.3 两组计划的执行效率比较
两组计划的总MU、治疗时间比较,差异均无统计学意义(P>0.05),见表3。
表3 两组计划的执行效率比较(±s,20例,剂量率400 MU/min)
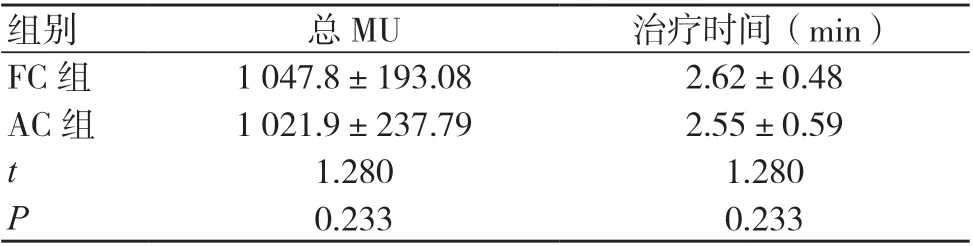
表3 两组计划的执行效率比较(±s,20例,剂量率400 MU/min)
注:FC 为固定准直器,AC 为自动准直器,MU 为机器跳数
组别总MU治疗时间(min)FC 组1 047.8±193.082.62±0.48 AC 组1 021.9±237.792.55±0.59 t 1.2801.280 P 0.2330.233
2.4 两组计划的剂量验证通过率比较
FC组与AC组的γ通过率分别为(95.34±0.37)%和(95.76±0.47)%,差异无统计学意义(t=2.164,P=0.059)。
3 讨论
食管癌放射治疗技术的发展经历了从最初的二维普通放射治疗到三维适形放射治疗(threedimensional conformal radiation therapy,3D-CRT),再到目前广泛应用的IMRT 3个阶段。与其他放射治疗技术相比,IMRT 具有更好的靶区剂量适形度和均匀性,对OAR 的保护也更具优势,可在提高临床治愈率的同时改善患者的生命质量[13]。
IMRT 可分为静态野调强技术(静态IMRT)、动态叶片调强技术(动态IMRT)和旋转调强技术,其中旋转调强技术包括断层治疗(tomotherapy)和容积旋转调强放射治疗(volumetric arc modulated therapy,VMAT)。在IMRT 治疗中,为了可以在射野内调节射束强度,多叶准直器(multi-leaf collimator,MLC)的形状常是不规则、偏轴的,而MLC 过中线运动的距离会限制IMRT 的最大射野,如瓦里安直线加速器的MLC 过中线距离不超过14.5 cm,因此,当射野宽度>14.5 cm 时,会出现分野治疗。这样会造成分野衔接处剂量的准确性降低、MU 增加、治疗时间延长等现象,从而导致治疗效率降低,同时分野治疗也会导致正常组织中低剂量受照射体积的增加。
当食管癌靶区范围较大时,应用常规IMRT技术会导致周围正常组织,尤其是肺组织中产生广泛分布的低剂量区域[14]。有研究报道,放射性肺炎的发生与肺的V20和Dmean密切相关[15-17]。同时,有研究认为,肺V5~V65均与放射性肺炎密切相关[18],其中肺V5是最重要的影响因素[19-21]。国外有研究显示,肺接受低剂量照射的体积(V5)是放射性肺炎发生的重要风险因素,并建议将肺V5控制在<60%[19]或65%[20]的水平。国内也有研究证实,当肺V5>55%时,2级以上放射性肺炎的发生率会显著提高[22]。因此,有效降低肺组织低剂量区(V5)的体积成为减少放射性肺炎发生的关键。
FC 技术在IMRT 中的应用正逐步被临床所关注。有研究发现,FC 技术在治疗头颈部大靶区(>14 cm)病灶时,与常规IMRT 对比,可以降低总MU,并可提供更好的剂量均匀性,且在剂量率相同的情况下,可以缩短患者的治疗时间[1]。国内相关研究显示,FC 技术应用于直肠癌、鼻咽癌的放射治疗中,可以降低总MU,缩短治疗时间[2-3,8]。在肺癌的相关研究中发现,FC 技术可以更好地保护靶区周围OAR 和正常组织,并可有效改善肺V5、V20、V30、Dmean等计量学参数[4]。在乳腺癌的相关研究中发现,FC 技术能明显提高靶区剂量的适形度,并可降低肺和心脏的受照射剂量[5-6]。基于以上分析,本研究将FC 技术应用于食管癌根治性放射治疗中,以期减少肺组织低剂量照射区域,进而减少放射性肺炎的发生。
本研究结果显示,两组计划的PTV 计量学参数比较,差异均无统计学意义(P>0.05),均能满足临床需求,表明FC 技术的靶区计量学参数与传统技术相当;FC 计划的双肺V5和Dmean均低于AC计划,差异有统计学意义(P<0.05),表明FC 技术在OAR 保护方面完全可以满足临床需求,不弱于AC 技术,且其在肺低剂量防护方面(肺V5)更具优势,利于减少放射性肺炎的发生风险;两组计划的总MU、治疗时间比较,差异均无统计学意义(P>0.05),表明FC 技术在确保治疗效果的前体下,并未出现MU 增加、治疗时间延长的情况,可有效保证治疗效率;两组的γ 通过率比较,差异无统计学意义(P>0.05),但均达到了95%以上,满足临床需求[12]。以上研究结果表明,FC 技术不仅可以有效保证靶区的剂量适形度和均匀性,同时在OAR 保护方面同样可以满足临床需求。因此,FC 技术适用于体积较大、形状不规则、周围OAR较多的靶区,尤其可以优化对低剂量反应敏感的OAR 的剂量分布。
此外,有研究显示,FC 技术可以减少总MU[1-3],本研究结果与其不符,原因可能为:其研究对象为头颈部肿瘤及盆腔肿瘤,计划设计所用射野数较多(如头颈部肿瘤9野[1,3]、直肠癌7野[2,8]);而本研究仅应用了5野照射,这是否表明FC 技术降低总MU 的优势在射野数相对较少的放射治疗计划中体现的不明显,对此仍有待进一步研究证实。
综上所述,FC 技术和AC 技术均能实现良好的剂量分布,满足食管癌根治性放射治疗的临床需求,是安全有效的治疗方式;FC 技术在肺低剂量限制方面更具优势,对AC 技术无法有效优化的肺低剂量区域,FC 技术可以提供一条新的技术手段。

