1,8-萘酰亚胺类衍生物的合成及细胞活性研究
黄晶晶, 罗金荣, 王雅萱, 罗建君, 闫 丽,韦楠楠, 董 敏*, 叶 勇, 魏涌标*
1,8-萘酰亚胺类衍生物的合成及细胞活性研究
黄晶晶, 罗金荣, 王雅萱, 罗建君, 闫 丽,韦楠楠, 董 敏*, 叶 勇, 魏涌标*
(广西医科大学 药学院,广西 南宁 530021)
以4-溴-1,8萘二甲酸酐作为先导化合物,通过氨解、亲核取代合成了9个1,8-萘酰亚胺类衍生物,通过质谱(MS)、核磁共振氢谱(1H-NMR)、核磁共振碳谱(13C-NMR)表征其结构,采用CCK8法检测目标化合物对乳腺癌MCF-7、肺癌H460、肝癌HepG2的细胞活性。结果表明,9个衍生物中目标化合物3b的体外抗肿瘤活性较优,对H460最为敏感,作用48 h的半抑制浓度IC50=4.12±0.36 µM。1,8-萘酰亚胺类衍生物对癌细胞具有一定的体外生长抑制作用,有望发展为一种新型的抗肿瘤候选化合物,用于癌症的化学预防和治疗。
萘酰亚胺;亲核取代;CCK8;细胞毒性
2020年全球罹患癌症的总人数达1 929万,近1 000万人因癌症而死亡,中国新发癌症人数和癌症死亡人数分别为457万例和300万例,位居全球第一,乳腺癌已成为全球第一大癌,其次为肺癌、结肠癌,全世界有1/5的人在其一生中都会罹患癌症[1]。值得关注的是,除了高患病率和致死率之外,癌症低龄化也越来越明显。癌症就像一枚炸弹,严重破坏人类的生命健康和生活质量,而如今临床上用于治疗癌症的药物仍十分有限。
癌细胞无限增殖是恶性肿瘤的最大特点,DNA复制在细胞增殖过程中至关重要[2],拓扑异构酶II是一种ATP依赖的酶,可通过双链DNA的断裂来催化DNA拓扑结构的变化,对DNA复制必不可少[3-5]。研究表明,萘酰亚胺是一类以DNA和拓扑异构酶Ⅱ为靶标的多环胺类化合物,具有π共轭平面结构,可通过插入作用或沟槽结合嵌入到DNA碱基对中间,改变DNA的拓扑结构,影响 DNA的复制,阻断细胞的分裂,从而表现出抗肿瘤活性[6-11]。国内外研究者以萘酰亚胺类作为先导,萘环和顶端亚胺结构为重点,进行了包含不同元素、不同基团的修饰和改造,例如在萘酰亚胺芳香环上引入多种活性基团如硝基、氨基、卤素,又或者在3位和4位并入各类芳香环[12-17]。在合成的衍生物中筛选具有显著的抗癌活性的化合物分子,先后有一些代表药物进入了临床试验,但受限于骨髓抑制、N-乙酰化毒性、中枢神经系统毒性等严重不良反应,未能成功上市[18]。因此,利用肿瘤细胞与正常细胞之间的DNA差异性[19],合理设计萘酰亚胺衍生物,成为开发潜在的抗癌候选化合物的热门趋势。
本研究以4-溴-1,8萘二甲酸酐为原料,通过在N-酰亚胺位和4-取代位引入不同的取代基,以期获得抗肿瘤活性增强、毒副作用减弱、水溶性良好、与DNA强结合的新化合物,并以肺癌H460、肝癌HepG2、乳腺癌MCF-7三种癌细胞作为体外研究对象,初步评价其抗肿瘤活性,为开发新型萘酰亚胺类抗癌药物提供理论据。
1 实验
1.1 试剂与仪器
4-溴-1,8萘二甲酸酐、乙胺(化学纯)、薄层色谱板(T6221)均购于阿拉丁试剂(上海)有限公司,柱层析硅胶(200~300目)购于青岛海洋化工有限公司,无水乙醇购于成都科龙化工试剂,除特别说明外,合成所用试剂均为分析纯。
MS经FT-ICR MS高分辨质谱仪(德国 Bruker公司)测定,1H-NMR谱、13C-NMR谱用AVANCE Ⅲ HD 600核磁共振波谱仪(德国 Bruker公司)测定,内标为TMS。吸光度值用SpectraMaxPlus384连续光谱扫描式酶标仪(Molecular Devices公司)测定。CCK-8购于MCE公司,H460人肺癌细胞、HepG2人肝癌细胞、MCF-7人乳腺细胞购自中国科学院上海细胞生物研究所细胞库。
1.2 化学合成
以4-溴-1,8萘二甲酸酐为起始原料,通过酸酐氨解在N-亚酰胺位取代得到不同长度烷烃侧链的中间体2a-2c,在DMF作用下中间体与各种胺反应亲核取代得到目标化合物3a-3i,具体见图1。
1.2.1中间体2a-2c的制备
以N-乙基-4-溴-1,8-萘酰亚胺(2a)为例,首先4-溴-1,8萘二甲酸酐(1.0 g,3.61 mmol)和乙胺(0.44 mL,8 mmol)溶于80 mL无水乙醇,80℃回流反应2小时,室温冷却后移至4℃冰箱冷藏,待沉淀析出后过滤,滤渣经无水乙醇多次洗涤,真空干燥,得到淡黄色固体2a。中间体N-正丙基-4-溴-1,8-萘酰亚胺(2b)和N-正丁基-4-溴-1,8-萘酰亚胺(2c)的合成:分别用正丙胺和1-正丁胺替换乙胺,其他制备方法同上。
1.2.2目标化合物3a-3i的合成
以N-乙基-4-((2-二甲氨基)乙氨基)-1,8-萘酰亚胺(3a)为例,2a(500 mg,1.6 mmol)、N,N-二甲基乙二胺(0.17 mL,1.6 mmol)及DMF(25 mL)加到100 mL单口圆底烧瓶中,110℃搅拌反应过夜,结束反应冷至室温后,加入50 mL H2O,二氯甲烷萃取2~3次,合并有机相,减压旋蒸除去溶剂。粗产物经硅胶柱层析分离纯化[二氯甲烷/甲醇(/)=40∶1],真空干燥后得到纯的目标化合物3a,红色粉末状固体。
目标化合物3b-3i的合成:中间体2b、2c替换中间体2a,分别与N,N-二甲基乙二胺、N,N-二甲基丙二胺、N,N-二乙基乙二胺、3-二乙胺基丙胺、乙醇胺反应,其他制备方法同上。
1.3 目标化合物体外抗癌活性研究
取对数生长期的H460、HepG2和MCF-7细胞以5 000/孔的密度接种于96孔板中,每孔100 µL,并设置不同浓度的给药组,每组三个复孔。96孔板在37℃,5%CO2条件下孵育24 h后,各给药组加入不同浓度的目标化合物,每孔200 µL,阴性对照组和空白对照组分别加入等体积的不含药物培养基或PBS。测试化合物作用48小时后,弃去旧培养基,每孔加入100 µL新培养基和10 µL CCK-8,避光孵育1 h。用酶标仪测定450 nm波长下的吸光度,计算半抑制浓度IC50值。
2 结果与讨论
2.1 9个化合物合成和表征
9个目标化合物均未见报道,其合成路线如图1所示。首先以4-溴-1,8萘二甲酸酐为原料,无水乙醇为溶剂,通过酸酐氨解反应取代不同的烷烃侧链得到中间体,由于这几种胺的沸点相对较低,故所加入的胺要过量,且反应时间不宜过长。反应结束后只需冷却等待固体析出过滤分离沉淀,无水乙醇洗涤沉淀,干燥后可直接用于下一步反应。这一步反应速率快、后处理简单、产物易得且产率高。第二步无需催化剂,选择在高沸点溶剂DMF中用不同的胺取代中间体4-Br位得到目标化合物。反应结束后冷却至室温,先加水再用二氯甲烷萃取以除去溶剂,但由于目标化合物也极易溶于水,故萃取时需要少量多次,直至目标产物萃取完全。需要注意的是,由于该反应体系仍含有大量DMF,柱层析纯化得到的流份经过减压旋蒸后也难以得到固体,故将浓缩后的液体置于-20℃冰箱中冷冻等待沉淀析出,然后通过过滤、真空干燥,即可得到纯的粉末状目标化合物。结构通过1H-NMR、13C-NMR和MS确证,波谱数据如表1所示。

图1 目标化合物3a-3i的合成路线
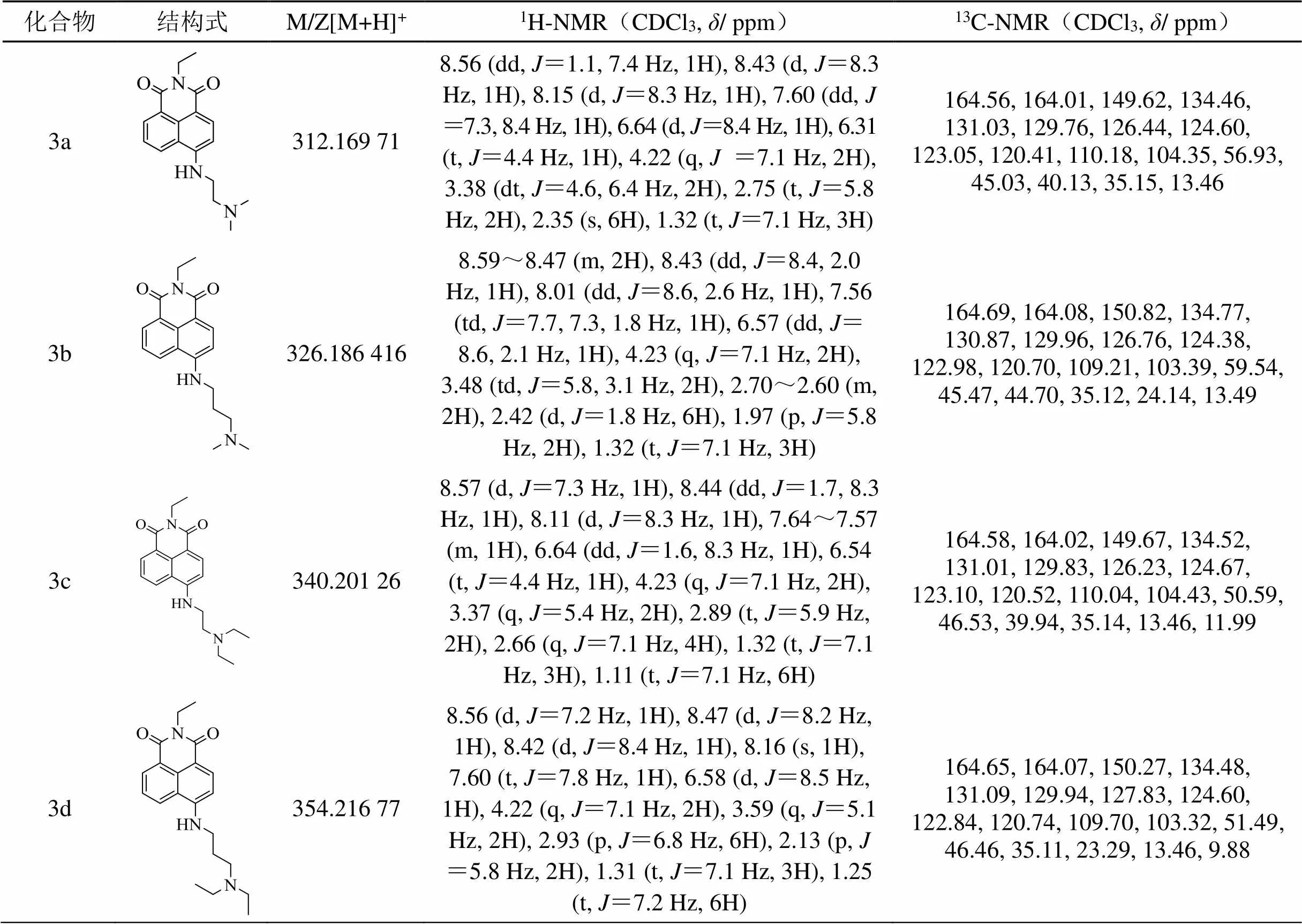
表1 目标化合物3a-3i的物理性质及波谱数据
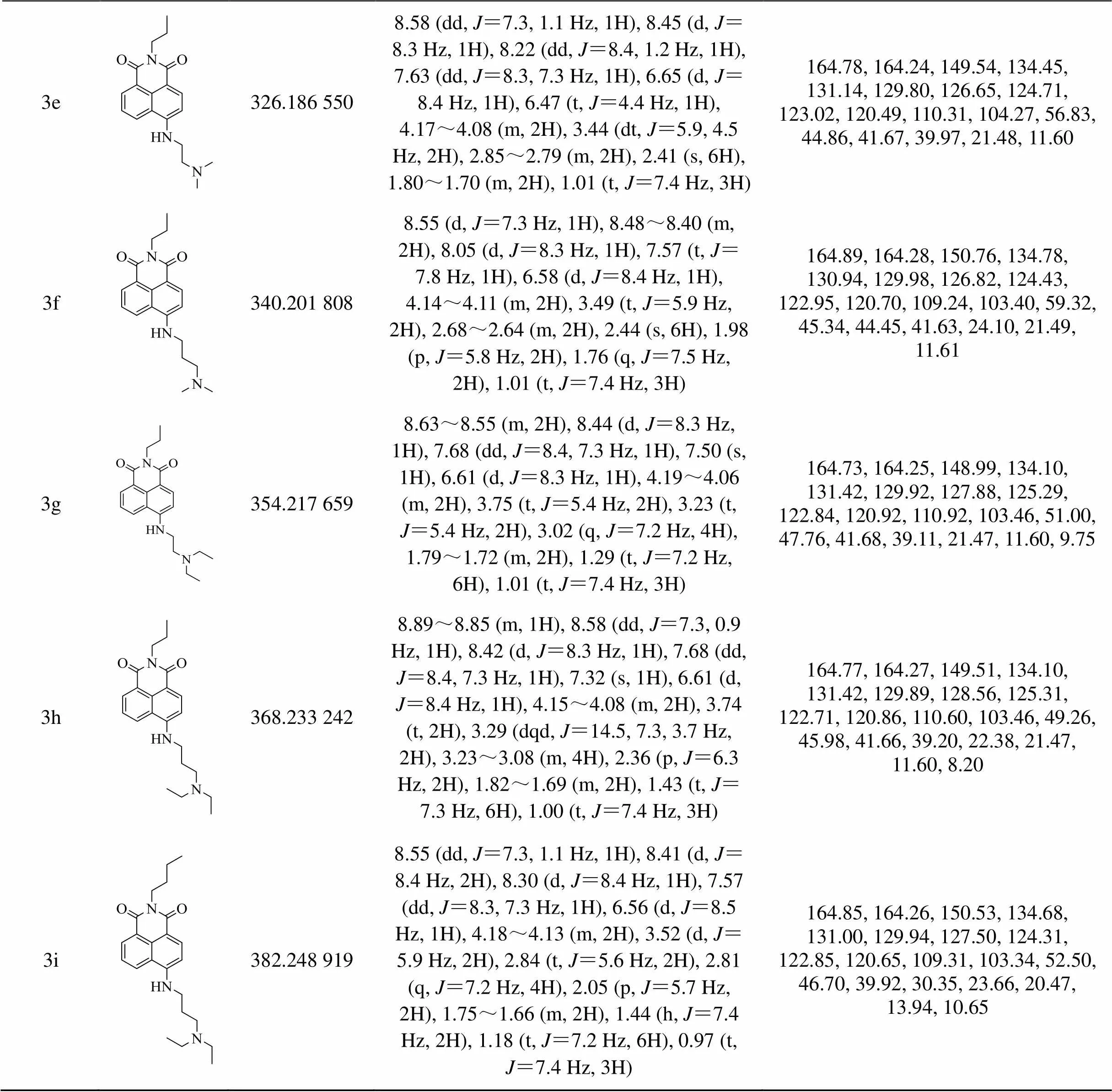
(续表1)
2.2 CCK8法检测9个化合物对癌细胞增殖的影响
表2是目标化合物3a-3i对多种肿瘤细胞的体外抑制作用,由表可知,化合物3b是合成得到的9个 1,8-萘酰亚胺类衍生物中活性最好的,其作用于 H460、MCF-7、HepG2细胞48 h的IC50分别为4.12±0.36、7.28±0.74、7.30±0.12 µmol/L。
通过CCK8法初步筛选发现,本研究合成的衍生物对癌细胞增殖的抑制活性均优于母核结构。当4-Br位的取代基相同,N-亚酰胺位的烷烃侧链不同时,在一定范围内,碳链越短,化合物的活性更佳,如3a、3b、3c的活性均优于对应的衍生物3e、3f、3g的活性;而当N-亚酰胺位的侧链长度相同,4-Br位用 N,N-二甲基-1,3-二氨基丙烷取代的化合物3b、3f活性均强于其他胺取代的衍生物,说明引入甲基可能对其抗肿瘤活性有益。构效研究提示,至少含有一个氨基基团是这类结构的化合物其发挥抗肿瘤活性的前提;侧链中必须含有氮原子,侧链上的碱性基团影响其抗肿瘤作用的强弱,当侧链上的氮原子与酰亚胺环中的氮原子被2个亚甲基相隔时,化合物的活性最高[6, 18]。化合物3b对所测试的三株癌细胞均表现出良好的抗增殖作用,其IC50值均小于10 µmol/L,这可能与取代基的大小和空间构象有关,使得3b与DNA的结合能力更强,从而对癌细胞产生更强的杀伤作用。当然,此类衍生物还需要进一步深入研究其体内外活性和构象关系,通过结合动物研究和临床医学试验来验证这些化合物在癌症治疗或化学预防中的作用。

表2 目标化合物3a-3i对多种肿瘤细胞的体外抑制作用(x±s,n=3)
3 结论
本研究采用高效快捷的方法成功合成了9个尚未见报道的1,8-萘酰亚胺类衍生物,并对其结构进行确证,体外活性研究结果表明其对癌细胞具有较强的抗增殖作用,尤其是化合物3b,作用H460细胞48 h的IC50为4.12±0.36 µM,具有较好的成药前景,本课题组后续将继续深入研究其作用机制和体内抗癌活性。
[1] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2021, 4: 1-41.
[2] Huppert, Julian L, and Shankar Balasubramanian. G-quadruplexes in promoters throughout the human genome[J]. Nucleic Acids Research, 2007, 35(2): 406-413.
[3] Kellner U, Sehested M, Jensen P B,. Culprit and victim-DNA topoisomerase II[J]. Lancet Oncology, 2002, 3(4): 235-243.
[4] Ju B G, Garcia-Bassets I, Glass C K,. A topoisomerase II-mediated dsDNA break required for regulated transcription[J]. Science, 2006, 312(5781): 1798-1802.
[5] Champoux J J. DNA topoisomerases: Structure, function, and mechanism[J]. Annual Review of Biochemistry, 2001, 70: 369-413.
[6] Brana M F, Cacho M, Gradillas A,. Intercalators as anticancer drugs[J]. Current Pharmaceutical Design, 2001, 7(17): 1745-1780.
[7] Brana M, Ramos A. Naphthalimides as anticancer agents: Synthesis and biological activity[J]. Current Medicinal Chemistry. Anti-cancer Agents, 2001, 1(3): 237-255.
[8] Waring M J, González A, Jiménez A,. Intercalative binding to DNA of antitumour drugs derived from 3-nitro-1,8-naphthalic acid[J]. Nucleic Acids Research, 1979, 7(1): 217-230.
[9] Tian Z, Su L, Xie S,. Synthesis, biological activitity and fluorescence spectroscopy of naphthalimide-polyamine conjugates[J]. Chinese Journal of Organic Chemistry, 2013, 33(7): 1514-1521.
[10] 齐齐, 孙岳明, 哈涌泉. 1,8-萘酰亚胺类衍生物的结构及紫外―可见吸收光谱[J]. 物理化学学报, 2009, 25(6): 1143-1148.
[11] Yang Q, Xu J, Sun Y,. Hydrolysis of plasmid DNA and RNA by amino alkyl naphthalimide as metal-free artificial nuclease[J]. Bioorganic & Medicinal Chemistry Letters, 2006, 16(4): 803-806.
[12] Kokosza K, Andrei G, Schols D,. Design, antiviral and cytostatic properties of isoxazolidine-containing amonafide analogues[J]. Bioorganic & Medicinal Chemistry, 2015, 23(13): 3135-3146.
[13] Quintana-Espinoza P, Martín-Acosta, Pedro, Amesty, ángel,. 5-Ethynylarylnaphthalimides as antitumor agents: Synthesis and biological evaluation[J]. Bioorganic & Medicinal Chemistry, 2017, 25(6): 1976-1983.
[14] Quintana-Espinoza P, García-Luis, Jonay, Amesty, ángel,. Synthesis and study of antiproliferative, antitopoisomerase II, DNA-intercalating and DNA-damaging activities of arylnaphthalimides[J]. Bioorganic & Medicinal Chemistry, 2013, 21(21): 6484-6495.
[15] Tian Z, Huang Y, Zhang Y,. Spectroscopic and molecular modeling methods to study the interaction between naphthalimide-polyamine conjugates and DNA[J]. Journal of Photochemistry and Photobiology. B, Biology, 2016, 158: 1-15.
[16] Qian X, Li Z, Yang Q. Highly efficient antitumor agents of heterocycles containing sulfur atom: Linear and angular thiazonaphthalimides against human lung cancer cell in vitro[J]. Bioorganic & Medicinal Chemistry, 2007, 15(21): 6846-6851.
[17] Braña M F, Cacho, Mónica,. New analogues of amonafide and elinafide, containing aromatic heterocycles: Synthesis, antitumor activity, molecular modeling, and DNA binding properties[J]. Journal of Medicinal Chemistry, 2004, 47(6): 1391-1399.
[18] 朱虹, 丁健. 萘酰亚胺类化合物作为抗肿瘤药物的研发现状[J]. 中国新药杂志, 2007(10): 742-747.
[19] 张海洋, 齐秀丽, 陈高云. 萘酰亚胺类DNA嵌合剂抗肿瘤构效关系研究进展[J]. 国际药学研究杂志, 2020, 47(1): 8-15+21.
魏涌标(1978~),男,副教授,硕士生导师;从事天然产物先导化合物抗肿瘤研究。ybwei2008@126.com
Synthesis and Evaluation of the Antiproliferative Activities of 1,8-Naphthalimide Derivatives
HUANG Jing-jing, LUO Jin-rong, WANG Ya-xun, LUO Jian-jun, YAN Li,WEI Nan-nan, DONG Min*, YE Yong, WEI Yong-biao*
(Department of Pharmaceutical Chemistry, School of Pharmaceutical Sciences, Guangxi Medical University, Nanning 530021, China)
To design and synthesize 1,8-naphthalimide derivatives and evaluate their cytotoxicity in vitro. 1,8-naphthalimide derivatives were synthesized by ammonolysis and nucleophilic substitution reaction with 4-bromo-1,8-naphthalene dicarboxylic anhydride as the lead compound. Their structures were characterized by MS,1H-NMR and13C-NMR. CCK8 assay was used to detect the inhibitory effect of the target compounds in the human cell lines H460, HepG2 and MCF-7. A series of 1,8-naphthalimide derivatives with different substituents were successfully synthesized and characterized. Among them, the target compound 3b has better antitumor activity in vitro and is the most sensitive to H460. The IC50of compound 3b for 48 h was 4.12±0.36 μM. 1,8-naphthalimide derivatives can inhibit the proliferation of cancer cells and may be an emerging new type of anti-tumor candidate compounds for the chemoprophylaxis andtreatment of cancer.
naphthalimide; nucleophilic substitution reaction; CCK8; cytotoxicity
R914.5
A
1009-220X(2022)01-0015-06
10.16560/j.cnki.gzhx.20220110
2021-03-01
国家自然科学基金地区项目(批准号NO. 81760620);广西自然科学基金面上项目(批准号2021GXNSFAA220122)。
黄晶晶,女,广西百色人,硕士;专业方向:药物化学。
通讯作者:董敏(1978~),女,副教授,硕士生导师;从糖尿病药理研究。

