m6A甲基化酶METTL3和WTAP在牦牛组织及脂肪细胞中的表达
张永峰 ,顾亚荣,马兰花,阎 萍
(1.兰州大学草地农业科技学院,甘肃 兰州 730020;2.中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730000)
作为青藏高原的主体畜种,牦牛(Bos grunniens)对生活在高海拔地区的藏民族具有重要意义,不仅提供了肉、奶、燃料等基本生活资料,而且是藏传佛教和藏文化传承的重要载体[1]。在传统放牧条件下,青藏高原漫长、寒冷的冷季(10月 -次年5月)牧草短缺,牦牛饲草不足,导致季节性体重变化较大,形成了“夏肥、秋壮、冬瘦、春乏”的恶性循环[2,3]。青藏高原暖季(6月 -9月)饲草相对充沛,牦牛机体储存了大量的脂肪。作为潜在的能量供应器官,脂肪组织在冷季里维持了牦牛机体的基本能量需求和抵抗外界的严寒[4]。牦牛为适应青藏高原独特的生活环境,其脂肪的合成、代谢和调节具有明显的物种和组织特异性[5]。在高寒环境下,脂肪对调节动物机体的能量平衡起着至关重要的作用。由于青藏高原环境和生物要素的异质性,牦牛在长期草场营养匮乏等生态逆境的选择压力下,可能形成了一种有效的脂肪发育和调节适应机制[6]。
N6-甲基腺苷(m6A)作为RNA 上可逆的化学修饰是一种新兴的转录后基因调控方式,是真核生物mRNA 上最丰富的内部修饰,参与脂质积累、能量代谢等多种生物学过程[7]。研究者利用MeRIP-Seq(一种基于m6A 抗体免疫沉淀并结合新一代高通量测序技术的方法)在猪脂肪组织中鉴定到2 826 个甲基化修饰位点,主要分布于基因CDs 区、终止密码子和3’UTR 区域[8]。对高脂和低脂肉鸡的脂肪组织MeRIP-Seq 测序发现高甲基化基因主要与脂肪酸生物合成和脂肪酸代谢相关,而低甲基化基因主要参与脂肪发育的相关过程[9]。这些研究表明m6A 修饰在家畜动物脂肪发育过程中扮演着重要的角色。目前关于m6A 修饰对牦牛脂肪发育的研究尚未有报道。一些酶类可以动态调控RNA m6A 甲基化修饰,包括甲基转移酶(METTL3、METTL14 和WTAP[10]和去甲基化酶(ALKBH5 和FTO)[11],及甲基化阅读蛋白(YTHDF1-3)[12]。
METTL3 和METTL14 的异构体联合亚单位蛋白WTAP 催化哺乳动物mRNA 上m6A 的形成。甲基转移酶的核心亚单位METTL3 已被证实能够调节胚胎发育[13]、细胞重编程[14]和精子发生[15],而其在小鼠体内的缺失会导致早期胚胎致死[16]。小鼠精原细胞分化过程中,METTL3 介导的m6A 修饰通过影响精子发生的功能基因调节精原细胞的分化[15]。CRISPR-Cas9 敲除METTL3 导致小鼠胚胎干细胞分化受损[17]。此外,METTL3 介导的m6A 修饰通过维持Myod mRNA 水平调节骨骼肌细胞的分化[18]。WTAP是一种广泛表达的核蛋白,细胞中调控某些基因的转录和转录后事件[19]。WTAP与METTL3 和METTL14相互作用,调节RNA 转录本上的m6A 水平[20]。WTAP有助于将METTL3 和METTL14 招募到它们的靶mRNA 上,且对METTL3 的核斑点定位具有重要作用,敲除WTAP对胚胎有致死作用[21],这说明其在脊椎动物发育中具有重要的生物学特性。此外,WTAP参与众多细胞进程事件,如可变剪接[22]、X-染色体失活[23]和细胞周期调节[21]。敲除WTAP会导致HeLa和293FT 细胞中m6A 总体水平的下降[10]。另有研究发现,METTL3 高表达于猪脂肪组织及与肥胖型的金华猪相比METTL3高表达于瘦肉型的长白猪[24]。敲除METTL3 和WTAP 可抑制小鼠3T3-L1 前脂肪细胞的分化[25]。以上研究表明,METTL3 和WTAP对机体发育及细胞分化具有重要的调控作用。因此,阐明METTL3 和WTAP 在家畜动物重要组织及细胞中的表达规律显得尤为重要。
综上,METTL3 和WTAP 与动物机体发育相关,可能调控动物脂肪组织的发育,但其分子调控机制尚不明确。牦牛脂肪组织及前体脂肪细胞分化过程中二者的表达模式尚未见报道。因此,本试验以世界上人工培育的第一个牦牛品种大通牦牛为试验对象,通过qPCR 检测了m6A 甲基化转移酶METTL3和WTAP在各组织和前体细胞增殖分化阶段的表达水平,检测了牦牛前体脂肪细胞分化阶段(0、4、8 和12 d)细胞m6A 甲基化水平,初步探究牦牛各组织及前体脂肪增殖细胞分化过程中METTL3和WTAP的表达变化规律,以期为阐释METTL3和WTAP对动物脂肪发育的分子调控机制提供理论依据。
1 材料与方法
1.1 试验动物及组织
本试验动物由青海省大通种牛场提供。采集18 和30月龄3 头大通母牦牛心、肝、脾、肺、肾、皮下脂肪和背最长肌样品,快速置于液氮罐中备用。
1.2 牦牛原代前体脂肪细胞的分离培养
3日龄大通牦牛选取于青海省大通种牛场,颈动脉放血处死后带入细胞室采样间采集用于细胞分离的肾周和皮下脂肪组织。在无菌环境下,尽可能的去除表皮、血管和结缔组织。剩余的组织用含1%抗生素的PBS 洗涤数次,无菌环境下切成约1 mm3的小块。用1%的I 型胶原蛋白酶(美国GIBCO 公司)在37 ℃下不断搅拌消化60~90 min。将消化后的组织用40 μm 尼龙网筛过滤,滤液在1 400×g 离心5 min。随后,在室温下用红细胞裂解缓冲液(0.154 mol·L-1NH4Cl,10 mmol·L-1KHCO3,0.1 mmol·L-1EDTA)孵育10 min,然后用200 μm 尼龙网筛过滤和无血清培养基洗涤两次,1 400×g 离心5 min 吸去上清然后加含10%胎牛血清的培养基重悬细胞。细胞悬液转移至25 cm2培养瓶中,至37 ℃、5%CO2培养箱中培养。
1.3 牦牛前体脂肪细胞的诱导分化及油红O 染色
牦牛前体脂肪细胞以1×104个·皿-1的密度培养于35 mm 培养皿,细胞达到融合状态后进行诱导分化。完全培养基中添加3-异丁基-1-甲基黄嘌呤(0.5 mmol·L-1)、地塞米松(1 μmol·L-1)、罗格列酮(0.5 mmol·L-1)和胰岛素(10 μg·mL-1)诱导培养细胞2 d。间隔2~3 d 更换培养基一次,添加胰岛素(10 μg·mL-1)的完全培养基培养细胞至12 d。
室温下将分化的脂肪细胞用4%的多聚甲醛固定30 min,之后用过滤的60% (W/V)的油红O 溶液染色30 min。然后用蒸馏水洗涤细胞2~3 次,在光学显微镜(Leica,德国)下进行观察和拍照。
1.4 细胞总RNA 的提取
牦牛组织和脂肪细胞中总RNA 参照TRIZOL Reagent (Invitrogen,美国)试剂说明书提取。核酸蛋白检测仪(Thermo,美国)检测RNA 浓度和质量,之后使用PrimeScripTMRT reagent Kit (TaKaRa,大 连)进行总RNA 的反转录。
1.5 牦牛前体脂肪细胞分化阶段m6A 甲基化水平的测定
将细胞总RNA 浓度稀释到100~300 ng·μL-1,采用比色法m6A RNA 甲基化定量检测试剂盒(Epigentek,美国)测定细胞中总RNA 的m6A 甲基化水平。
1.6 PPARγ、C/EBPα、FABP4、WTAP 和METTL3实时荧光定量PCR 检测
依据NCBI 牦牛PPARγ、CEBP/α、FABP4、WTAP和METTL3的序列,利用Primer Premier 5.0 设计各基因实时荧光定量引物(表1)。以β-actin为内参基因来确定目标基因的相对表达量。qRT-PCR 的总体积为10 μL,5 μL 2×SYBR Premix Ex Taq II (TaKaRa,大连);0.4 μL 上下游引物(10 μmol·L-1)和0.8 μL 稀释的cDNA。qPCR 反应程序如下:95 ℃下预变性30 s;95 ℃变性5 s;引物特异Tm 30 s;39 个循环,以加热速率为0.5 ℃·10 s-1从65 到95 ℃创建溶解曲线。Bio-Rad CFX96 荧光定量PCR 仪上进行上述试验过程。

表1 荧光定量PCR 引物Table 1 Sequence-specific primers used for real-time fluorescence quantitative PCR
1.7 数据统计
各基因的荧光定量Ct 检测值通过Bio-RadManager 软件获得,运用2-ΔΔCt法和β-actin为内参计算各目的基因的相对表达量。SPSS 25 进行各组数据差异显著性分析,Duncan 法进行多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 牦牛不同组织及不同年龄阶段皮下脂肪组织中METTL3 和WTAP 的表达模式
选取30月龄母牦牛3 只,采用荧光定量PCR检测METTL3和WTAPmRNA 在各组织中的表达,METTL3和WTAP广泛表达于牦牛心脏、肝脏、脾脏、肺、肾脏、背最长肌和皮下脂肪组织(图1A 和B)。肝脏中METTL3的表达最高(P<0.05),其次是肾脏,表达量最低的是皮下脂肪组织;皮下脂肪组织中WTAP的表达最为丰富,其次是心脏,脾脏中WTAP的表达量最低。皮下脂肪组织中METTL3的表达量30月龄高于18月龄但未达到显著水平(P>0.05),30月龄WTAP的表达量显著高于18月龄(P<0.01) (图1C 和D)。
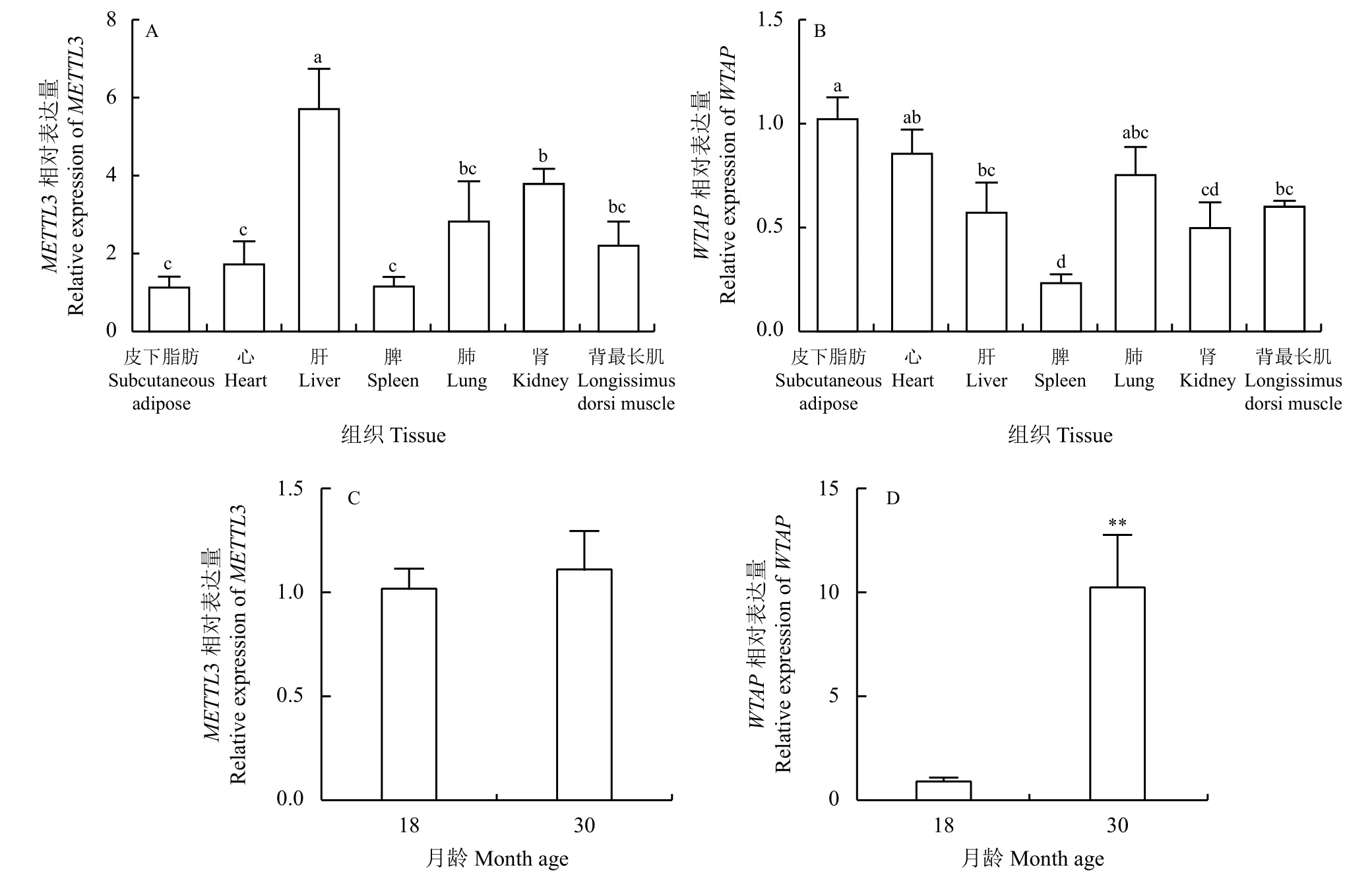
图1 METTL3 和WTAP 在牦牛不同组织不同时期皮下脂肪组织的相对表达量Figure 1 Relative expression of METTL3 and WTAP in different tissues and subcutaneous adipose tissue of yak at different stages
2.2 牦牛原代前体脂肪细胞的培养及形态学特征
采集牦牛皮下脂肪和肾周脂肪组织,I 型胶原酶消化法培养获取牦牛前体脂肪细胞(图2A-D)。刚消化的前体脂肪细胞呈圆球形悬浮于培养基中(图2A),培养24 h 之后部分细胞贴壁生长(图2B),培养5 d 之后细胞全部贴壁生长且细胞呈三角形及短梭形(图2C),细胞培养至9 d,形态变为长梭形呈现出成纤维细胞的形态特征并基本达到融合状态(图2D)。

图2 牦牛前脂肪细胞不同阶段的形态特征Figure 2 Morphologic characteristics of yak preadipocytes at different stages
2.3 牦牛前体脂肪细胞诱导分化模型的建立
牦牛前体脂肪细胞分化过程如图3 所示。细胞生长接触抑制时进行诱导分化,此时为诱导0 d,细胞中出现少量的小脂滴(图3A)。分化第4 天,牦牛前体脂肪细胞内可见脂滴数明显增加(图3B)。第8 天时,细胞中的小脂滴聚集且出现了许多大脂滴及少量的脂环(图3C)。大多数细胞在第12 天完全分化,细胞中生成多而密的脂环(图3D)。脂肪细胞分化特异性标志基因的结果显示(图3E),与分化的早期阶段(0 d)相比,PPARγ的表达呈现上升趋势,在第12 天的表达量显著高于第0 天(P<0.05)。C/EBPα 和FABP4的表达量在细胞分化第8 天时表达量最高(P<0.05),分化12 d 时表达量略有下降但显著高于0 d 和4 d (P<0.05) (图3F 和G)。这表明,在本试验条件下,前体脂肪细胞完全分化为脂肪细胞。
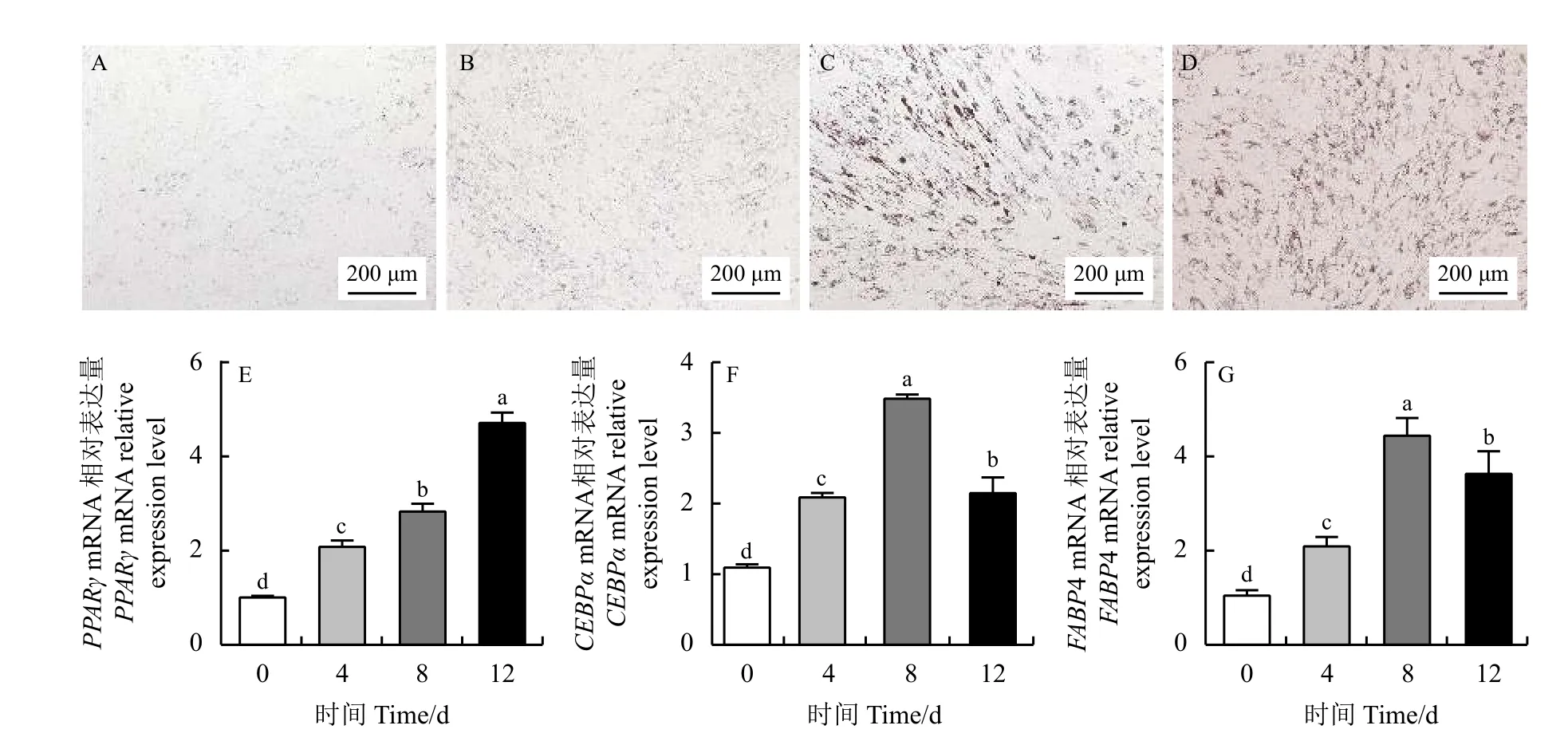
图3 牦牛前体脂肪细胞诱导分化及PPARγ、C/EBPα 和FABP4 诱导分化过程中的表达模式Figure 3 Induced differentiation of yak preadipocytes and expression patterns of PPARγ,C/EBPα,and FABP4 during yak preadipocyte differentiation
2.4 METTL3 和WTAP 在牦牛前体脂肪细胞增殖过程中的表达
为了探究METTL3和WTAP在牦牛脂肪发育过程中的潜在功能,本研究检测了METTL3和WTAP在细胞增殖3 个时期(24、48 和72 h)的表达水平(图4)。从细胞接种到培养72 h,细胞密度越来越大,72 h 时到达接触生长的状态(图4A)。METTL3和WTAP基因表达结果显示(图4B),METTL3和WTAP的表达量在细胞增殖阶段呈现下降-上升的表达趋势(P<0.05)。

图4 牦牛前体脂肪细胞增殖过程形态变化及METTL3 和WTAP 的表达Figure 4 Morphological changes of yak preadipocytes during proliferation,and expression of METTL3 and WTAP
2.5 METTL3 和WTAP 在牦牛前体脂肪细胞分化过程中的表达模式
进一步检测METTL3和WTAP在牦牛前体脂肪细胞分化过程中的动态变化规律,选取细胞分化的4 个时间点(0、4、8 和12 d) (图5)。METTL3mRNA表达量呈现上升-下降-上升的趋势,4、8 和12 d 的表达量显著高于0 d (P<0.05)。WTAPmRNA 表达量呈现上升-下降的趋势,4 d 的表达量高于0 d (P>0.05);8 和12 d 的表达量显著低于0 d (P<0.05)。

图5 牦牛前体脂肪细胞分化过程中METTL3 和WTAP 的表达Figure 5 Expression of METTL3 and WTAP during yak preadipocytes differentiation
2.6 牦牛前体脂肪细胞分化各阶段mRNA 的m6A甲基化水平
为了进一步明确牦牛前体脂肪细胞分化过程中mRNA m6A 含量的变化规律,对细胞分化过程中的4 个阶段RNA (0、4、8 和12 d)进行m6A 水平检测(图6)。牦牛前体脂肪细胞分化过程中m6A水平的变化呈现出逐渐上升的趋势。在12 d 时细胞内RNA 的m6A 丰度最高。
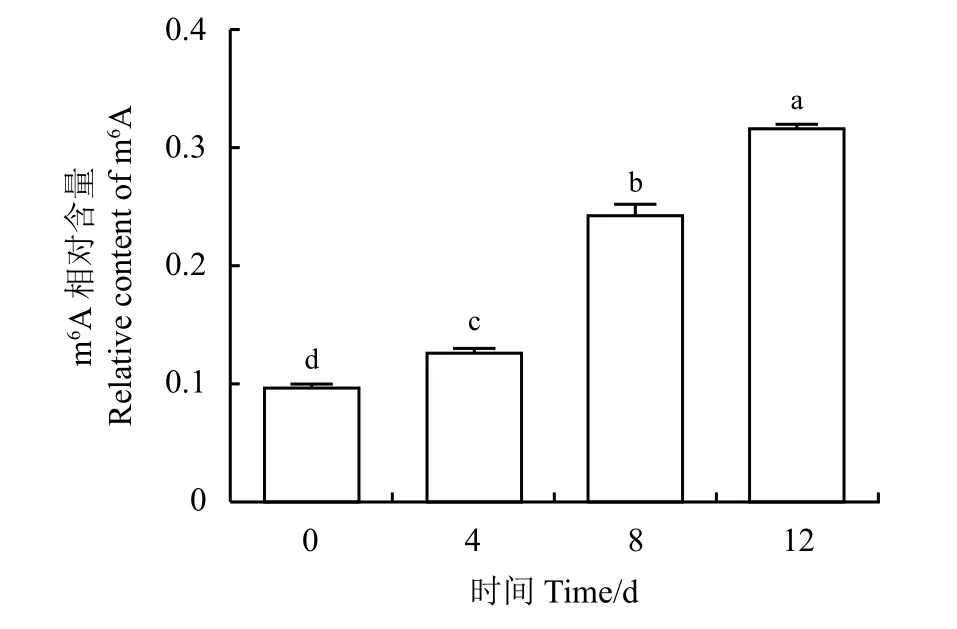
图6 牦牛前体脂肪细胞分化过程中m6A 甲基化水平的定量检测Figure 6 Quantitative determination of m6A methylation level during yak preadipocyte differentiation
3 讨论
m6A RNA 甲基化是继非编码RNAs、组蛋白修饰和DNA 甲基化之后,表观遗传学领域的又一研究热点,其广泛存在于动植物的各类组织器官,是真核生物mRNA 中含量最为丰富的甲基化修饰方式。研究发现,m6A RNA 甲基化修饰在生物机体代谢中发挥着重要的作用,如控制昼夜节律[26-27]脂质沉积[28]和成脂分化[29-30]。WTAP 和METTL3 是m6A去甲基化酶的重要组分[7]。本研究基因的组织表达结果显示,WTAPmRNA 表达量在皮下脂肪组织高于其他组织,这与猪各组织中的研究结果相一致[24]。WTAP 可引导METTL3 进入核斑点从而使目标RNA发生甲基化[20],敲除WTAP 导致METTL3 的降解并显著降低了m6A 的水平[10]。因此,可以推测WTAP对牦牛脂肪组织的发育具有重要的作用。本研究发现METTL3在肝脏组织中的表达高于其他组织,皮下脂肪组织表达量最低。Wang 等[31]发现METTL3高表达于肩胛部棕色脂肪组织,是肩胛部棕色脂肪发育必不可少的调节因子,通过调控m6A 甲基化修饰水平的变化和Prdm16、Pparg 和Ucp1 的转录表达从而促进小鼠出生后肩胛部棕色脂肪的发育。表明METTL3的表达具有组织特异性。与正常组织相比,METTL3显著高表达于肝癌组织,这与本研究结果具有相似之处[32]。肝脏是糖、脂合成、代谢、储存和再分配的中枢器官[33],通过内分泌途径调节能量平衡、繁殖和免疫反应等生物学过程[34]。这些结果表明,牦牛肝脏中产生的METTL3可能通过内分泌的方式调节牦牛脂肪及其他组织的发育。
胚胎干细胞中(embryonic stem cells,ESC) METTL3的遗传失活或耗竭,导致m6A 在选定靶基因上的去除和细胞分化时Nanog表达的延长,及体内外ESC从自我更新向分化成多个细胞系退出的受损。因此,m6A 甲基化修饰可作为一种转录水平的标记物来调节胚胎干细胞分化和决定细胞命运[17]。小鼠胚胎干细胞的相关研究表明,METTL3 影响小鼠胚胎干细胞的维持和分化[35]。小鼠胚胎成纤维细胞甲基化位点的发生主要依赖于WTAP 的修饰[36]。因此可以推测METTL3 和WTAP 在细胞分化过程中发挥着重要的作用。WTAP在牦牛脂肪细胞增殖阶段呈现下降-上升的趋势,在诱导分化阶段呈现逐渐下降的趋势。METTL3在细胞增殖阶段的表达呈现下降-上升趋势,分化阶段呈现出上升-下降-上升的趋势,METTL3表达量与分化阶段RNA 中m6A 含量变化趋势相一致,提示在牦牛脂肪细胞分化阶段METTL3大于调控细胞中m6A 的整体含量。小鼠前体脂肪细胞分化中WTAP和METTL3协同调控细胞内甲基化水平的变化从而调节3T3-L1 细胞周期和细胞的有丝分裂克隆扩增,进而促进3T3-L1 细胞中脂质的形成[25]。在WTAP缺失的情况下,METTL3结合RNA 的能力显著下降,表明WTAP调控m6A 甲基转移酶复合物(METTL3 和METTL14)到靶mRNA的募集[31]。而本研究发现在前体脂肪细胞分化后期METTL3的表达显著升高,而WTAP的表达有所下降,这与3T3-L1 细胞分化后期WTAP增强METTL3到靶RNA 的募集研究结果相类似[25]。此外,在HepG2细胞中敲低METTL3细胞中脂质积累减少,推测m6A RNA 甲基化介导了昼夜节律和脂质代谢之间的相互作用[37]。对猪前体脂肪细胞分化的研究中发现,METTL3介导的m6A 抑制脂肪细胞中脂质的形成[29]。Yao 等[39]发现猪骨髓干细胞中METTL3的缺失通过依赖YTHDF2 增强 Janus 激酶1 mRNA 的稳定性和激活STAT5 来促进脂肪生成,这表明METTL3通过m6A 依赖的方式调控BMSCs 的分化。以上研究表明WTAP和METTL3对脂肪细胞的分化具有调控作用,在不同的细胞系及组织发育过程中具有不同的调控作用。这也充分暗示了WTAP和METTL3对动物脂肪组织发育及脂肪细胞的分化具有重要的调控作用,但其具体功能机制有待进一步研究。
4 结论
本研究揭示了WTAP和METTL3在牦牛各组织及前体脂肪细胞增殖与分化阶段的表达模式,METTL3在肝脏组织中高度表达,WTAP在皮下脂肪组织中高度富集。二者在牦牛前体脂肪细胞增殖后期具有较高的表达水平,METTL3在脂肪细胞分化后期表达显著上升。细胞整体m6A 含量在牦牛前体脂肪细胞分化后期也具有较高水平。初步揭示WTAP和METTL3对牦牛脂肪组织的发育及前体脂肪细胞的增殖与分化具有重要的调控作用。

