SOC1调控植物开花时间的分子机制
齐联联,宿 强,张 珂
(1.北京林业大学草业与草原学院,北京 100083;2.七台河市林业和草原局,黑龙江 七台河 154600)
高等植物开花分为成花诱导、花原基的形成和花器官的发育3 个过程[1]。成花诱导是植物从营养生长向生殖生长转变,进行花芽分化的重要节点,决定植物的开花时间[2]。从植物繁殖和资源分配的角度来看,适当的开花时间对作物的产量和植物的成功繁殖至关重要。2015年统计了模式植物拟南芥(Arabidopsis thaliana)中调节开花时间的基因有306 个[3],这些基因构成复杂精细的调控网络精准控制植物的开花时间。即高等植物开花是多基因共同调控的结果。
Onouchi 等[4]采用抑制性诱变的方法筛选造成CO过表达拟南芥发生晚花的突变体时,筛选到4 个基因可以部分抑制35S::CO过表达株系的早花表型,2 号染色体上的一个位点定义了1 个新的基因座将其命名为SUPPRESSOR OF OVEREXPRESSIO OF CONSTANS1(SOC1)。过表达35S::SOC1发生不依赖于光周期的拟南芥早花现象[5];T-DNA 插入突变证明SOC1突变不依赖于光周期造成晚花[6]。以上证明SOC1具有调控植物开花时间的功能。而SOC1主要在发育中的叶片和茎尖分生组织中表达来调控拟南芥的开花时间[6]。之后陆续在其他植物材料中克隆到SOC1的同源基因,MtSOC1a过表达促进蒺藜苜蓿(Medicago truncatula)开花和主茎伸长,其突变体表现为开花延迟且主茎缩短的表型[7]。可见SOC1不仅能调控植物的开花时间,还具有调控植物形态建成的功能。矮牵牛(Petunia hybrida)Fbp20/UNS(FLORAL BINDING PROTEIN20/UNSHAVEN)是SOC1的同源基因,过表达Fbp20/UNS的全长基因促进植物开花,过表达缺失MADS 结构域的截短体Fbp20/UNS造成晚花[8]。此外,SOC1还具有调节拟南芥气孔开放[9],使烟草(Nicotiana tabacum)和矮牵牛花和叶片的叶绿素含量升高、增强其光合作用,并提高植物的耐热性的功能[10]。足以见得,SOC1在不同植物中的功能既有保守性又有特异性。
SOC1是植物的开花整合因子,其调控植物开花时间的分子机制被广泛研究。SOC1转录因子受蛋白或核酸调控,或与其他转录因子形成二聚体或高阶复合物进入细胞核,靶向特异开花基因从而调控植物开花。本研究分析SOC1的结构特征,预测SOC1的蛋白互作网络,总结SOC1调控植物开花时间的分子机制,为今后在其他植物中进行开花时间的研究提供参考。
1 SOC1 基因及其编码蛋白的结构特征
1.1 SOC1 基因的结构特征
SOC1基因由7 个外显子和6 个内含子组成(图1),编码MADS-box 转录因子,是典型的MIKC 蛋白。它由两个保守区MADS 域和K 域与两个不保守区I 域和C 末端组成,每个结构域具有不同的功能[11]。其中,N 端的MADS 结构域是最保守的区段,其长度约60 个氨基酸,可以和含有CArG-box 的DNA 序列特异结合或与其他蛋白形成二聚体运输到细胞核内从而调控下游靶基因的表达[11]。如果MADS结构域内部的Arg24发生突变,那SOC1就不能与LFY的启动子结合,丧失部分开花能力[12]。K 域是同源蛋白、异源蛋白相互作用形成二聚体的功能域,长度约为70 个氨基酸[11]。在MIKC 型蛋白中,形成α-螺旋的氨基酸定位在I 结构域中,所以I 域在转录因子与DNA 结合形成二聚体过程中必不可少[11]。Lee 等[12]证明了MADS 域和I 域在SOC1 和AGL24 互作形成异源二聚体运输到细胞核过程中发挥重要作用。即MADS 域和I 域可有效保证转录因子与DNA 结合形成二聚体。C 域是最不保守的区域,是植物进化过程中形成多样性功能的重要区段,可以促进K 域形成复合物。而且C 末端含有一些保守的基序,其中SOC1-motif,保守性很强,被认为是不同植物材料SOC1的共有序列,这些基序在转录激活过程中发挥重要作用[11,13]。

图1 AtSOC1 (AT2G45660.1)基因的结构Figure 1 Gene structure of AtSOC1 (AT2G45660.1)
1.2 SOC1 编码蛋白的一级结构特征
从ncbi (national center for biotechnology information) (https://www.ncbi.nlm.nih.gov/protein/)上 查 找已经克隆的12 种单子叶植物和双子叶植物中的SOC1的氨基酸序列,采用DNAMAN8 比对氨基酸序列(图2),从上到下依次为(括号内含登录号):拟南芥AtSOC1(NP-182 090.1)、烟草NtSOC1(AFY06683.1)、玉米(Zea mays)ZmSOC1(AIR75259.1)、水稻(Oryza sativa)OsMADS50/OsSOC1(Q9XJ60.1)、小麦(Triticum aestivum)WSOC1(BAF56968.1)、大 豆(Glycine max)GmSOC1(NP-001236377.1)、草 莓 (Fragaria vesca)FvSOC1(NP-001266966.1)、月 季 (Rosa chinensis)RcSOC1(GIH54602.1)、李(Prunus salicina)PsSOC1(AGD88523.1)、甜橙(Citrus sinensis)CsSL1(ABS846 59.1)及CsSL2(ABS84660.1)、蒺藜苜蓿MtSOC1(XP-006383341.2)、苹 果(Malus domestica)MdSOC1(NP-001280844.1)。通过多序列比对发现,不同植物材料中SOC1氨基酸序列在MADS 域的保守性相对较高,具有多个连续的保守位点;而C 末端具有较高的差异性,但都具备亮氨酸拉链结构和SOC1-motif。这也能解释蛋白质在生物进化过程中的稳定性及功能的多样性。

图2 多种植物中SOC1 氨基酸序列的同源比对Figure 2 Homologous alignment of amino acid sequences of SOC1 in various plants
1.3 SOC1 编码蛋白的高级结构特征
蛋白质的结构与其功能密切相关,即使其一级结构不变,蛋白质的构象发生改变就有可能影响其功能,所以了解蛋白质的高级结构可帮助预测其功能。采用SOPMA 在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预 测SOC1 蛋白的二级结构(表1),结果显示,SOC1 蛋白的二级结构的主要组成元件为α-螺旋和无规则卷曲,其次为延伸链,β-转角所占的比例最小。采用Phyre2 在线软件(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测SOC1 蛋白的三级结构(图3),李PsSOC1 与甜橙CsSL1 蛋白的构象与其他植物材料明显不同,其他10 中植物材料的蛋白三级结构很相似。

图3 多种SOC1 蛋白的三级结构预测Figure 3 Prediction of tertiary structure of SOC1 in several plants
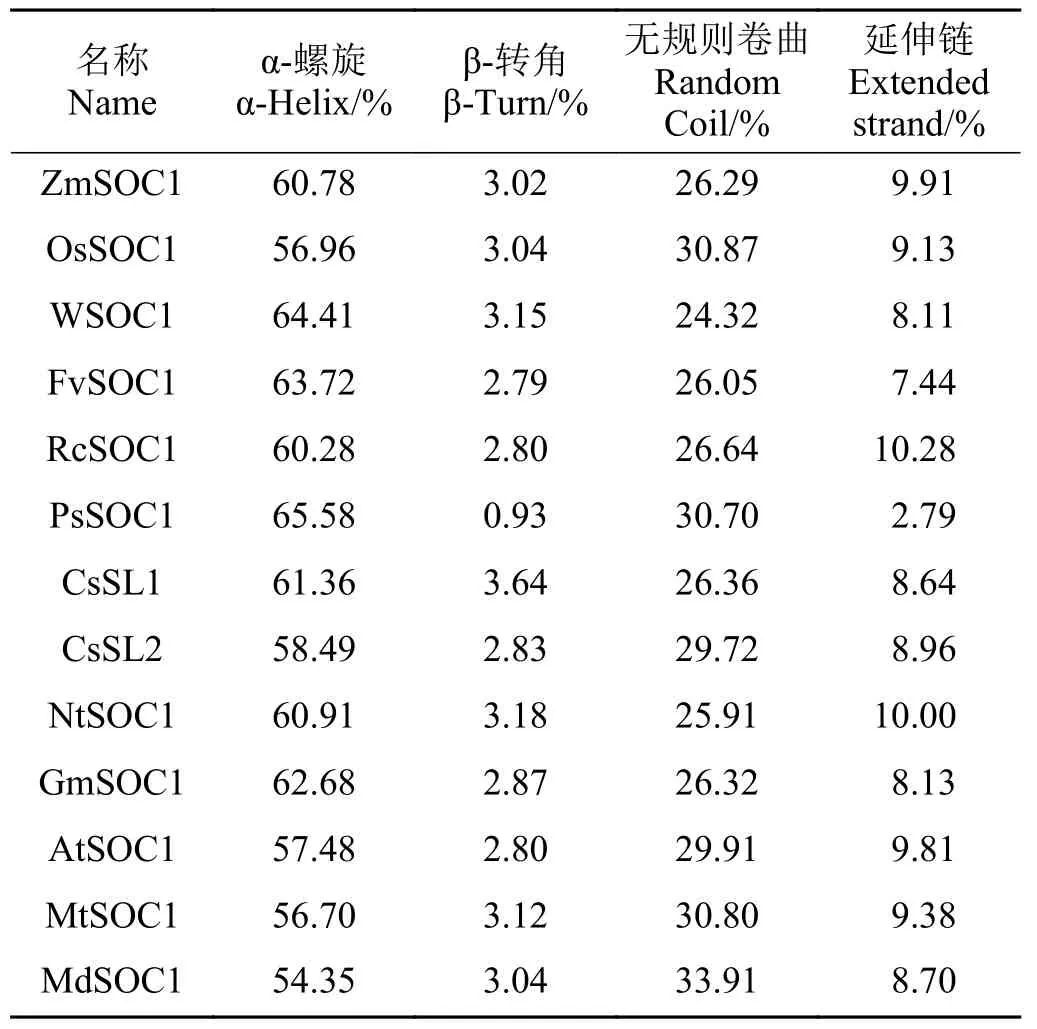
表1 多种SOC1 蛋白二级结构主要组成元件及比例Table 1 Proportion of main components of secondary structure of SOC1 in various plants
研究发现在不同品种的烟草中过表达NtSOC1可以不依赖光周期发生早花,且Nicotiana tabacum品种的过表达NtSOC1株系表现出花粉管较野生型伸长,蒴果坐落于叶柄之上的表型,而野生型植株的蒴果并不具备叶柄[14]。Lee 等[15]利用T-DNA 转化株系从水稻中分离到OsMADS50/OsSOC1,与SOC1的氨基酸同一性达50.6%,过表达OsMADS50/OsSOC1显示极早花表型,抑制OsMADS50/OsSOC1表达表现出晚花表型及节间数量增加的性状。可见SOC1在不同的植物中具有多效性。双子叶植物甜橙CsSL1和CsSL2[16]、大豆GmSOC1[17],单子叶植物水稻OsMADS50/OsSOC1[15]、玉米ZmSOC1[18]均促进植物开花。但并非所有植物中的SOC1同源基因均具有促进开花的功能。草莓FvSOC1过表达抑制了短日照条件下的成花启动,而其突变体在短日照条件下和长日照条件下持续开花;同时FvSOC1通过激活赤霉素生物合成基因来调节腋芽向匍匐茎的分化形成多个分枝[19],即FvSOC1通过调控不同的靶基因继而调节营养生长和生殖生长。可见肽链盘曲折叠形成不同的蛋白构象从而使得SOC1在不同的植物中具有多样性的功能。
1.4 拟南芥AtSOC1 蛋白互作网络预测
蛋白质是功能的执行者,而蛋白互作是行使功能的主要方式。不同的蛋白互作可能调控不同的靶基因从而具有不同的功能,所以蛋白之间的物理关系能帮助探究基因的功能。利用STRING 在线工具(https://www.string-db.org)查找AtSOC1 的互作网络(图4),得到11 个蛋白与AtSOC1 蛋白直接互作,其中LFY 蛋白与SOC1 互作的分数最高(0.981),其次是FT (0.969)、CO (0.969)、LATE (0.953)、TFL1 (0.930)、
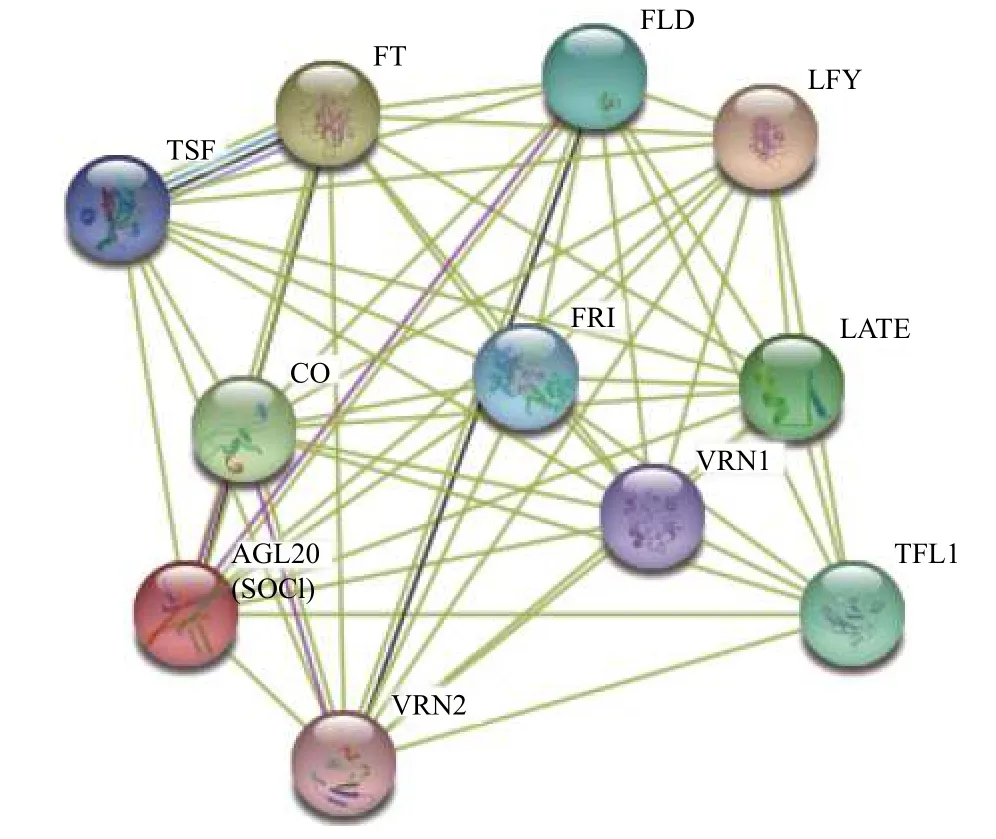
图4 拟南芥AtSOC1 的蛋白互作网络Figure 4 Protein interaction network of AtSOC1 in Arabidopsis thaliana
FLD (0.917)、FRI (0.909)、TSF (0.903)、VRN1 (0.840)、VRN2 (0.838)。蛋白互作预测工具并不能反映所有存在互作关系的蛋白,具体的蛋白互作网络仍需试验挖掘。拟南芥PIN1的同源基因肽脯氨酰顺反异构酶Pin1At 在体内与AGL24 蛋白和SOC1 蛋白相互作用促进拟南芥开花,在体外与发生Thr-Pro 磷酸化的AGL24 蛋白和Ser-Pro 磷酸化的SOC1 蛋白互作造成拟南芥晚花,但Pin1At 并没有改变AGL24与SOC1的转录水平。可见,AGL24 蛋白的Thr-Pro位点与SOC1 蛋白的Ser-Pro 位点在调控拟南芥开花功能中发挥重要的作用[20]。
2 SOC1 的上下游信号转导机制
植物开花过程中较多的MADS-box 转录因子多以二聚体或多聚体的形式特异的结合DNA 调控下游基因的表达[21]。SOC1转录因子受蛋白或核酸调控,或与其他转录因子形成二聚体或高阶复合物调控植物开花。比如拟南芥在面对干旱胁迫时,体内的脱落酸结合元件ABF3、ABF4 与NF-YC (Nuclear Factor-YC)亚基互作形成聚合物结合在SOC1的启动子区域,激活SOC1的转录表达从而促进开花,产生干旱逃逸反应[22]。
2.1 FT、CO 调控SOC1 的表达
FT(Flowering locus T)基因具有高度保守的PEBP 结构域,编码19.8 kDa 左右的可移动蛋白,属于磷脂酰乙醇胺结合蛋白(PEBP)[23]。在水稻中的研究发现FT 的同源蛋白Hd3a 先在细胞质中与14-3-3 蛋白互作形成二聚体再进入细胞核与bZIP 转录因子编码的FD 蛋白形成FAC 三聚蛋白复合物调控植物开花[24]。研究发现过表达FT引起的早期开花表型被fd-2部分抑制,说明FD 蛋白是FT调控植物开花不可或缺的因子[25]。Yoo 等[26]的研究表明在SOC1过表达拟南芥植株和功能突变体中,FT的表达量与野生型相近,说明FT的表达不受SOC1的影响;而在FT过表达植株中,SOC1的表达水平上调,在ft-10突变体中,SOC1的含量下调;并且35S::CO植株中FT的表达先于SOC1的表达。以上说明,FT作用于SOC1的上游发挥正向调控作用。FT的表达受到CO/BBX1 (B-box1)的调控,叶片韧皮部中的CO 蛋白通过其保守的TGTG (N2-3) ATG 基序及CCT 基序结合在FT近端启动子区域[27]或与其他转录因子NF-Y 相互作用形成复合体激活FT的转录表达[28],FT 蛋白在茎顶端分生组织中和FD 蛋白形成复合体从而级联SOC1的表达来启动开花[29]。CO-FT-SOC1的级联通路在植物中较为保守,是调控植物开花的经典模型。2002年Hepworth[30]提出另一种观点,CO 蛋白不通过FT而是直接结合在SOC1的启动子上调控其表达。2014年Hou 等[31]提出长日照条件下CO 蛋白与NF-Y (Nuclear Factor-Y)亚基形成复合物直接结合在SOC1的启动子的NFYBE元件区域,该模型直接验证CO 蛋白可以直接调控SOC1的表达。即CO 蛋白可以通过激活FT的方式间接调控SOC1的表达,也可以直接调控SOC1的表达。除CO 蛋白外,也有研究[32]发现REM16 转录因子通过直接结合在FT、SOC1的启动子区域激活其转录从而促进拟南芥开花。
2.2 FLC 及其同源基因与SVP 互作调控SOC1的表达
FLC(Flowering Locus C)编码MADS-box 蛋白,是抑制植物开花的主要转录因子[33]。研究表明FLC结合在FT第一个内含子的CArG 区域和SOC1启动子的CArG 区域[34]。Searle 等[33]进一步揭示FLC通过两种途径抑制植物开花,一是抑制叶片中FT的表达从而间接抑制开花相关基因的表达;二是FLC抑制茎顶端分生组织中SOC1的表达并抑制FD的上调从而破坏FT的表达信号(FT-FD 蛋白复合体)。即FLC通过抑制SOC1、FT和FD的表达抑制植物开花。发挥生物活性的FLC 蛋白大约是800 kDa 的高阶复合物,即FLC需要和其他蛋白或者核酸发生物理作用形成二聚体或高聚复合物才能发挥生物活性抑制植物开花[34]。探究FLC调控SOC1开花诱导过程的分子机制发现,拟南芥营养生长阶段的FLC 与SVP 蛋白在叶片及茎顶端分生组织均可形成FLC-SVP 抑制复合体,结合在FT和SOC1启动子的CArG 区抑制其转录,从而抑制植物成花诱导过程[35]。而研究发现FLC 与DELLA 的RGA 蛋白相互作用形成复合物加强了FLC对下游靶基因的抑制活性,继而负调控下游SOC1和FT的表达延迟植物开花[36]。进一步证实了FLC以复合体的形式发挥生物活性的观点。
拟南芥中FLC还有5 个同源基因,FLM(FLOWERING LOCUS M)/MAF1(MADS AFFECTING FLOWERING 1)和MAF2、MAF3和MAF4和MAF5[37]。FLC的同源基因同样编码MIKCC型转录因子,可与FLC 蛋白相互作用形成FLC-MAFs 复合物,冗余的抑制植物的开花诱导[37]。研究进一步发现FLM、MAF2 和MAF4 与SVP 直接相互作用,形成MAFs-SVP 异二聚体通过下调FT、SOC1的转录表达来抑制开花[37-39]。所以,SVP 极有可能与MAFs 及FLC互作形成SVP-MAFs-FLC 高阶复合物来调控植物开花时间。MAFs 还可响应温度产生可变剪切体来调控植物的开花时间。FLM是开花抑制因子,可依赖于温度产生4 种不同的剪切体,分别为FLM-α、FLMβ、FLM-γ和FLM-δ[40]。其中剪切体FLM-β和FLMδ具有生物活性,可与SVP 蛋白互作形成异二聚体,16 ℃环境下SVP-FLM-β 阻遏复合物占据的比例较高,通过下调SOC1的表达阻止早熟开花;27 ℃环境下SVP-FLM-δ 复合物占据主导,而FLM-β的比例降低,同时伴随环境温度的升高SVP活性降低,不能抑制SOC1的表达从而促进早花[38]。MAF2 在低温条件下与SVP 结合形成复合物(MAF2-SVP)抑制开花,而在高温条件下不存在相互作用[39]。在Col型拟南芥中MAF2同样可以响应温度产生3 种不同的 剪 切 体(MAF2var1、MAF2var2和MAF2var5)[39]。在相对低温条件下,MAF2var1含量较高占据主导,与SVP 互作形成阻遏复合物抑制开花;随温度升高,MAF2var2占据主导,因其蛋白结构缺少K 域和C 域不能与SVP 互作所以不能抑制开花;MAF2var5在拟南芥植株体内可以与SVP 蛋白互作促进早花,但其表达含量较低,在其他植物中的开花调控功能还需另行讨论。足以见得SVP是一个很重要的中心调节因子,SVP与FLC的作用位点相同,均结合在FT启动子上的vCArG 基序和SOC1启动子上的CArG基序抑制其转录从而抑制植物开花[35,41]。有趣的是,SVP还可直接结合在miR172a 启动子上抑制其表达,miR172 通过下调AP2 类转录因子(TOE1、TOE2、SMZ、SNZ、AP2)的表达,激活FT-SOC1通路使花期提前[42]。
2.3 DELLA 蛋白调控SOC1 表达
DELLA 蛋白属于植物特有的GRAS 基因家族,N 端具有保守的DELLA 结构域,可以响应赤霉素(GA)信号发生降解,C 端具有GRAS 结构域可以调控蛋白互作和转录激活[43]。DELLA 蛋白缺少DNA结合结构域,通过与多种转录因子互作调控叶片和茎顶端分生组织中FT、SOC1的表达水平进而调控植物的开花时间[44]。
DELLA 蛋白可与NF-Y 亚基及CO 蛋白发生物理作用形成聚合物结合在SOC1的启动子区域,直接调节SOC1的转录[31]。DELLA 蛋白和NF-Y 亚基形成二聚体,导致NF-Y 无法与SOC1启动子的NFYBE元件结合,不能激活SOC1的转录;而赤霉素受体GIDI 感受GA 信号之后降解DELLA 蛋白,使NF-Y亚基直接结合在SOC1启动子的NFYBE 元件区域,通过去甲基化酶REF6 降低SOC1的甲基化水平从而上调SOC1的表达促进拟南芥开花;而长日照条件下,DELLA 蛋白RGA 与CO、NF-Y 亚基形成多聚复合物结合在SOC1启动子的NFYBE 元件上造成早花[31]。Bao 等2019年研究发现,短日照条件下myc3突变体开花时间提前,FT的表达水平上调,采用染色质免疫共沉淀发现MYC3通过结合在FT的启动子区域抑制其表达造成晚花[45]。因为短日照条件下,GA 含量低,DELLA 蛋白大量积累并稳定MYC3的表达,使其与FT启动子结合(MYC3-FT)从而抑制FT的表达;长日照条件下,GA 含量升高使DELLA 蛋白被降解,CO 蛋白的丰度显著高于MYC3,CO 蛋白结合在FT启动子区域促进拟南芥开花[45]。即根据日照长度的不同,MYC3 与CO 蛋白竞争性的结合在FT的启动子上调控植物开花。在此之前的一项研究[46]表明,长日照条件下DELLA蛋白与CO 蛋白互相作用形成复合体(DELLA-CO)抑制CO的转录活性,拮抗CO-FT通路从而抑制拟南芥开花。WRKY 转录因子同样介导DELLA 蛋白参与调控植物的成花转变过程[47]。遗传杂交试验证实WRKY75通过上调FT基因的表达促进拟南芥开花;WRKY75 与DELLA 蛋白GAI、RGL1 互作在细胞核内形成复合物,抑制WRKY75的转录活性,从而抑制FT-SOC1通路延迟植物开花。
2.4 miR156-SPL 通路调控SOC1 的表达
拟南芥SPL(SQUMOSA PROMOTER BINDING PROTEIN LIKE)基因家族含有17 个成员,根据SPL 基因中SBP结构域的大小被分为两个分支,第1 分支是编码SBP 结构域超过800 个氨基酸的SPL1、SPL7、SPL12、SPL14、SPL16,第2 分 支 是SBP 结构域少于400 个氨基酸其他的12 个成员。除SPL8之外的其他11 个第2 分支成员均是miR156(microRNA156)的靶基因,按照编码蛋白的大小及蛋白结构分为2 类:编码蛋白较小的SPL3(SPL3、SPL4、SPL5)和编码蛋白较大的SPL9(SPL2、SPL6、SPL9、SPL10、SPL11、SPL13、SPL13-Like、SPL15)[48]。
随植物发育进程的推进,受miR156 负调控的SPL表达不断积累,推进成花诱导的完成。GR 诱导和染色质免疫共沉淀试验发现叶片中SPL9、SPL10可以结合在miR172b (microRNA172b)启动子上激活其转录,继而抑制AP2 类转录因子的表达使FTSOC1活性提高促进开花[49]。研究者[50]在2009年发现SPL9还可以通过调控MADS-box 基因调控植物开花,SPL9在茎顶端分生组织中直接结合在SOC1和AGL42启动子区域的CATC 基序来上调SOC1和AGL42的表达实现早花。即SOC1是SPL9的直接下游靶基因。而Jung 等[51]在2012年发现SOC1可以直接结合在SPL3、SPL4和SPL5的启动子CArG box 区域促进开花,FT-FD 复合体也可以直接结合在SPL3、SPL4和SPL5的启动子区域或者通过FT-SOC1通路间接上调SPL3、SPL4和SPL5的 表达;而SPL3、SPL4和SPL5结合在下游LFY的启动子上促进其表达使花期提前。也就是说SOCI可作用于SPL的上游参与开花诱导,即SOC1-SPL-LFY通路。综上,SOC1与SPL可互相结合到对方的启动子区域激活下游MADS-box 基因或miR172-AP2-FTSOC1的表达从而促进开花。
SPL 蛋白可与DELLA 蛋白发生物理作用并通过调控不同的下游靶基因抑制拟南芥开花[52]。RGA 蛋白与SPL9 蛋白互作形成二聚体抑制SPL9的转录活性,不依赖光照可抑制茎顶端分生组织中SOC1、FUL基因的表达延迟开花;除此之外,短日照条件下RGA-SPL9 复合物还可在叶片中直接抑制miR172 的表达,继而抑制AP2-FT-SOC1通路造成晚花[52]。SPL3和SPL5启动子含有硝酸盐反应元件(NREs),NLP7 (NIN-LIKE PROTEIN 7)和NLP6 是硝酸盐信号的主要转录因子,能够结合到SPL3和SPL5的硝酸盐反应元件上,不构成胁迫条件的低浓度氮会延迟植物开花,但并不改变植物的营养相变过程,而硝酸盐调控植物开花必须通过调控茎尖分生组织中SOC1的表达来实现[53]。即低浓度氮通过降低茎尖分生组织中SOC1的表达来延迟植物开花。3 种拟南芥自然变异材料响应KNO3浓度调节开花时间与SOC1和FT的表达有关,关键核心基因GI(Gigantea)、SPL与FLC的表达也会受到硝酸盐浓度变化的影响[54]。开花诱导不仅受硝酸盐信号的影响,糖信号也会影响植物的开花诱导进程。6-磷酸海藻糖合成基因TPS1(TREHALOSE-6-PHOSP HATE SYNTHASE 1)在茎顶端分生组织中通过上调SPL3、SPL4、SPL5的表达促进开花;TPS1还可以不依赖于miR156-SPL通路直接在叶片中上调FT-SOC1的表达促进开花[55]。
2.5 SOC1 与AGL24 互作激活LFY 的转录
AGL24是SVP的同源基因,编码MADS-box 转录因子,两者结合在SOC1启动子的同一位点,但对SOC1的作用是相反的。SOC1结合在AGL24的启动子区域促进其表达,与此同时,AGL24同样可以结合在SOC1的启动子区域上调其表达,两者在茎尖形成一个正向反馈循环[56]。在植物由营养生长向生殖生长转变时,SOC1 与AGL24 在茎顶端分生组织中相互作用形成复合物,由细胞质转移到细胞核,结合在LFY启动子上激活其表达从而完成开花诱导[12]。江为利用酵母双杂交系统说明芥菜(Brassica juncea)全长SOC1 与全长AGL24 蛋白存在互作关系[57],进一步发现Histone deacetylase 9 (HDA9)蛋白不能直接与SOC1、AGL24 蛋白互作,但可以结合在SOC1与AGL24启动子上[58]。张俊利进一步构建HDA9 的氨基酸突变体,发现HDA9D172A、HDA9H174A和HDA9D261A与SOC1、AGL24启动子的结合强度均显著减弱。可见芥菜HDA9 的第172、174 和261 这3 个活性位点在一定程度上调节它与开花整合子SOC1、AGL24的相互作用[59]。LFY和AP1是花分生组织特征基因,是影响花序发育的关键因子,这些基因的顺利表达不可逆转地赋予茎顶端从营养分生组织向花分生组织转变的能力;LFY和AP1发生功能突变时,花原基被叶芽特征的营养结构取代,无法发育成完整的花器官[60]。随着花分生组织的发育,LFY和AP1不仅通过调控花器官发育基因促进花器官发育,而且同时抑制AGL24和SOC1的表达,防止成花逆转和确定花分生组织和花器官的同一性[60]。
3 总结与展望
SOC1调控植物开花诱导的过程受多个基因共同作用,将上游的作用信号汇集于此。本文总结了与SOC1互作调控植物开花时间的上下游基因,主要包括CO、FT、FLC、SVP、DELLA 蛋白、AGL24及LFY,它们的作用机制研究的相对比较清晰。近些年关于营养信号(如硝酸盐和糖信号)调控SOC1表达的成果较多,但具体的分子机制还需进一步分析和探讨。本研究将提到的SOC1调控植物开花时间的分子作用通路归纳为图5。迄今关于SOC1调控植物开花仍有很多的问题亟待解决。首先,多个转录因子都可以结合在SOC1启动子区域,那在调控SOC1表达时如何确定某个基因占据主导地位?植物是如何权衡多个转录因子调节植物的开花时间?并不清楚。其次,调控SOC1表达的转录因子如FLC需要形成二聚体或者高阶复合物才能发挥其生物活性,多年的研究发现FLC 蛋白可与SVP 蛋白、MAFs 蛋白等发生物理作用形成二聚体或高阶复合物,但现在并不清楚FLC 聚合物具体包括几种蛋白,需要深入探讨。再次,目前并不清楚SOC1能否移动,集中研究SOC1在茎顶端分生组织调控植物的开花诱导过程,而叶片中的SOC1是否可以移动到茎尖需要进一步分析。而且,SOC1调控植物的花期已成为大家的共识,SOC1在不同的植物材料中表现出性状的多效性,可能是其下游靶基因不同或者是同一调控通路在不同的植物中分化出新的功能,且不同科属或者品种之间的开花调控网络可能存在差异,所以很有必要利用不同的植物材料进行SOC1的功能研究及其分子机理的探究。
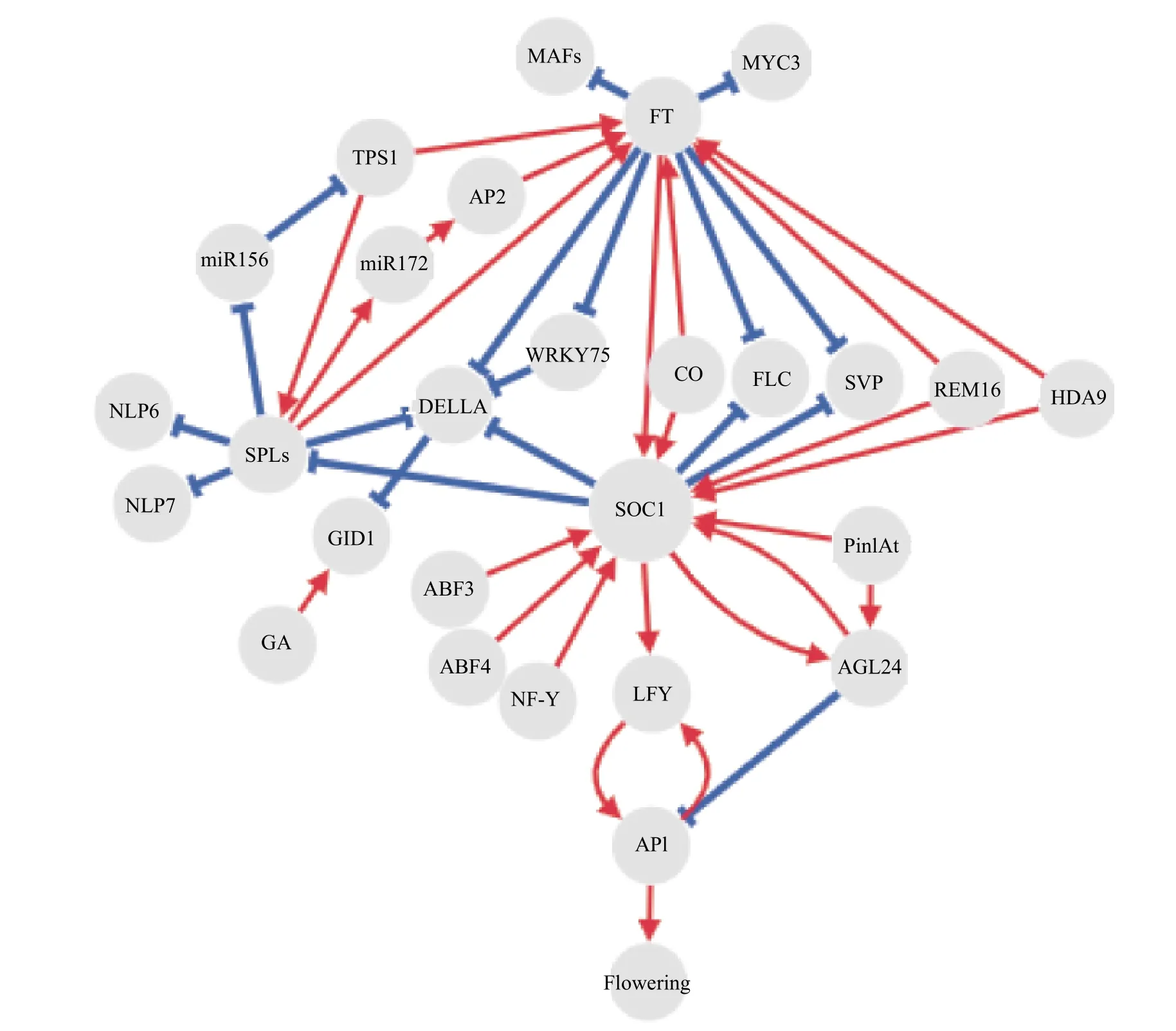
图5 SOC1 介导的花期调控网络Figure 5 Network of flowering time regulation mediated by SOC1

