棉属AADD异源四倍体后代筛选及性状鉴定
陈天,李昱樱,杨亚杰,候林慧,常永春,荣二花,吴玉香
(山西农业大学 农学院,山西 晋中 030801)
棉属(Gossypium)有52个种(变种),其中47个为二倍体棉种(2n=2x=26),5个为异源四倍体棉种(2n=4x=52)[1]。栽培种陆地棉(Gossypium hirsutum)和海岛棉(G. barbadense)为异源四倍体,是世界上最重要的经济作物之一。陆地棉因其产量高而在世界范围内广泛种植,海岛棉以其优良纤维品质而闻名,世界上90%以上的棉花纤维产量来自陆地棉和海岛棉,其长期以来主导棉花产量和贸易[2-3]。
自然界异源四倍体棉种基因组是由2个亚基因组组成,它们被命名为A和D,是在大约100~200万年前旧大陆A基因组祖先与新大陆D基因组祖先杂交然后染色体数目加倍形成。然而,关于棉属异源四倍体棉种A组的真正起源历史以及A组的分化程度还存在争议,异源四倍体棉种的供体种也一直是棉属进化研究的热点。自然条件下由于A、D组棉种之间的生殖隔离,A组和D组棉种很难杂交成功。仅有的报道如亚洲棉×雷蒙德氏棉[4]、亚洲棉×瑟伯氏棉[5]、亚洲棉×戴维逊氏棉[6-7]、亚洲棉×异常棉[8],以及本实验室前期合成的草棉×雷蒙德氏棉[2]等。目前,普遍认为二倍体物种草棉和雷蒙德氏棉是异源四倍体棉的祖先,因为它们和异源四倍体在分子水平上高度相似[9-11]。
实验室前期模拟自然界异源四倍体棉种形成过程,以A基因组的草棉作母本与D基因组的雷蒙德氏棉杂交获得杂种,对杂种植株进行秋水仙碱多倍体诱变,最后得到结铃的植株,目前已经获得了育性较为稳定的人工异源四倍体[12]。本研究旨在探讨伴随着杂交加倍的多倍体物种形成后的形态学和细胞遗传学变化规律,以及通过和陆地棉的SRAP分子标记比较,揭示人工选择对进化趋势的影响,为棉属异源四倍体棉种起源进化提供确凿证据,也为棉花种质创新提供新材料。
1 材料和方法
1.1 试验材料
本试验所用材料为前期远缘杂交及加倍合成的人工异源四倍体,具体合成过程为:以红星草棉为母本,野生雷蒙德氏棉为父本杂交获得杂种,并经形态学、细胞遗传学和分子标记鉴定远缘杂种为真杂种[2],然后采用嫁接繁殖获得大量杂种植株,对嫁接苗枝条进行秋水仙碱多倍体诱变,最后得到结铃的植株,收获种子S1,逐年种植并自交获得可育的人工异源四倍体S2代和S3代。本试验选用S2代和S3代植株以及亲本草棉为材料,并采用自然界异源四倍体陆地棉TM-1作对照。研究材料基本信息见表1。由于育种工作的艰辛和样本延续的实际困难,本研究中部分活体材料难以保存,存在父本部分数据缺失和其它样本重复数不足的问题。

表1 研究材料基本信息Table 1 Basic information of research materials
1.2 试验方法
1.2.1 人工异源四倍体的形态学鉴定
将亲本和获得的人工异源四倍体种子S2和S3同时在培养箱中育苗,出现2片真叶后移栽温室,盆栽种植,盆栽间距0.5 m。对杂种植株进行长势和形态性状观察,并和母本及陆地棉做比较,选取倒三叶至倒四叶且完全展开的叶片进行观察并测量分析,从形态学角度鉴定比较人工异源四倍体和亲本及陆地棉的差异,以及鉴定其本身的真实性。叶面积测量仪型号为YMJ-A。
1.2.2 流式细胞仪倍性检测
对多倍体后代植株进行流式细胞倍性检测,参照Doležel[13]的方法按以下步骤进行操作:(1)从温室取20 mg的新鲜嫩叶,洗净放在塑料培养皿的中心,加入1 mL裂解液。(2)立即用一次性手术刀片将嫩叶切碎,混匀数次。(3)用42 μm微孔过滤膜将混合液过滤至样品管中。(4)加入3倍滤液体积的DAPI染色液,冰上染色2 min。(5)将悬浮液引入流式细胞仪,对细胞核DNA相对荧光强度进行检测。(6)根据公式计算待测样品倍性,计算公式如下:
试验所用流式细胞仪型号为Partec CyFlow Space。
1.2.3 人工异源四倍体的细胞遗传学鉴定
(1)取材与固定:取新鲜长约2~4 mm幼蕾,剥去苞叶,水洗后浸泡在卡诺氏固定液(无水乙醇∶氯仿∶冰乙酸=5∶3∶2)24 h,转移至70%乙醇中于4 ℃保存备用。(2)制片:剥开固定好的花蕾,取4~5颗花药置于载玻片上,滴加适量卡宝品红染液,用解剖针轻挤压花药,使花粉母细胞逸出,去除可见杂质,盖上盖玻片,酒精灯微烤载玻片2 s,使内容物染色效果显著,最后将滤纸放在盖玻片上用拇指微压,吸走溢出染液。(3)镜检:将新制备的载玻片放置于显微镜下观察,统计500个以上清晰的花粉母细胞减数分裂行为并拍照,统计500个以上清晰的花粉粒并拍照。
1.2.4 SRAP分子标记鉴定
(1)选取草雷人工异源四倍体及草棉、陆地棉新鲜嫩叶为材料,用CTAB植物基因组DNA快速提取试剂盒(货号DL114-01,北京博迈德基因技术有限公司)提取DNA。(2)通过基于PCR的相关序列扩增多态性分子标记(Sequence-related am⁃plified polymorphism, SRAP)对提取的DNA样品进行多态性分析。SRAP-PCR反应体系:总体积10 μL,包 含5 μL 2×Taq PCR MasterMix(含 染料),2 μL ddH2O,1 μL正向引物,1 μL反向引物,1μL模板DNA(50 ng·μL-1)。(3)SRAP-PCR扩增程序:94 ℃预变性5 min;94 ℃变性45 s,35 ℃退火45 s,72 ℃延伸1 min,5个循环;94 ℃变性45 s,52 ℃退火45 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min;4 ℃保存。(4)电泳:向凝胶瓶中加入40 mL 8%非变性聚丙烯酰胺工作液、200 μL 10%过硫酸铵溶液、80 μL四甲基乙二胺,摇匀后灌胶,200 V电压下电泳100 min,随后用0.1%染色液银染30 min,显影至出现清晰条带后,置于显影仪上人工读带。SRAP引物参考Li等[14],序列信息见表2,由生物工程股份有限公司合成,试验所用PCR扩增仪型号为兰杰柯SCILOGEX梯度PCR扩增仪,电泳仪型号为北京君意JY300C型,显影仪型号为北京六一WD-9406型。

表2 SRAP引物序列信息Table 2 Sequence information of SRAP primers
1.3 数据统计分析
本研究使用Microsoft Excel和SPSS软件对所得数据进行统计分析,使用Origin 2019b软件作图。
2 结果与分析
2.1 人工异源四倍体形态学鉴定
本研究对母本草棉和人工异源四倍体植株形态进行观察比较(图1):母本草棉(图1A)植株整体为塔状,枝条紧凑,叶片多且密,叶色为深绿色。人工异源四倍体(图1B)植株整体为倒塔状,下部枝叶较少,多集中在植株中上部。

图1 人工异源四倍体和母本草棉植株形态比较Fig.1 Plant morphology comparison between artificial allotetra⁃ploid and G. herbaceum
对母本草棉、父本雷蒙德氏棉和人工异源四倍体S1、S2的叶片形状进行观察比较(图2):母本草棉叶裂在3~5裂左右,差异较大,中间3个裂片相比其它的大。父本雷蒙德氏棉为心型叶,无叶裂。草雷异源四倍体S1和S2叶片趋近母本,叶裂在5裂左右,裂刻深且窄。此外,人工异源四倍体叶片出现叶脉皱缩现象。S1、S2的叶片和陆地棉TM-1相比:大小较陆地棉小,裂片数较陆地棉多且裂刻较深,颜色较陆地棉深。对P1、P2及四倍体植株叶面积、叶形指数进行统计,结果显示人工异源四倍体与亲本在叶面积、叶形指数均存在极显著差异(表3),并且数值大小间于亲本之间(图3)。

图2 不同世代人工异源四倍体和亲本及陆地棉叶片形态比较Fig.2 Leaf morphology comparison between artificial allotetra⁃ploids of different generations, its parents and G. hirsutum TM-1
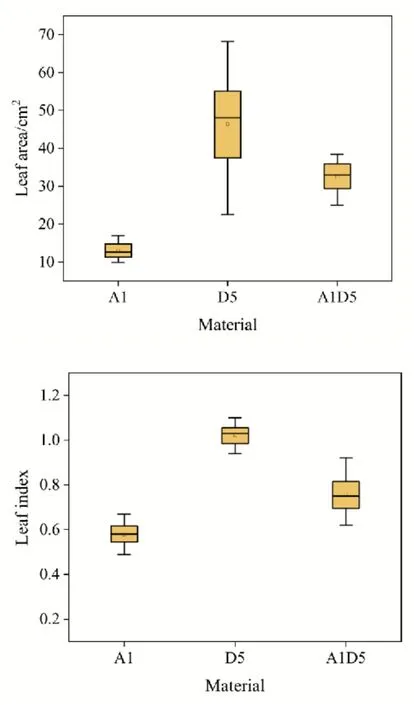
图3 叶面积、叶形指数在人工异源四倍体及亲本之间的变化趋势Fig.3 Trends of leaf area, leaf index between artificial allotetra⁃ploids and its parents

表3 人工异源四倍体和亲本叶片性状的差异显著性分析Table 3 Difference significance analysis of leaf traits between artificial allotetraploids and its parents
2.2 流式细胞倍性检测结果
以陆地棉TM-1做参照,用流式细胞技术检测人工异源四倍体植株的相对DNA含量,结果显示(表4,图4),TM-1的荧光峰值为215.94,所选4株S2-1、S2-2、S2-3、S2-4的 荧 光 峰 值 分 别 为246.43、232.39、195.52、232.21,所选1株S3荧光峰值为258.46。检测结果表明,所选5株人工异源四倍体S2代和S3代植株的荧光峰值与陆地棉TM-1接近,均为异源四倍体。同时可以看到多倍体后代不同单株间荧光强度差异较大,可能是由于在人工合成新多倍体的过程中,染色体组发生了复杂的重组,期间可能发生片段的丢失等去冗余的情况。
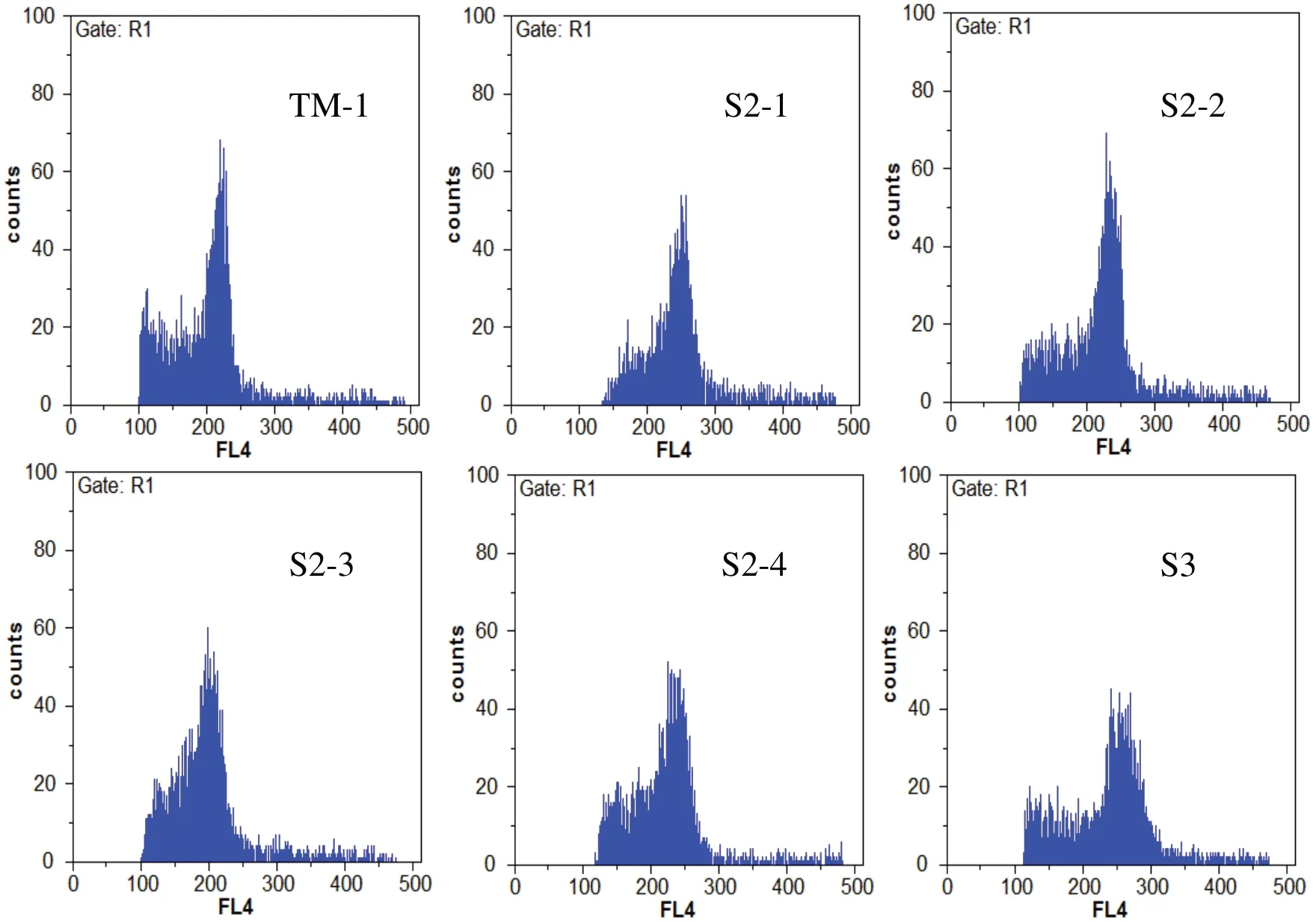
图4 不同世代人工异源四倍体流式细胞倍性检测结果Fig.4 Flow cytometry results for ploidy level in artificial allotetraploids of different generations
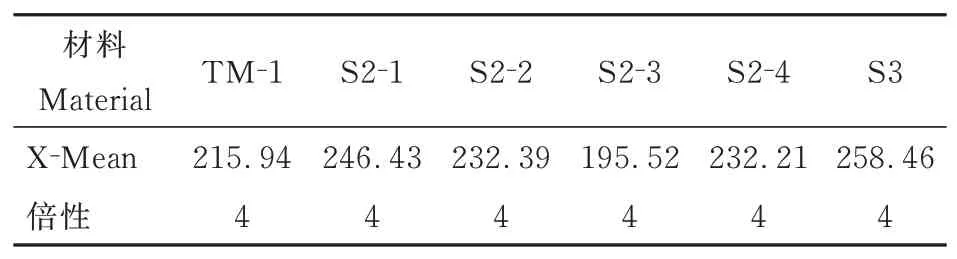
表4 不同世代人工异源四倍体流式细胞倍性检测结果Table 4 Flow cytometry results for ploidy level in artificial allotetraploids of different generations
2.3 人工异源四倍体细胞学鉴定
对陆地棉及亲本的花粉母细胞减数分裂行为进行观察,发现其减数第一次分裂和减数第二次分裂均正常,减数第二次分裂末期形成的四分体大小一致,分布均匀。对草雷人工异源四倍体S2和S3花粉母细胞减数分裂分别进行500次重复观察并进行统计。结果显示,S2和S3减数分裂都存在异常行为。主要表现在:在减数分裂末期既出现大小正常的单分体和二分体(图5A、图5B),也出现分裂不均等的四分体(图5C),异常减数分裂行为可能是第1次减数分裂前期同源染色体联会出现紊乱,多价体不均等分离造成;在四分体时期,会形成三分体到八分体等异常多分体(图5E~图5H),同时也会有正常四分体出现(图5D)。对观察结果进行统计(表5),S2正常四分体比例为23.4%,S3正常四分体比例为44.8%,高于S2,但远低于陆地棉。正常四分体和异常四分体都有可能发育成花粉粒,在研究中观察到了多种形态的花粉粒,如破裂的花粉粒(图6A),椭圆形花粉粒(图6B),发育不全的花粉粒(图6C),正常花粉粒(图6D)。对草雷人工异源四倍体S2和S3花粉粒形态分别进行500次重复观察并进行统计(表6),结果显示,S2正常花粉粒比例为55.4%,S3正常花粉粒比例为64.4%,高于S2。统计结果进一步表明人工异源四倍体的育性在逐代恢复,但还需要继续种植并自交进一步稳定和提高其育性。
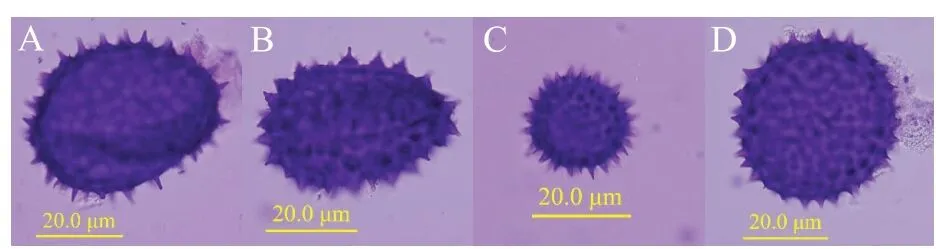
图6 人工异源四倍体花粉粒形态Fig.6 Pollen grain morphology for artificial allotetraploid
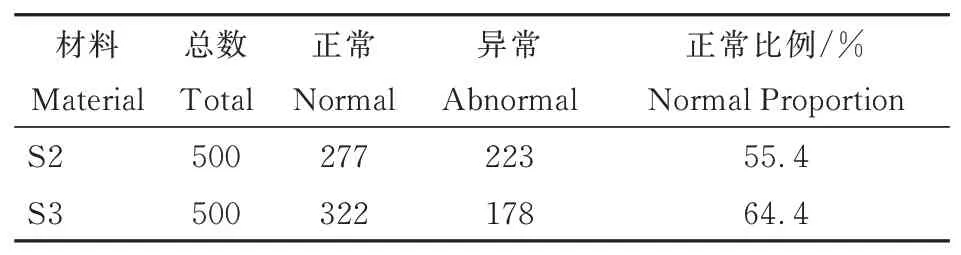
表6 人工异源四倍体花粉粒形态数量及比例Table 6 Number and proportion of pollen grain morpholo⁃gy for artificial allotetraploid
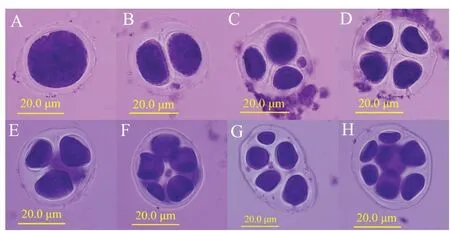
图5 人工异源四倍体花粉母细胞减数分裂行为Fig.5 Meiosis behavior of pollen mother cells for artificial allotetra⁃ploid
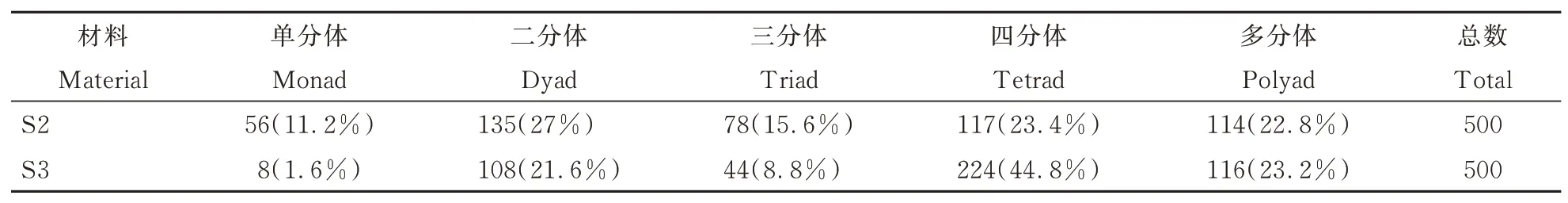
表5 人工异源四倍体减数分裂末Ⅱ多分体数量及比例Table 5 Number and proportion of polyad for artificial allotetraploid in telophase II of meiosis
2.4 SRAP分子标记鉴定
本研究对25对SRAP随机引物进行筛选,选出13对多态性好的引物应用于本试验。从扩增结果可知(表7),13对引物共扩增出106个清晰条带,平均每对引物扩增出8.15个条带,其中有57个多态性条带,单对引物多态性条带比例在22.22%~85.71%之间,平均每对引物多态性条带比例为44.60%。在引物Me4-Em2中不仅扩增出相同的条带,还扩增出特异性条带(图7左);在Me2-Em5中除了扩增出S2、S3共有的特异性条带,还扩增出S3独有的特异性条带(图7右)。对多态性条带进行分析(表8),人工异源四倍体有26个条带与陆地棉具有一致性,18个条带与母本草棉具有一致性,13个为特异性条带,其遗传比例分别为46%、31%、23%(图8)。分析结果表明,人工异源四倍体与陆地棉染色体组均为AADD,其基因组具有高度同源性,但新形成的异源四倍体与陆地棉分子水平存在差异,这也间接证明人工选择对陆地棉基因组进化产生的影响。下一步期望通过和陆地棉杂交,观察分析其是否存在生殖隔离以及对其杂种后代进行性状分析鉴定,进一步育成生产上有利用价值的新品种。
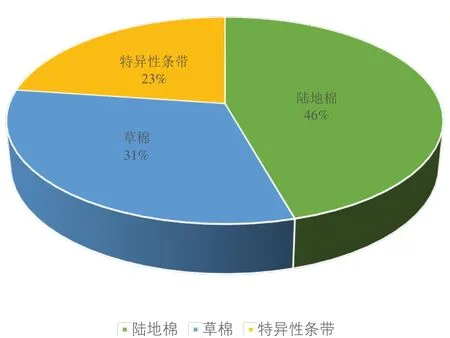
图8 人工异源四倍体的SRAP多态性分布Fig.8 The resources of SRAP polymorphism for artificial allotetra⁃ploid
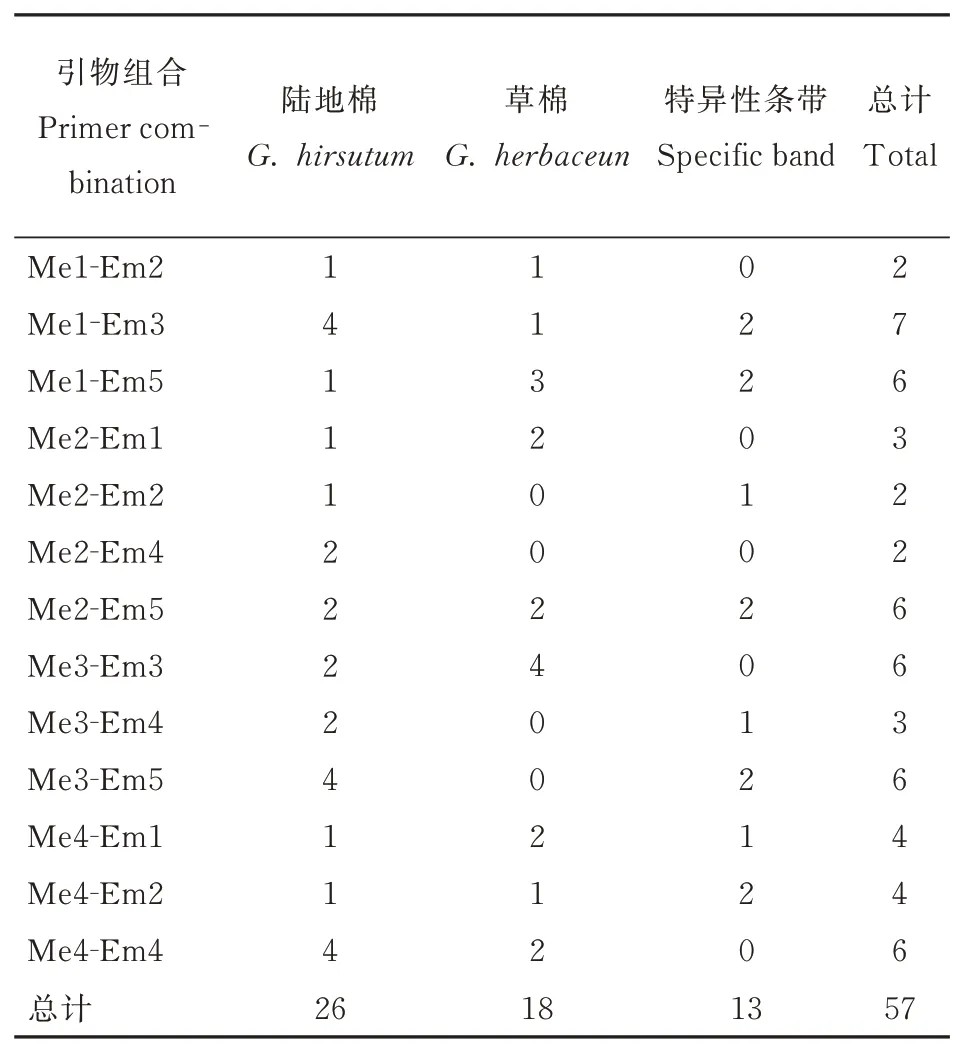
表8 草雷人工异源四倍体SRAP多态性分析Table 8 Analysis of SRAP polymorphisms for artificial al⁃lotetraploid
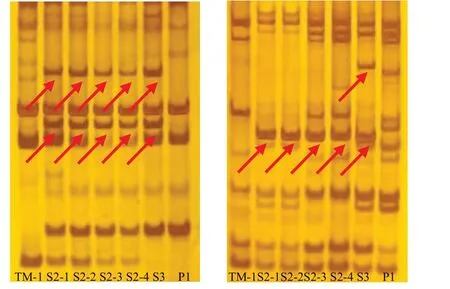
图7 SRAP引物扩增结果Fig.7 The results of SRAP primes
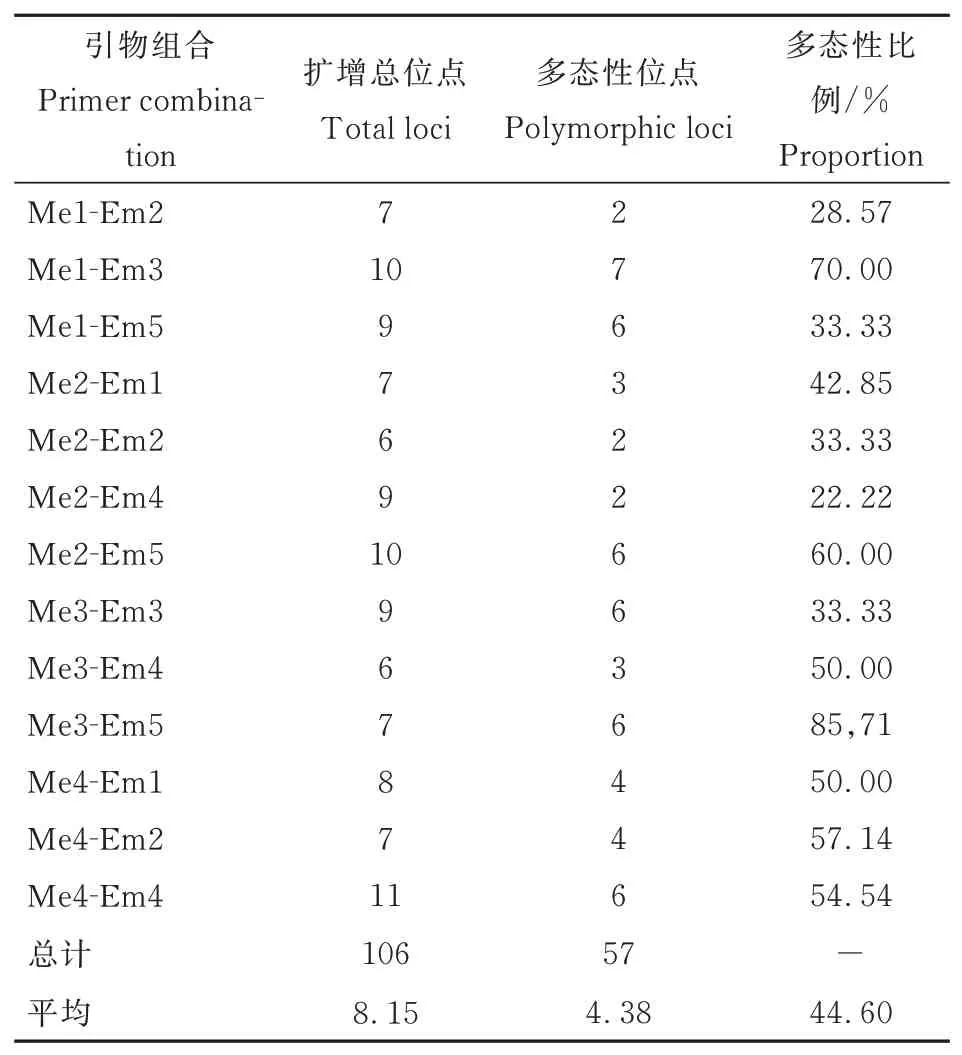
表7 13对SRAP引物扩增结果Table 7 The results of 13 pairs of SRAP primer
3 讨论
3.1 棉属多倍体起源与进化
多倍体化普遍发生在植物的进化过程中,是形成新物种的重要途径。棉花是研究植物多倍体化的一个重要类群[15],最初以细胞学为基础,通过分子系统学研究将二倍体棉种细分为A~G和K8个基因组[16]。大量证据表明,自然界5个四倍体棉花是异源多倍体,其中一个基因组类似于旧世界A基因组二倍体,另一个基因组类似于新世界的D基因组二倍体[17]。由于自然界异源四倍体的2个亲本基因组存在于不同半球的二倍体物种中,因此异源多倍体棉花是如何以及何时形成的问题已经引发了半个多世纪的讨论。有研究表明A1组的草棉和A2组的亚洲棉都可能是异源四倍体棉种A基因组的祖先供体种。Stephens等[18]最早采用遗传学和形态学证据表明A2是现存异源四倍体棉种的供体种;但Gerstel等[19]通过细胞遗传学研究坚持认为A1比A2更接近异源四倍体的供体种。吴玉香等[20]对草棉×雷蒙德氏棉、草棉×瑟伯氏棉、亚洲棉×雷蒙德氏棉、亚洲棉×瑟伯氏棉四个杂交组合分析发现,D组雷蒙德氏棉与A1、A2杂交都能成功产生杂种后代,验证了雷蒙德氏棉作为D基因组供体种。A和D两个基因组在棉属进化的早期大约700~1100万年前曾各自经历了单独进化,约100~200万年前发生了旧世界棉种A染色体组供体种和新世界D染色体组供体种的杂交,随后经历了杂种染色体加倍形成了异源四倍体,接着新形成的异源四倍体经历了上千年亚基因组的不对称选择和进化[21]。最近几年,一批人工合成的棉花多倍体已经报道出来。Liu等[22]以A组草棉和G组澳洲棉为亲本杂交再加倍获得异源多倍体植株(基因组AAGG);申状状等[23]对栽培种陆地棉和野生种斯特提棉的杂种后代及多倍体后代(基因组AADDCC)进行陆地棉有参转录组测序,分析了三倍体杂种植株及异源六倍体植株与两亲本的基因表达水平;杨亚杰等[24]对草棉进行染色体加倍,经流式细胞倍性检测和细胞学鉴定,获得了草棉三倍体和同源四倍体植株,并成功收获多倍体种子。本研究获得的草雷人工异源四倍体基因组为AADD,与陆地棉基因组一致,为棉属远缘杂交种质创新及基因组进化提供了新思路。
3.2 新合成人工异源四倍体的应用前景
棉属种间杂种后代遗传变异非常丰富,通过人工远缘杂交使得培育出具有野生种质资源优势的可栽培棉种成为可能。聂以春等[25]成功将亚洲棉和司笃克氏棉杂交及加倍获得异源四倍体杂种(基因组A2A2E1E1),经过十二代自交培育出结铃率高、农艺性状优良的新棉花种质资源。本研究以草棉为母本,雷蒙德氏棉为父本进行远缘杂交,得到AD远缘杂种和人工异源四倍体AADD,并从形态学和分子水平进行了杂种鉴定,分子水平表明杂种中既有父母本的条带又存在新条带,说明亲本染色体进行了遗传重组[2]。人工异源四倍体基因组和陆地棉一致,流式细胞结果显示,所选多倍体植株荧光峰值与陆地棉接近,均为异源四倍体。分子鉴定结果显示:在多态性条带中,异源四倍体植株有26个条带与陆地棉具有一致性,细胞学鉴定结果显示:S3代比S2代有较高的育性,表明人工异源四倍体植株育性在逐代恢复。由于草棉与雷蒙德氏棉亲缘关系远,杂种一代在减数分裂时,染色体无法正常配对[2],在对其进行秋水仙碱加倍处理后,可配对的同源染色体增多,育性有所恢复,但还需要继续对其进行性状观察,并进一步恢复其育性,未来期望通过和陆地棉杂交,观察分析其是否存在生殖隔离以及对其杂种后代进行性状分析鉴定,进一步育成生产上有利用价值的新品种。下一步也将对所获得的AD远缘杂种、人工合成的异源四倍体棉种及其参考物种陆地棉进行表观遗传研究,进一步阐明亲本基因组在杂种中的互作机理和表达模式,探讨伴随着杂交加倍后基因的表达变化和基因组进化趋势,为棉属异源四倍体棉种形成和起源进化及其基因表达调控提供最直观的分子遗传解析。
4 结论
本研究通过远缘杂交和加倍合成人工异源四倍体,并对其进行一系列鉴定分析。形态学鉴定结果表明人工异源四倍体性状间于2亲本之间,流式细胞检测结果表明其为异源四倍体,花粉母细胞减数分裂观察结果表明异源四倍体的育性在逐代恢复,SRAP分子标记结果表明人工异源四倍体出现了新条带,并且与陆地棉基因组具有同源性,本研究为探讨自然界棉属异源四倍体起源与进化提供了新思路,也为棉属种质创新提供了新材料。

