基于网络药理学的痰热清注射液治疗(COVID-19)机制研究
杨书彬,刘 莹, ,王 毅 ,刘子维 ,张海鸣,聂颖兰,孙 健*
(1.黑龙江中医药大学, 哈尔滨 150040;2.中国中医科学院 医学实验中心,道地药材国家重点实验室培育基地,北京 100700)
COVID-19作为一种新发传染病,传染性强,传播速度快,抗击疫情任务艰巨.目前,尚未发现治疗COVID-19的特效化学药,中药仍发挥着 “中流砥柱”的作用.虽已研制出相关疫苗,但新冠疫苗效力有限,如英国阿斯利康制药公司于2021年3月25日宣布,该公司的疫苗预防有症状新冠肺炎的效力为76%.而且,各国注射疫苗后感染COVID-19的案例,仍然时有发生,更有注射疫苗后猝死的报道.所以,中药治疗仍是全人类对抗疫情的重要选择.
痰热清注射液治疗新冠肺炎的机制具有较高的研究价值,该注射液由黄芩、熊胆粉、金银花等中药组成,主要用于细菌或病毒引起的急慢性支气管炎、肺炎及上呼吸道感染疾病的治疗[1].国家卫生健康委和国家中医药管理局联合发布8版《新型冠状病毒肺炎诊疗方案》,痰热清注射液被该方案(第6版至第8版)列为临床治疗期重型和危重型COVID-19的推荐用药[2-4].基于临床证实痰热清注射液是抗击COVID-19的有效药物,其作用机制具有较高的研究价值.
本课题组在前期痰热清注射液成分研究的基础上,通过收集痰热清注射液活性成分的靶点信息,采用网络药理学与分子对接方法构建“痰热清注射液成分-靶点- COVID-19疾病”网络,并探究痰热清防治COVID-19的作用机制,为该药更广泛地应用于临床防治COVID-19提供理论依据.
1 实验内容
1.1 痰热清注射液作用靶点的获取
通过课题组前期实验,检测到痰热清注射液中 22个成分,可以在大鼠体内稳定存在1 h以上,通过Swiss Target Prediction、SEA、以及Stitch数据库,获得痰热清注射液作用靶点信息.
1.2 COVID-19 疾病靶点的收集
以“Novel coronavirus pneumonia”为关键词检索 GeneCards(https://www.genecards.org/)与DRUGBANK(https://www.drugbank.ca/)数据库,收集与 COVID-19 相关的作用靶点.
1.3 构建 PPI 网络及核心靶点筛选
将疾病靶点与药物靶点上传至 STRING10.5软件(http://string db.org),种属选择为“Homosapiens”,参数保持默认设置,获取 PPI 网络.将上述两部分靶点,输入 Cytoscape3.6.1 软件构建交集靶点网络.
1.4 构建药物-活性成分-靶点网络图
将中药及其活性成分,药物与疾病共同靶点,输入Cytoscape3.6.1 软件,构建痰热清注射液-活性成分-靶点-COVID-19 关系网络图并进行分析,明确其相互作用关系.
1.5 GO 分析及 KEGG 分析
使用DAVID数据库进行 GO 功能分析和 KEGG 富集分析,利用Cytoscape软件构建痰热清注射液主要活性成分作用于COVID-19 疾病的靶点网络 .两者构建PPI网络并以degree值大于二倍中位数为原则筛选出核心靶点后,对核心靶点进行富集.将富集结果按照P值由小到大排序,筛选出 GO 富集分析出的较核心条目以及 KEGG 富集的较核心信号通路并将其可视化.
1.6 成分-靶点分子对接
为了支撑预测的可靠性,进行分子对接.分子对接以药材中主要活性成分与作为抗SARS-COV的有效药物瑞德西韦(Remdesivir)为配体,以新型冠状病毒3CL水解酶、SARS-PLpro抑制剂和血管紧张素转化酶Ⅱ为受体,利用 SYBYL-X 2.0软件Surflexdock模块进行分子对接,对接的结果以打分函数 Total Score给出,以mol2格式保存.利用SYBYI分子对接模块的 Total Score打分函数对配体分子进行筛选, Total Score打分函数综合考虑了极性作用、疏水作用、焓和熔剂化等因素,该值越大,对接复合物越稳定,说明小分子化合物与大分子蛋白质的匹配结合作用越好,并将打分最高的两个活性成分进行可视化.
2 实验结果
2.1 筛选痰热清注射液成分及靶点
通过Swiss Target Prediction、SEA、以及Stitch数据库筛选后获得149个痰热清注射液有效成分的作用靶点.
2.2 新型冠状病毒肺炎的相关靶点
以“Novel coronavirus pneumonia”为关键词,通过 GenCards和DRUGBANK数据库检索 COVID-19 的相关靶点,共得到439个 COVID-19 的相关靶点.
2.3 药物-活性成分-靶点网络图
利用 Cytoscape3.6.1 构建痰热清注射液药材-活性成分-靶点网络.其中每个节点(node)代表作用成分及作用靶点,作用成分与作用靶点的连接(边,edge)则代表这些靶点之间的相互作用,节点的度值(degree)代表网络中节点与节点相连的数目.获取到痰热清—活性成分—COVID-19—靶基因调控网络的可视化图片,见图1,其中包含 92 个节点,246 条边.
2.4 痰热清蛋白-蛋白相互作用网络图(PPI)
采用STRING10.5平台(http://string db.org),种属选择为“Homosapiens”,参数保持默认设置,获取 PPI 网络.痰热清注射液中化合物共筛选出直接靶点149个,PPI后间接靶点301个,共得到靶点450个.COVID-19 的相关靶点共得到439个,PPI后间接靶点1069个,共得到靶点1508个.导入 Cytoscape3.7.2 绘制核心靶点网络.以degree值大于二倍中位数为卡值,选取卡值以上的节点为核心靶点,经过对两个PPI网络取交集共获得了80个核心靶点,圆节点代表蛋白靶点,圆点大小及颜色代表靶点蛋白相互作用的紧密程度(如图2).

图1 痰热清中药材-活性成分-COVID-19 相关靶基因网络图Figure 1 Network diagram of target genes related to COVID-19 in Tanreqing, a traditional Chinese medicine
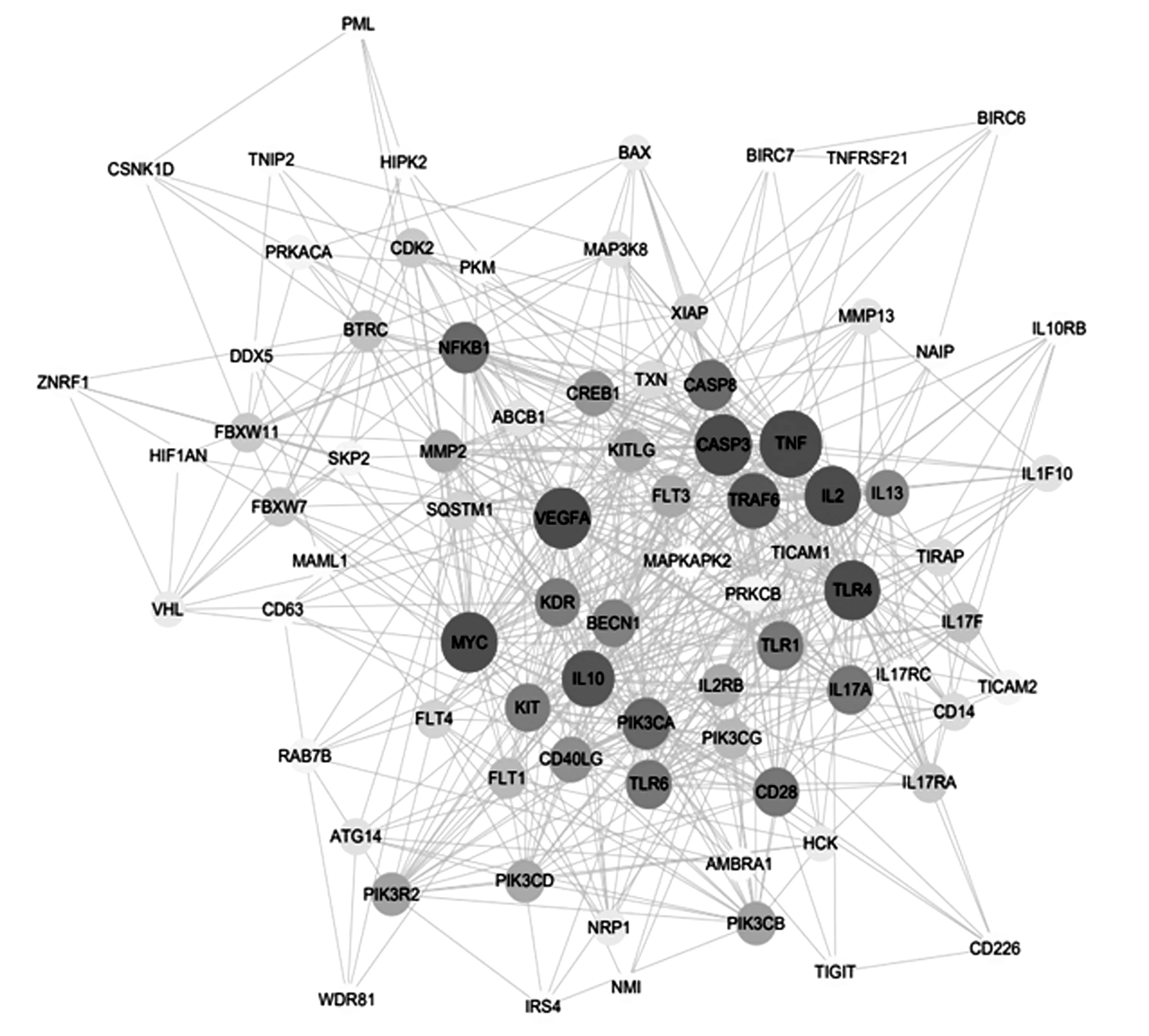
图2 核心靶点网络图Figure 2 Core target network diagram
2.5 GO 富集分析及 KEGG 通路富集分析结果
将得到的核心靶点输入 DAVID 6.8 中,进行 GO 生物过程和 KEGG 信号通路富集分析,对PPI后取交集得到的80个关键靶点进行GO功能富集和 KEGG 通路富集分析,最终得到GO 生物过程166条、KEGG 信号通路105条.对富集结果按照P值由小到大排序,进行数据可视化处理,见图3、4. 将富集出重要通路及靶点进行可视化处理,见表5.

图3 GO-生物过程富集分析Figure 3 Enrichment analysis of GO-biological processes

图4 KEGG信号通路饼状图Figure 4 Pie chart of KEGG signaling pathway

表1 KEGG信号通路-靶点表
2.6 分子对接结果
将痰热清注射液中的血中活性成分与血管紧张素转化酶Ⅱ, (PDB ID∶1R42)、 SARS-CoV-2 3CL 水解酶(PDB ID: 6LU7)和SARS-PLpro抑制剂(PDB ID∶3e9s)进行分子对接实验.采用SYBYL-X软件进行加氢,计算电荷,添加原子等操作.分子对接结果显示, 与瑞德西韦(阳性对照药)相比较,异绿原酸A、新绿原酸、异绿原酸C均能较好的与 ACE2、SARS-CoV-2、 3Cl PRO结合.将与3个受体蛋白结合较好的两个活性成分进行可视化处理,结合残基如图. 见图5~10.

图5 SARS-PLpro与异绿原酸A对接结构图Figure 5 Joint structure diagram of SARS-PLPRO and isochlorogenic acid A
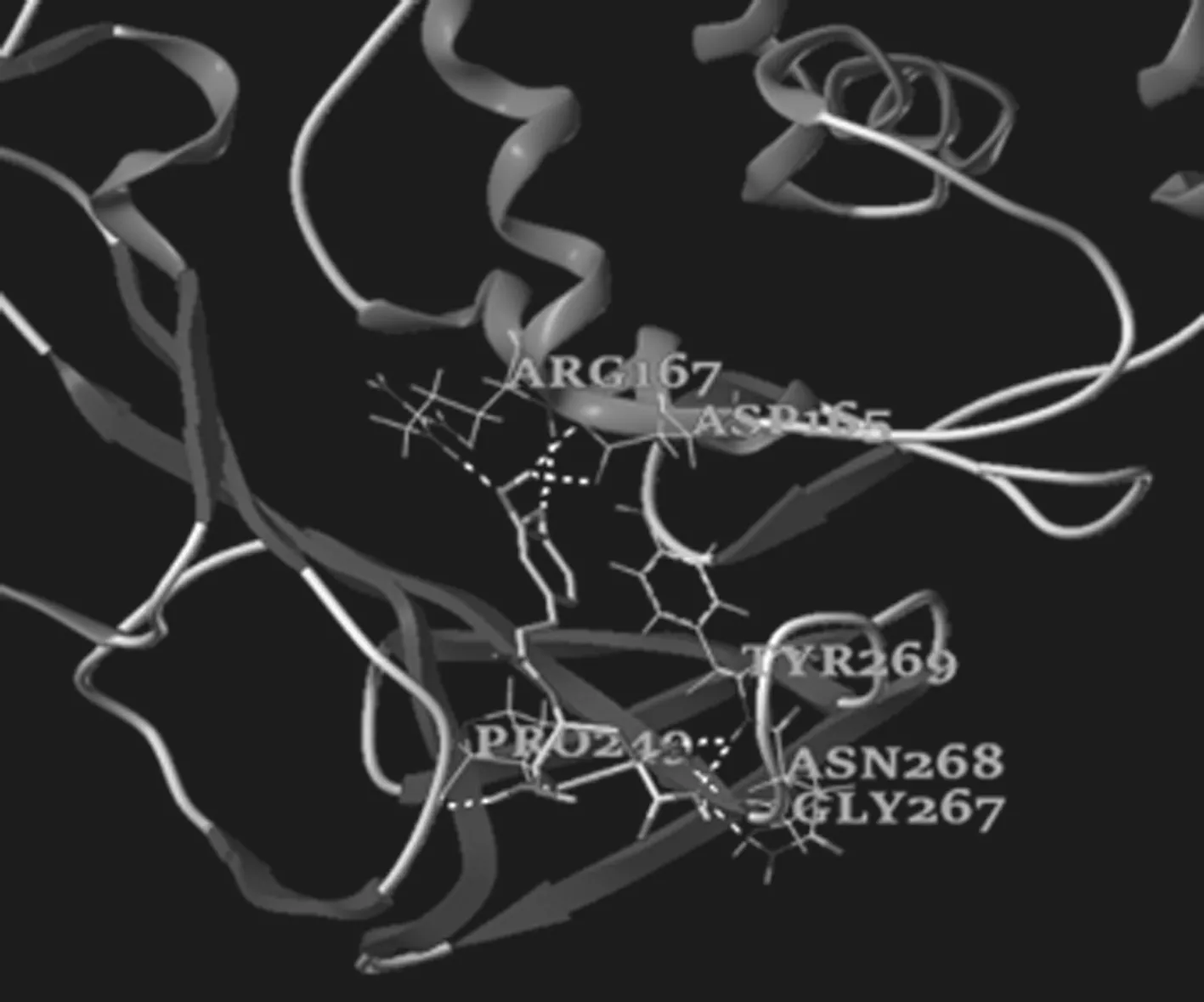
图6 SARS-PLpro与新绿原酸对接结构图Figure 6 Joint structure diagram of SARS-PLPRO and neochlorogenic acid

图7 SARS-CoV-2 3ClPRO与异绿原酸A对接结构图Figure 7 Joint structure diagram of SARS-CoV-2 3CLPRO and isochlorogenic acid A
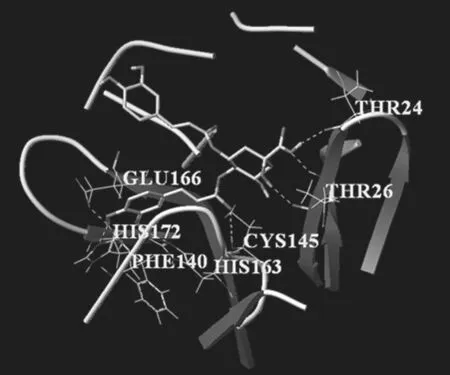
图8 ACE2与异绿原酸A对接结构图Figure 8 Butt structure diagram of ACE2 and isochlorogenic acid A

图9 ACE2与异绿原酸C对接结构图Figure 9 Butt structure diagram of ACE2 and isochlorogenic acid C

图10 SARS-CoV-2 3ClPRO与异绿原酸C对接结构图Figure 10 Docking structure diagram of SARS-CoV-23 CLPRO and isochlorogenic acid C
3 讨 论
痰热清注射液具有清热、化痰、解毒等功效,可用于痰热阻肺证[5],被《新型冠状病毒肺炎诊疗方案》(第6版至第8版)列为临床治疗期重型和危重型COVID-19的推荐用药,其以中药复方多成分,多靶点的优势,凸显了痰热清注射液在治疗新冠肺炎中的重要作用.本研究主要利用网络药理学对痰热清注射液的药效成分,靶基因及通路等进行相关探析,发现痰热清注射液可以通过抑制COVID-19对机体的入侵感染、抑制“炎症风暴”、免疫调节、控制凋亡等多个方式发挥治疗COVID-19的作用.
痰热清注射液可以抑制COVID-19对机体的感染.SARS-COV-2以血管紧张素转化酶Ⅱ(ACE2)为受体,进入宿主细胞后,翻译的多聚蛋白经3-糜蛋白酶样蛋白酶(3CLpro)和木瓜蛋白酶样蛋白酶(PLpro)水解切割,释放较小的功能性蛋白质,导致细胞因子释放及肺部炎症[6-7].经分子对接实验发现,痰热清中异绿原酸A、新绿原酸、异绿原酸C等核心成分与新冠病毒入侵机体的靶蛋白对接情况良好,与瑞德西韦的结合能接近,表明痰热清注射液可能对 COVID-19有良好的阻滞作用.
痰热清注射液可以作用于PI3K、TNF、Jak-STAT、NFκB、NOD 样受体等信号通路,抑制“炎症风暴”,从而发挥治疗COVID-19的作用[8-11].有研究报道“炎症风暴”是COVID-19患者由轻症转重症的重要原因,也是患者死亡的原因[12-14].由KEGG通路富集分析显示,痰热清主要通过 PIK3CA、PIK3CB、PIK3CG、PIK3CD、PIK3R2、CASP3、CASP8、TNF、NFKB1、MYC、IL2、IL10、VEGFA等靶基因发挥主要治疗作用.其中,PIK3CA、PIK3CB、PIK3CD是ⅠA型磷脂酰肌醇3激酶(PI3K)的亚型,而PIK3CG(p110y)属于IB型PI3KS亚型,主要在免疫细胞中表达. PIK3CA、PIK3CB、PIK3CG、PIK3CD、PIK3R2五个靶基因与MYC、NFKB1作用于PIK3K-Akt通路、联合CASP3、TNF、NFKB1介导TNF通路,联合MYC启动Jak-STAT通路,与TRAF6、TNF、NFKB1同时参与NFκB通路.PI3K-Akt信号通路通过调控炎症反应细胞的激活和炎症递质的释放在肺和气道的慢性炎症中发挥作用,JAK-STAT通路的激活已被证明能刺激IL-6和其他炎症细胞因子的产生,而这些细胞因子又可以吸引大批免疫细胞到感染部位,以协调对受感染细胞的破坏TNF与巨噬细胞/单核细胞在急性炎症过程中产生炎症细胞因子有关,在抵抗感染中起关键作用;TNF信号通路是通过对细胞因子、趋化因子、细胞黏附因子等的表达发挥其作用,是参与免疫和炎症反应的主要通路之一.活化的NFκB转录因子作为一种“快速作用”的转录因子,调节参与慢性炎症反应症状,痰热清中有效成分也可通过调节ToLL样受体通路、阻止NFκB磷酸化释放进入细胞核,调控TNF-a、L-6、L-13等炎症因子的转录,减轻炎症症状在炎症反应中.NOD 样受体是一类新型胞浆内的固有免疫模式识别受体,能够识别各种危险信号,释放细胞因子,诱导炎症细胞的活化,从而引起炎症反应,参与多种肺部疾病的发生发展[15].
痰热清注射液可以通过免疫调节的方式,发挥治疗COVID-19的作用.免疫调节在抗击SARS-CoV-2病毒中也尤为重要,SARS-CoV-2感染后导致强烈的炎症免疫反应,机体免疫系统被某些因素异常激活,炎性细胞因子急剧升体免疫系统失调,出现全身炎症免疫反应、多器官功能衰竭等临床表现的综合征.研究表明,MAPK级联是调节宿主对感染免疫应答的关键信号通路[16],是痰热清注射液抗病毒功能的潜在机制的一部分,被PIK3CA、PIK3CB、PIK3CG、PIK3CD、PIK3R2五个靶基因与PRKCB、MYC、CASP3、TNF、NFKB1联合启动;Toll样受体也具有免疫病原模式识别受体,可识别激活天然免疫系统来抵抗病原微生物的入侵,干预病毒入侵后机体免疫功能失调的状态.
细胞凋亡率COVID-19致病性也有直接关系.痰热清中有效成分可以通过抑制机体的NF-κB 活化[17],维护病原体侵染细胞的正常凋亡[18].CASP8(Caspase-8)是细胞凋亡的起始者,几乎能激活所有凋亡级联反应下游的Caspase而诱发凋亡[19].CASP8联合TNF与其他关键靶点,共同介导Toll样受体通路及细胞凋亡通路.PIK3CA、PIK3CB、PIK3CG、PIK3CD、PIK3R2协同RKCB、NFKB1激活HIF-1通路.研究发现HIF-1α通过调控血管生成、细胞凋亡等过程中发挥重要的生物学作用,故推测本方可能通过激活HIF-1α通路来帮助受损细胞正常凋亡来控制疾病的蔓延[20-21].
综上所述,本研究应用网络药理学和分子对接的方法,探究了痰热清注射液治疗COVID-19的作用机制,证实了痰热清注射液通过抑制病毒入侵、抑制炎症介质,参与抵抗肺炎、调节细胞凋亡和调节免疫的功能,起到预防和治疗新型冠状病毒肺炎的作用.同时,研究中涉及化学成分和靶标仍需后续从细胞和分子层面进行实验研究,从而为痰热清治疗COVID-19的临床和基础研究提供支持.

