玉米氮状况相关生物标记物的筛选和应用
石习,宁丽华,葛敏,邬奇,赵涵
玉米氮状况相关生物标记物的筛选和应用
石习1,2,宁丽华2,葛敏2,邬奇2,赵涵1,2*
1南京农业大学农学院,南京 210014;2江苏省农业科学院种质资源与生物技术研究所/农业生物学省级重点实验室,南京 210014
【背景】RNA表达丰度作为一种生物标记物已广泛应用于临床诊断阶段,但在农业栽培中诊断作物营养状况的应用较少。【目的】挖掘和验证转录水平上可以作为生物标记物精确指示玉米氮营养状况的基因,指导精准施用氮肥。【方法】基于不同氮素处理的基因芯片和RNA-Seq数据,通过生物信息学和统计学方法初步筛选出基因表达丰度高度响应氮素处理的生物标记物候选基因;利用不同基因型、不同氮处理的玉米材料,通过荧光定量PCR方法和凯氏定氮法,进一步筛选氮响应生物标记物基因;并构建预测玉米氮状况的广义线性模型,准确指示玉米氮营养状况。【结果】首先初步筛选出10个表达水平较高的基因,且mRNA表达丰度高度响应氮素处理的生物标记物候选基因;利用不同氮素条件下种植的B73材料从10个候选基因中进一步筛选出8个在充足氮、限制氮处理后基因表达丰度存在显著差异的基因;随后选取遗传多样性丰富、生态区域广泛的26种自交系材料和4种杂交种材料进一步筛选,发现有4个基因表达独立于基因型,可以在不同基因型玉米材料中稳定表达;并且通过相关性分析发现,在充足氮和限制氮处理下,这4个基因表达丰度差异与穗位叶总氮含量差异具有显著相关性(2均大于0.6),表明这4个基因可以作为氮响应生物标记物进行实际应用;将4个氮响应生物标记物基因分别组合构建两基因、三基因、四基因线性模型,由(2)、(3)和(4)这三个基因构建的线性模型用于预测玉米植株氮状况的应用性最强,其函数关系为=1.143+0.0172-0.3023+0.0174;选取大田种植的6个杂交种材料对三基因模型预测功能进行验证,结果表明,三基因模型能够在大田环境中准确诊断玉米植株氮素营养状况。【结论】获得4个高度响应玉米氮状况的生物标记物基因,构建的三基因模型可以准确预测玉米氮素营养状况。该生物标记物的开发可以有效实时监测玉米植株氮状态,优化氮肥使用,从而实现成本最低时农作物产量的最大化。
玉米;生物标记物;氮素;穗位叶;总氮测定;广义线性模型
0 引言
【研究意义】玉米是中国重要的粮饲作物,其生长过程中对氮肥需求量极大。在农业生产中,为了获得更高的玉米产量,农民不断施用化肥[1]。此外,农民通常采用‘一炮轰’式施肥方式,即一次性投入大量肥料,不再追肥,这种施肥方式并未遵循玉米对氮肥需求的阶段性规律。研究表明,近年来,中国化肥投入和粮食产出极不相称,化肥施用量的增速远远超过粮食产量的增速,氮肥利用率直线下降[2]。过量施用氮肥并不能保证产量的持续增加,反而导致玉米品质下降、农民生产成本增加等问题,另外过量施用氮肥还会造成农田土壤大面积酸化[3]、水体富营养化、大量氮沉降[4]等环境问题。这些问题持续威胁着人类的健康和福祉。所以,如何科学施用氮肥、提高玉米氮肥利用率成为研究人员重点关注的问题。利用氮响应RNA生物标记物精确指示玉米氮素营养状况,指导农业工作者依据植株需求科学施用氮肥,对提高作物氮肥利用率,降低生产成本,减少氮肥施用对生态环境造成的污染等具有重要意义。【前人研究进展】精准施氮的管理决策取决于对作物氮素营养状况和土壤养分丰缺的精确评价。作物氮素营养状况诊断的方法有多种,但这些方法都存在一定的局限性。叶色、生长形态等作物外部形态诊断法[5]以其简单易行的优点,被广大农民广泛采用。但是该方法具有严重滞后性,不适合应用于农业生产,当农民观察到明显的缺氮现象时,作物的产量和品质已经受到严重影响。凯氏定氮法[6]是一种常用的化学方法,是国家及行业内对于植物全氮测定的标准方法,该方法结果准确,但是需要经过取样、清洗、杀青、烘干、研磨、称重、实验室分析等多道处理[7],试验操作繁琐耗时、破坏性强、危险性大,不能用于高通量测定。SPAD-502®ChlorophyⅡ Meter2作为一种无损、快速的诊断方法,被广泛应用于棉花[8]、水稻[9]、小麦[10]、玉米[11]、大麦[12]等多种作物氮素状况的测定领域。但是方法受到一些因素的限制,如叶位和基因型[13],同一材料的重复性较差,因此,需要多次测量取平均值作为其测定结果。光照能引起叶绿体的运动,测定SPAD值前光照强度的变化可能会改变同一份样品的测定结果[14]。以上方法存在诸多局限性,需要不断开发一些新的、可靠的诊断方法来准确、稳定、实时地诊断作物氮素营养状况,满足高通量测定的要求。转录组包含了生物体如何与环境相互作用的丰富信息,记录了基因表达随环境变化的变化。来自不同病毒和细菌感染的血液转录组显示,宿主对病毒和细菌感染的反应是不同的[15]。以这些差异表达的基因为出发点,在RNA水平上开发敏感、特异的基因表达生物标志物,以准确区分病毒性和细菌性感染,为临床诊断提供依据。目前RNA生物标记物已广泛应用于临床诊断领域,在农业栽培领域应用还较少,但也有成功应用。GWENAELLE等[16]以向日葵作为试验材料研究植物对干旱胁迫的转录反应,开发出3个与植物水分状况高度相关的基因,其表达独立于4个测试基因型和植物阶段(开花前和开花后)。Kenkel等[17]发现生物标记物基因表达变化的大小与热应激压力强度呈正比,可以通过基因表达生物标记物量化热胁迫珊瑚礁受损严重程度。【本研究切入点】RNA生物标记物能够动态反映细胞状态和调控过程,其表达水平相比DNA可以提供更多调控信息,比蛋白质生物标记物更加灵敏,在医学领域应用价值极高。但在农业栽培领域应用还较少,缺乏RNA生物标记物基因指示作物氮素营养状况的研究。玉米缺氮会严重影响玉米产量与品质,深入研究一组可以灵敏诊断玉米植株氮状况的RNA生物标记物基因,可以有效指示玉米精确施肥。【拟解决的关键问题】本研究利用不同氮素处理的基因芯片和RNA-Seq数据鉴定出一组高度响应玉米氮状况的生物标记物候选基因,通过荧光定量PCR的方法筛选出4个稳定表达且独立于材料基因型的基因,建立了指示玉米植株氮营养状况的诊断模型,并进行了田间验证。氮响应RNA生物标记物可以作为有效的农艺工具实时监测田间玉米植株的氮状况,精确指示农业工作者依据植株需求科学施肥,从而达到按需施肥、玉米高产高效的目的。
1 材料与方法
1.1 试验材料
温室试验:所用供试玉米(L.)品种为No.1—No.31,共31种玉米材料(电子附表1),其中,B73材料设置10组生物学重复,其他材料各设置3组生物学重复。于2020年5月至7月在江苏省农业科学院进行温室试验,玉米籽粒采用全营养土穴盘播种,三叶期(V3阶段)移栽于45 cm×30 cm×50 cm盆内。盆栽试验采用限制施氮量(全氮含量为0.7 g·kg-1)的大田土壤,连续5年未施用氮肥,pH为6.1—6.8。以0.4 g·kg-1氮肥(尿素)、0.12 g·kg-1磷肥(P2O5)和0.08 g·kg-1钾肥(K2O)为基肥。待植株生长至六叶期(V6阶段)时进行追肥处理,共设置2组氮素处理,追施0.6 g·kg-1尿素的充足氮处理(N1)和不增施氮肥的限制氮处理(N0)。
大田试验:所用供试玉米品种为No.32—No.37,共6种玉米杂交种材料(电子附表1),各设置10组生物学重复。于2021年5月至8月在江苏省农业科学院六合基地高低氮池中种植,玉米籽粒采用全营养土穴盘播种,V3期移栽到大田高氮池(sufficient nitrogen,SN)、低氮池(deficient nitrogen,DN)中。高氮池土壤全氮量为1.348 g·kg-1,低氮池土壤在每年种植玉米之前用水浸泡后搅拌机充分搅拌,以保证土壤养分均匀,土壤全氮量为0.798 g·kg-1。
1.2 氮响应生物标记物候选基因的初步筛选
从NCBI网站上下载获得(GSE32361[18])初步筛选氮响应生物标记物候选基因所使用的数据,该数据包括不同氮素处理下玉米材料DNA的基因芯片数据。(1)首先通过Microsoft Excel 2010对该数据进行简单数据过滤处理,将下载获得的强度值求导以2为底的对数值,并以Log2强度值>9.0为标准,筛选出基因表达强度较高的探针集;对同一探针充足氮处理与限制氮处理下的基因表达强度值进行检验分析,以<0.01作为显著差异标准,筛选出高度响应不同氮素处理的探针集;计算充足氮、限制氮处理下基因表达强度值差异倍数,并以基因表达强度值至少相差10倍为标准,进一步筛选出积极响应不同氮素处理的探针集。(2)将数据过滤获得的探针序列分别比对到B73基因组上,获得每条探针对应基因ID,去除重复基因;(3)对葛敏等[19]在足氮和低氮处理下B73材料基因表达RNA-Seq数据进行同样数据过滤,将芯片数据与RNA-Seq数据结果叠加,取在2组数据中基因表达水平均较高且充足氮、限制氮处理下基因表达差异显著的基因;(4)通过MAIZE GDB网站获得这些候选基因信息,根据基因在玉米植株各部位表达情况,筛选出在叶片中稳定表达的候选基因;作为氮响应生物标记物候选基因进行荧光定量PCR验证。
1.3 样品处理
在玉米生长至十二叶期(V12阶段)收集样品,共37个玉米品种,温室试验中B73材料有10组生物学重复,其他品种各3组生物学重复,大田试验中各玉米材料有10组生物学重复,取1/2片穗位叶样品,液氮研磨至粉末状,取1/4叶片粉末立刻冻存于-80℃备用,后续用于穗位叶RNA提取试验;其他3/4叶片粉末于105℃烘箱杀青30 min,再于65℃烘至恒重,过60目细筛,备用,后续用于凯氏定氮法叶片总氮含量测定试验。
1.4 叶片总氮含量的测定
玉米穗位叶组织样品按上述方法处理,称取处理后的样品0.05 g,用凯氏定氮法测定叶片总氮,记录滴定体积。利用以下公式计算叶片总氮含量:
全氮量(mg·g-1)=(V-V0)×c(1/2HCl)×14.0×10-3/m
式中,V:滴定试液时所用酸标准溶液的体积(L);V0:滴定空白时所用酸标准溶液的体积(L);c:0.01 mol·L-1(1/2HCl)标准溶液浓度;m:烘干叶片粉末的质量(g)。
1.5 氮响应生物标记物候选基因表达测定
提取粉末。使用Invitrogen TRIzol试剂(ThermoFisher公司)提取穗位叶RNA。使用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit试剂盒(TaKaRa公司)进行反转录反应,使用ChamQTMSYBR® qPCR Master Mix试剂盒(TaKaRa公司)进行qRT-PCR试验,按照试剂盒说明配制qRT-PCR反应混合液,使用7900 HT TagMan machine仪器(Applied Biosystems公司)按照两步法进行60°C退火温度和40个PCR循环的qRT-PCR反应。本研究所使用的引物如表1所示,其中NM11为内参引物,基因号为。
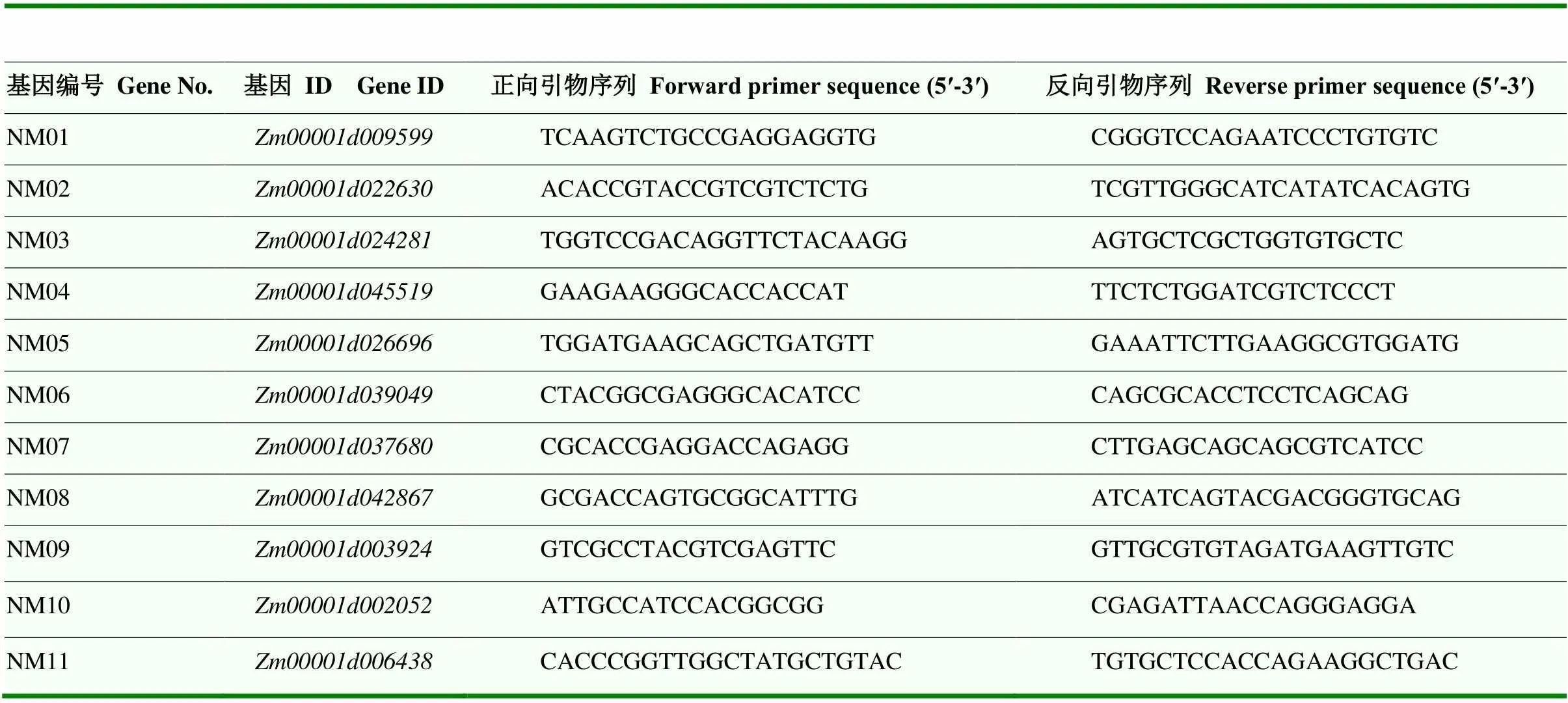
表1 本研究所用的引物序列
1.6 数据统计及分析
采用Microsoft Excel 2010对同一玉米材料在N0、N1 2种氮素处理下4个氮响应生物标记物基因表达丰度差异(N1﹕N0)与植株穗位叶总氮含量差异(N1﹕N0)进行相关性分析。以2>0.6,<0.01作为显著相关标准。
采用SPSS 20.0软件线性回归分析进行两基因、三基因、四基因广义线性模型的构建。
2 结果
2.1 初步筛选出10个氮响应生物标记物候选基因
采用多个数据过滤和处理步骤初步筛选氮响应生物标记物候选基因(表2)。首先进行数据过滤,以Log2强度值>9.0为标准,从84 246条探针中筛选出基因表达水平较高的11 891条探针;通过检验,以<0.01作为显著差异标准,筛选出6 632条充足氮处理与限制氮处理基因表达水平差异显著的探针;以充足氮、限制氮处理下基因表达强度值至少相差10倍为标准,进一步筛选出69条探针。将这些探针与B73基因组比对,获得基因ID,这69条探针分别代表63个不同基因;利用葛敏等[19]在足氮和低氮处理下B73材料基因表达RNA-Seq数据进行同样数据过滤,将芯片数据与RNA-Seq数据结果叠加,筛选出25个在2组数据中基因表达水平均较高且充足氮、限制氮处理后基因表达差异显著的基因;通过MAIZE GDB网站获得这些基因在玉米植株各部位表达情况,有10个基因在叶片中稳定表达且表达水平较高;将这10个基因作为生物标记物候选基因,进一步通过荧光定量PCR试验进行筛选。
2.2 筛选出8个候选基因高度响应氮素处理
为了验证这10个生物标记物候选基因在玉米穗位叶中高度响应氮素处理,选取玉米品种B73作为试验材料,进行充足氮(N1)、限制氮(N0)处理(图1-A和图1-B),在N1、N0处理下,B73材料表现出明显的表型差异,植株生长形态高度响应氮素处理,B73是一种氮敏感玉米材料。

表2 氮响应生物标记物候选基因的初步筛选
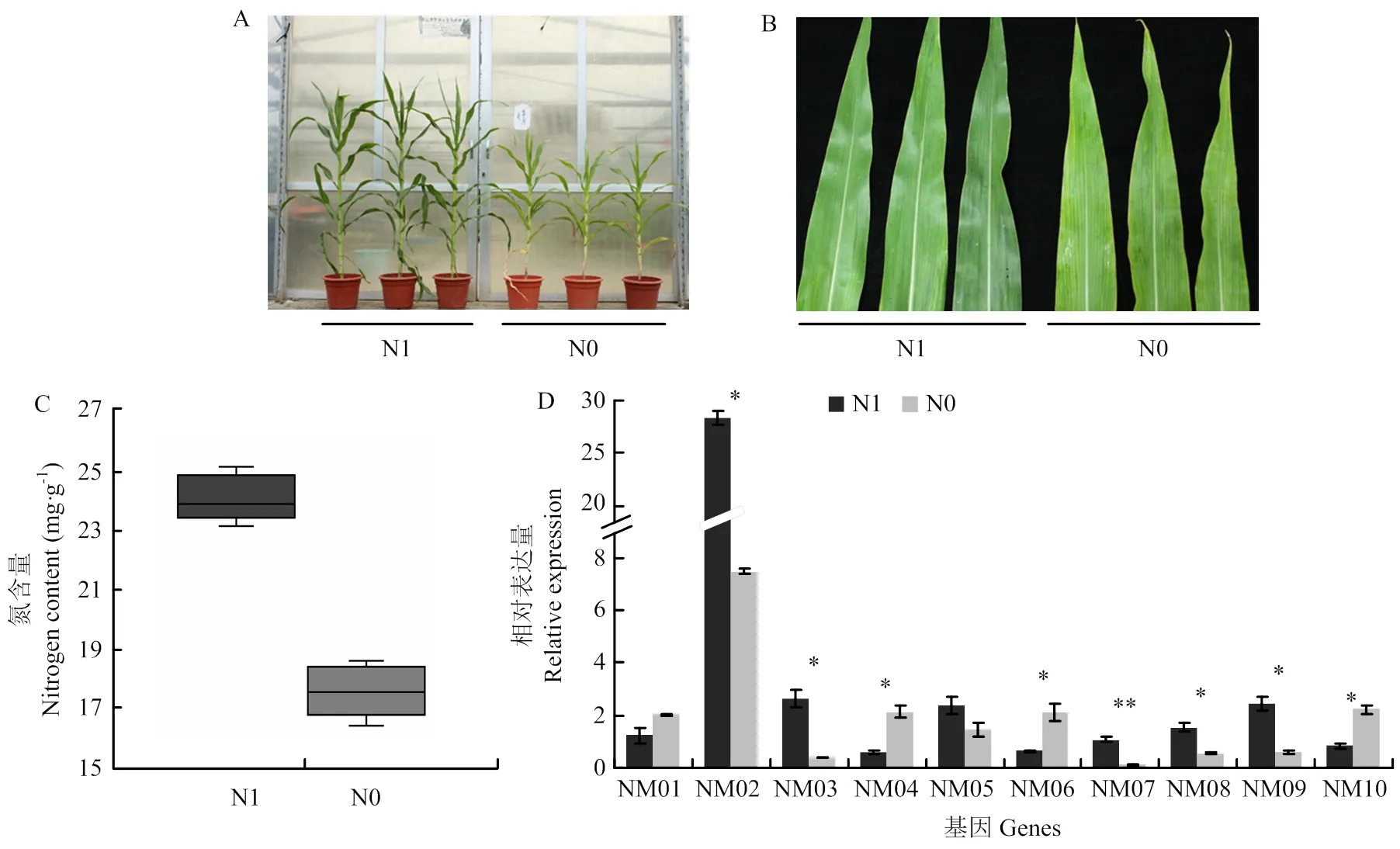
A、B:N1、N0氮素处理下B73株型差异;C:N1、N0氮素处理下B73总氮含量差异;D:N1、N0氮素处理下10个候选基因的表达情况
利用凯氏定氮法对B73材料穗位叶总氮含量进行测定,如图1-C所示,充足氮(N1)处理下叶片总氮量平均为24 mg·g-1,限制氮(N0)处理下叶片总氮量平均为17.5 mg·g-1,穗位叶总氮含量差异显著,充足氮处理B73总氮含量显著高于限制氮处理。
利用荧光定量PCR方法对10个生物标记物候选基因在玉米穗位叶中基因表达丰度变化进行检测(图1-D),在2种氮素(N1、N0)处理下,NM01、NM05基因表达丰度变化不显著,其他基因表达丰度变化均差异显著,并且在10组生物学重复B73材料中可以稳定表达。在N0处理后,NM02、NM03、NM07、NM08、NM09基因表达量下调,NM04、NM06、NM10基因表达量上调。根据以上结果筛选出8个基因在充足氮(N1)、限制氮(N0)处理下表达差异显著,并且可以稳定表达的生物标记物候选基因。
2.3 筛选出4个候选基因表达独立于基因型
为了确定这8个候选基因的表达是否独立于基因型,选取遗传多样性丰富、生态区域广泛的26种自交系材料和4种杂交种材料(电子附表1,材料No.2—No.31),进行相同充足氮(N1)、限制氮(N0)处理,进一步筛选这8个候选基因。V12阶段收集穗位叶进行RNA提取和荧光定量PCR试验(图2),在N1、N0处理后,(NM02)、(NM03)、(NM06)、(NM07)至少在25种材料中存在基因表达显著差异,与在B73材料中表达模式一致(图1-D,表3)。其他4个基因在30种供试材料中出现多种材料表达模式不一致,具有基因型依赖性。综上所述,进一步筛选出4个氮响应生物标记物候选基因,其基因表达独立于基因型,可以在不同基因型玉米材料中稳定表达(表3)。
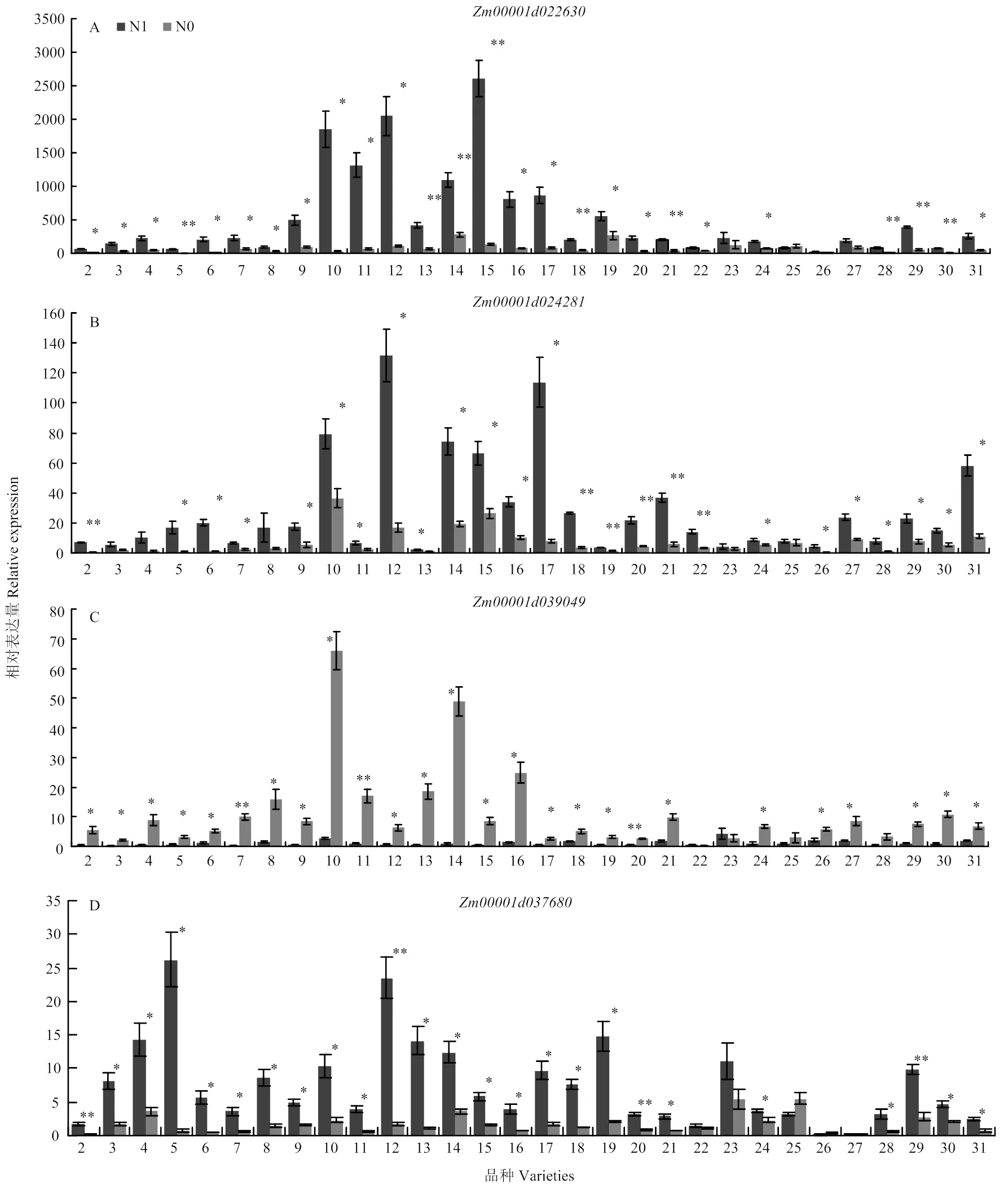
*:P<0.05;**:P<0.01。下同 *: P<0.05; **: P<0.01. The same as below
2.4 筛选的4个基因可以准确指示玉米氮营养状况
为了研究这4个候选基因的表达丰度能否准确指示玉米氮营养状况,利用凯氏定氮法对穗位叶实际总氮含量进行测定(图3-A),No.2—No.21、No.28— No.31材料在充足氮(N1)环境下穗位叶总氮含量显著高于限制氮(N0)环境,其他No.22—No.27材料的穗位叶总氮含量在N1和N0氮处理后差异不显著。
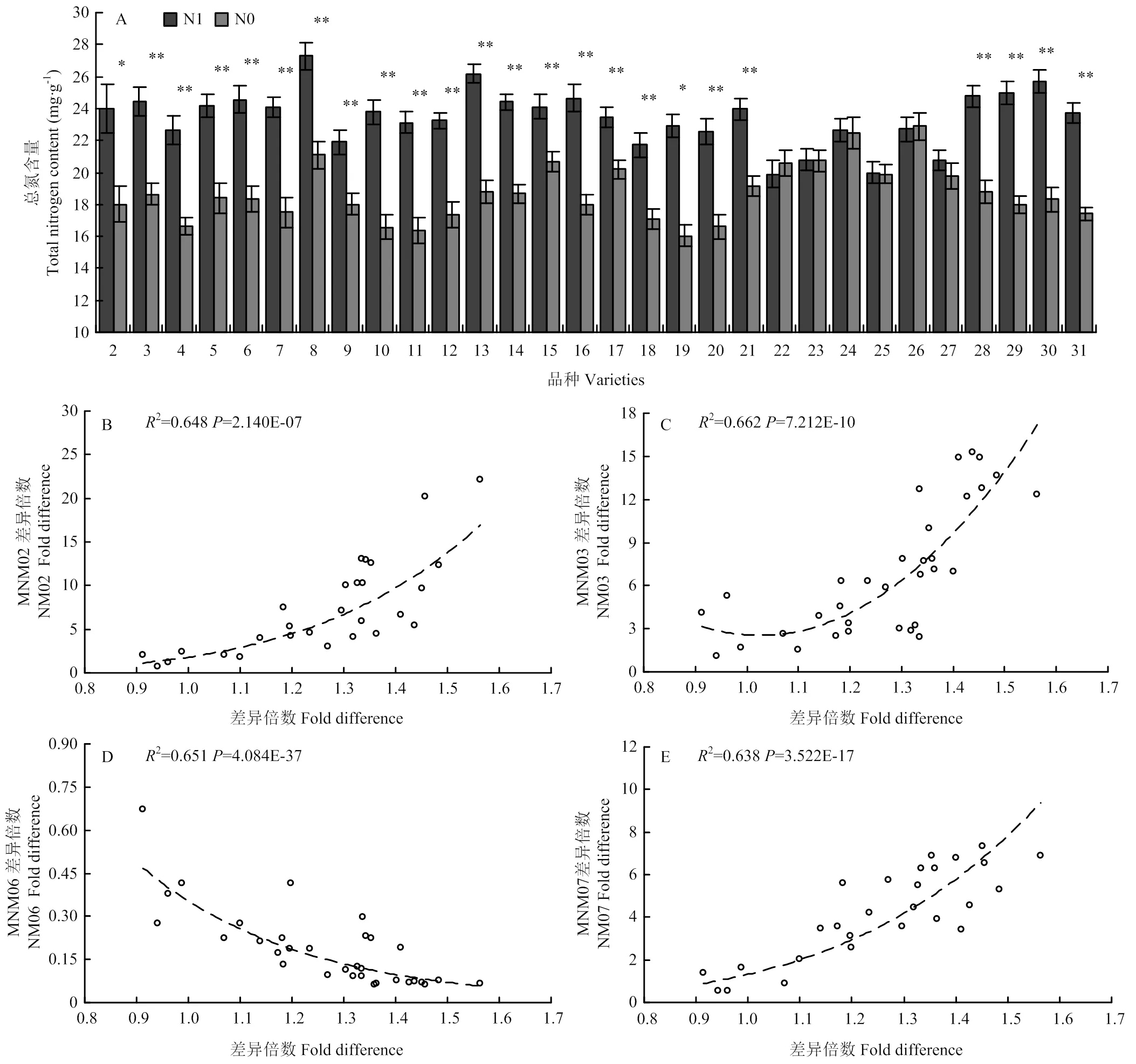
A:凯氏定氮法穗位叶总氮测定;B—E:NM02、NM03、NM06、NM07基因表达丰度变化与总氮含量变化的相关性分析

表3 4个生物标记物候选基因
为了确定在N1和N0处理后穗位叶实际总氮含量变化与生物标记物候选基因表达丰度变化是否具有相关性,对二者进行相关性分析(图3-B—图3-E),N1、N0处理后穗位叶总氮含量变化与生物标记物候选基因表达丰度变化均具有显著相关性,2为0.63—0.67,相关性模型多以乘幂和多项式为最佳。其中,NM02、NM03、NM07基因的表达丰度变化与总氮含量变化呈正相关,NM06基因呈负相关。相关性分析结果表明,这4个基因能够准确反映玉米植株氮素营养状况,且基因表达独立于基因型,可以作为氮响应生物标记物基因进行实际应用。
2.5 三基因模型预测玉米氮状况结果最佳
为了促进生物标志物的实际应用,利用NM02、NM03、NM06、NM07这4个氮响应生物标记物基因构建了两基因、三基因、四基因模型,用于预测玉米氮素状况。利用qRT-PCR试验数据和总氮含量数据构建模型,以郑58为对照材料,与其他材料进行比较(Fold difference=郑58/其他材料)。如图4所示,以郑58与其他材料的生物标记物基因表达差异比值为值(NM02(1)、NM03(2)、NM06(3)、NM07(4)),实际氮含量差异比值为值,利用SPSS2.0软件线性回归分析方法进行模型构建,分别获得两基因、三基因、四基因广义线性模型。
在两基因模型中,NM06(3)和NM07(4)构建的线性模型相关性最高,2为0.51。在三基因模型中,NM03(2)、NM06(3)和NM07(4)这三个基因构建的线性模型相关性最高,2为0.53。四基因模型与三基因模型相关性基本一致,均高于两基因模型。基于预测效果与测试成本考虑,三基因模型可以作为玉米氮素状况的最佳预测模型,应用于诊断玉米氮营养状况。两基因模型、三基因模型、四基因模型预测模型如图4所示,函数关系如表4所示。
2.6 三基因模型的实际应用
为了验证三基因模型是否可以有效应用到实际生产中,在V12阶段采集大田种植的6个杂交种材料穗位叶,通过荧光定量PCR试验,获得NM03、NM06、NM07 3个基因在转录水平的表达丰度,根据=1.143+0.0172-0.3023+0.0174函数关系,计算出值,=充足氮环境下郑58总氮含量/预测材料总氮含量,其中,郑58材料在充足氮环境下实际测得总氮含量为24.5 mg·g-1,限制氮环境下为18.7 mg·g-1(图3-A),可以计算出大田试验材料的预测氮含量(图5)。在高氮池(SN)中种植的材料预测穗位叶氮含量平均值在26.1 mg·kg-1,最小值在22.1 mg·kg-1,在低氮池(DN)中种植的材料预测穗位叶氮含量平均值在14.7 mg·kg-1,最大值在18.2 mg·kg-1。在大田高氮池(SN)和低氮池(DN)中种植的同一材料,穗位叶预测氮含量差异显著。以上结果表明,三基因模型可以准确预测出大田环境中玉米材料的氮状况,可以有效应用到实际生产中。
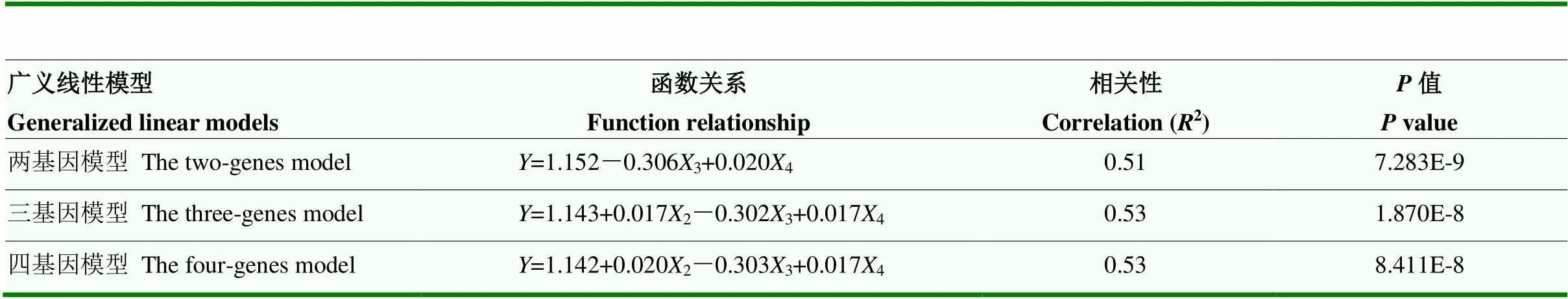
表4 模型函数关系
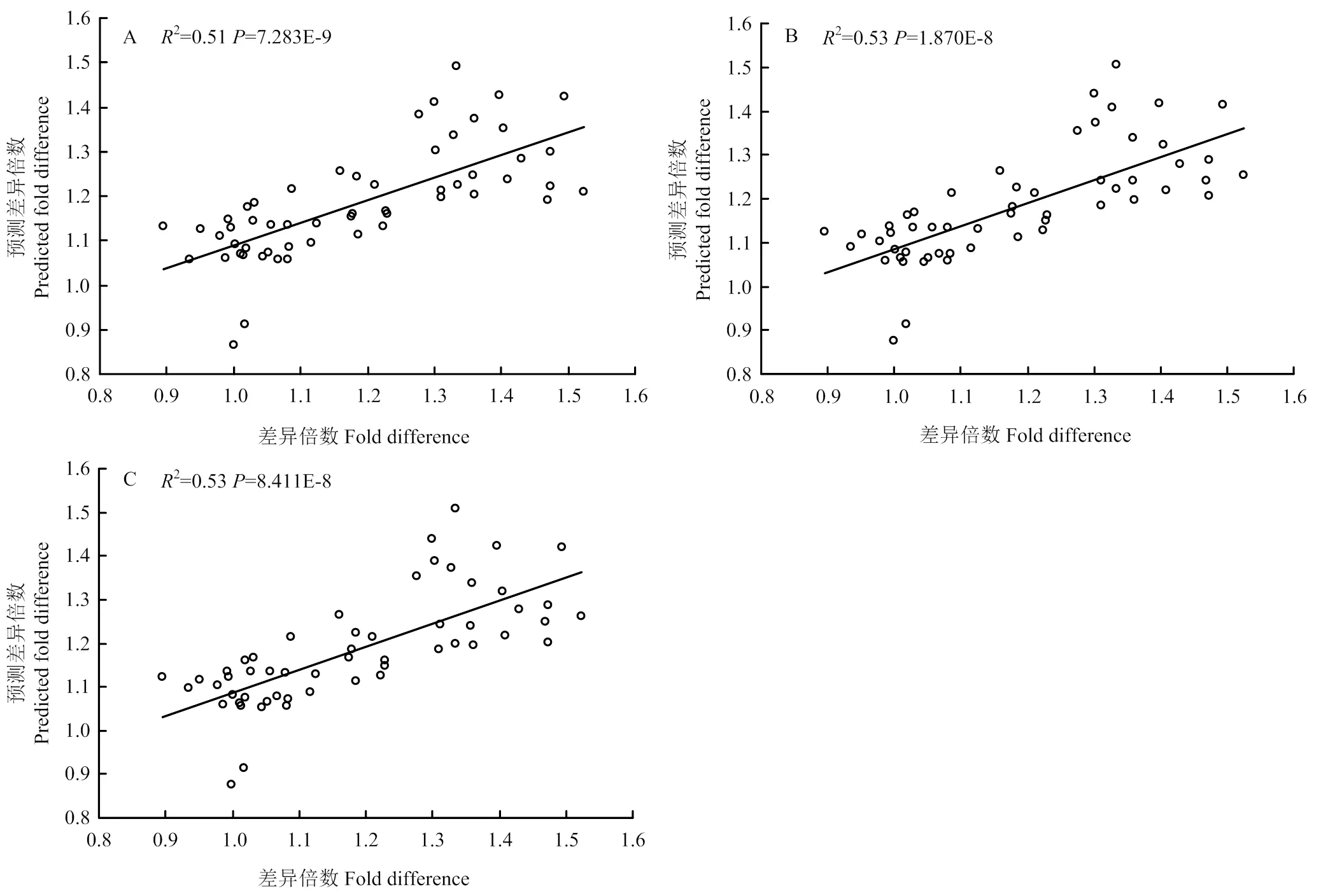
A:两基因模型;B:三基因模型;C:四基因模型
A: The two-genes model; B: The three-genes model; C: The four-genes model
图4 广义线性模型
Fig. 4 The generalized linear model
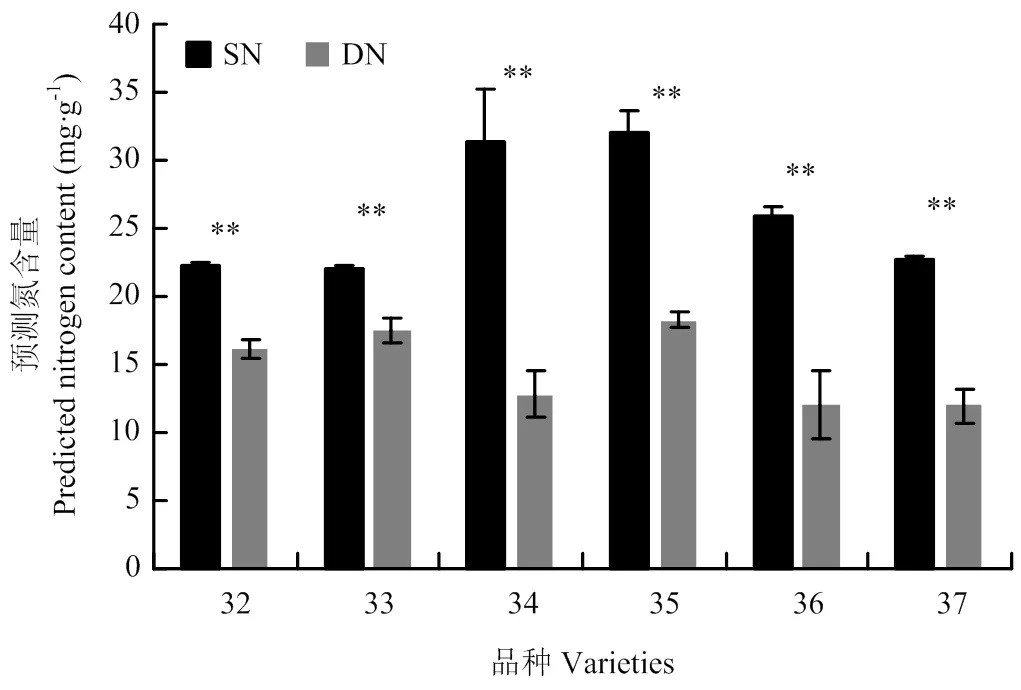
图5 三基因模型预测的氮含量结果
3 讨论
3.1 RNA生物标记物的广泛应用
RNA分子作为生物标记物广泛应用于疾病诊断、治疗及预后监测等方面[20],其表达水平相比DNA可以提供更多调控信息,比蛋白质生物标记物更加灵敏,特异性更高,在医学领域应用价值极高。RNA生物标记物在生物体受到外界环境胁迫早期,细胞内一些响应该胁迫的基因在RNA水平产生异常变化信号,为机体提前预警,由于RNA生物标记物的灵敏性和预警性,在医学上备受关注,并且该方法取样小,对受试生物危害小,也是生物标记物在医学领域研究中的一大优势[21]。虽然RNA生物标记物应用于植物领域检测农艺性状的研究还较少,但该方法的优势在植物领域同样存在。本研究以玉米为模型,通过挖掘转录水平上可以作为生物标记高度响应不同氮素处理的基因,开发出一套RNA生物标记物,精确指示田间玉米氮素营养状况,从而可以指导玉米农业生产中科学施氮,获得更高的玉米产量和品质。
3.2 施氮充足对玉米产量与品质的重要性
本研究中采集V12阶段穗位叶进行生物标记物候选基因的筛选,V12阶段玉米植株处于大喇叭口期(V11—V12),营养生长和生殖生长同时进行,叶片、茎节等营养器官旺盛生长、雌雄穗等生殖器官强烈分化与形成[22]。此时期是玉米一生中生长发育最旺盛的阶段,也是田间管理最重要的阶段,要保证玉米施肥充足。边大红等[23]结合前人研究发现采用播种或苗期少量施氮,大喇叭口期重施氮肥的分次施氮方式有利于促进夏玉米茎秆和雌穗发育。周琦等[24]分别在拔节期、大喇叭口期、吐丝期追加氮肥,发现在大喇叭口期追肥产量差异最为显著。常程等[25]研究发现,在大喇叭口期追施氮肥,有利于促进花前干物质积累,增大花后籽粒体积、粒数和粒重,从而获得高产。因此,从实际生产考虑,在进行生物标记物候选基因筛选时,选择V12阶段作为取样节点,如果检测结果发现植株缺氮,可及时追肥,避免对籽粒产量和品质产生影响,以达到最好的应用效果。
本研究在确定4个氮响应生物标记物基因的表达丰度能否准确指示玉米氮营养状况中,选择玉米穗位叶总氮量作为植株氮营养状况的评估标准。前人研究发现玉米穗位叶氮含量与玉米产量之间呈显著正相关。碳、氮代谢是植物体内最主要的两大代谢过程,这两个过程相互联系又相互制约,碳代谢为氮代谢提供碳源和能量,氮代谢为碳代谢提供酶和光合色素,二者又共同竞争光反应生成的同化力、ATP和碳骨架[26]等。叶片是植物进行光合作用的主要器官,穗位叶碳的同化物是玉米籽粒形成及其物质基础主要来源[27],穗位叶缺乏充足的氮素供应,会导致叶片叶绿素含量降低,光合效率下降,光合产物累积减少,从而导致玉米产量和品质下降[28-29]。本研究将穗位叶总氮量作为玉米氮素营养状态评估标准,旨在通过氮含量评估叶片氮代谢是否可以为碳代谢提供充足的酶和光合色素,满足籽粒淀粉积累的需要。并且用于筛选的生物标记物基因的样品也取自穗位叶,与穗位叶氮含量测定样品是同一份,相关性更强,从而通过生物标记物基因表达丰度预测植株氮状况是否可以满足籽粒灌浆和干物质积累的需要。
3.3 氮响应生物标记物基因表达的独立性
通过生物信息学和荧光定量PCR试验筛选出4个氮响应生物标记物基因,其中(NM03)编码多胺氧化酶1,在节间、叶片、根等组织及萌发过程中表达,多胺是植物生长或适应环境变化所必需的。多胺氧化酶1负责将精胺和热精胺反向转化为亚精胺[30],调节激素信号,从而参与到对生物或非生物胁迫的防御反应。(NM06)编码一个MYB转录因子,在节间、胚、叶片中表达。MYB蛋白家族庞大,功能多样,大部分MYB家族蛋白作为转录因子发挥作用,是植物发育、代谢、防御生物和非生物胁迫过程中的关键调控因子[31]。编码营养贮藏蛋白2,主要在籽粒、分生组织、叶片和根中表达,储藏蛋白为幼苗早期发育提供营养物质,并参与到植物吸收、转运和再利用养分等过程[32]。(NM02)编码一个KNOTTED INDUCED1蛋白,该基因在叶片和雌穗花丝中表达,该基因发生隐性突变后会导致玉米茎秆分枝能力的缺失和多余雌穗的产生[33]。这4个氮响应生物标记物基因,、参与防御非生物胁迫反应,参与养分吸收、转运。这些基因的功能可能部分反应低氮胁迫处理会对这些基因表达产生重要影响。这些基因在叶片中表达量丰富,并且积极响应氮素处理,灵敏度高,其RNA表达丰度可以作为生物标记物,精确指示玉米氮素营养状况。
本研究在进行氮响应生物标记物开发与挖掘过程中,涉及玉米品种范围广,包括27个自交系材料和10个杂交种材料,这些材料主要包括氮敏感型材料和少部分氮钝感型材料。在充足氮(N1)、限制氮(N0)处理后,编号No.1—No.21材料叶片总氮含量表现出显著差异,包括B73、郑58等,这些材料是氮敏感型材料,编号No.22—No.27材料(Mo17、昌7-2、DH392、PH4CV、L239、D1798Z)叶片总氮含量变化小且差异不显著,这些材料比较耐低氮,是氮钝感材料。杂交种材料大多是氮敏感型材料,喜氮,在一定施氮范围内,玉米产量随施氮量增加而增加。例如B73材料是氮敏感型材料,Mo17是氮钝感型材料[19],其杂交种BM对氮素比较敏感,育种家在选育杂交种材料时,考虑到生产实际,倾向于选育喜氮杂交种材料。氮敏感型玉米品种在低氮环境中产量很差,当处于充足氮环境中,产量大幅度提高,产量受氮肥施用影响很大,而耐低氮型玉米材料在低氮环境下产量较高,当提供充足氮肥时,产量不会发生显著变化[34-35],氮敏感型品种和耐低氮品种氮利用效率不同。对于这一现象,本研究认为耐低氮型材料可能在低氮胁迫下产生应激反应,导致植物体努力吸收土壤中的氮素。不管是氮敏感型材料,还是氮钝感型材料,本研究中筛选得到的氮响应RNA生物标记物基因,其表达情况可以准确反映这些材料的氮状况,31种氮敏感型材料在N1、N0处理后基因表达差异显著,而6种耐低氮型材料,基因表达差异不显著。
3.4 应用潜力
利用这4个氮响应生物标记物基因构建的预测模型,以三基因模型最佳,可以精确指示玉米植株氮素营养状况,应用到大田实际生产中。与传统方法相比,筛选获得的4个基因高度响应氮素处理,灵敏度极高,在限制氮处理转充足氮处理仅2 h,生物标记物基因复合表达值已出现明显变化,15和26 h变化更加明显[18]。在植物尚未表现出缺氮表型时,在转录水平提前检测到缺氮信号,及时补充氮源,避免了长期缺氮对玉米籽粒品质和产量产生影响;方法准确度高,将N1和N0处理下生物标记物基因表达丰度差异与凯氏定氮法实际测得总氮含量差异与进行相关性分析,相关显著(2均大于0.6);试验流程简单,试剂无腐蚀性,安全性高;该方法仅取少量穗位叶提取RNA进行检测,对穗位叶损伤小,不会影响玉米籽粒的干物质积累和正常灌浆;此外,该方法主要通过荧光定量PCR方法对植株氮状况进行检测,结果稳定,生物学重复性好,且生物标记物基因表达独立于品种基因型,不受品种材料限制。因此,利用RNA生物标记物基因预测玉米植株氮素营养状况具有较强应用价值。本研究仍存在一些需要继续完善的地方,从生产实际考虑,对V12阶段叶片进行生物标记物基因表达情况的测定,缺乏对不同发育阶段全面测定生物标记物基因表达情况。
4 结论
开发出4个可以稳定反映玉米植株氮状况的RNA生物标记物基因,其表达独立于基因型;构建的三基因广义线性模型可以准确预测玉米植株氮状况,指导生产实践中科学施氮。
References
[1] YAN X, JIN J Y, LIANG M Z. Grain crop fertilization status and factors influencing farmers’ decision making on fertilizer use: China case study. Agricultural Science & Technology, 2016, 17(10): 2394-2440.
[2] 赵英杰. 花生—春玉米轮作的肥料效应及减量优化施肥技术研究[D]. 保定: 河北农业大学, 2019.
ZHAO Y J. Study on fertilizer effect and reduction fertilization technology of peanut-spring maize rotation[D]. Baoding: Hebei Agricultural University, 2019. (in Chinese)
[3] GUO J H, LIU X J, ZHANG Y, SHEN J L, HAN W X, ZHANG W F, CHRISTIE P, GOULDING K W T, VITOUSEK P M, ZHANG F S. Significant acidification in major Chinese croplands. Science, 2010, 327(5968): 1008-1010.
[4] LIU X J, ZHANG Y, HAN W X, TANG A H, SHEN J L, CUI Z L, VITOUSEK P, ERISMAN J W, GOULDING K, CHRISTIE P, FANGMEIER A, ZHANG F S. Enhanced nitrogen deposition over China. Nature, 2013, 494(7438): 459-462.
[5] ELLIOTT D E, REUTER D J, GROWDEN B, SCHULTZ J E, MUHLHAN P H, HEANES J G. Improved strategies for diagnosing and correcting nitrogen deficiency in spring wheat. Journal of Plant Nutrition, 1987, 10(9): 1761-1770.
[6] PATTON C J, TRUITT E P. Methods of analysis by the U.S. Geological Survey National Water Quality Laboratory; determination of the total phosphorus by a Kjeldahl digestion method and an automated colorimetric finish that includes dialysis. Journal of the American Medical Association, 1992, 15(39): 92-146.
[7] 宋文冲, 胡春胜, 程一松, 代辉. 作物氮素营养诊断方法研究进展. 土壤通报, 2006(2): 2369-2372.
SONG W C, HU C S, CHENG Y S, DAI H. Research progress on diagnostic methods of crop nitrogen nutrition. Chinese Journal of Soil Science, 2006(2): 2369-2372. (in Chinese)
[8] WOOD C W, TRACY P W, REEVES D W, EDMISTEN K L. Determination of cotton nitrogen status with a hand-held chlorophyll meter. Journal of Plant Nutrition, 1992, 15(9): 1435-1448.
[9] TURNER F T, JUND M F. Chlorophyll meter to predict nitrogen top dress requirement for semidwarf rice. Agronomy Journal, 1991, 83(5): 926-928.
[10] FOLLETT R H, FOLLETT R F, HALVORSON A D. Use of a chlorophyll meter to evaluate the nitrogen status of dryland winter wheat. Communications in Soil Science & Plant Analysis, 1992, 23(7/8): 687-697.
[11] CHAPMAN S C, BARRETO H J. Using a chlorophyll meter to estimate specific leaf nitrogen of tropical maize during vegetative growth. Agronomy Journal, 1997, 89(4): 557-562.
[12] 唐延林, 王人潮, 张金恒, 王珂. 高光谱与叶绿素计快速测定大麦氮素营养状况研究. 麦类作物学报, 2003, 23(1): 63-66.
TANG Y L, WANG R C, ZHANG J H, WANG K. Study on determining nitrogenous levels of barley by hyperspectral and chlorophyll meter. Journal of Triticeae Crops, 2003, 23(1): 63-66. (in Chinese)
[13] TURNER F T, JUND M F. Assessing the nitrogen requirements of rice crops with a chlorophyll meter method. Australian Journal of Experimental Agriculture, 1994, 34(7): 1001-1005.
[14] OLAV H B, SOLHAUG K A. Effect of irradiance on chlorophyll estimation with the minolta SPAD-502 leaf chlorophyll meter. Annals of Botany, 1998(3): 389-392.
[15] SATHYABAARATHI R, USHASHI B, DEVI D G, ROOPARANI K, CHANDRANI T, DIPSHIKHA C, NARAYANASWAMY B K, AMIT S, NAGASUMA C. VB10, a new blood biomarker for differential diagnosis and recovery monitoring of acute viral and bacterial infections. EBioMedicine, 2021, 67(2): 103352.
[16] GWENAELLE M, MAYJONADE B, DIDIER V. A biomarker based on gene expression indicates plant water status in controlled and natural environments. Plant Cell & Environment, 2013, 36(12): 2175-2189.
[17] KENKEL C D, SHERIDAN C, LEAL M C, BHAGOOLI R, CASTILLO K D, KURATA N, MCGINTY E, GOULET T L, MATZ M V. Diagnostic gene expression biomarkers of coral thermal stress. Molecular Ecology Resources, 2014, 14(4): 667-678.
[18] YANG X F, WU J R, ZIEGLER T E, YANG X, ZAYED A, RAJANI M S, ZHOU D F, BASRA A S, SCHACHTMAN D P, PENG M S, ARMSTRONG C L, CALDO R A, MORRELL J A, LACY M, STAUB J M. Gene expression biomarkers provide sensitive indicators of in planta nitrogen status in maize. Plant Physiology, 2011, 157(4): 1841-1852.
[19] 葛敏, 吕远大, 张体付, 周玲, 林峰, 赵涵. 玉米氮素敏感性差异自交系的表达谱分析. 作物学报, 2016, 42(10): 1487-1494.
GE M, Lü Y D, ZHANG T F, ZHOU L, LIN F, ZHAO H. Global transcriptome analysis in high- and low-nitrogen responsive inbred lines of maize. Acta Agronomica Sinica,2016, 42(10): 1487-1494. (in Chinese)
[20] 何磊, 许利剑. 生物标记物在胃癌诊断及预后中作用的研究进展. 医学研究生学报, 2020, 33(9): 1004-1008.
HE L, XU L J. Research progress on the role of biomarkers in the diagnosis and prognosis of gastric cancer. Journal of Medical Postgraduates, 2020, 33(9): 1004-1008. (in Chinese)
[21] 潘晓晗, 郝春华, 陈芙蓉, 王维亭, 黄长江, 汤立达. 脑梗死生物标志物研究进展. 现代药物与临床, 2020, 35(1): 189-196.
PAN X H, HAO C H, CHEN F R, WANG W T, HUANG C J, TANG L D. Research progress on biomarkers for cerebral infraction. Drugs & Clinic,2020, 35(1): 189-196. (in Chinese)
[22] 刘文娟, 常丽娟, 岳丽杰, 宋君, 张富丽, 王东, 吴佳蔚, 郭灵安, 雷绍荣. 两个玉米品种维管束鞘叶绿体的非光化学淬灭对干旱胁迫的响应. 中国农业科学, 2020, 53(8): 1532-1544.
LIU W J, CHANG L J, YUE L J, SONG J, ZHANG F L, WANG D, WU J W, GUO L A, LEI S R. Response of non-photochemical quenching in bundle sheath chloroplasts of two maize hybrids to drought stress. Scientia Agricultura Sinica, 2020, 53(8): 1532-1544. (in Chinese)
[23] 边大红, 刘梦星, 牛海峰, 魏钟博, 杜雄, 崔彦宏. 施氮时期对黄淮海平原夏玉米茎秆发育及倒伏的影响. 中国农业科学, 2017, 50(12): 2294-2304.
BIAN D H, LIU M X, NIU H F, WEI Z B, DU X, CUI Y H. Effects of nitrogen application times on stem traits and lodging of summer maize () in the Huang-huai-hai plain. Scientia Agricultura Sinica,2017, 50(12): 2294-2304. (in Chinese)
[24] 周琦, 张富仓, 李志军, 强生才, 田建柯, 李国栋, 范军亮. 施氮时期对夏玉米生长、干物质转运与产量的影响. 干旱地区农业研究, 2018, 36(1): 76-82.
ZHOU Q, ZHANG F C, LI Z J, QIANG S C, TIAN J K, LI G D, FAN J L. Effects of nitrogen application at different stages on growth, yield, and dry matter transportation of summer maize. Agricultural Research in the Arid Areas, 2018, 36(1): 76-82. (in Chinese)
[25] 常程, 刘晶, 隋阳辉, 张书萍, 史磊, 肖万欣, 王和君, 王金艳, 徐亮. 施氮时期对春玉米果穗不同粒位籽粒发育及产量的影响. 辽宁农业科学, 2021, 2(2): 8-12.
CHANG C, LIU J, SUI Y H, ZHANG S P, SHI L, XIAO W X, WANG H J, WANG J Y, XU L. Effect of nitrogen application period on grain development in different ear positions and yield of spring maize. Liaoning Agricultural Sciences, 2021, 2(2): 8-12. (in Chinese)
[26] 宋建民, 田纪春, 赵世杰. 植物光合碳和氮代谢之间的关系及其调节. 植物生理学通讯, 1998, 34(3): 230-238.
SONG J M, TIAN J C, ZHAO S J. Relationship between photosynthetic carbon and nitrogen metabolism in plants and its regulation. Plant Physiology Communications, 1998, 34(3): 230-238. (in Chinese)
[27] 张凤路, 江亚丽, 赵国顺, 张俊花.14C-同化物在玉米果穗上的分布与籽粒败育关系. 作物学报, 2006, 32(7): 1104-1106.
ZHANG F L, JIANG Y L, ZHAO G S, ZHANG J H. Relationship between distribution of14C-assimilates and kernel abortion in maize. Acta Agronomica Sinica, 2006, 32(7): 1104-1106. (in Chinese)
[28] 汤继华, 谢惠玲, 黄绍敏, 胡彦民, 刘宗华, 季洪强, 寇志安. 缺氮条件下玉米自交系叶绿素含量与光合效率的变化. 华北农学报, 2005, 20(5): 10-12.
TANG J H, XIE H L, HUANG S M, HU Y M, LIU Z H, JI H Q, KOU Z A. The changes of chlorophyll content and photosynthetic productivity in maize inbred lines under the low-nitrogen stress. Acta Agriculturae Boreali-Sinica, 2005, 20(5): 10-12. (in Chinese)
[29] 吕丽华, 赵明, 赵久然, 陶洪斌, 王璞. 不同施氮量下夏玉米冠层结构及光合特性的变化. 中国农业科学, 2008, 41(9): 2624-2632.
Lü L H, ZHAO M, ZHAO J R, TAO H B, WANG P. Canopy structure and photosynthesis of summer maize under different nitrogen fertilizer application rates. Scientia Agricultura Sinica, 2008, 41(9): 2624-2632. (in Chinese)
[30] LIU T B, KIM D W, NIITSU M, BERBERICH M, KUSANO T. POLYAMINE OXIDASE 1 from rice () is a functional ortholog of POLYAMINE OXIDASE 5. Plant Signaling & Behavior, 2014, 9(9): 1559-2324.
[31] DUBOS C, STRACKE R, GROTEWOLD E, WEISSHAAR B, MARTIN C, LEPINIEC L. MYB transcription factors in. Trends in Plant Science, 2010, 15(10): 573-581.
[32] STASWICK P E. Novel regulation of vegetative storage protein genes. The Plant Cell, 1990, 2(1): 1-6.
[33] GREENE B, WALKO R, HAKE S. Mutator insertions in an intron of the maize knotted1 gene result in dominant suppressible mutations. Genetics, 1994, 138(4): 1275-1285.
[34] TSAI C Y, HUBER D M, GOVER D V. Relationship of N deposition to grain yield and N response of three maize hybrids. Crop Science, 1984, 24(2): 277-281.
[35] 向春阳, 常强, 马兴林, 关义新, 凌碧莹, 张宝石. 玉米不同基因型对氮营养胁迫的反应. 黑龙江八一农垦大学学报, 2002, 14(4): 5-7.
XIANG C Y, CHANG Q, MA X L, GUAN Y X, LING B Y, ZHANG B S. Response to nitrogen stress on maize genotypes. Journal of Heilongjiang Bayi Agricultural University,2002, 14(4): 5-7. (in Chinese)
Screening and Application of Biomarkers Related to Maize Nitrogen Status
SHI Xi1,2, NING LiHua2, GE Min2, WU Qi2, ZHAO Han1,2*
1College of Agriculture, Nanjing Agricultural University, Nanjing 210014;2Institute of Crop Germplasm and Biotechnology, Jiangsu Academy of Agricultural Sciences/Provincial Key Laboratory of Agrobiology, Nanjing 210014
【Background】The transcriptional levels of selected genes, referred as biomarkers, have been widely applied in clinical diagnosis processes. They were yet rarely used in agricultural cultivation for determining the nutrient statues in maize. 【Objective】This study aims to explore the genes that can be used as biomarkers to reflect the nitrogen abundance in maize, so as to help the precise application of nitrogen fertilizer. 【Method】Based on the data of gene chip and RNA-Seq under different nitrogen treatments, we chose the genes with high transcriptional abundance in response to N fluctuation as candidates. These genes were further screened by qRT-PCR and Kjeldahl methods using maize materials with different genotypes under different nitrogen treatments. The generalized linear models for predicting nitrogen status were constructed to accurately indicate the nitrogen nutrition status of maize. 【Result】Firstly, we selected ten candidate genes with high expression level that are responsible for N fluctuation. Secondly, we found eight candidate genes that are differentially expressed under N treatment; Next, twenty-seven inbred and four hybrid lines covering a rich array of genetic diversity were selected to screen the candidate genes, and found that four genes stably expressed in different genotypes of maize. The expression abundance difference of these four genes were significantly correlated with total nitrogen content in panicle leaves through correlation analysis (2was greater than 0.6) with sufficient nitrogen and limited nitrogen treatment in thirty materials. According to the above results, these four genes can be used as nitrogen response biomarkers to indicate maize nitrogen status. The two-genes, three-genes and four-genes models were constructed by these four biomarker genes for predicting nitrogen status. The three-genes model was composed of(2),(3) and(4) were the most useful model for predicting the nitrogen status of maize plants, and the functional relationship was=1.143+0.0172-0.3023+0.0174.Finally, the prediction function of the three-genes model was verified with six hybrids planted in the field. The results show that the three-genes model can accurately diagnose the nitrogen nutrition status of maize planted in the field environment. 【Conclusion】We explored and verified four biomarker genes highly responsive to maize nitrogen status. The three-genes model works best in predicting the maize nitrogen nutrition status. The development of the biomarker can effectively and real-timely monitor the nitrogen status of maize plants, thus is helpful for optimizing the use of nitrogen fertilizer, thereby maximize the crop yield at the lowest cost.
; biomarker; nitrogen; panicle leaf; determination of total nitrogen; generalized linear models
2021-07-30;
2021-10-18
国家自然科学基金(32001564)、江苏省农业生物学重点实验室重大自主研究课题(JKLA2021-ZD0)
石习,Tel:13813928391;E-mail:nancy1448374364@163.com。通信作者赵涵,Tel:15062206158;E-mail:zhaohan@jaas.ac.cn
(责任编辑 李莉)

