捆绑缝合法在机器人辅助腹腔镜肾脏部分切除术中的疗效观察
邓浩天,李子尧, ,王声政,范雅峰,陶 金,于栓宝,王健阁,梁 静,张雪培, 3
(1.郑州大学第一附属医院泌尿外科,河南郑州 450052;2.郑州大学电气工程学院,河南郑州 450001;3.河南省慢性肾脏疾病精准治疗重点实验室,河南郑州 450052)
肾癌是泌尿系统常见的恶性肿瘤,占所有癌症的2%~3%[1]。随着影像学技术的发展,早期肾癌的检出率较前有很大的提高。目前肾脏部分切除术(Partial nephrectomy,PN)是临床T1~2N0M0肾肿瘤的标准治疗方法[2],与传统的肾根治切除手术相比,PN能够更好地保留肾功能,减少心血管事件的发生,提高患者的生活质量[3-5]。机器人辅助肾部分切除术(robot-assisted partial nephrectomy,RPN)因其具有转开放手术概率低、减少出血量和住院时间、减少术后并发症、保留更多肾功能等方面的优势,近年来在保肾手术中被广泛运用[6-7]。但是仍然存在手术时间较长、术后患侧肾脏萎缩、肾功能减退等问题[8]。因此,我们在传统缝合方法的基础上进行改良,采取一种新的缝合方式,从而达到进一步降低术中出血、减少术后并发症发生、缩短肾脏热缺血时间、最大限度保留患者肾脏功能的目的。
1 资料与方法
1.1 一般资料2018年12月-2019年12月共160例患者于郑州大学第一附属医院行RPN。其中106例患者采用捆绑缝合法进行肾脏创面缝合。收集这106例患者临床基本资料,包括年龄、性别、体质指数 (body mass index,BMI)、美国麻醉师协会(American Society of Anesthesiologists,ASA)分级、术前基础疾病、肿瘤大小、肿瘤R.E.N.A.L.评分、手术时间、术中肾脏热缺血时间、术中失血量、术后并发症、术后住院时间、术后病理结果以及术前和术后生化指标等。术后并发症根据Clavien-Dindo分类系统进行分级[9],病理结果采用2009年肿瘤TNM分期系统及2004年WHO肿瘤分级标准进行。
1.2 手术方法
1.2.1患者体位和Trocar位置 患者采取健侧70°~90°侧卧位,取脐上2 cm腹直肌旁12 mm切口,置入气腹针,使气腹压力增加至12~15 mmHg (1 mmHg=0.133 kPa),拔除气腹针后置入12 mmTrocar,作为机器人镜头臂通道;头侧的8 mm套管置于锁骨中线肋缘下方2横指,距离镜头套管8~10 cm;尾侧的8 mm套管放置于髂前上棘内上方,同样距离镜头套管8~10 cm;头侧和尾侧的8 mm套管作为机器人1号臂和2号臂通道;另外还需要于左(右)下腹部和脐上置入12 mm一次性Trocar为助手通道。对于右侧手术,还需要于剑突下方放置1个5 mm Trocar,用于术中牵拉肝脏(图1A、B)。
1.2.2肿瘤的暴露、肾门解剖及肿瘤切除 在髂血管水平沿结肠外侧Toldt线切开侧腹膜,左侧上至脾脏外上方、下达乙状结肠外侧,切开脾结肠韧带和脾肾韧带,使脾脏靠重力作用充分后仰。沿Gerota筋膜前层和结肠融合筋膜之间分离,使降结肠和结肠脾曲坠向腹部中线。继续向内侧分离,沿Gerota筋膜前层和胰腺融合筋膜之间分离,使胰腺尾部充分展开,暴露左肾腹侧面的轮廓和肾门区域,可看到主动脉搏动。右侧切开上至结肠肝曲、肝下缘和三角韧带、下达盲肠外侧,沿Gerota筋膜前层和结肠融合筋膜之间分离,暴露位于结肠系膜后方的十二指肠降部。在融合筋膜下方游离十二指肠将之推向腹部中线,充分显露位于十二指肠侧后方的下腔静脉。暴露肾脏,游离处理肾脏血管,采用生殖静脉标记法[10],解剖出肾脏动静脉。切开肾周筋膜,游离肿瘤周围脂肪组织,必要时可使用术中超声明确肿瘤边缘。准备好“哈巴狗”血管夹,在阻断肾动脉前10 min,静脉滴注甘露醇100 mL,在阻断肾动脉前2 min静脉注射低分子肝素6 250 U,阻断肾动脉后,提起瘤冠脂肪组织,沿肿瘤旁开0.3~0.5 cm冷剪刀切割肾实质,顿性和锐性分离相结合,游离肿瘤基底部,将肿瘤及周围少许正常肾组织一起完整切除。
1.2.3捆绑缝合法 将1号臂单极电剪换为大号持针器,采用2-0倒刺可吸收缝合线20~30 cm,于线尾固定Hem-O-lock夹。首先从切口上端右缘的包膜外进针,穿过肾皮质和创面基底部后出针收线,其后自上而下连续缝合皮质和髓质层至切口最低位;然后自切口下端基底部的髓质层进针,经对缘的肾皮质穿出包膜,其后自下而上连续缝合髓质层和皮质层至切口最高位,最后1针经切口上端左缘的包膜外穿出,Hem-O-lock夹固定。最后另取一根2-0倒刺可吸收缝线长15~50 cm,线尾固定Hem-O-lock,自切口上端右缘的包膜外进针,缝针穿过皮质层和髓质层经切口对缘的包膜外出针,其后自上而下连续缝合皮、髓质层自切口下端,完成创面修复(图1C~F)。
移除血管夹,降低气腹压3~5 mmHg,观察有无活动性出血,给予鱼精蛋白50 mg对抗肝素,取出标本,留置引流管,逐层关闭切口。
1.3 术后检查及随访术后绝对卧床3~5 d,监测患者生命体征、引流量,术后3 d复查血常规、尿常规、肾功能、电解质。通过电子病历系统所登记的患者信息进行电话随访,分别于术后1个月复查泌尿系超声,其后每6个月复查胸部和泌尿系计算机断层扫描(computed tomography,CT)。

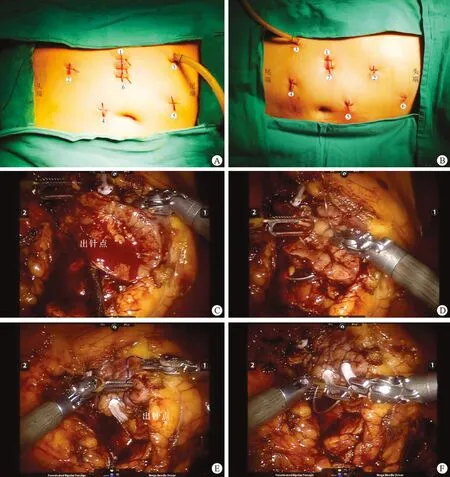
A、B:机器人左肾与机器人右肾部分切除术,其中①、②和③分别接机器人镜头臂12 mm通道、1号和2号臂8 mm通道,④和⑤助手12 mm通道,⑥切口(左肾)及剑突下牵引肝脏5 mm通道(右肾)⑦切口(右肾);C、D:捆绑缝合法中一侧包膜与对侧肾实质进行连续缝合;E、F:捆绑缝合法中两侧肾包膜进行连续缝合以及缝合完成后的效果图。
2 结 果
2.1 患者的临床资料共106例患者纳入研究(表1)。患者平均年龄(53.3±14.1)岁,平均BMI 24.7±2.7,合并高血压、冠心病、糖尿病、脑梗的比例分别是28.3%、9.4%、17.9%、14.2%,24例(22.6%)患者合并既往腹部手术史;通过术前影像学评估,肿瘤平均直径(38.2±13.0)mm,平均RENAL评分(8.2±1.8)分,有4例(3.8%)患者检查出双肾肿瘤,患者术前临床分期在T1a~T2b之间,其中有5例(4.7%)患者为临床T2期。
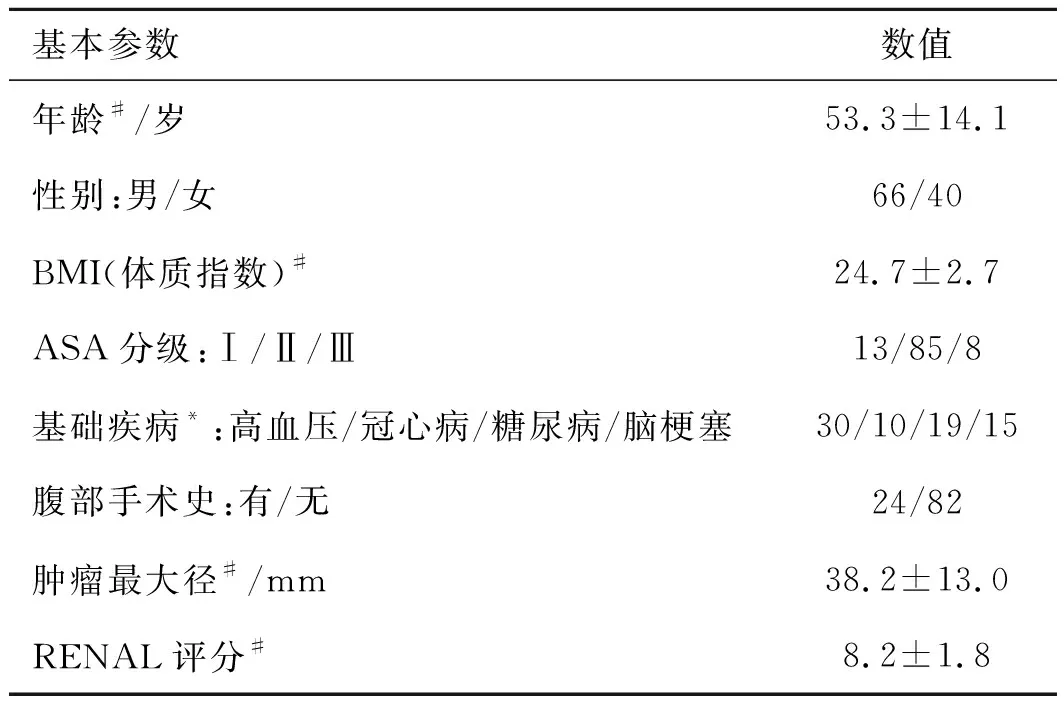
表1 纳入的106例患者术前临床资料 (例)
2.2 手术结果及病理特征106例患者均成功运用捆绑缝合法完成RPN(表2)。平均手术时间(119.8±47.3)min,术中平均失血量(81.9±64.3)mL,肾脏平均热缺血时间(14.2±3.3)min,术后平均住院时间(6.9±1.3)d。所有患者均未转为开放或者根治性手术,术后病理结果提示切缘均为阴性:其中良性肿瘤13例(12.3%),恶性肿瘤93例(87.7%)中肾脏透明细胞癌占69.8%。结合患者术前肾小球滤过率与术后复查肾小球滤过率,患者术后整体肾功能较术前平均降低13.4%。

表2 106例患者手术及术后临床病理结果
2.3 术后并发症发生情况术后共7例(6.6%)患者发生并发症,其中Clavien≤Ⅱ级5例,均通过保守治疗得到缓解;2例(1.9%)患者发生Ⅲ级并发症,1例于术后30 d来院复查发现肾脏包膜下积液并肾脏积水,予以行穿刺引流+输尿管支架管置入,另外1例在术后45 d因腰部负重出现血尿,急诊至我院行介入栓塞手术。
2.4 随访结果106例患者中位随访时间为13.4个月(四分位数间距:10.2~16.4个月),在随访过程中,1例(0.9%)透明细胞肾细胞癌Ⅱ级患者于术后8个月出现患肾前缘局部复发,予以行根治性肾切除+部分结肠切除手术治疗,1例(0.9%)透明细胞肾细胞癌伴小灶肉瘤样癌患者于术后12个月出现骨转移,予以靶向药物治疗,目前带瘤生存。
3 讨 论
随着诊疗理念的改进,PN已是目前处理临床T1~2N0M0肾肿瘤的“金标准”[11],不仅可以达到与根治手术相似的肿瘤控制效果[12],而且可改善患者肾功能预后、提高患者生活质量[5]。PN手术方式有传统开放式手术(open partial nephrectomies,OPN)、腹腔镜微创手术(laparoscopic partial nephrectomy,LPN)以及RPN。3种手术方式局部复发率、远处转移率以及与癌症相关的死亡率相似[13]。但是RPN在患者的估计失血量、热缺血时间、术后并发症发生率、术后住院时间等方面均优于OPN和LPN[7]。同时就机器人系统本身而言,其可提供三维放大图像,提高操作灵活性以及通过防颤系统增加主刀医师的可控性[14],在处理复杂肿瘤、明确肿瘤边界方面更有优势[15]。本次数据结果显示,RPN平均手术时间、术中出血量、术后住院时间以及热缺血时间分别是(119.8±47.3)min、(81.9±64.3)mL、(6.9±1.3)d、(14.2±3.3)min,其术后并发症发生率为6.6%,与目前报道的开放或者腹腔镜手术相比,具有明显优势,并且术中仅使用两个机械臂,充分发挥机器人灵活性,节约手术成本。
PN术后肾脏功能损失程度是评估手术效果的一项重要指标,虽然目前已在术中预防肾脏功能下降方面做出许多措施,但是术后患肾功能下降仍达到10%~25%[8],对患者产生不利影响。而肾脏功能损失与切除正常肾脏组织以及肾脏热缺血时间有关[16]。肾脏热缺血时间以及切除正常肾组织对肾脏功能产生不可逆损伤,影响患者预后。本研究通过整理收集国内外已报道的RPN文献案例中手术时间、术中出血量、术中热缺血时间、术后高级别并发症以及术后病理阳性切缘等指标(表3),并根据所采用的缝合方法不同将数据进行归纳总结分为间断缝合组及连续缝合组。间断缝合组、连续缝合组及捆绑缝合组在手术时间(189.0 minvs.193.6 minvs.119.8 min)、术中出血量(155.0 mLvs.226.0 mLvs.81.9 mL)、术中热缺血时间(19.7 minvs.20.3 minvs.14.2 min)、术后高级别并发症发生率(8.5%vs.14.2%vs.6.6%)以及术后切缘阳性率(3.9%vs.2.2%vs.0%)等方面比较,捆绑缝合组均优于其他两组(表4),同时本研究中采用捆绑缝合法行RPN,其术后整体肾功能约下降13.4%,捆绑缝合法能够取得较好的手术效果。并且,此次研究中,共有24例(22.6%)患者合并既往腹部手术史,20例(18.9%)患者患肾有多支动脉血供,平均肿瘤直径(38.2±13.0)mm,平均Renal评分(8.2±1.8)分,与报道的肿瘤直径2.4~3.3 cm、Renal评分7.2分相比[6,17-23],手术难度增大却未增加术后风险。

表3 机器人肾部分切除术捆绑缝合法相关变量与其他研究中心结果比较

表4 机器人肾部分切除术中本文捆绑缝合法相关变量与其他研究中心结果比较
PN术中创面缝合有传统双层缝合(内层止血并关闭集合系统,外层“8”字缝合)、Hem-O-lock夹免打结缝合(内层止血并关闭集合系统,外层Hem-O-lock夹每针滑动固定连续缝合)[17]、肾血管处“V”字缝合[24]以及倒刺线免打结缝合[25]等多种方法。目前尚缺乏相关文献比较这些缝合方式在缩短肾脏热缺血时间上的优势。有学者提出肾段动脉阻断及不阻断技术行PN[26-27],缩短肾脏热缺血时间,有利于肾脏功能保护,但是该技术有一定局限性,通常仅适用于边缘位置的肿瘤,并且其围手术期输血率较高、手术时间较长;此外肾段动脉阻断仅在部分医学中心能够施行。本研究中,采用捆绑缝合法行RPN取得一定成果,可提高手术效率、缩短手术时间及肾脏热缺血时间、降低患者术中出血量及术后并发症发生率,有利于患者术后恢复及肾功能保护,使患者PN术中能够获益。但对于特殊部位肿瘤(如肾门部位的肿瘤),需要多种缝合方式相结合。
关于各种缝合方法之间的效果比较仍缺乏高质量证据,仍需开展前瞻性的对照研究评价捆绑缝合法的并发症发生率和功能恢复效果。结合本次研究结果与国内外数据(表4),我们认为对于临床T1~T2期肾脏肿瘤患者,采用捆绑缝合法行RPN安全有效,能够明显缩短肾脏热缺血时间,有利于保护肾功能,减少术中出血量,降低术后并发症,临床上值得推广运用。

