葫芦烷型降三萜类化合物的研究进展
霍晓爽,王钧篪,斯建勇
葫芦烷型降三萜类化合物的研究进展
霍晓爽,王钧篪*,斯建勇*
中国医学科学院北京协和医学院药用植物研究所中草药物质基础与资源利用教育部重点实验室,北京 100193
葫芦烷型降三萜类化合物是一类结构新颖的化合物,是在葫芦烷型三萜的30个碳骨架的基础上减少1个或几个碳所得。按其缺少碳原子的位置可分为2-降(a)、3-降(b)、19-降(c)、27-降(d)、29-降(e)、19,29-降(f)、25,26,27-降(g)、24,25,26,27-降(h)、23,24,25,26,27-降(i)、22,23,24,25,26,27-降(j)、22,23,24,25,26,27,29-降(k)、20,21,22,23,24,25,26,27-降(l)共12种类型。此类化合物结构新颖多样,具有抗肿瘤、抗炎、降血糖和抗氧化等多种药理活性。对葫芦烷型降三萜类化合物的植物分布、化学结构特征以及药理活性进行系统的总结,以期为该类化合物进一步的开发与合理利用提供参考。
葫芦烷型降三萜;抗肿瘤;抗炎;降血糖;抗氧化
葫芦烷型三萜类化合物是四环三萜中较为重要的一类骨架类型。这些化合物大多是葫芦素的衍生物,在C-3位多有羟基或其他含氧基团,在植物中多以游离或与糖结合成苷的形式存在[1]。葫芦烷型降三萜则是在葫芦烷型三萜化合物30个碳骨架的基础上发生环化、重排或降解后失去1个或几个碳原子后得到的[2]。据统计,至今已有100多种葫芦烷型降三萜化合物被报道,它们结构新颖多样,其中一些具有显著的生物活性。目前关于葫芦烷型降三萜类化合物的报道还局限于化学成分的提取、分离、结构鉴定和药理活性的筛选。因此,本文旨在对葫芦烷型降三萜类化合物的植物分布、结构特征及药理活性进行系统的总结与分析,为该类化合物进一步的开发与合理利用提供参考。
1 植物分布
葫芦烷型降三萜类化合物主要分布于葫芦科的各属植物中,1970年Doskotch等[3]在秋海棠科植物球根秋海棠Voss var.L.中分离得到1种六降葫芦素类化合物hexanorcucurbitacin D,这是自然界中首次发现的葫芦烷型降三萜类化合物。随着对此类化合物研究的不断深入,葫芦烷型降三萜类化合物在葫芦科以及其他科植物中也陆续被发现。如丝瓜属植物具盖丝瓜(L.) Cogn.[4]、泻根属植物白泻根L.[5]、波棱瓜属植物波棱瓜(Ser.) C.B.Clarke[6]、西瓜属植物药西瓜(L.) Schrad[7]、苦瓜属植物苦瓜Linn.var.Ser.[8]等植物中均分离得到过该类化合物。近年来,少许该类化合物在瑞香科植物皇冠果(Scheffff.) Boerl.[9]、大戟科植物小花玛莱亚(Benth.) Müll.Arg.[10]、樟科植物瑶山润楠S.Lee et F.N.Wei[11]和鳄梨Mill.[12]、菊科植物宽叶兔儿风(D.Don) Sch.-Bip.[13]、杜英科植物Schltr.[14]、玄参科植物胡黄连Royle ex Benth.[15]、刺篱木科植物脚骨脆Gagnep.[16]等植物中亦有发现。这表明葫芦烷型降三萜类化合物在植物中的分布并不具有植物亚类特异性。此外,由于葫芦烷型降三萜类化合物是在葫芦烷型三萜化合物的30个碳骨架的基础上失去1个或几个碳原子所得,故按其缺少碳原子的数目可分为一降、二降、三降、四降、五降、六降、七降、八降;按其缺少碳原子的位置可分为2-降(a)、3-降(b)、19-降(c)、27-降(d)、29-降(e)、19,29-二降(f)、25,26,27-三降(g)、24,25,26,27-四降(h)、23,24,25,26,27-五降(i)、22,23,24,25,26,27-六降(j)、22,23,24,25,26,27,29-七降(k)、20,21,22,23,24,25,26,27-八降(l)共12种类型。葫芦烷型降三萜类化合物在植物中的分布见表1。

表1 葫芦烷型降三萜类化合物在植物中的分布

续表1

续表1

续表1
2 结构特征
葫芦烷型降三萜类化合物按其缺少碳原子的位置主要可分为a~l共12种类型。
2.1 一降葫芦烷型
在已知的葫芦烷型降三萜类化合物中,从葫芦烷型三萜骨架中失去1个碳原子的情况最为普遍,主要可分为a~e 5种类型,各类型化合物的名称及结构见表1和图1。
2.1.1 a型 此类化合物主要是由葫芦烷型三萜骨架A环的C-2位被氧原子取代,形成罕见的内酯型结构。2001年Kawahara等[4]从具盖丝瓜中分离得到的2种新葫芦烷型化合物1、2均属于此类型,这也是自然界中最早发现的内酯型葫芦烷结构。a型化合物1~4的化学结构见图1。
2.1.2 b型 目前该类化合物仅在葫芦科植物药西瓜[7]中被发现,主要有2种类型,一种是葫芦烷型三萜骨架A环上的C-3位被氧原子取代形成罕见的内酯型结构,另一种是A环上的C-3丢失,形成5/6/6/5-稠环体系。这2种结构新颖的葫芦烷型降三萜均具有良好的生物学活性。b型化合物5、6的化学结构见图1。
2.1.3 c型 该类化合物数量很少,仅在葫芦科植物苦瓜[8,18]中被分离鉴定出来,目前发现的仅有2种,一种是在葫芦烷型三萜骨架B环的19位甲基被羟基取代,另一种是19位甲基丢失,B环发生芳香化。c型化合物7、8的化学结构见图1。
2.1.4 d型 该类化合物的主要结构特征是在葫芦烷型三萜骨架D环侧链上的C-17发生氧化,碳原子丢失,C-23、C-25位形成α,β-不饱和酮结构。目前仅在葫芦科植物苦瓜[20-21]和十一叶雪胆[19]中被发现。d型化合物11、12的化学结构见图1。
2.1.5 e型 在所有的一降葫芦烷型三萜化合物中,e型化合物最多。并且,还可根据其A环是否芳香化分为芳香化(13~41、48~52)和非芳香化(42~47、53~58)的e型葫芦烷型降三萜。1987年Achenbach等[22]从中美洲葫芦科植物的种子中分离得到的一种未知结构的葫芦烷型降三萜fevicordin A及其苷fevicordin A糖苷,它们与葫芦烷型三萜的主要区别是C-4位失去1个甲基,同时A环被芳香化。这是该类化合物首次从植物中被分离得到。e型化合物13~58的化学结构见图1。

图1 一降葫芦烷型三萜的化学结构
2.2 二降葫芦烷型
二降葫芦烷型即f型,该类化合物结构特点是在葫芦烷型三萜骨架基础上,A环的C-4位甲基缺失,在C-4、5位形成双键;B环C-9位甲基缺失。化合物59~62的化学结构见图2。

图2 二降葫芦烷型三萜的化学结构
2.3 三降葫芦烷型
三降葫芦烷型即g型,该类化合物(63~72,图3)在自然界的分布较广,在樟科[11]、菊科[13]和葫芦科[36]植物中均有发现,其结构特点是在葫芦烷型三萜骨架的基础上,D环C-17位侧链失去3个碳原子。其中化合物63是第1个被发现的具有三降葫芦烷型骨架的化合物。
2.4 四降葫芦烷型
四降葫芦烷型即h型,该类化合物十分罕见,直到2020年才由Yuan等[13]从宽叶兔儿风中分离得到化合物73(图4),并对其光谱数据进行分析,其结构特点是在葫芦烷型三萜骨架的基础上,D环C-17位侧链失去4个碳原子。这也是首次从兔儿风属植物中分离得到葫芦烷型三萜类化合物。
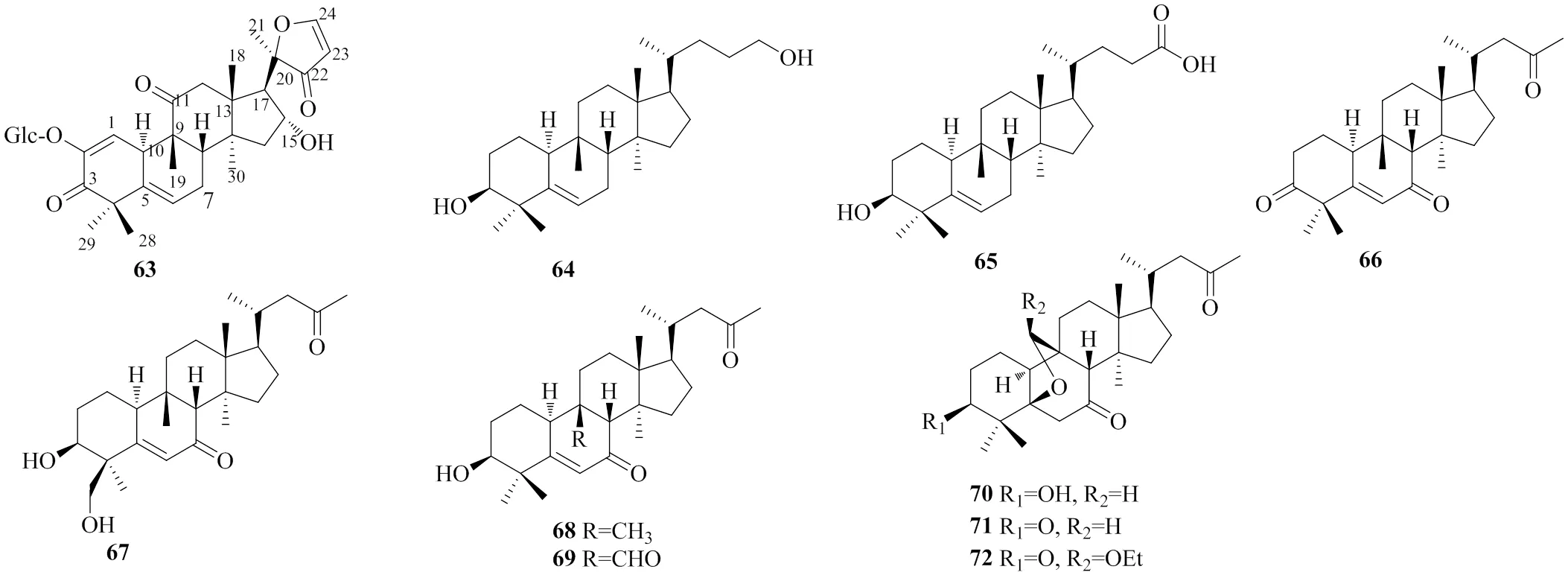
图3 三降葫芦烷型三萜的化学结构
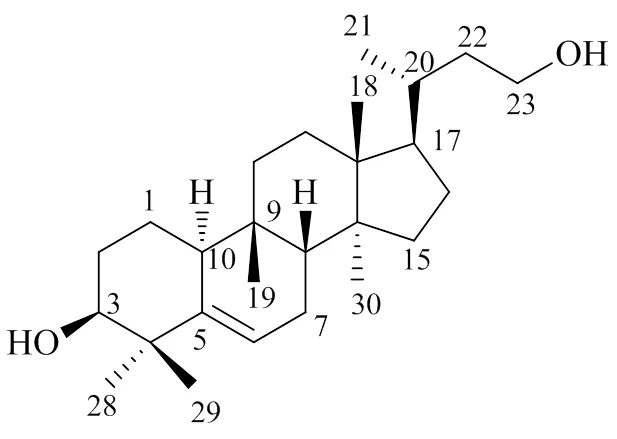
图4 化合物73的化学结构
2.5 五降葫芦烷型
五降葫芦烷型即i型,该类化合物目前仅在葫芦科植物苦瓜中被发现,其结构特征是在葫芦烷型三萜骨架的基础上,D环C-17位侧链失去5个碳原子,化合物74~81的化学结构见图5。
2.6 六降葫芦烷型
化合物84是从秋海棠科植物[3]中分离得到的一种葫芦烷型降三萜类化合物,这也是首次关于葫芦烷型降三萜的报道,其结构特征是在葫芦烷型三萜骨架的基础上,D环C-17位侧链失去6个碳原子形成乙酰基,化合物82~94的化学结构见图6。
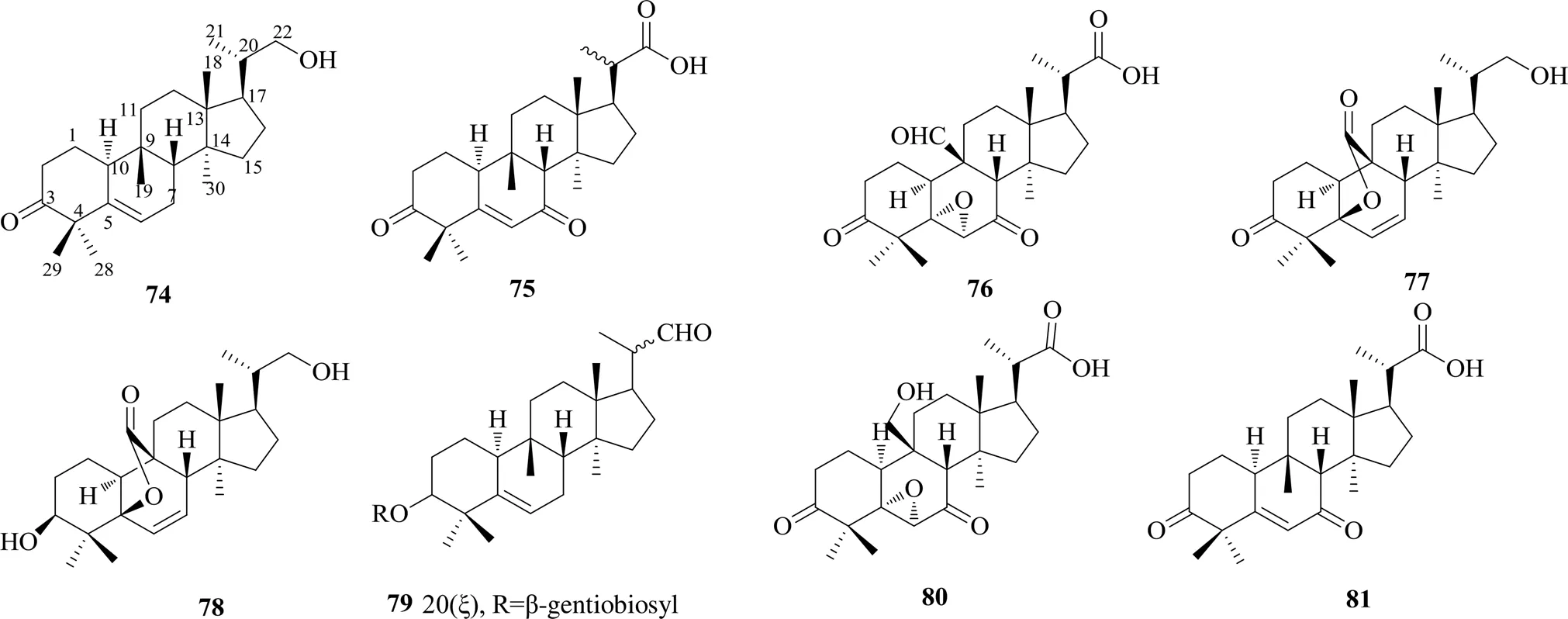
图5 五降葫芦烷型三萜的化学结构
2.7 七降葫芦烷型
七降葫芦烷型即k型,该类化合物数量较少,目前仅在葫芦科植物中被发现,其结构特征与j型类似,但其除了在葫芦烷型三萜骨架的基础上,D环C-17位侧链失去6个碳原子形成乙酰基外,在C-4位还失去1个甲基,A环被芳香化,化合物95、96的化学结构见图7。
2.8 八降葫芦烷型
2002年Kanchanapoom等[45]从葫芦科植物三尖栝楼中分离得到1种化合物(104),这是首次从自然界中分离得到的一类八降葫芦烷型化合物,目前该类化合物仅在葫芦科植物中被发现,其结构特征是在葫芦烷型三萜骨架的基础上,D环C-17位侧链全部缺失,失去8个碳原子,在C-16或C-17位连有1个羰基。化合物97~105的化学结构见图8。
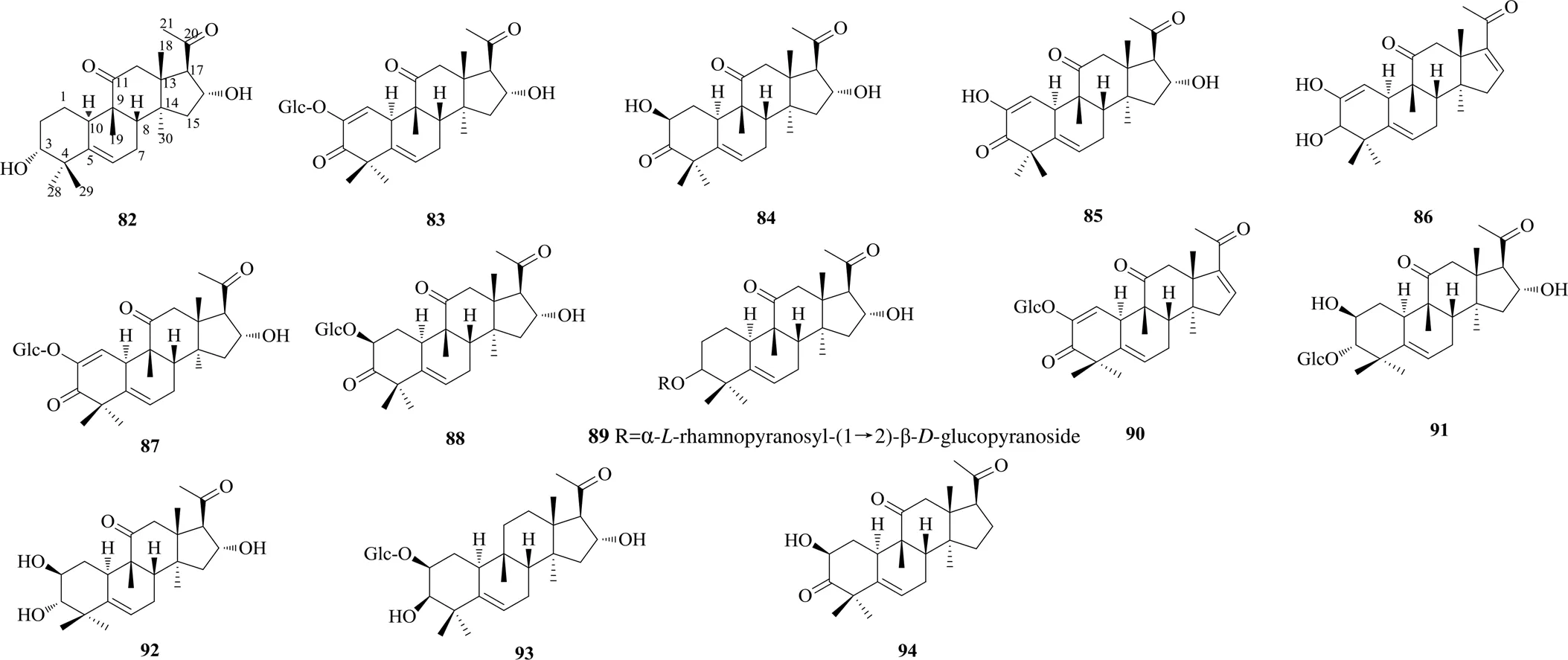
图6 六降葫芦烷型三萜的化学结构
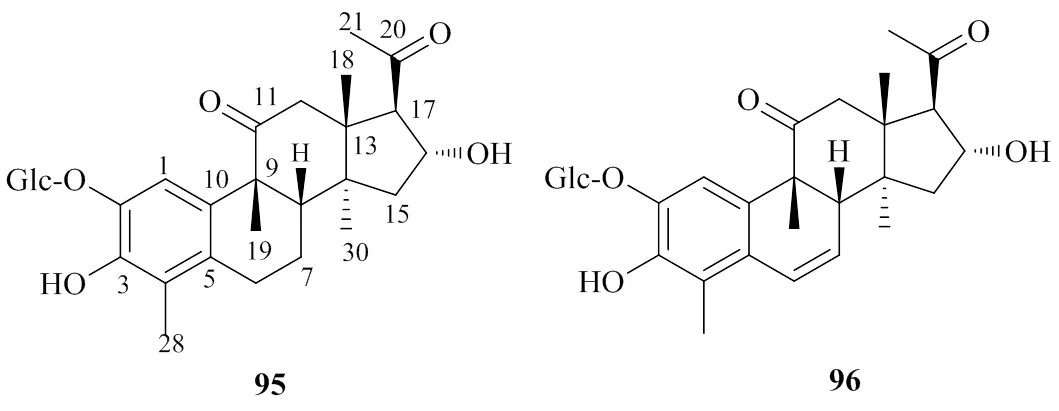
图7 七降葫芦烷型三萜的化学结构
3 药理活性
3.1 抗肿瘤
葫芦烷型化合物一般被认为具有良好的抗肿瘤活性,以往的研究已经证实了其对肝癌、肺癌、胃癌、乳腺癌等均有抑制作用[53]。通过现代药理学研究发现,葫芦烷型降三萜类化合物同样也具有潜在的抗肿瘤活性。Zhang等[21]通过MTT法检测发现化合物12对人早幼粒急性白血病HL-60细胞有很强的细胞毒活性,其半数抑制浓度(median inhibition concentration,IC50)为(7.5±0.8)μmol/L,甚至优于阳性对照5-氟尿嘧啶(5-fluorouracil,5-FU)的活性(IC50=9.5 μmol/L);对人胃癌AZ521细胞表现出中等的细胞毒活性;对人胰腺癌CRL1579细胞、人肺癌A549细胞、人乳腺癌SK-BR-3细胞均表现出一定的细胞毒活性。Konoshima等[54]以淋巴瘤Raji细胞中组织纤溶酶原激活因子(tissue plasminogen activator,t-PA)诱导的EB病毒早期抗原的抑制作用作为抗肿瘤活性的初步评价,对葫芦科植物塔尤泻瓜中的24种29-降葫芦烷型降三萜化合物进行筛选,发现部分化合物可对其表现出显著的抑制作用。此外,该研究还进一步建立了体内小鼠皮肤二阶段致癌模型,经化合物处理后评估各化合物在小鼠皮肤肿瘤模型中的抑制作用,结果显示部分化合物对小鼠皮肤肿瘤表现出显著的抗肿瘤活性。
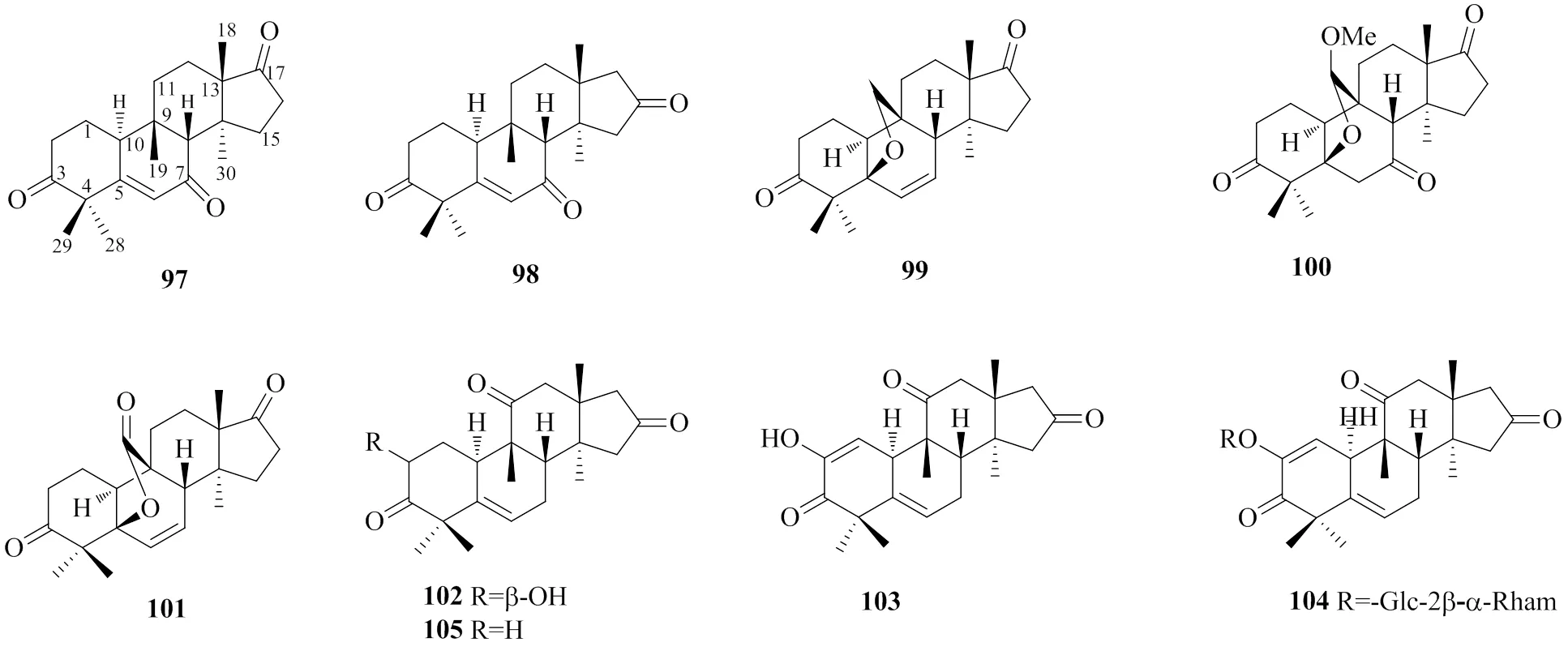
图8 八降葫芦烷型三萜的化学结构
此外,还有研究发现葫芦烷型降三萜类化合物对人前列腺癌PC-3细胞[7]、人结肠腺癌HCT-8细胞[19]、人口腔表皮样癌KB细胞[55]也具有一定的细胞毒活性。
3.2 抗炎
Yuan等[13]以环氧化酶2(cyclooxygenase-2,COX-2)抑制剂NS-398为阳性对照,对化合物64、65、73的COX-2抑制活性进行评价,结果显示化合物64对COX-2的抑制作用最强,化合物65、73次之,该研究通过比较三者的结构差异,并推断其结构中的侧链是影响其对COX-2抑制作用强弱的主要因素。Jardón-Delgado等[52]通过研究发现化合物105对t-PA诱导的小鼠耳肿胀有显著的抗炎作用,当单耳给药量为1 mg时,其抗炎活性可达41%。Almeida等[55]采用角叉菜致大鼠后足水肿的急性非感染炎症模型和角叉菜致大鼠肉芽肿模型,经化合物49、50处理后,评估给药前后大鼠爪体积和肉芽肿质量变化,结果显示两者均能显著抑制大鼠中角叉菜胶引起的后足水肿和肉芽肿损伤,且呈剂量相关性。此外,化合物49、50还可抑制小鼠体内由醋酸引起的毛细血管通透性。
3.3 抗氧化
Jiang等[6]通过研究发现化合物4对黄嘌呤氧化酶(xanthine oxidase,XO)有明显的抑制作用,其IC50值为(15.27±0.29)μmol/L,这与已知的XO抑制剂别嘌醇[IC50=(2.51±0.17)μmol/L]效果相当,并指出其抑制XO的活性可能与化合物结构中α,β-不饱和酮的共轭体系或A-B环的共轭键或C-17位侧链乙酰化有关,并且结构中的共轭体系越多,活性就越高。这也是首次关于内酯型降葫芦素具有XO抑制活性的报道。Douhoré等[10]采用1,1-二苯基-2-苦基肼(1,1-diphe-nyl-2-picrylhydrazyl,DPPH)法和铜离子还原法分别测定化合物52~54的抗氧化活性和还原活性,结果显示化合物52~54均具有良好的抗氧化能力和还原能力,且呈剂量相关性。其中化合物52的抗氧化能力和还原能力都是最高的,该研究还指出其抗氧化活性可能与化合物52结构中含有酚基有关,其还原活性可能和结构中芳香核的共轭和电子离域有关。Lin等[43]通过测定化合物81的DPPH自由基清除活性、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2′-azinobis(3-ethylbenzthiazoline-6-sulphonic acid)diammonium salt,ABTS]自由基阳离子清除活性、超氧阴离子清除能力、XO抑制活性和氧自由基吸收能力等指标评估其抗氧化作用,结果显示虽然该化合物对XO无抑制活性,但对ABTS自由基阳离子、超氧阴离子、氧自由基均具有清除活性且呈浓度相关性,这表明化合物81具有良好的抗氧化的活性。
3.4 肝保护
Chang等[50]以5-FU为阳性对照,经MTT法检测发现葫芦烷型降三萜类化合物可对叔丁基过氧化氢(-butyl hydroperoxide,-BHP)诱导的人肝癌HepG2细胞的损伤有保护作用,且在100 mmol/L浓度下对HepG2细胞无细胞毒活性。Chen等[36]通过研究发现化合物66 10 mmol/L和化合物75 5 mmol/L均可保护-BHP诱导的HepG2细胞损伤达对照组的55%以上。
3.5 抗HIV
Chen等[38]通过体外抑制人T细胞性白血病C8166细胞的人类免疫缺陷病毒(human immunodeficiency virus-1,HIV-1)复制实验发现化合物68、70都具有中等的抗HIV-1活性,其半数有效浓度(median effective concentration,EC50)分别为8.45、25.62 μg/mL,并且对C8166细胞的细胞毒作用均较小(IC50>200 μg/mL)。这也是首次关于葫芦素具抗HIV活性的报道。Chen等[39]通过类似的实验验证了化合物77、101也具有一定的抗HIV-1活性,且对C8166细胞几乎无细胞毒性。
3.6 降血糖
糖尿病是最常见的慢性疾病之一,也是导致心血管疾病发展的主要诱因,主要分为胰岛素依赖性1型糖尿病和非胰岛素依赖性2型糖尿病[56]。此前,关于葫芦烷型三萜化合物的降糖作用也已有文献报道[57],Huang等[58]通过研究发现化合物7在体外能刺激小鼠小肠内分泌STC-1细胞中肠促胰岛素胰高血糖素样肽-1(glucagon likepeptide-1,GLP-1)的分泌,且呈剂量相关性增加,GLP-1可进一步刺激内分泌胰腺分泌胰岛素,从而达到降低血糖的作用。但是目前对此类化合物的降血糖作用研究较少,需要对其作用机制进一步深入研究。
3.7 其他
3.7.1 促进神经细胞突起生长 Xu等[16]研究发现化合物94对神经生长因子(nerve growth factor,NGF)介导的PC12神经细胞突起的生长具有促进作用,并呈剂量相关性。对NGF的现代药理学研究表明促进神经细胞突起生长的生物活性物质可能对阿尔茨海默病的治疗有潜在的应用价值[59],因此该化合物的发现有助于阿尔茨海默病和其他神经系统疾病的治疗。
3.7.2 促进胶原蛋白合成 Morikawa等[60]通过考察化合物93的胶原蛋白合成促进作用和胶原酶抑制活性,发现其在10~30 μmol/L下能显著促进胶原蛋白的合成且对胶原酶活性并无抑制作用,但关于此方面的研究较少,其作用机制需进一步深入探究。因为胶原蛋白有助于维持皮肤弹性,因此该活性化合物可用于预防皮肤衰老等,在一些功能性食品或化妆品上十分具有应用价值。
3.7.3 雌激素受体部分激动/拮抗 Hsu等[8]通过雌激素受体(estrogen receptor,ER)α和β的反式激活实验发现化合物7可表现出微弱的ER激动活性和明显的拮抗活性,这也是首次关于葫芦烷型三萜类化合物调节ER活性的报道,其具体作用机制仍不明确,有待于进一步的药理验证。
3.7.4 影响细胞间信号转导 Kawahara等[4]研究发现化合物1和人成骨样Saos-2细胞共培养6 h,能够调节Saos-2细胞中多瘤增强子结合蛋白2αA(polyoma enhancer binding protein 2αA,PEBP2αA)和破骨形成抑制因子(osteoclastogenesis-inhibitory factor,)基因表达,使两者的信使RNA水平均显著下降,进而抑制骨形成,促进骨吸收,最终导致骨密度的下降。
3.7.5 抗生殖 Almeida等[55]通过动物模型对化合物49、50的抗生殖作用进行评价,发现其能可逆地阻止小鼠生殖周期的发情期,并且毒性较低,因此该类化合物对开发新型避孕药具有十分重要的价值。
4 结语与展望
近年来对葫芦烷型降三萜类化合物的研究极大地丰富了葫芦烷型三萜化学的内容,而且该类化合物的结构新颖多样,多具有潜在的生物活性,研究发现其在抗肿瘤、抗炎、抗氧化、降血糖等方面的药理活性十分显著,可见葫芦烷型降三萜类化合物具有良好的临床应用前景,这也为癌症、糖尿病以及一些炎症相关疾病的治疗提供了新的思路,同时为新药开发提供了新颖的先导结构。此外由于化合物的结构往往与其药理活性紧密相关,通过对此类化合物进行总结,对今后其他类似化合物的结构鉴定及新型活性药物的发现都具有重要意义。但遗憾的是有关此类化合物的研究仍处于初期阶段,获得的成分数量有限,目前关于葫芦烷型降三萜类化合物的药效及作用机制研究还多停留在体外实验,很多药理作用都有待进一步的验证,因此,今后的研究应更着重于利用现代先进的技术手段对新化合物进行探索及其药效和作用机制的进一步深入研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Lou H X, Li X, Onda M,.Stereochemistry of novel triterpenes from[J]., 1991, 39(9): 2271-2276.
[2] Vincken J P, Heng L, de Groot A,.Saponins, classification and occurrence in the plant kingdom [J]., 2007, 68(3): 275-297.
[3] Doskotch R W, Hufford C D.Hexanor-cucurbitacin D, a degraded cucurbitacin fromvar.[J]., 1970, 48(11): 1787-1788.
[4] Kawahara N, Kurata A, Hakamatsuka T,.Two novel cucurbitacins, neocucurbitacins A and B, from the Brazilian folk medicine “Buchinha” () and their effect on PEBP2alphaA and OCIF gene expression in a human osteoblast-like Saos-2 cell line [J]., 2001, 49(10): 1377-1379.
[5] Matsuda H, Nakashima S, Abdel-Halim O B,.Cucurbitane-type triterpenes with anti-proliferative effects on U937 cells from an Egyptian natural medicine,: Structures of new triterpene glycosides, bryoniaosides A and B [J]., 2010, 58(5): 747-751.
[6] Jiang H Z, Hu S, Tan R X,.Neocucurbitacin D, a novel lactone-type norcucurbitacin as xanthine oxidase inhibitor from[J]., 2020, 34(12): 1728-1734.
[7] Liu Y S, Zhang L, Xue J J,.Norcolocynthenins A and B, two cucurbitane 3-nor-triterpenoids fromand their cytotoxicity [J]., 2020, 101: 104045.
[8] Hsu C, Hsieh C L, Kuo Y H,.Isolation and identification of cucurbitane-type triterpenoids with partial agonist/antagonist potential for estrogen receptors from[J]., 2011, 59(9): 4553-4561.
[9] Kurnia D, Akiyama K, Hayashi H.29-Norcucurbitacin derivatives isolated from the Indonesian medicinal plant,(Scheff.) Boerl [J]., 2008, 72(2): 618-620.
[10] Douhoré G Y T, Attioua K B, Soro Y,.Nor-cucurbitacins from the leaves of(Benth.) Müll.Arg.(Euphorbiaceae) [J]., 2020, 143: 104538.
[11] Gan M, Liu M, Liu B,.Cucurbitane glucosides from the root of[J]., 2011, 74(11): 2431-2437.
[12] Ohsaki A, Kubota T, Asaka Y.Perseapicroside A, hexanorcucurbitacin-type glucopyranoside from[J]., 1990, 29(4): 1330-1332.
[13] Yuan W L, Dong X Y, Huang Z R,.Triterpenoids fromlatifolia and their cyclooxyenase-2 (COX-2) inhibitory activities [J]., 2020, 10(1): 13-21.
[14] Fang X D, Phoebe C H, Pezzuto J M,.Plant anticancer agents, XXXIV.cucurbitacins from[J]., 1984, 47(6): 988-993.
[15] Stuppner H, Wagner H.New cucurbitacin glycosides from[J]., 1989, 55(6): 559-563.
[16] Xu J, Kang J, Sun X,.Di-and triterpenoids from the leaves ofand neurite outgrowth promoting effects of PC12 cells [J]., 2016, 79(1): 170-179.
[17] Sahranavard S, Naghibi F, Siems K,.New cucurbitane-type triterpenoids from[J]., 2010, 76(10): 1014-1017.
[18] Li Y C, Xu X J, Yang J,.One new 19-nor cucurbitane-type triterpenoid from the stems of[J]., 2016, 30(8): 973-978.
[19] Feng W, Zhou Y, Zhou L Y,.Novel cucurbitane triterpenes from the tubers ofwith their cytotoxic acitivity [J]., 2019, 24(2): 331.
[20] Liao Y W, Chen C R, Hsu J L,.Norcucurbitane triterpenoids from the fruits ofvar.[J]., 2013, 8(1): 79-81.
[21] Zhang J, Huang Y, Kikuchi T,.Cucurbitane triterpenoids from the leaves of, and their cancer chemopreventive effects and cytotoxicities [J]., 2012, 9(2): 428-440.
[22] Achenbach H, Hefter-Bübl U, Constenla M A.Fevicordin A and fevicordin A glucoside, novel norcucurbitacins from[J]., 1987(6): 441-442.
[23] Achenbach H, Waibel R, Hefter-Bübl U,.Constituents of: New norcucurbitacin and cucurbitacin glycosides [J]., 1993, 56(9): 1506-1519.
[24] Himeno E, Nagao T, Honda J,.Structures of cayaponosides A, B, C and D, glucosides of new nor-cucurbitacins in the roots of[J]., 1992, 40(10): 2885-2887.
[25] Valente L M, Gunatilaka A A, Glass T E,.New norcucurbitacin and heptanorcucurbitacin glucosides from[J]., 1993, 56(10): 1772-1778.
[26] Himeno E, Nagao T, Nonda J,.Studies on the constituents of the root of(VELL.) COGN.I.structures of cayaponosides, new 29-nor-1,2,3, 4,5,10-hexadehydrocucurbitacin glucosides [J]., 1994, 42(11): 2295-2300.
[27] Himeno E, Nagao T, Honda J,.Studies on the constituents of the root of(VELL.) COGN.III.structures of cayaponosides, 29-nor-1, 2, 3, 4, 5,10-hexadehydrocucurbit-6-ene glucosides [J]., 1994, 42(11): 2370-2372.
[28] Himeno E, Nagao T, Honda J,.Studies on the constituents of the root of(VELL.) COGN.II.structures of cayaponosides, new 29-nor-2, 11-dioxocucurbita-3, 5-diene glucosides [J]., 1994, 42(11): 2301-2304.
[29] Nakano K, Kanai Y, Murakami K,.Nor-cucurbitacin glucosides from[J]., 1994, 37(3): 817-820.
[30] Matos M E O, Machado M I L, Craveiro A A,.Nor-cucurbitacin glucosides fromspecies [J]., 1991, 30(3): 1020-1023.
[31] Li D P, El-Aasr M, Ikeda T,.Two new cucurbitane-type glycosides obtained from roots ofSwingle [J]., 2009, 57(8): 870-872.
[32] 王雪芬, 卢文杰, 陈家源, 等.罗汉果根化学成分的研究(I) [J].中草药, 1996, 27(9): 515-518.
[33] Si J Y, Chen D H, Tu G Z.Siraitic acid F, a new nor-cucurbitacin with novel skeleton, from the roots of[J]., 2005, 7(1): 37-41.
[34] 王雪芬, 卢文杰, 陈家源, 等.罗汉果根化学成分的研究(Ⅱ) [J].中草药, 1998(5): 293-296.
[35] 斯建勇, 陈迪华, 沈连钢, 等.广西特产植物罗汉果根的化学成分研究 [J].药学学报, 1999, 34(12): 918-920.
[36] Chen C R, Liao Y W, Wang L,.Cucurbitane triterpenoids fromand their cytoprotective activity in tert-butyl hydroperoxide-induced hepatotoxicity of HepG2 cells [J]., 2010, 58(12): 1639-1642.
[37] Ramalhete C, Lopes D, Mulhovo S,.New antimalarials with a triterpenic scaffold from[J]., 2010, 18(14): 5254-5260.
[38] Chen J, Tian R, Qiu M,.Trinorcucurbitane and cucurbitane triterpenoids from the roots of[J]., 2008, 69(4): 1043-1048.
[39] Chen J C, Liu W Q, Lu L,.Kuguacins F-S, cucurbitane triterpenoids from[J]., 2009, 70(1): 133-140.
[40] Chen J C, Lau C B, Chan J Y,.The antigluconeogenic activity of cucurbitacins from[J]., 2015, 81(4): 327-332.
[41] Miyahara Y, Okabe H, Yamauchi T.Studies on the constituents ofL.II.Isolation and characterization of minor seed glycosides, momordicosides C, D and E [J]., 1981, 29(6): 1561-1566.
[42] Soh D, Bakang B T, Tchouboun E N,.New cucurbitane type triterpenes fromSchumach.(Cucurbitaceae) [J]., 2020, 38: 90-95.
[43] Lin K W, Yang S C, Lin C N.Antioxidant constituents from the stems and fruits of[J]., 2011, 127(2): 609-614.
[44] Achenbach H, Horn K, Dominguez X A,.Cucurbitanes and cucurbitane-type glycosides from[J]., 1993, 33(2): 437-445.
[45] Kanchanapoom T, Kasai R, Yamasaki K.Cucurbitane, hexanorcucurbitane and octanorcucurbitane glycosides from fruits of[J]., 2002, 59(2): 215-228.
[46] Rao M M, Meshulam H, Lavie D.The constituents ofL.Part XXIII.Cucurbitacins and hexanorcucurbitacins [J]., 1974: 2552.
[47] Hatam N A R, Whiting D A, Yousif N J.Cucurbitacin glycosides from[J]., 1989, 28(4): 1268-1271.
[48] Chen C, Qiang S, Lou L,.Cucurbitane-type triterpenoids from the stems of[J]., 2009, 72(5): 824-829.
[49] Wang D C, Pan H Y, Deng X M,.Cucurbitane and hexanorcucurbitane glycosides from the fruits ofcv dayangua [J]., 2007, 9(6/7/8): 525-529.
[50] Chang C I, Chen C R, Liao Y W,.Octanorcucurbitane triterpenoids protect against tert-butyl hydroperoxide-induced hepatotoxicity from the stems of[J]., 2010, 58(2): 225-229.
[51] Chen J C, Zhang G H, Zhang Z Q,.Octanorcucurbitane and cucurbitane triterpenoids from the tubers ofwith HIV-1 inhibitory activity [J]., 2008, 71(1): 153-155.
[52] Jardón-Delgado A, Magos-Guerrero G A, Martínez-Vázquez M.Isolation of a new anti-inflammatory 20,21, 22,23,24,25,26,27-octanorcucurbitacin-type triterpene from[J]., 2014, 9(1): 1934578X1400900.
[53] 张金芳, 张晓瑞, 郑敏思, 等.葫芦素类化合物的药理作用研究进展 [J].医药导报, 2020, 39(12): 1710-1716.
[54] Konoshima T, Takasaki M, Kozuka M,.Inhibitory effects of cucurbitane triterpenoids on Epstein-Barr virus activation and two-stage carcinogenesis of skin tumor.II [J]., 1995, 18(2): 284-287.
[55] Almeida F R C, Rao V S N, Matos M E O.Antiinflammatory, antitumour and antifertility effects in rodents of two nor-cucurbitacin glucosides fromspecies [J]., 1992, 6(4): 189-193.
[56] 余爱琴.什么是糖尿病?糖尿病有危害吗? [J].医疗保健器具, 1997, 4(4): 28.
[57] Harinantenaina L, Tanaka M, Takaoka S,.constituents and antidiabetic screening of the isolated major compounds [J]., 2006, 54(7): 1017-1021.
[58] Huang T N, Lu K N, Pai Y P,.Role of GLP-1 in the hypoglycemic effects of wild bitter gourd [J]., 2013, 2013: 625892.
[59] Bai R, Zhang C C, Yin X,.Striatoids A-F, cyathane diterpenoids with neurotrophic activity from cultures of the fungus[J]., 2015, 78(4): 783-788.
[60] Morikawa T, Inoue N, Nakanishi Y,.Collagen synthesis-promoting and collagenase inhibitory activities of constituents isolated from the rhizomes ofRoyle ex Benth [J]., 2020, 143: 104584.
Research progress on nor-cucurbitacin triterpenes
HUO Xiao-shuang, WANG Jun-chi, SI Jian-yong
Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education, Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China
Nor-cucurbitacin triterpenes are a class of compounds with novel structures, which are formed by the reduction of one or several carbons on the 30 carbons skeleton of cucurbitacin-type triterpenoids.According to the position of vacant carbon atom, they could be divided into twelve types, including 2-nor (a), 3-nor (b),19-nor (c), 27-nor (d), 29-nor (e), 19,29-nor (f), 25,26,27-nor (g), 24,25,26,27-nor (h), 23,24,25,26,27-nor (i), 22,23,24,25,26,27-nor (j), 22,23,24,25,26,27,29-nor (k) and 20,21,22,23,24,25,26,27-nor (l).Moreover, nor-cucurbitacin triterpenes have various pharmacological effects, such as antitumor, anti-inflammation, antidiabetics, and anti-oxidant, etc.Plant distribution, chemical structural characteristics and pharmacological activities of nor-cucurbitacin triterpenes were systematically summarized in this paper, in order to provide a reference for further development and rational utilization of these compounds.
nor-cucurbitacin triterpenes; antitumor; anti-inflammation; antidiabetics; anti-oxidant
R282.710.5
A
0253 - 2670(2022)05 - 1558 - 12
10.7501/j.issn.0253-2670.2022.05.032
2021-06-23
中国医学科学院创新工程项目(2017-12M-1-013)
霍晓爽,女,硕士,主要从事生药学研究。E-mail: huoxiaoshuang@implad.ac.cn
通信作者:王钧篪,男,助理研究员,博士,主要从事天然植物药化学成分的研究。E-mail: jcwang@implad.ac.cn
斯建勇,男,教授,博士生导师,主要从事天然植物药化学成分的研究。E-mail: jysi@implad.ac.cn
[责任编辑 崔艳丽]