汉石桥湿地南部核心区富营养化成因及防治对策
张 勇 董 雪 蔡春轶* 颜 泓 党永峰 季世琛 王雪瑞
(1 北京市顺义区汉石桥湿地自然保护区管理中心,北京 101309;2 国家林业和草原局调查规划设计院,北京 100714;3 北京圣海林生态环境科技股份有限公司,北京 100083)
水体富营养化是一种因水生态系统中氮、磷营养盐过多而造成的水污染现象,国内外研究主要集中在水体富营养化成因、评价、危害和防治等几个方面。20世纪下半叶,国外学者发现河流(湖、库)受水文和水系特征、沉积物性质、地形地貌和周边植被特征等因素影响,易处于富营养状态,但极少发生自然富营养化;而人类活动产生的生活污水、工业废水、农田肥料等才是引发水体富营养化的主要原因(Prepas et al, 2003)。在水体监测评价方面,早期以透明度、营养盐、叶绿素a等水体理化指标为主(Ritter, 1985),近年来卫星遥感监测、大数据在线监测等方法在监测预警方面得到广泛应用。国内对富营养化水体的评价方法以综合指数法、主成分分析法、人工神经网络法等统计学方法为主,国外以综合评价法(ASSETS)、河口营养状况评价法(OSPAR-COMPP)等为主(黄徐等, 2020; Bricker et al, 2003)。水体富营养化会造成水生态系统退化、损害养殖经济收益、威胁饮用水安全等(Silbergeld et al, 2000; 高爱环等, 2005)。截至2020年,我国110个重要的湖泊(水库)中,有29%的湖泊(水库)处于轻度富营养及以上状态(中华人民共和国生态环境部,2021),富营养化水体的治理仍是未来水生态建设工作的重点之一。
汉石桥湿地是北京市的大型芦苇沼泽湿地之一,素有京郊“小白洋淀”之称。湿地南部核心区水体近几年出现富营养化现象,对湿地生态环境造成一定破坏。本研究对南部核心区富营养化成因进行分析,并提出水体富营养化防治策略,旨在为湿地保护和修复工作提供科学依据。
1 材料与方法
1.1 研究区概况
汉石桥湿地位于潮白河水系箭杆河支流蔡家河下游,实际控制面积5.74 km2,平均地表径流量4.4×108m3,地下水位一般在1.5~2.5 m,储水量约1×107~2×107m3/km2(闫子, 2021)。湿地水域主要由核心区和游览区组成(图1),芦苇保护区主要在北部核心区,直接接收再生水补水,与其他水域相对隔离;南部核心区与游览区互相联通,两处水域中水生植物群落较少。湿地平均水深1.2 m,主要水源为再生水,其次为自然降水,年平均水深1.2 m。
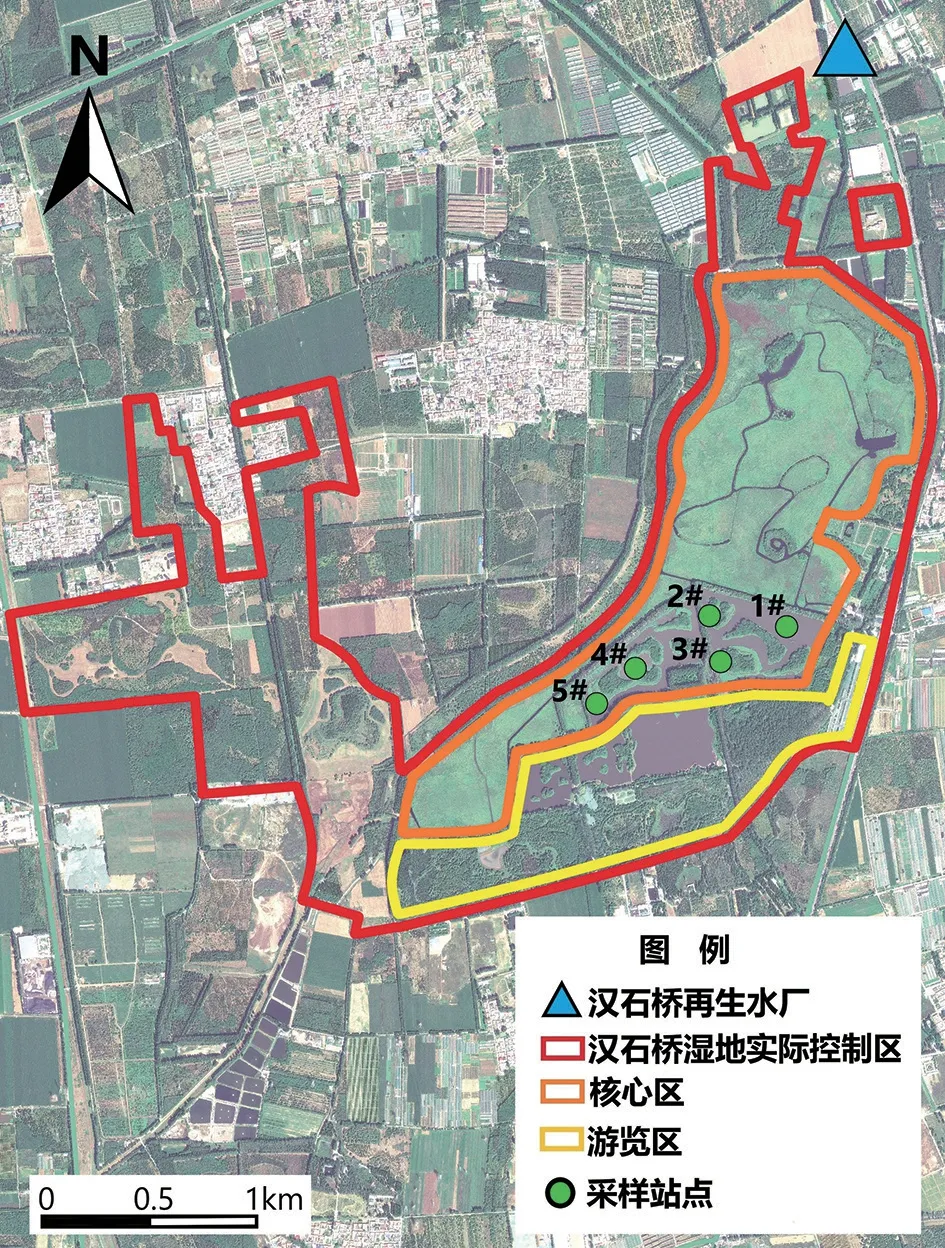
图1 采样站点位置图Fig.1 Sampling site location
汉石桥再生水厂处理杨镇镇区的生活污水与工业废水,处理工艺为“人工格栅-破碎机-WWRR曝气塘-砂滤罐”,再生水排放标准为《城镇污水处理厂排放标准DB11 890-2012》B级,日均排放量约3 600 m3(汛期约4 500 m3)。再生水在进入北部核心区前,通过再生水厂西侧面积为13 hm2的潜流湿地进行深度处理,使水质达到总氮≤1.5 mg/L,总磷≤0.1 mg/L标准。近几年由于再生水厂内曝气塘处理效率低、冬季进水水质超标,以及潜流湿地净化效果受温度影响等问题(李伟等, 2019),进入北部核心区的再生水无法稳定达到上述设计标准。
2019年3—9月以南部核心区为研究区域,每月进行1次调查采样工作,在南部核心区范围内共设置5个采样站点,其中1#、2#、3#站点位于东侧水域,4#、5#站点位于西侧水域,站点分布如图1所示。
1.2 水质采样与检测
使用有机玻璃采水器在水面下0.5 m处采集1 L水质样品、1 L叶绿素a(Chl.a)样品(加入1 mL 1%碳酸镁悬浊液),所有样品装入聚乙烯样品瓶中置于4℃保温箱内储存运输,并在12 h内完成检测。使用HACH SL1000型便携式多参数水质快速检测仪现场测定水体温度(WT)、pH值和溶解氧(DO),使用黑白盘现场测定透明度(SD),使用艾沃斯AS-V5型数字照度计现场测定光照强度(Lux)。使用重铬酸钾法测定化学需氧量(COD)、酸性高锰酸钾法测定高锰酸盐指数(CODMn)、碱性过硫酸钾消解紫外分光光度法测定总氮(TN)、钼酸铵分光光度法测定总磷(TP)、丙酮提取分光光度法测定叶绿素a(Chl.a),具体方法参照《水和废水监测分析方法(第四版)》(国家环境保护总局, 2002)进行。
1.3 数据分析与作图
选取SD、TN、TP、CODMn、Chl.a5项指标,采用综合营养状态指数(Trophic Level Index,TLI)对水体的营养状态进行评价(武瑾等, 2021)。将计算结果TLI进行分级 :贫营养(0<TLI(∑)≤30)、中营养(30<TLI(∑)≤50)、轻度富营养(50<TLI(∑)≤60)、中度富营养(60<TLI(∑)≤70)和重度富营养(70<TLI(∑)≤100)。为直观表现各月水体富营养状态差异,利用ArcGis10.2软件对TLI数据进行绘图。
利用SPSS 19.0软件对各项水质指标进行Pearson相关性分析及主成分分析(PCA),相关分析用于研究叶绿素a与各项水质指标之间的相关性。在主成分分析前,将各项水质数据进行Z-Scorre标准化处理,以解决各指标纲量不同的问题(武瑾等, 2021),同时利用KMO-Bartlett 球形检验对各个变量的相关性进行检验,当KMO值>0.6、P值<0.05时,表明该组水质因子之间相互独立,可以进行主成分分析。
2 结果与讨论
2.1 水体富营养化评价
由图2可知,2019年3—9月南部核心区TLI变化范围为45.70~67.95,均值为59.33±6.03,最低值出现在3月,最高值出现在9月。南部核心区水体处于轻度-中度富营养状态。以均值来看,调查期间5个站点富营养化程度由低到高分别为4#、5#、1#、2#、3#,其中4#与5#呈轻度富营养状态,1#、2#与3#呈中度富营养状态。东侧水域富营养化程度高于西侧,原因是两处水域相对隔离,而再生水自1#站点附近进入南部核心区,TN>0.3 mg/L、TP>0.02 mg/L的水体为富营养化水体(余林康, 2013),输入过量的营养盐加重了东侧水域的富营养化程度。东侧水域水生植物数量少、化感作用削弱、充足的光照与营养盐共同促进了藻类的生长(Zhang et al,2018)。各月富营养化程度由低到高依次为:3月、5月、4月、6月、7月、9月、8月,其中仅3月呈中营养状态,4—5月为轻度富营养状态,而6—9月均为中度富营养状态。6—9月南部核心区月平均水温为25.57~33.59℃,是多数藻类的最适生长温度(柴小颖, 2009),同时芦苇湿地表层土壤中有机质含量高(赵同谦等, 2008),汛期集中降雨形成的地表径流会携带大量有机质进入水体,加重了水体污染程度。流动水体会降低藻类密度(Tang et al, 2018),而湿地内各水域之间联通性差、水体不流动,悬浮物和颗粒态营养盐逐渐沉积,增加了上层水体透明度与溶解性营养盐含量(汤显强, 2020),由于水体更新周期长,营养盐逐年积累(郑剑锋等,2014),多种因素共同促进了藻类生长。对各月TLI进行单因素方差分析发现,TLI随时间变化并未表现出显著性差异(P>0.05),在一定程度上说明南部核心区水体富营养化程度较为稳定。武士蓉等(2015)研究发现2013年南部核心区除4月与10月处于中营养状态外,5月至9月均为富营养状态,与本次调查结果相似。

图2 汉石桥湿地南部核心区水体富营养化状态Fig.2 Eutrophication status in the southern core area of Hanshiqiao wetland
2.2 叶绿素a与水质因子的相关性分析
Chl.a反映水体中浮游植物的生物量特征,与各项水质因子的相关关系复杂,利用相关性分析研究Chl.a与SD、Lux、pH值、WT、DO、COD、TN、TP 8项水质因子之间的关系,结果如表1所示,Chl.a与SD、pH值、DO呈极显著负相关,Chl.a与Lux、WT、COD、TN呈极显著正相关。

表1 Pearson相关系数Table 1 Pearson correlation coefficient
在一定范围内,浮游植物的光合作用速率与光照强度和水温成正比。春季随着光照时间与强度的增加、水温的回升,浮游植物大量繁殖,悬浮在水体中,降低了水体透明度。已有文献报道Chl.a通常与DO、pH值呈正相关(刘毛亚等, 2020; 吴阿娜等, 2011),但在富营养化水体中浮游植物过度繁殖造成有机质增多,生物呼吸与有机质氧化会消耗大量氧气;同时水生植物数量稀少限制了水体溶解氧的主要来源,最终导致溶解氧含量降低,因此Chl.a与DO呈极显著负相关,此结果与贾振睿等(2015)的研究结果一致。藻类衰亡分解会释放溶解性有机碳(DOC),使水体COD升高,因此Chl.a与COD呈极显著正相关(阮晓红等, 2008)。多数研究表明Chl.a与pH值呈正相关(罗宜富等, 2017; 李蒙等, 2009),原因是浮游植物光合作用会吸收水体中的CO2,使HCO3-减少、pH值上升,但此类研究结果多出自未发生严重水体富营养化或水华的水域。本研究中由藻类衰亡分解产生的DOC会在微生物的作用下转变为溶解无机碳(DIC,包括无机碳酸盐、碳酸氢盐、H2CO3及CO2),造成水体pH值降低,Chl.a与pH值呈极显著负相关,与李翔等(2021)的研究结果一致。
浮游植物的相关指标与氮、磷营养盐的关系复杂,一方面浮游植物在生长过程中会吸收氮、磷营养盐,在衰亡过程中又会释放氮、磷营养盐(吴怡等, 2013);另一方面其群落特征也会受到其他环境和生物因素的影响。浮游植物生长过程中吸收氮与磷的原子比为16/1(Redfield,1958),本次调查中TN/TP值均小于16,说明南部核心区的浮游植物磷元素充足但缺少氮元素,而TN与Chl.a呈正相关,TP与Chl.a无相关性,综合推断TN是南部核心区浮游植物生长的限制性因素。
2.3 水体富营养化驱动因子分析
利用主成分分析在众多水质数据中剔除具有相关性的因子,筛选出几个独立的综合因子对研究结果进行充分解释(蔡金傍等, 2007; 方红卫等, 200; 林晶, 2017)。将3—9月的SD、Lux、pH值、WT、DO、COD、TN、TP、Chl.a水质数据进行标准化处理,并进行KMO-Bartlett 球形检验,检验结果KMO为0.631(P<0.05),表明可以进行主成分分析,结果如表2所示。

表2 主成分提取结果及载荷系数Table 2 Principal component extraction results and load coefficient
主成分分析共提取出3个特征根值大于1的主成分,方差解释率分别为48.16%、17.866%、12.301%,累积方差解释率为78.327%。主成分1与主成分2的方差解释率大、包含信息量多,将与主成分1相关联的水质因子作为影响水体富营养化的主要驱动因子,与主成分2相关联的水质因子作为次要驱动因子。
主 成 分1中,Lux、pH值、WT、DO、COD、Chl.a等载荷系数绝对值大于0.6,主成分1反映了光照条件、温度与溶解氧等水体的物理特征、酸碱特征、有机质特征及浮游植物生物量特征,其中Lux、WT、COD、Chl.a等与主成分1呈正相关,pH值、DO与主成分1呈负相关。主成分2中,TN和TP的载荷系数的绝对值>0.6,主成分2反映的是水体中氮、磷营养盐特征,二者均与主成分2呈正相关关系。由前文分析与王震等(2014)的研究可知,pH值、DO、COD是影响Chl.a的被动因子,因此造成南部核心区水体富营养化主要驱动因子为Lux、WT、Chl.a,次要驱动因子为TN与TP。
3 水体富营养化防治对策
3.1 再生水利用
调查期间南部核心区平均水位为1.1 m,其中6月平均水位最低,为0.96 m。再生水是湿地的主要水源,日常水量不足造成南部核心区常年处于低水位状态。浅水水体与底泥之间强烈的物质交换,加速了沉积物中的氮、磷营养盐向水体中释放,降低了水体污染负荷能力,易造成水体发生富营养化。为满足杨镇镇区日益增长的污水处理需求,2018年7月—2020年7月,汉石桥再生水厂进行改扩建工程,每年可为汉石桥湿地提供4.2×106m3的合格再生水,约占汉石桥湿地待恢复区及现状湿地核心区最少需水量的69.58%(中国科学院生态环境研究中心, 2017)。在此基础上,加强湿地水资源规划利用与杨镇海绵城市建设、北京城市学院二期建设的密切联系,使再生水补水量达到湿地生态需水量。
3.2 水动力条件改善
合格的再生水可以稀释污染物,但再生水的引入需要结合南部核心区水动力分布特征,因地制宜地设置进水口、出水口与流动路径,必要时可通过一定的工程措施进行引导(邢广彦等, 2006)。在现有河湖富营养化治理的案例中,设置过水通道进行引水稀释、构建水系循环等措施均取得了良好的效果(李安峰等, 2013; 吴菊珍等, 2011; 姚云辉等, 2019)。北部核心区是再生水的主要储存净化区,仅在春、秋季通过1处管道向南部核心区补水,水流路径过于单一(北部核心区-南部核心区-游览区),日常水体流动性差,加剧湿地水体的富营养化程度。在现有高程及再生水充足的情况下,利用3处水域及周边自然和人工沟渠,结合新建、改建输水管道,重新构建多样化的调水路径。再生水在不同位置进入北部核心区,经芦苇群落进一步净化后,再通过多条管道与沟渠分别进入南部核心区与游览区的不同区域,形成“一区净化,多线调水”的格局,同时提升3处水域的水体流动性。
3.3 水生生物调控
当前汉石桥湿地有23种鱼类,包括植食性、肉食性、杂食性和滤食性鱼类,减少植食性鱼类(尤其是草鱼)的数量是水体由藻型向草型转变的重要前提。增加肉食性鱼类的数量可以通过下行效应间接减少藻类数量,提升水体透明度(李传红等, 2008)。以鲤(Cyprinus carpio)、黄颡鱼(Pelteobagrus fulvidraco)为主的底栖杂食性鱼类日常活动会搅动底泥再悬浮,使沉积物中的营养物质重新进入水体(赵文等, 2000),加剧水体富营养化,也会造成下层水体浑浊影响沉水植物生长,因此需要减少鲤、黄颡鱼等杂食性底栖鱼类的数量。滤食性鱼类可以有效降低藻类总生物量,但会使藻类向小型化转变、物种多样性降低(阮景荣等, 1995),因此是否需要调控滤食性鱼类数量有待进一步研究。
2007—2008年南部核心区拥有丰富的水生植物群落,受水位变化、鱼类啃食等因素影响,至2011年以后水生植物群落基本消失。水体富营养化成因的分析结果显示,在有效控制植食性鱼类的前提下,亟需重建丰富的水生植物群落。水生植物在遮蔽水面光照、降低水下温度、减少底泥再悬浮及污染物释放、吸收氮磷营养盐、抑制藻类生长等方面具有良好作用(朱元钦等, 2021),水生植物种类应优先选择对总氮吸收能力强的本地物种,如芦苇(Phragmites communis)、水葱(Scirpus validus)、香 蒲(Typha orientalis)、金鱼藻(Ceratophyllum demersum)等(马国强等, 2020)。
水体富营养化会破坏底部生境,降低大型底栖动物多样性(龚志军等, 2001),当前南部核心区底栖动物以耐污类摇蚊幼虫(Chironomus)为主,而背角无齿蚌(Anodonta woodiana)、圆顶珠蚌(Unio douglasiae)、梨形环棱螺(Bellamya purificata)等滤食性底栖动物数量较少。蚌、螺类主要滤食水体中藻类及有机颗粒可有效控制藻类与悬浮物数量、提升水体透明度(孟顺龙等, 2009)。根据南部核心区生境特征选择适宜的物种,在底质改良或水生植物群落初步恢复之后再进行投放,以保障底栖动物的成活率。
4 结论
(1)汉石桥湿地南部核心区TLI为45.70~67.95, 均值为59.33±6.03,水体处于轻度—中度富营养状态。水体富营养化的主要驱动因子为光照强度、水温、叶绿素a,其次为总氮与总磷。
(2)叶绿素a与透明度、pH值、溶解氧呈极显著负相关,相关系数分别为-0.473、-0.576、-0.502;与光照强度、水温、化学需氧量、总氮等呈极显著正相关,相关系数分别为0.661、0.539、0.486、0.630,TN是藻类生长的限制因子。
(3)依据调查分析结果,提出再生水利用、水动力条件改善、水生生物调控等水体富营养化治理措施。

