奥氮平和齐拉西酮不良事件信号挖掘与分析*
张华琦,张 妮,王敏建△
(1.重庆市精神卫生中心金紫山院区,重庆 401147; 2.重庆医科大学药学院,重庆 400016)
药品不良事件(ADE)自发呈报系统可获取药物在真实世界中的安全性数据,是目前最主要的ADE 监测方式,其信号检测是目前药品上市后监测的重要数据来源。指定医疗事件(DME)清单由国际医学用语词典(MedDRA)中的首选语(PT)组成,由欧洲药品管理局(EMA)制订,是欧洲药品监管网络的工具之一,EMA 和其他成员国使用该清单来关注值得特别关注的可疑ADE报告,并用于筛选和识别与多个治疗类药物/药理学相关的严重医学事件[1]。精神分裂症治疗的重要手段为药物治疗[2],目前临床常用药物包括典型与非典型抗精神病药物,后者因其更强的抗精神病作用和更少的锥体外系反应而广泛应用于临床[3]。但国家药品监督管理局发布的多期药品不良反应(ADR)信息通报中提出,应关注非典型抗精神病药物的严重ADR 如肝衰竭、尿潴留风险等相关信息[4-5],说明非典型抗精神病药物仍需持续进行上市后监测。奥氮平与齐拉西酮均为临床常用非典型抗精神病药物,既往的临床试验提示,2种药品对精神分裂症均有较好疗效,但严重ADR 的差异不明[6]。故需挖掘美国食品和药物管理局不良事件报告系统(FAERS)中奥氮平与齐拉西酮的ADE 信号,分析高频上报事件及DME 事件,以评价这2 种药品在真实世界中的安全性,并总结其特征,为临床应用提供参考。现报道如下。
1 资料与方法
1.1 数据来源
数据源于FDA 的FAERS 数据库,其作为FDA 用于药品上市后安全性监测及评价的首要信息来源,收集了各国药师、制药企业、医师、消费者等的ADE报告,每季度更新1次[7]。FAERS中所有ADE数据均采用MedDRA中的PT 进行编码。通过应用程序编程接口(API)提取FAERS 数据库中结构化的ADE 数据。为保证数据的完整性,限定时间为2004 年1 月1 日至2020 年9 月30日,目标药品通用名为“Olanzapine”“Ziprasidone”,得到目标药品的ADE报告。
1.2 信号检测方法
比例失衡测量法是国际常用的ADE 信号检测方法,其原理是比较ADE 出现频率与背景频率的差异,即在一个数据库中,当目标药品- 事件的组合出现的频率明显高于整个数据库的背景频率,同时达到一定阈值时即为出现1个ADE信号[8]。本研究中采用比例失衡测量法中的频数法,即报告比值比(ROR)法[9]进行信号检测。ROR值越大,其与可疑ADE间的关联性越强[10]。
1.3 DME 清单筛选
重点评价和分析上报频数前30 位的ADE。基于DME 清单对奥氮平、齐拉西酮的所有安全信号进行DME 清单筛选。DME 清单为欧盟于2016 年发布,包括急性肝损伤、粒细胞缺乏和尖端扭转型室性心动过速等在内的62个PT信号。
2 结果
2.1 ADE 上报基本情况
分别提取奥氮平、齐拉西酮的ADE 报告320 份和544 份。其中,奥氮平报告中男女均衡,齐拉西酮报告中女性多于男性;年龄分布均集中在未成年人;患者结局以导致住院或住院时间延长为主。详见表1。
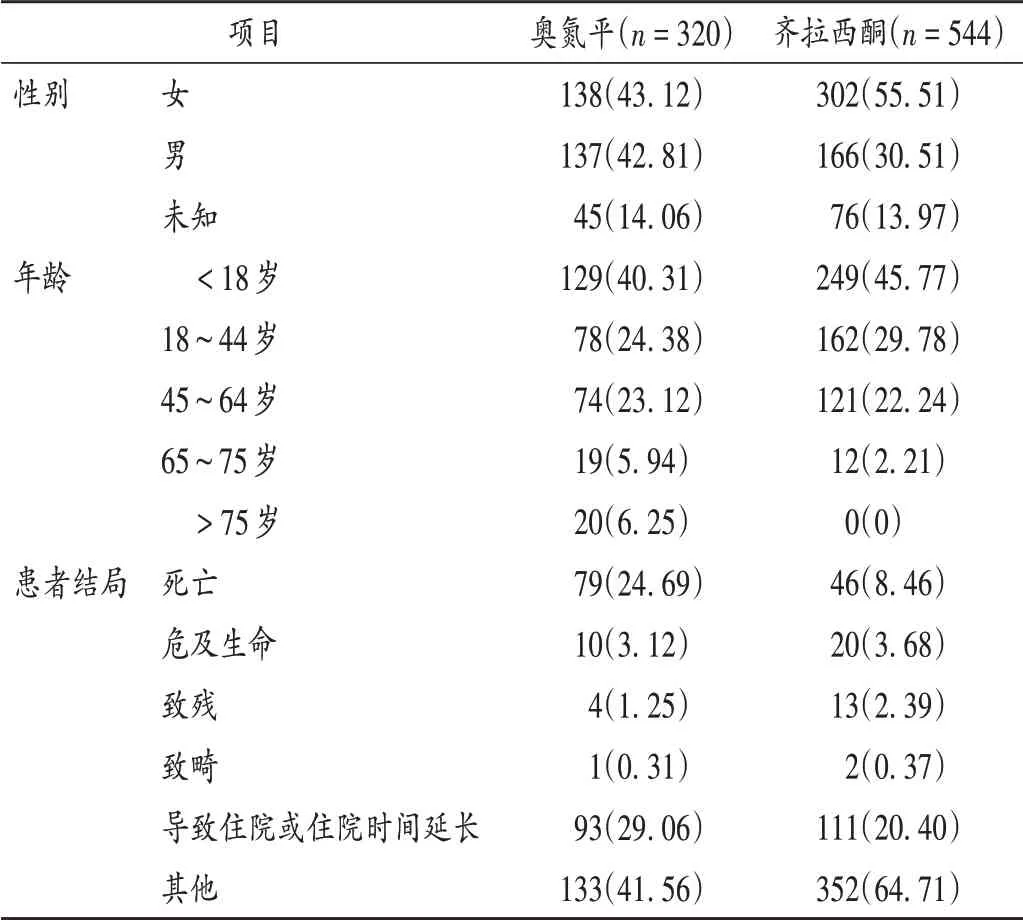
表1 ADE报告基本情况[例(%)]Tab.1 Basic information of ADE reports[case(%)]
2.2 信号检测结果
奥氮平、齐拉西酮分别检出6 个、11 个药品说明书未收录信号。上报频数前30 位的ADE 中,两药均以神经系统疾病为主。奥氮平以糖尿病性昏迷、代谢紊乱及神经抑制性恶性综合征信号较显著;齐拉西酮以肥胖、神经抑制性恶性综合征及2型糖尿病信号较显著。两药ADE均涉及糖尿病、2型糖尿病、吞咽困难等。详见表2。

表2 上报频数前30位ADE信号检测结果Tab.2 Detection results of ADE signals with top 30 reporting frequencies
ADE 信号清单筛选后奥氮平和齐拉西酮分别检出11 种和8 种DME,均以横纹肌溶解信号最显著。详见表3,共同检出信号的ROR详见图1。

图1 DME共同信号检测结果Fig.1 Detection results of the common DME signals

表3 DME信号检出情况Tab.3 The detection of DME signals
3 讨论
本研究中基于FAERS 数据库进行ADE 信号挖掘,探索性地分析了奥氮平和齐拉西酮在自发呈报系统中的高频上报事件和DME 事件。两药的高频上报事件多集中在神经系统疾病,与赵泽青等[11]及马敏康等[5]的研究结果一致。奥氮平和齐拉西酮对黑质纹状体多巴胺(D2)受体有阻断作用[12],故易出现神经系统性ADE。两药高频上报ADE 以神经抑制性恶性综合征信号较显著[奥氮平,ROR= 50.31,95%CI(47.51,53.27);齐拉西酮,ROR= 34.60,95%CI(31.16,38.42)]。该病为严重且可致命的疾病,接受过抗精神病药物治疗患者的发病率为3%,且非典型抗精神病药物相比典型抗精神病药物的致死率更高[13-14],用药时应高度警惕。
奥氮平与齐拉西酮均检出了横纹肌溶解信号。横纹肌溶解常伴急性肾功能衰竭、电解质紊乱、心律失常等症状,有肌痛、无力、水肿、茶色尿等常见临床表现[15]。但当前研究中抗精神病药物导致横纹肌溶解的机制尚不明确。有研究显示,抗精神病药物可通过间歇性增加骨骼肌细胞膜的通透性促进肌酸激酶渗透;另一种中枢机制学说的解释是,药物通过阻断纹状体通路多巴胺受体而引起肌肉僵硬、不自主运动、静坐不能和肌酸激酶升高[16]。患者接受奥氮平或齐拉西酮治疗时如出现肌痛、肌无力、腹痛及茶色尿,医务人员应及时监测患者的肌红蛋白、乳酸脱氢酶、肌酸激酶等肝肾功能指标,判断是否发生了横纹肌溶解,确诊后根据其严重情况,及时给予停药、利尿、碱化尿液等系列措施,必要时进行血液透析直至好转[17]。
两药共同检出的DME 信号中,均存在尖端扭转型室性心动过速及心源性猝死,齐拉西酮的信号值高于奥氮平,在检测频率排名前30 的PT 信号中,齐拉西酮也检出了QT 间期延长,应引起重视。按心率校正的QT间期(QTc间期)作为反映心肌细胞复极过程的指标,可能与多源性室性期外收缩和多形性室性心动过速有关,可能导致晕厥、心源性猝死和心脏停搏等[18]。临床试验表明,齐拉西酮至少延长QTc 4.7 ms,超过基线的1%,过量时则中度延长QTc[19]。KAYE 等[20]的研究中,全球40万例患者服用齐拉西酮后未发现与之相关的尖端扭转型室性心动过速。迄今为止,虽然齐拉西酮在临床应用中还未出现QT 间期延长导致临床ADE 风险性增加的现象,但有明显心血管病史(如近期发生过急性心肌梗死、非代偿性心力衰竭、心律不齐、QT 间期延长或家族性QT 间期延长综合病史)的患者应避免使用齐拉西酮。QTc间期持续超过500 ms的患者应停用齐拉西酮[21]。奥氮平过量也未见QTc 延长,其延长QTc 间期的效应与氟哌啶醇或利培酮相似[19]。也有研究表明奥氮平会增加QTc 延长的风险[22]。因此,使用齐拉西酮与奥氮平时应密切关注患者QT 间期延长及尖端扭转型室性心动过速的发生。
文献[4]中提到的“非典型抗精神病药物导致的粒细胞缺乏”,在本研究中也有检出,且奥氮平信号值[ROR= 6.54,95%CI(5.73,7.46)]大 于 齐 拉 西 酮[ROR= 3.90,95%CI(2.87,5.31)]。有研究认为,氯氮平会导致严重的粒细胞缺乏症,而奥氮平则不会引起该症,但奥氮平、齐拉西酮致粒细胞减少的报道[23-24]。鉴于非典型抗精神病药物潜在的致粒细胞缺乏症风险,临床医师应仔细询问患者病史,有白细胞减少或骨髓抑制者应禁用或慎用该类药品。严格按药品说明书要求,于用药前、治疗中及停药后监测患者的白细胞及中性粒细胞计数,确保用药安全。
本研究中通过数据挖掘,从大量ADE 数据中评价奥氮平和齐拉西酮较关注且严重的ADE,反映了药品在真实世界的安全性。临床应加强对奥氮平和齐拉西酮严重ADR 和新的ADR 信号的关注,以保障患者的用药安全。需注意的是,本研究中信号检测方法产生的信号不代表药物和该信号存在必然因果关系,尚需更进一步的临床研究确定。同时,数据库中部分报告带有的随意性、内容不完整性和低报漏报等也会对结果造成偏倚[25]。尽管如此,本研究仍以一种快速且低耗的方法,为药品上市后的安全性评价提供了新的思路。

