2016—2020年华北地区猪繁殖与呼吸综合征病毒分子流行病学调查
王丙雷,王 晶,刘 媛,陈少杰,顾文源,郭 禹,2,范京惠,2*,左玉柱,2* (.河北农业大学动物医学院,河北 保定 0700;2.河北省兽医生物技术创新中心,河北 保定 0700;.邢台市邢东新区动物卫生监督所,河北 邢台 05400)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)也被称为猪神秘病或蓝耳病,该病是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起,以各年龄段猪表现呼吸道症状,妊娠母猪流产、死胎以及高病死率为主要特征[1-2]。PRRS最早于1987年发生于美国,并很快流行于欧洲和美洲[3]。直至2006年由变异毒株HP-PRRSV为病原引起的高致病性PRRS在我国南方暴发,引起了人们的关注和重视,随后在国内出现了极易的类NADC30毒株[4]。高致病性毒株在全国范围内传播,给养猪业造成了严重的经济损失,已成为养猪业中危害最为严重的疾病之一[5]。
PRRSV为动脉炎病毒属的成员,单股、正链、不分节段RNA病毒,该病毒基因组长度约为15 kb,编码9个开放阅读框(ORF):1a,1b,2a,2b,3~7[2]。由于依赖RNA的RNA聚合酶缺乏3′至5′核酸外切酶的校对能力,因此RNA病毒的突变率很高。PRRSV核苷酸取代的计算速率为每年(4.7~9.8)×10—2/位点,是报道的RNA病毒中最高的[6]。PRRSV的糖蛋白5(GP5)由开放阅读框5(ORF5)编码,包含多个中和表位,其编码序列通常用于PRRSV分离株的系统发育分析和分类。通过严格的分子时钟模型对分离毒株进行BEAST估计,得出ORF5的平均替代率为7.966×10—3,可信区间的95%为每年(6.943~9.031)×10—3替代/位点[6]。迄今为止,PRRSV已在全球范围内被识别,并分为2种不同类型:PRRSV-1(欧洲血统,原型病毒Lelystad病毒,LV)和PRRSV-2(北美血统,原型病毒,VR-2332)[7],这2个基因型共有50%~80%的氨基酸序列和55%~70%的核苷酸同一性[8]。根据ORF5序列间的遗传关系,Ⅱ型PRRSV分为9个谱系,谱系1~谱系9(L1~L9)[9]。同样,每种病毒亚型的菌株之间也存在广泛的遗传变异。这种变异意义重大,因为实验室和现场研究支持以下论点:遗传上不同的PRRSV变异体可能具有固有的毒力和临床特性。由ORF5基因编码的GP5蛋白作为主要的结构蛋白,其功能最复杂和最易变异,该蛋白在病毒附着和内在化过程中发挥了重要作用[10-11]。因此,检测ORF5基因的遗传变异对PRRSV的流行病学研究具有重要意义。目前,PRRSV已被视为控制猪场疾病的主要问题之一,虽然商品化的疫苗可预防和控制PRRSV,但无法为猪群提供充足且有效的保护[12],且导致疫苗免疫失败的重要因素是PRRSV的遗传多样性[11]。因此,对流行株的遗传多样性分析将有助于制定有效的预防和控制策略,本试验为进一步了解在2016—2020年华北地区PRRSV的流行病学和遗传特征,对测序得到的33条PRRSV ORF5基因开展遗传进化及分子流行病学分析。
1 材料与方法
1.1样品采集2016—2020年,在华北地区的不同猪场中采集到692份临床组织样本,—80℃保存。
1.2引物设计参考GenBank上登录的PRRSV ORF5基因设计1对引物ORF5-F/R,引物由上海生工生物工程有限公司合成。ORF5-F:5′-AGGCTTGACCCTGCCTGCCTTGA-3′,ORF5-R:5′-GAATTCACAAGCAGTGCCGACTG-3′。
1.3病毒核酸的提取根据RNeasy Mini试剂盒说明书提取病毒总RNA,并通过反转录试剂盒PrimeScriptTM1st Strand c DNA Synthesis Kit进行反转录,以获得cDNA,—80℃保存。
1.4PRRSV ORF5基因扩增以1.3中获得的cDNA为模板,ORF5-F/R为引物对PRRSV阳性样品进行PCR扩增,反应体系为20μL:10 mmol/L d NTP 3μL,10×PCR Buffer 2μL,Taq酶0.5μL,2μL cDNA,上、下游引物各1μL,10μL dd H2O。PCR反应程序:94℃5 min;94℃30 s,55℃30 s,72℃1 min,35个循环;72℃10 min。PCR产物于1.5%琼脂糖凝胶中电泳,经鉴定为阳性的PCR产物送至上海生工生物工程有限公司测序。
1.5PRRSV ORF5基因遗传进化分析在MEGA 7.0软件中利用1 000个重复的最大复合似然和bootstrap置信度,通过邻接连接构建系统发育树。从GenBank下载筛选到的PRRSV毒株的参考序列。通过Meg Align对获得的序列和71条ORF5参考序列进行核苷酸和氨基酸的同源性分析,探究核苷酸和氨基酸的变异模式。
1.6PRRSV GP5蛋白分析利用Net Nglyc 1.0 Server网站预测GP5蛋白中潜在的N-糖基化位点。
2 结果
2.1PRRSV ORF5基因的扩增通过RT-PCR检测692份临床样品,结果共获得368份阳性样品,阳性率为53.18%。对2016—2020年在华北地区的368份PRRSV阳性样本进行ORF5基因扩增,共有33份样品扩增出了目的条带,除HB-XT为600 bp外,其余均为603 bp(图1)。测序获得的33条PRRSV ORF5序列已上传至GenBank。
图1 部分PRRSV ORF5基因PCR鉴定结果
2.2ORF5基因遗传进化分析为研究PRRSV的遗传关系,本试验利用MEGA 7.0软件建立了ORF5基因遗传进化树(图2)。根据建好的进化树将104株(其中·代表分离的毒株)分为Ⅰ型和Ⅱ型,Ⅱ型又进一步分为9个谱系。本试验中的9株属于Lineage 8,其中包含高致病性代表性毒株JX-A1株和Hu N4株,以及疫苗株CH1-a和CH1-R,其余24株与美国JL580株和中国类NADC30株(CHsx1401)均属于Lineage 1。然而,北美型VR-2332和活疫苗株MLV RespPRRSV属于Lineage 5.1,野生型重组株GM2和QYYZ属于Lineage 3,本研究中获得的33株PRRSV均分布在Lineage 1和Lineage 8,据此推断近2~3年PRRSV流行毒株以NADC30株Lineage 1为主。核苷酸和氨基酸同源性分析结果显示,33株ORF5基因之间的核苷酸同源性为81.1%~99.8%,氨基酸同源性为80.1%~99.5%。氨基酸同源性分析发现,Lineage 8中9株之间同源性为92%~98.5%,而与CH1a和JXA1同源性分别为90.9%~95.4%和94.2%~99.8%。Lineage 1中的24株之间的氨基酸同源性为85.6%~99.5%,与NADC30毒株的同源性为91.7%~95%,而与CHsx1401株和JL580株的氨基酸同源性略低于NADC30毒株,分别为89.4%~94.7%和90.5%~93.9%。
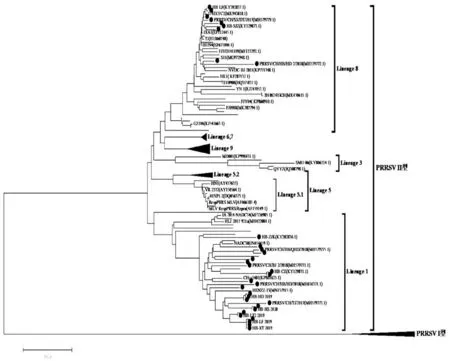
图2 PRRSV ORF5基因遗传进化树分析
2.3GP5蛋白氨基酸序列分析本研究获得的33条GP5蛋白氨基酸序列与参考序列比对(图3),结果显 示,与 参 考 毒 株(VR-2332、JXA1、HUN4、NADC30)相比,在信号肽区域(1~31aa)、跨膜区(TM)发生了不同程度变异。而在13位氨基酸有2种突变,且均发生在亚组3中:R→Q和R→P,其中包含11个Q13R突变和5个P13R突变。作为另一个重要的突变位点,151位氨基酸在Lineage 1中除HB-HS株均有R151K突变,而Lineage 8中无该位点突变。位于B表位(中和表位)中的多个位点均发生了突变,Lineage1中的6株(HB-LF2、HB-XT 2019、HB-SJZ 2020、HB-LF 2019、HB-XT 2018和HB-ZJK)发现了N38H突变,此外,39位氨基酸仅在Lineage 8中发生了与JX-A1株相同的I39L突变。同时在A表位(诱骗表位)中发现Lineage 8中大多数出现了A27V突变;而在28、29和30位氨基酸仅有少数出现了突变,HB-ZJK发现了独特的P28L突变;Lineage 8中HB-TS和HB-HS 2018株分别发现了D29V和A29V突变;HB-XT-2株出现了独特的E30N突变,HB-XT和HB-SJZ-2 2018和HBHS 2020株出现了S30N突变。GP5第137位氨基酸被认为可以区分野毒株与疫苗株的鉴别位点[13]。33株PRRSV在137位氨基酸均为S,不同于VR2332株和MLV Resp PRRS株的突变A137S,说明分离到的毒株均为野毒株。在67~90,107~119和138~150位氨基酸区域相对保守。

图3 PRRSV GP5氨基酸序列分析
2.4GP5蛋白糖基化位点分析通过Net Nglyc 1.0 Server网站预测并分析了GP5蛋白潜在的糖基化位点,结果显示,本研究中33株GP5蛋白中预测到了7个N-糖基化位点,分别为N30,N32,N33,N34,N35,N44和N51。如表1中显示,33株分别含有3~5个N-糖基化位点,且在7个位点中均有N44和N51位点。数量仅次于N44和N51位点的是N34和N30糖基化位点,分别有25个和23个位点。而Lineage 8中仅有1个N32位点,Lineage 1中有2个N32位点。就N33位点而言,Lineage 8和Lineage 1中分别有2个和17个位点。Lineage 1中的N-糖基化位点均无N35位点,Lineage 8中有6个N35位点。

表1 PRRSV GP5蛋白中的N-糖基化位点

续表1
3 讨论
2006年在江苏省暴发了HP-PRRS,并于2007年确认了高致病性变异毒株为引起该病的病原,随后该病在国内多呈现为地方性流,HP-PRRSV严重影响了中国养猪业[14]。先前的研究表明,HPPRRSV可能起源于中国经典PRRSV(类似CH-1a),并逐渐转变为HP-PRRSV毒株,在nsp2中不连续地缺失了30个氨基酸,导致了毁灭性病毒的产生。然而,后来的研究表明,这种独特的缺失与PRRSV的毒力无关[15]。尽管针对HP-PRRSV的商业MLV疫苗(例如,JXA1-P80,TJMF-92,R98和Hu N4-F112)被广泛使用,但是由于PRRSV基因组极易发生突变、重组和缺失等变异,引起抗原性发生改变,导致商品化疫苗的保护力下降,使得当前的控制策略未能提供可持续的疾病控制。同时,广泛使用MLV疫苗可能会增加猪群的免疫选择压力,从而加速PRRSV的变异和进化[16-17]。2013年,类似NADC30的PRRSV毒株在中国出现,这增加了PRRS在现场的复杂性。在随后的1~2年中,中国报道了许多NADC30样和中国HP-PRRSVs/VR-2332之间的重组菌株[16,18-19]。本实验室在2016—2020年收集到692份临床样品通过RTPCR检测,结果共获得368份阳性样品,阳性率为53.18%。PRRSV检出率较高,防控力度需要加大。
本试验共收集到华北地区368株PRRSV阳性样品,并用特异引物扩增出了33条ORF5基因序列,经进化树分析得出33株均为北美型,其中9株分布在Lineage 8(包含HP-PRRSV株-JX-A1,Hu N4株),24株分布在Lineage 1(包含NADC30株和类NADC30株)。同源性分析结果显示,33株北美型之间的氨基酸序列同源性为80.1%~99.5%,与JX-A1株和NADC30株的同源性分别为81.1%~99.5%和85.6%~94.5%。这意味着华北地区流行的毒株为HP-PRRSV株和类NADC30株,且在华北地区以类NADC30毒株流行为主,但分布在Lineage 1的24株核苷酸与氨基酸的同源性差距较大,这提示华北地区类NADC30毒株一直处于进化状态,且更加复杂,与此同时防疫意识仍然需要高度警惕。此外,2018年之前流行的HPPRRSV正逐渐被流行的类NADC30毒株所取代,并发展成为优势毒株,外部环境的不同PRRSV不可控因素可以通过不同途径侵袭猪场内部,使得猪场内部野毒株和变异毒株感染几率的风险加大。
GP5蛋白由ORF5基因编码,是PRRSV变异中最为明显的结构蛋白,它包括3个区域:N端信号肽区域(signal peptide)、诱骗表位(Decoy)、中和表位(PNE)、2个高变区(HVRs)和3个跨膜区(TM)[20],其中抗原决定簇27VLVN30和37SHLQLIYNL45作为主要的诱骗表位和中和表位,具有很高的变异性并且在诱导免疫应答中发挥重要作用[21]。而且,在PNE中H38、I42、Y43和N44的残基被认为是GP5的主要抗原识别位点,39~41位氨基酸可能有助于抗体结合。本试验结果表明,33株中除了HB-XT株在AA33中具有特定的缺失,其他毒株均未发现缺失。GP5蛋白的13、151位氨基酸(NADC30株:13Q和151K,VR2332株:13R和151R,MLV Resp PRRSV株:13Q和151G)被认为是与PRRSV毒力相关的关键残基。本试验中只有Lineage 1中11株有Q13R突变且与本谱系JL580株和NADC30株、Lineage 5.1 MLV Resp PRRSV疫苗株相同,而在Lineage 8中的13位氨基酸与JX-A1和Hu N4株均为R。同时,Lineage 1中在151位氨基酸均发生了R151K,而Lineage 8中未发生突变,这些结果证明了在华北地区发生的PRRS中存在着高致病性毒株和类NADC30毒株的流行。同时,我们还发现在A表位中发生了A27V、P28L、D29V和E30N突变,B表位中的38、39和40位氨基酸均发生了突变,尤其在39位氨基酸发生突变的数量较多且具有与JX-A1和Hu N4相同的突变。因此,我们推测位于中和表位中氨基酸发生突变,导致抗原性改变,使用不同毒株疫苗对华北地区流行的毒株中和效果不一致,这可能是疫苗未能对宿主提供有效保护力的原因。
GP5蛋白通常具有许多潜在的N-糖基化位点,病毒N-糖基化在病毒的毒性和存活中起着至关重要的作用,因为它促进了正确的蛋白质折叠,这被认为与病毒敏感性和宿主的免疫反应有关,起到帮助病毒从疫苗诱导的免疫反应中逃逸的作用[22]。因此,确定具有保守基序6Asn-X-Ser/Thr(N-X-S/T)的潜在糖基化位点。有研究报道北美基因型GP5蛋白共有4个N-糖基化位点(N30、N34、N44和N51),且位点的突变容易降低PRRSV中和抗体的水平进而增强了PRRSV宿主体内的增殖。本研究对PRRSV GP5蛋白氨基酸全序列进行了糖基化位点的预测,分析了位于抗原表位中的N-糖基化位点。结果表明,33株PRRSV预测得到了7个N-糖基化位点,且不同株潜在的位点和数量均不同,分别含有3~5个位点。作为GP5蛋白的保守N-糖基化位点,在本试验中的N44和N51位点没有发生缺失和突变,这与之前的报道N44和N51位的糖基化信号高度保守相一致。然而,其余5个糖基化位点在不同位置均发生了突变,仅HB-XT在N33位点发生了缺失,但不同氨基酸位点的缺失对糖基化位点的预测影响不大。本试验推测出的N-糖基化位点主要位于抗原表位中的糖基化位点,不同数量及位点可能会减弱中和抗体表位的免疫原性。这些结果提示,在华北地区PRRSV中,由于氨基酸的缺失和突变可能导致了抗原性改变,但其生物学功能仍需进一步研究,研究PRRSV GP5蛋白N-糖基化位点对病毒感染能力以及免疫原性具有重要意义。
类NADC30传入我国数年间,因其较强的基因变异能力,加之与本土毒株的基因重组能力也较强,迅速发展成为我国猪场中的优势毒株,而商品化类的疫苗对其猪场的免疫保护能力总是不尽如人意,使得我国猪场对PRRSV防控难度增强。而试验通过RT-PCR对2016—2020年收集的华北地区692份组织进行阳性样品的筛选,并对ORF5基因进行扩增和测序。从遗传进化分析、序列相似性分析、GP5蛋白氨基酸分析3个方面分析了华北地区PRRS遗传特点和流行情况。根据遗传进化和相似性分析表明本研究获得的33株均为Ⅱ型。此外,根据GP5蛋白氨基酸序列比对发现,氨基酸位点突变导致毒力不同,可以得出在华北地区流行的毒株以类NADC30为主,同时还存在少数高致病性毒株的流行。本研究从分子水平分析了华北地区PRRSV的流行特征,这些结论有助于制定具有针对性的防控措施和进行新疫苗的研发。

