2021 ESC急慢性心力衰竭指南解读
崔振双,田国祥
在过去30年中,心力衰竭(心衰)领域在基础及临床实践研究方面不断取得新的进展,结合近年来循证医学方面的研究成果,2021年8月欧洲心脏病学会(ESC)在《2016年急慢性心力衰竭指南》的基础上,再次颁布新的版本,对心衰的诊断、治疗等多方面内容进行更新。为使广大临床工作者方便、快捷地了解新指南的内容,本文将对新指南进行全面、细致地解读。
1 心衰的定义及分类
1.1 定义指南仍沿用以往的概念,心衰定义为由于心脏结构和/或功能异常导致静息和/或运动时心腔压力增高和/或心脏输出不足而引起的一组临床综合征,表现为呼吸困难、乏力、颈静脉压力升高、肺部啰音、外周水肿等症状、体征。心肌病变、瓣膜病、心包疾病及心脏节律、传导异常均可成为心衰的病因。指南再次指出,诊断心衰时,必须先明确病因,再根据不同的病理发病机制,制定相应的治疗方案。
1.2 心衰的分类
1.2.1 按左室射血分数(LVEF)分类2021年ESC心衰指南,对这一部分进行了更新,将射血分数中间值的心衰(HFmrEF)改为射血分数轻度降低的心衰(HFmrEF),提示此类心衰本质上可能更接近射血分数降低的心衰,从而为其治疗做出了明确推荐:
·射血分数保留的心衰(HFpEF),LVEF≥50%;
·射血分数轻度降低的心衰(HFmrEF),LVEF为41%~49%;
·射血分数降低的心衰 (HFrEF),LVEF≤40%。
1.2.2 按心衰发生的部位分类按发生心衰的部位分为:左心衰、右心衰和全心衰。2021ESC指南特意将右心衰单独进行描述。右室心功能不全的主要病因来自于左室功能不全引起的肺动脉高压。此外还有一些其他病因,如致心律失常性右室心肌病(ARVC)、瓣膜病、右室心肌梗死等。要对右室进行整体的量化评估后才能做出诊断,最常用的评估工具为超声心动图。至少包含以下1个参数:右室面积变化分数(FAC)、三尖瓣环收缩期位移(TAPSE)、三尖瓣环水平组织多普勒(DTI)测得的收缩期速度(S” )。
1.2.3 按心衰发生的缓急分类按心衰发生的缓急分为急性心衰和慢性心衰,新指南主要介绍了四种急性心衰表型:急性失代偿性心衰、急性肺水肿、孤立性右室衰竭、心源性休克。
1.2.4 按心衰的严重程度分类一直以来临床都采用纽约心功能(NYHA)分级定义心衰的严重程度。对于各种类型心衰的处理策略不同,预后也显著不同。此次指南专门对终末期心衰的诊断治疗进行了详细的描述。
2 流行病学
2.1 发病率发达国家,年龄校正后的心衰发病率下降,反映了心血管疾病治疗效果的改善。但由于年龄老化,实际发病率仍是提高的。目前欧洲整个人群发病率约为3/1000人·年,成人中发病率约为5/1000人·年。由于研究中只涵盖了已识别或诊断的心衰病例,其真实的发病率可能会更高。心衰的发病率随年龄的增长而增高:年龄<55岁时发病率约为1%,70岁及以上人群发病率>10%。研究提示,住院心衰患者,约50%为HFrEF,约50%为HFpEF/HFmrEF。ESC长期的注册研究提示,门诊心衰患者中,约60%为HFrEF,24%为HFmrEF,16%为HFpEF。
2.2 病因心衰的病因存在人种差异,在西方发达国家中,冠心病和高血压是心衰的主要原因。目前,我国心衰的主要病因为冠心病。与HFpEF相比,HFrEF和HFmrEF的患者更多患有冠心病。除冠心病外,高血压、瓣膜病、心律失常、心肌病、先心病、心肌炎等也是心衰的发病原因之一。
3 心衰的诊断
在怀疑患者发生心衰时建议做如下检查:12导联心电图、N末端脑钠肽前体(NT-proBNP)/脑钠肽(BNP)、常规检验[血尿素氮(BUN)、肌酐(Cr)、电解质、血细胞计数、肝功、甲功、空腹血糖、糖化血红蛋白(HbA1c)、血脂、血浆转铁蛋白饱和度转铁蛋白(Tf)]、经胸超声心动图、胸片等。必要时行核磁共振(MBI)检查、冠脉造影(CAG)/冠脉CT造影(CTA)、肺功能运动试验、右心导管检查。尽管给予规范的治疗,心衰仍进行性恶化,提示可能存在特异的心肌病变,通过检查心肌明确时,可考虑行心内膜活检。指南给出了心衰诊断的简单流程(图1)。
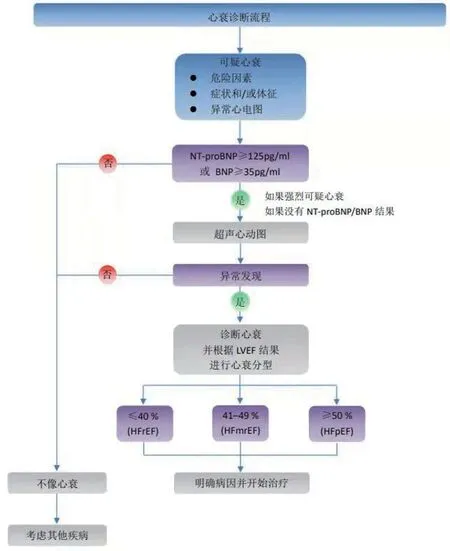
图1 心衰诊断流程图
4 治疗原则
在考虑器械治疗前必须先予以最优化的药物治疗及非药物性的介入治疗。指南按心衰类型,分别列出治疗建议。
4.1 HFrEF新指南首次将SGLT-2抑制剂(SGLT-2i)列为心衰治疗的基石用药,将以往心衰治疗的“金三角”(ACEI/ARNI、β受体阻滞剂、MRA),改为:ACEI/ARNI、β受体阻滞剂、MRA和SGLT-2i,从而开启了心衰治疗的“新四联”时代(图2)。
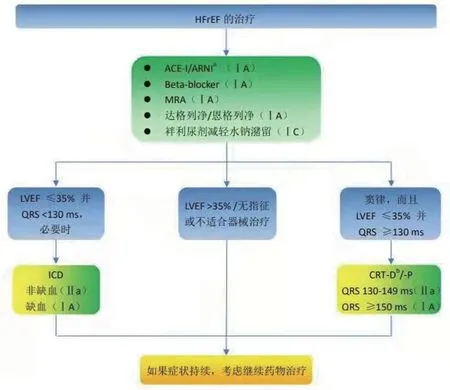
图2 射血分数减低型心衰Ⅰ级治疗流程图
4.2 沙库巴曲缬沙坦(ARNI)沙库巴曲缬沙坦作为一个里程碑式的抗心衰治疗口服药已写入多国的心衰指南之中,其卓越的疗效是基于对脑啡肽酶-血管紧张素Ⅱ受体的双重抑制机制。PARADIGM-HF随机阳性药对照研究奠定了沙库巴曲缬沙坦在HFrEF治疗中的基石地位,与依那普利比较,沙库巴曲缬沙坦降低稳定型慢性HFrEF患者主要终点心血管死亡或心衰住院达20%,心源性猝死的发生率也减少了20%,生活质量评分明显改善。PIONEER-HF研究表明,沙库巴曲缬沙坦可用于急性失代偿性心衰患者,即新发或慢性心衰恶化而住院的HFrEF患者在血流动力学稳定后即可应用此药。TRANSITION研究为急性失代偿HFrEF住院患者血流动力学稳定后尽早使用沙库巴曲缬沙坦进一步提供了依据。EVALUATE-HF研究显示,治疗3个月后,沙库巴曲缬沙坦比依那普利改善左室重构更明显,而PROVE-HF等研究显示,用药12个月时较6个月时左室重构进一步改善,表明沙库巴曲缬沙坦可快速改善心衰患者的心脏重构,长期服用可持续获益。因此,从目前的循证医学证据来看,沙库巴曲缬沙坦的应用贯穿心衰管理的全程。指南要求,在血压足够高(一般SBP≥100 mmHg,1 mmHg=0.133kPa),估算肾小球滤过率(eGFR)>30 ml/min·1.73 m2时, ARNI可替代ACEI/ARB优先考虑使用。如已使用了ARB可直接换为ARNI;如已使用了ACEI,为避免发生血管水肿,可在停药36 h后使用ARNI。PRIME试验证实,ARNI可能是心衰合并功能性二尖瓣反流的最佳药物选择。心衰患者的回顾性研究表明,沙库巴曲缬沙坦可减少植入型心律转复除颤器或心脏再同步化治疗除颤器患者的室性心动过速/心室颤动,非持续性室性心动过速或室性期前收缩以及放电治疗,提示沙库巴曲缬沙坦有抑制室性心律失常的作用,但需要前瞻性临床研究证据。另外, 沙库巴曲缬沙坦还可以改善心衰患者的症状和生活质量、减少需要胰岛素治疗的糖尿病的发生率、减少eGFR降低的发生率、减少高血钾的发生、减少袢利尿剂的使用量。新指南做出ⅠA类推荐。
4.3 钠-葡萄糖协同转运蛋白2抑制剂(SGLT-2)钠-葡萄糖协同转运蛋白2抑制剂是一类新型降糖药物,可通过抑制SGLT-2减少肾脏近曲小管葡萄糖重吸收,降低血糖,并改善胰岛素抵抗,保护胰岛β细胞功能。SGLT-2抑制剂通过多种机制发挥心肌保护作用,最终影响心血管结局。其渗透性利尿作用可减轻心脏前后负荷,减少心肌工作氧耗;促进脂肪分解,轻度升高酮体水平,增加线粒体内ATP的生成和储备,改善心脏能量代谢;间接抑制心肌细胞的纤维化,延缓或改善心脏重构。DAPA-HF研究显示达格列净使糖尿病或非糖尿病的心衰患者均受益,被称为心衰治疗领域里程碑式的进展。EMPEROR-Reduced研究(恩格列净)为SGLT-2抑制剂成为HFrEF治疗一线用药增添了新证据。SOLOIST-WHF研究证实索格列净可降低心衰患者心血管死亡、住院及心衰紧急就诊发生率,且未增加酮症酸中毒发生风险。此类药物的主要副作用:增加反复生殖泌尿系统感染的风险,早期可出现eGFR轻度下降,但可逆转,不必停药。新指南ⅠA类推荐,优选达格列净和恩格列净。
4.4 其他药物
①利尿剂:Meta分析显示,袢利尿剂和噻嗪类利尿剂可以减轻HFrEF患者症状、提高活动耐量、降低心衰住院和死亡风险,指南做出ⅠC类推荐。
②β受体阻滞剂:临床研究早已证实,与ACEI及利尿剂同时使用,可改善患者症状,降低心衰的发病率、死亡率。而且只要血流动力学稳定,症状性心衰诊断之初,即可开始使用β受体阻滞剂,并滴定到最大耐受剂量。新指南做出ⅠA类推荐。
③醛固酮受体拮抗剂(MRA):可改善患者症状,降低心衰发病率、死亡率。其中依普利酮为选择性醛固酮受体拮抗剂,男性乳房发育的副作用较少。新指南做出ⅠA类推荐。
④Ⅰf抑制剂:对已经接受ACEI/ARNI、MRA、最大耐受量的β受体阻滞剂/不能耐受β受体阻滞剂或使用禁忌的窦律、LVEF≤35%心衰患者,当静息状态下心率≥70次/ min时,加用依伐布雷定,可降低心衰住院和心血管死亡风险(SHIFT研究)。指南做出ⅡaB、ⅡaC推荐。
⑤肼苯达嗪和二硝酸异山梨酯:目前尚缺乏有力的循证依据使用固定剂量的肼苯达嗪和二硝酸异山梨酯。仅有1个小型的随机对照研究显示,认为LVEF≤35%,或LVEF<45%合并左室扩大的NYHAⅢ~Ⅳ级的黑人心衰患者,在使用了ACEI/ARNI、MRA、β受体阻滞剂的基础上,加用肼苯达嗪和二硝酸异山梨酯可降低心衰住院和死亡风险。但这一结果不适用于其他种族患者。对于症状性HFrEF患者,如不能耐受ACEI/ARNI、MRA,使用肼苯达嗪和二硝酸异山梨酯可降低死亡风险。这一结果来自于1个小型对于退伍军人的研究,仅为男性,均使用了地高辛和利尿剂。肼苯达嗪和二硝酸异山梨酯的使用,指南做出Ⅱa类推荐。
⑥地高辛:对于症状性HFrEF患者,窦性节律,使用地高辛可降低住院风险。但在包括β受体阻滞剂在内的常规治疗基础上应用,效果尚未得到印证。DIG研究结果显示,地高辛对死亡率的影响为中性。地高辛对合并房颤的心衰的影响尚缺乏随机对照研究,基于一些非随机对照研究的结果,目前对于症状性心衰合并房颤的患者,当没有其他治疗可选时,应用地高辛治疗快心室率的HFrEF,可能有益。指南做出ⅡbB推荐。
4.5 药物治疗的新进展
①可溶性鸟苷酸环化酶(sGC)激动剂:VERICIGUAT(维利西呱)是一种新型口服sGC激动剂,通过NO-sGCcGMP通路,调节内皮功能和心肌能量代谢,预防甚至逆转左室肥厚和纤维化,减缓心室重构,并通过舒张全身和肺血管降低心脏负荷。VICTORIA研究显示,与安慰剂组相比,维利西呱显著降低因心血管死亡和或因心衰住院的机率,同时安全性不亚于安慰剂。Cenderitide是一种新型双重鸟苷酸环化酶激活剂,除直接激活sGC外,还可增加循环内源性利钠肽水平,发挥更有利于心衰的治疗作用。总之,该类药开辟了一个治疗心衰的新靶点,为难治性HFrEF的治疗带来新的希望。鉴于强有力的循证研究的支持,欧洲和美国已于2021年先后批准维利西呱用于治疗HFrEF,新指南ⅡbB推荐,目前国内此药尚未上市。
②心肌肌球蛋白激活剂:长期以来,正性肌力药物可改善血流动力学,但并不能改善心衰患者的临床预后,而选择性心肌肌球蛋白激动剂Omecamtiv mecarbil(OM)改变了这种状况。Ⅱ期临床试验COSMIC HF研究表明,OM可延长收缩期射血时间、增加心排血量,降低心率、NTproBNP、左室舒张末期内径和收缩末期内径。GALACTIC研究是迄今为止开展的心衰治疗领域最大规模的Ⅲ期全球性心血管结局研究之一,研究结果显示OM使HFrEF患者心血管死亡或首次心衰事件(心衰住院或其他心衰紧急治疗)降低8%,同时,不良事件各治疗组间平衡,充分体现了药物的安全性和有效性。但目前OM尚未获批。
4.6 HFrEF心脏节律的治疗对12个重要的心衰研究分析结果显示,自上世纪90年代中期至2015年这二十年间,随着心衰治疗的进展,从β受体阻滞剂、MRA、沙库巴曲/缬沙坦到ICD、CRT-D/P,HFrEF心衰患者心源性猝死下降了44%。由于存在明显的副作用,胺碘酮未表现出相同的效果。研究显示,因决奈达隆和Ⅰ类抗心律失常药:丙吡胺、恩卡胺、氟卡尼增加死亡率,不建议用于预防室性心律失常发作。
4.6.1 植入性心脏转复除颤器(ICD)
①一级预防:
·缺血性心衰患者(40 d内未发作过心肌梗死),经过≥3个月的优化药物治疗后,仍有症状(NYHAⅡ~Ⅲ级),LVEF≤35%,且预期寿命1年以上,为了降低患者猝死和全因死亡的风险,建议植入性心脏转复除颤器(ICD),指南ⅠA类推荐。
·非缺血性心衰患者,经过≥3个月的优化药物治疗,仍有症状(NYHAⅡ~Ⅲ级),LVEF≤35%,且预期寿命在1年以上,为了降低患者猝死和全因死亡的风险,可考虑植入ICD,指南Ⅱa A类推荐。
②二级预防:
·如果患者发生过引起血流动力学不稳定的室性心律失常,同时无可逆性病因存在,发生时间不在心肌梗死后48 h内,且患者预期寿命在1年以上,为降低患者猝死和全因死亡的风险,建议植入ICD,指南ⅠA类推荐。
·本指南指出,植入ICD,除了适应症,还必须要考虑到患者的意愿、生活质量等因素。
4.6.2 皮下埋藏式或穿戴式心脏转复除颤器(S-ICD)S-ICD适用于不适合植入ICD,但在一段时间内有猝死高风险的心衰患者,显示了同经静脉植入式相同的效果和相似的并发症发生率。但大型的VEST研究结果显示S-ICD没能减少近期心肌梗死且LVEF≤35%的患者的心律失常性死亡。目前期待大量关于这种器械的随机对照研究及长期应用的安全性和有效性的资料呈现。
4.6.3 心脏再同步化治疗(CRT)如果选择合适,CRT可减少心衰发病和死亡,进而改善心功能,提高生活质量。
·心衰患者,尽管经过优化的药物治疗,仍表现为窦律, QRS宽度≥150 ms,LBBB形态,LVEF≤35%,为降低发病和死亡率,建议植入CRT,指南ⅠA类推荐。
·有心室起搏指征的高度房室传导阻滞的HFrEF患者,不管心功能(NYHA)分级和QRS宽度如何,为减少发病,建议植入CRT,而不是右室起搏。其中包括房颤患者,指南ⅠA类推荐。
·心衰患者,尽管经过优化的药物治疗,仍表现为窦律,QRS宽度≥150 ms,非LBBB形态,LVEF≤35%,为降低发病和死亡率,可考虑植入CRT,指南Ⅱa B类推荐。
·心衰患者,尽管经过优化的药物治疗,仍表现为窦律,130 ms≤QRS宽度≤150 ms,LBBB形态,LVEF≤35%,为降低发病和死亡率,建议植入CRT,指南ⅡaB类推荐。
·已经植入常规起搏器或ICD的心衰患者,经优化的药物治疗后,心衰仍加重,LVEF≤35%,同时存在很大比例的右室起搏,应考虑将起搏器升级为CRT(Ⅱa B)。
·心衰患者,尽管经过优化的药物治疗,仍表现为窦律,130 ms≤QRS宽度≤150 ms,非LBBB形态,LVEF≤35%,为改善症状,减少发病和死亡,可考虑植入CRT,指南ⅡbB类推荐。
4.7 HFmrEF(41%≤LVEF≤49%)因HFmrEF与HFrEF较HFpEF更具相似性,故新指南将射血分数中间值心衰(HFmrEF)更名为射血分数轻度降低型心衰(HFmrEF)。到目前为止,尚无单纯针对HFmrEF患者的前瞻性、随机、对照研究,只能从一些研究的亚组分析中发现,ACEI、ARB、β-Bloc、MRA、ARNI可改善HFmrEF患者的预后,本指南首次给出了药物治疗的新建议。地高辛因未能降低死亡率,且有增加死亡的倾向,而未建议使用。对于HFmrEF患者,目前植入CRT或ICD的证据尚不充分。
NYHAⅡ~Ⅳ级HFmrEF的药物治疗推荐:为减轻症状和体征,对于存在充血的HFmrEF患者建议使用利尿剂,ⅠC类推荐。为降低住院和死亡风险,对HFmrEF患者,可考虑使用ACEI、ARB、β-Block、MRA、ARNI,均为Ⅱb C类推荐。
4.8 HFpEF此类心衰的名称发生过几次变化,且截止至现在尚缺乏界定LVEF截点的共识。以往多采用超声测量的LVEF值,本指南暂将这一截点定为50%。HFpEF与HFrEF、HFmrEF患者相比,年龄更大,女性更多,房颤、慢性肾病及非心血管性共病更常见。HFpEF病因多样,病理生理变化各异,其治疗方法各不相同。
4.8.1 诊断HFpEF的诊断目前仍具有挑战性,为方便、扩大临床应用,本指南采用以往诊断标准中,临床医生广泛且最常用的参数,制定并推荐了一个简化的诊断方案。方案主要标准包括以下内容:
①心衰的症状、体征。
②LVEF≥50%。
③心脏结构/功能异常的客观证据,尤其是左房大小(左房容量指数>32 ml/m2)、二尖瓣E峰速度<90 cm/s、间隔e” 速度<9 cm/s、E/e” >9是诊断的关键点,这些异常与左室舒张功能受损/左室充盈压升高及脑钠肽升高相一致。
④对于曾经明确有过LVEF≤40%病史的患者,虽然之后LVEF改善≥50%,应考虑为HFrEF康复或LVEF改善的心衰,而非HFpEF。指南建议,此类患者应接受持续的抗心衰治疗。
⑤房颤患者诊断HFpEF的标准:左房容量指数>40 ml/m2,最大负荷状态下,E/e” ≥15,三尖瓣反流速度>3.4 m/s,左室纵向应变<16%时诊断HFpEF的敏感性达62%,特异性达56%。
⑥如果根据以上标准仍不能明确诊断,应增加一些具有诊断意义的检查,如心肺运动试验(证实运动耐量下降,帮助鉴别呼吸困难的原因)、运动负荷试验、有创血流动力学监测等。
⑦血流动力学检查结果能够明确HFpEF诊断。有创测量的肺毛细血管楔压(PCWP)≥15 mmHg(安静状态)/PCWP≥25 mmHg(负荷状态)或左室舒张末压≥16 mmHg(安静状态),均可诊断为HFpEF。目前该检查主要限于科学研究。
4.8.2 治疗鉴于缺乏有力的循证医学证据,本指南未更新对HFpEF治疗的推荐。就在指南发布后,EMPEROR-Preserved研究证实恩格列净可显著降低HFpEF患者的全因死亡及心衰住院复合终点事件发生率。指南工作组也承认HFpEF的治疗方案仍处于修订过程中。指南建议,对HFpEF的治疗应以使用利尿剂减轻充血症状为目的(表1)。

表1 HFpEF的治疗建议
4.9 重度心衰
4.9.1 诊断标准本指南仍采用HFA-ESC 2018标准,尽管患者接受了最佳治疗仍具备框1的所有条件。
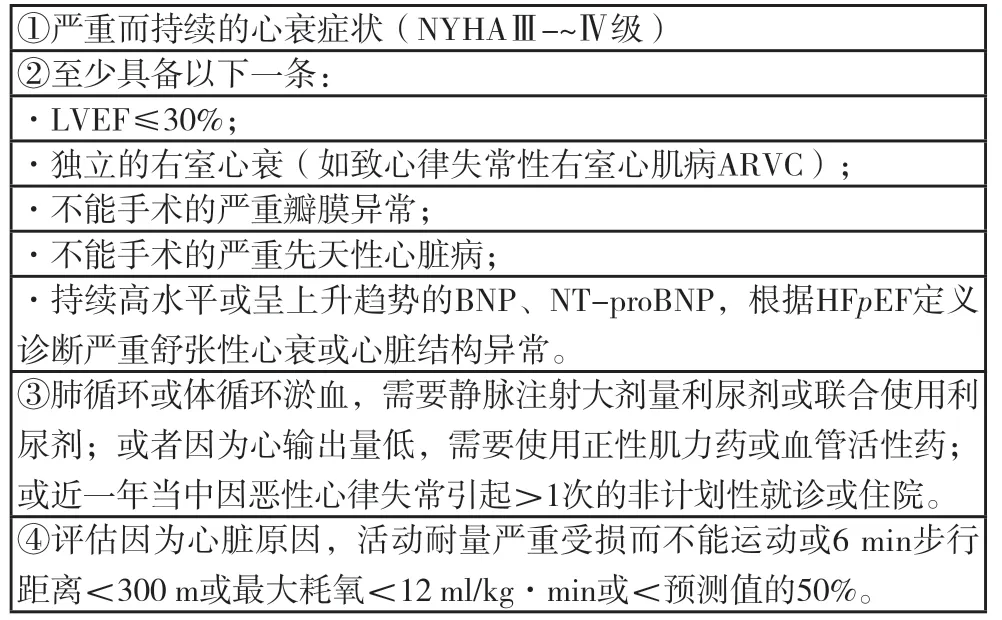
框1 重度心衰的诊断标准
4.9.2 治疗
①既然对最优化的内科治疗效果不好,应进一步对患者做出评估分级,适时进行机械辅助循环支持或心脏移植。
②晚期心衰姑息性治疗服务要点。
·重点在于,尽可能改善或保持患者及其家庭成员的生活质量,直至患者死亡。
·经常评估因晚期心衰或并发症引起的症状(如呼吸困难、疼痛),并尽力缓解。
·给患者及其家庭成员心理上的支持,并根据需求给予精神上的关照。
·深度关怀,将患者死亡地点和复苏方案(包括停止器械支持如ICD、或需要多学科协作的MCS)的选择纳入计划。
③减轻终末期心衰患者症状的治疗建议。
·呼吸困难:为减轻呼吸困难,可反复使用阿片类药物,但要注意其副作用(便秘、恶心、尿潴留、精神状态改变等)。当阿片类药物或非药物性治疗措施控制呼吸困难无效时,苯二氮卓类药物可作为二线或三线药物使用。增加吸入氧的浓度可减轻呼吸困难的症状。
·疼痛:非药物措施可能有帮助,另外,阿片类药物、羟考酮、芬太尼一般认为是安全的,可口服、静脉内、经皮使用。尤其适用于住院、姑息治疗中或在临终关怀医院的患者。
·焦虑和抑郁:提供常规抗焦虑和抑郁的治疗。
4.10 急性心衰本次指南更新,根据病因和发病机制、临床表现、起病速度、血流动力学改变等将急性心衰重新分为了四类,即急性失代偿性心衰(ADHF)、急性肺水肿、孤立性右心衰和心源性休克,并从评估、管理、主要治疗措施等方面分别给出建议(表2)。
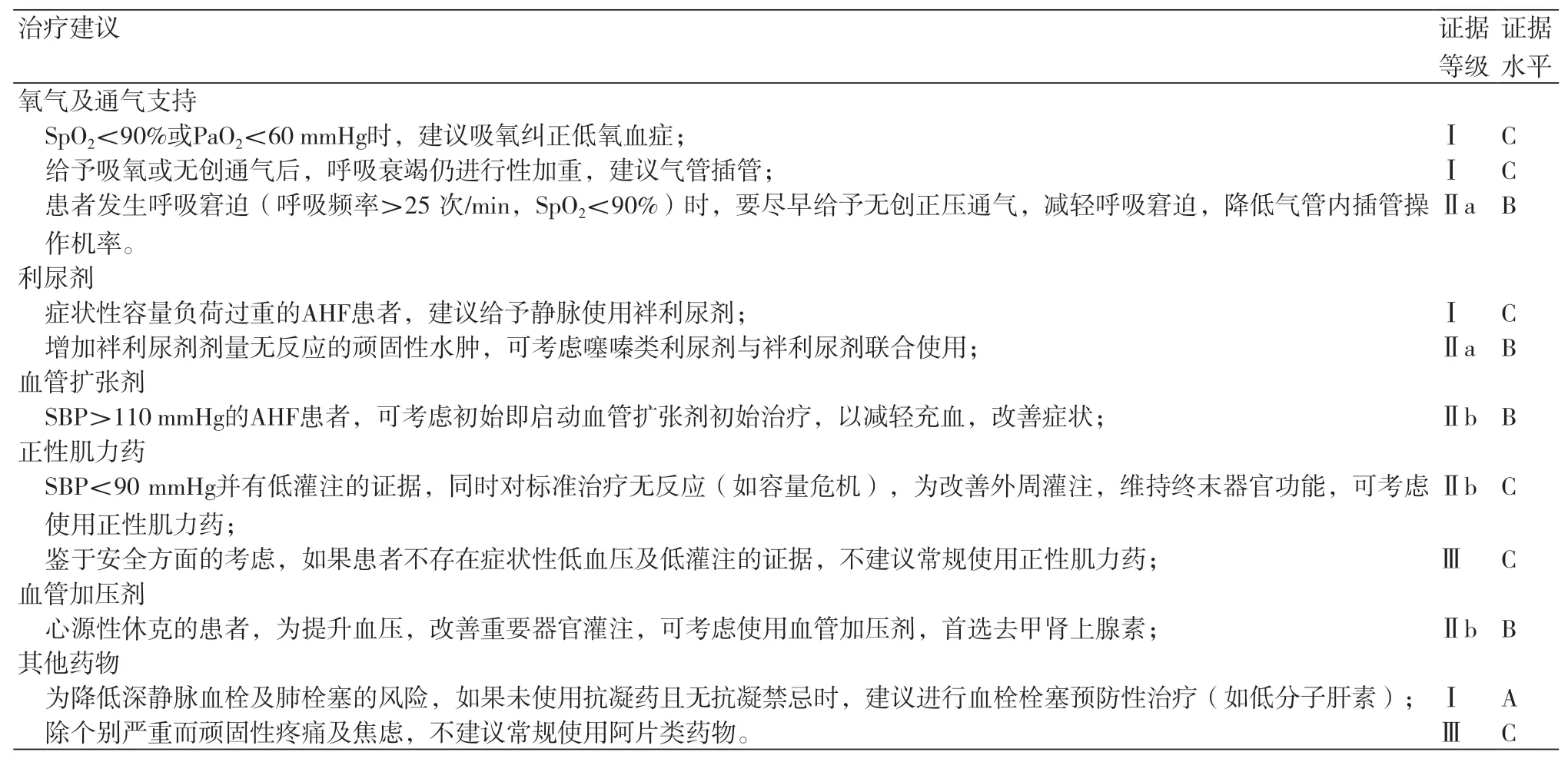
表2 急性心衰的治疗建议
5 心血管并发症及处理
5.1 心律失常及传导异常房颤时,应识别并治疗可能的病因及房颤的诱因、治疗心衰、预防栓塞事件、控制心室率、控制节律。室性心律失常的治疗包括纠正诱因(电解质紊乱,尤其是低钾/高钾、使用致心律失常药物)、优化心衰的药物及治疗心律失常(药物可选择胺碘酮,必要时可进行射频消融)。症状性心动过缓、停搏及房室传导阻滞的HFrEF患者,需要植入起搏器时,进行CRT或希氏束起搏更接近生理性起搏,对患者更有益。
5.2 慢性冠脉综合征(CCS)冠心病是工业化国家中等收入人群最常见的心衰原因,在低收入人群呈上升趋势。由于患者不能耐受一定量的活动,故不适合进行负荷试验。可通过冠脉造影或冠脉CTA明确诊断,并评估病变的严重性及再血管化指征。
5.3 瓣膜性心脏病重度主动脉瓣狭窄(AS)发生心衰,预后极差,应进行外科换瓣或TAVI(经导管主动脉瓣置换术)手术。药物治疗可改善患者严重主动脉瓣反流(AR)的心衰症状,尤其是RAAS抑制剂表现较好。β受体阻滞剂使用需要特别注意,其可延长舒张期而使主动脉瓣反流加重。重度AR出现心衰后应给予主动脉瓣换瓣治疗。若外科手术高危或存在禁忌,可选用TAVI手术。中重度二尖瓣反流(MR)在接受了最优化的药物治疗后仍有症状,可考虑进行“经皮边-边”的二尖瓣修复术或换瓣手术。三尖瓣反流(TR)治疗首先考虑药物治疗(利尿剂、神经内分泌拮抗剂),部分患者可考虑经导管介入治疗,对需要进行左心外科手术者,建议同时处理三尖瓣病变。
5.4 高血压高血压是引起心衰的主要原因,尤其是引起HFpEF的最主要的原因。2/3的心衰患者具有高血压病史,而60%~89%的高血压患者会发生HFpEF,所以治疗高血压是心衰治疗尤其是HFpEF治疗的重点。目前对HFpEF的最佳治疗方案尚不明确,但指南建议HFrEF的治疗策略可考虑用于HFpEF,HFrEF、HFrpEF的血压靶目标均尚不明确,应根据患者的临床特征个体化确定。
5.5 卒中由于卒中和心衰存在某些相同的危险因素,两种疾病常同时并存。心衰失代偿或新发心衰后30 d内是卒中的高发期,半年内逐渐下降。心衰合并卒中后死亡率明显增加。对于无房颤病史的窦律HFrEF患者,循证资料不支持常规抗凝治疗。如患者同时合并冠心病或外周动脉疾病,可考虑使用小剂量利伐沙班。如患者存在心室内血栓、高危血栓风险(如外周栓塞病史、围产期心肌病、左室致密化不全),应考虑抗凝。如患者有房颤或阵发房颤病史,CHA2DS2-VASc评分1分以上,可考虑抗凝治疗。
6 非心血管并发症及处理
6.1 糖尿病根据EMPA-REG OUTCOME、CANVAS、DECLARE-TIMI 58和VERTIS-CV等研究,指南建议,SGLT2抑制剂(坎格列净、达格列净、恩格列净、艾格列净或索格列净)用于存在心血管事件风险的2型糖尿病患者,降低因心衰住院、主要心血管事件、终末期肾病和心血管死亡的机率(ⅠA)。建议SGLT2抑制剂(达格列净、恩格列净和索格列净)用于2型糖尿病合并HFrEF的患者,降低因心衰住院和心血管死亡的机率(ⅠA)。指南不建议使用DPP-4抑制剂、GLP-1受体拮抗剂降低糖尿病合并心衰患者的心血管事件。不建议使用磺脲类降糖药用于心衰患者,可能会加重心衰。由于水钠潴留的副作用,使用胰岛素时,应注意监测可能发生心衰加重。噻唑烷二酮类降糖药禁用于心衰患者。
6.2 甲状腺疾病甲减、甲亢都可以促发心衰,应按照内分泌指南治疗各种甲状腺疾病。目前大家一致的做法是,当促甲状腺激素TSH>10 mIU/L,尤其是<70岁的患者,要进行纠正。TSH在7~10 mIU/L之间,也可考虑进行纠正。
6.3 肥胖肥胖是高血压、冠心病的危险因素,也和心衰风险增加相关。可能和HFpEF相关性更强。肥胖的心衰患者脑钠肽水平较低,这和清除受体的表达升高及脂肪组织对肽类的破坏增强有关。
6.4 虚弱、恶液质、肌少症虚弱合并心衰和不良预后、对治疗的接受能力及耐受性降低相关。虚弱和更高的死亡风险、住院率、功能减退及更长的住院时间相关。治疗应是多方位的,包括通过体育训练进行躯体康复、加强营养支持和针对于合并症进行的个体化治疗。最有帮助的还是运动和肌肉力量训练。运动训练对虚弱合并心衰的患者有益。
6.5 铁缺乏和贫血铁缺乏和贫血在心衰患者中很普遍,它和活动能力下降、反复因心衰住院和高的心血管及全因死亡均独立相关。铁缺乏可独立于贫血出现,在慢性心衰患者中,发生率最高可达55%,急性心衰患者中,发生率最高可达80%。本指南建议,对所有心衰患者常规进行贫血和铁缺乏的筛查,并查找其原因(Ⅰ C)。研究显示促红素不能降低全因死亡或心衰住院率,反而增加血栓栓塞事件,故不建议用于心衰患者贫血的治疗。指南建议,心衰合并铁缺乏时,使用羧基麦芽糖铁静脉补充铁剂(Ⅱa)。
6.6 肾功能不全慢性肾功能不全(CKD)与心衰(HF)常常并存。CKD是心衰患者发病和死亡率增加的独立性决定因素。指南建议,接受RAAS、ARNI或SGLT2抑制剂治疗的心衰患者,只要血清肌酐<266 μmol/L,升高<50%;或者只要eGFR>25 ml/min·1.73 m2,下降<10%,都不应该停药。
6.7 电解质紊乱血钾在4~5 mmol/L范围,死亡风险最低。低钠是急、慢性心衰患者预后不良的强有力的独立预测因素。血钠>124 mmol/L且没有症状时,无需静脉补钠。严重低钠时可因脑水肿引起神经系统症状,应及时治疗(高渗盐水)。
6.8 肺部疾病及睡眠障碍约20%的心衰患者同时有慢性阻塞性肺病(COPD),需要进行呼吸功能监测加以鉴别。心血管选择性的β受体阻滞剂不是COPD患者的绝对禁忌症,可小剂量使用并密切监测。积极治疗COPD能够改善心衰症状。超过1/3的心衰患者会发生睡眠障碍,急性心衰患者更多见。心衰患者可以进行夜间睡眠呼吸监测,必要时采取有效治疗措施(面罩式正压通气、适应性伺服式通气、膈神经刺激等)。
6.9 高脂血症及降脂治疗循证研究显示,如果没有其他使用他汀的适应症,不建议心衰患者使用他汀。已经在使用他汀的患者发生心衰后,也不必停用,因为没有他汀对心衰不利的证据。
6.10 痛风和关节炎慢性心衰患者高尿酸的发生率高达50%,利尿剂的使用可引起或加重高尿酸血症。血尿酸每增加1 mg/dl,全因死亡和因心衰住院的发生率分别提高4%和28%。别嘌醇是心衰患者降尿酸的首选药物。关节炎是比较常见的共病,非甾体消炎药可能引起心衰失代偿,心衰患者相对禁忌。
6.11 勃起功能障碍(ED)某些心血管药物,尤其是利尿剂和β受体阻滞剂可引起ED,也还有很多心血管药物与ED的关系尚不清楚。磷酸二酯酶抑制剂用于代偿性心衰一般是安全有效的,但不应与硝酸酯类药物同用。
6.12 抑郁心衰患者有20%发生抑郁,抑郁和较差的临床状态及不良预后相关,目前尚无心衰伴抑郁最佳治疗的共识。心理干预可能改善抑郁症状,良好的护理对于这类患者很重要。研究显示使用盐酸舍曲林和艾司西酞普兰是安全的。三环类抗抑郁药应避免用于心衰伴抑郁,可能引起低血压、心衰加重和心律失常。
6.13 癌症抗癌治疗、癌症本身及心血管疾病危险因素或已经存在的心血管疾病均可促发心衰,反之,心衰又会影响癌症的预后。计划接受心肌毒性药物治疗的癌症患者,治疗前必须进行基线评估,使用超声、NPs或肌钙蛋白监测心衰的发生。对于癌症存活患者,长时间内应定期复查,如果左室收缩功能受损(LVEF下降10%~50%),应给予ACEI和β受体阻滞剂治疗。
6.14 感染感染可使心衰症状加重或诱发急性心衰。如果条件允许,心衰患者可应考虑进行流感、肺炎球菌及新冠疫苗接种。心衰合并感染,除最佳的抗心衰治疗外,应积极抗感染治疗。
7 特殊人群的诊治
7.1 怀孕心衰患者怀孕有发生心衰失代偿等心血管并发症的高危风险。孕期随着循环血容量和心输出量的增加,对孕妇的心功能要求提高,使得之前未诊断但早就存在的能引起心衰的疾病如心肌病、瓣膜病暴露出来,产生孕期新发心衰。孕期和分娩带来的严重的精神压力能引起应激性心肌病。围产期心肌病(PPCM)多于孕晚期(后3个月)或产后数月内发生,产后诊断。为避免胎儿毒性,ACEI、ARB、ARNI、MRA、依伐布雷定、SGLT2抑制剂均属于禁忌,受孕前要停止使用。可选用选择性β受体阻滞剂(比索洛尔、琥珀酸美托洛尔)。如需要,肼苯哒嗪、口服的硝酸酯类、甲基多巴可以开始使用。指南建议溴隐亭可用于急性PPCM患者,但用药时也要考虑其副作用:深静脉血栓和停止泌乳,要伴以预防性(治疗性)抗凝治疗。对于心衰合并房颤的患者,前3个月和后3个月,选用低分子肝素抗凝,中间的3个月,可用低分子肝素或华法令(INR常规标准)。避免使用新型口服抗凝药。mWHOⅡ~Ⅲ级孕妇2个月评估一次,已有心衰的mWHOⅢ级孕妇每月必须评估一次,mWHOⅣ级的严重心衰(LVEF<30%,NYHAⅢ~Ⅳ级)孕妇,考虑结束妊娠。分娩方式应在35周前后,由多学科孕心团队的心脏医生、产科医生和麻醉医生与患者共同商量决定。
7.2 心肌病心肌病包括多种不同的疾病,均为心衰的重要原因。心肌病的病因很多,包括病理性基因突变、心肌毒性物质、自身免疫、贮积性疾病、感染和快速心律失常等。病史、实验室检查、影像学检查是一线基础的检查,超声心动图是诊断扩张型心肌病(DCM)、肥厚型心肌病(HCM)、心律失常型心肌病(AC)的重要检查手段。CMR可提供更为细致的形态及预后方面的信息,应作为基础检查。有必要对诊断的DCM、HCM、AC患者及其一级亲属进行基因检测,以发现和明确那些因基因突变引起的心肌病变。心内膜活检仍然是明确心肌病病理基础的金标准。
7.3 左心室致密化不全(LVNC)LVNC是一种罕见的以心内膜肌小梁增多、粗大为特征的先天性心肌病,属于常染色体显性遗传性疾病。
7.4 房性疾病房性疾病是指房衰和房性心肌病,是由于心脏结构、功能、电生理的复合型改变影响心房后引起的异常表现。是多种危险因素交互作用的结果,容易引起房颤和心衰的共病,如糖尿病、高血压、肥胖、吸烟和少动在房性疾病的发展中起到重要作用。房性疾病与心衰,尤其是HFpEF的病理生理变化有关。常并发房颤,并相互作用,有效的治疗心衰和房颤以及二尖瓣反流,可以对抗房性疾病的进展。可应用超声(二维和三维)、CT、CMR评估心房大小、形态及功能。测量心脏生物标志物,如高敏肌钙蛋白和利钠肽可对房性疾病的病理生理状态进行评估。房性疾病的治疗目标是预防房颤、体循环血栓栓塞及HFpEF。
7.5 心肌炎急性心肌炎临床表现从症状轻微到心源性休克表现各异。急性心肌炎伴心衰,至少要住院24 h治疗观察,标准的抗心衰治疗应该持续最少6个月。免疫抑制剂仅用于个别病例。
7.6 淀粉样变(CA)心肌淀粉样变和淀粉样变心肌病目前仍是容易漏诊的心衰原因。最常见的两种类型为:轻链(AL)型和转甲状腺素蛋白(ATTR)型心脏淀粉样变。ATTR包括野生型(wtTTR)和基因突变型(hTTR),前者占90%以上,后者<10%。应用超声、SPECT、CMR、血液指标检测、心外组织活检可基本诊断CA。心内膜活检(EMB)、基因检测可进一步明确淀粉样变的类型。稳定并减少甲状腺素样蛋白的产生是治疗TTR-CA的基础。Tafamidis可降低NYHAⅠ、Ⅱ级hTTR和wtTTR-CA患者的全因死亡和心血管住院率(ⅠB),静脉用patisiran(小RNA干扰分子)、经皮注射的inotersen(反义寡核苷酸),考虑用于多神经病变hTTR-CA。diflunisal超说明书用药结合质子泵抑制剂(PPI),考虑用于治疗wtTTR。保持正常循环血容量是治疗淀粉样变心衰的核心问题,可使用袢利尿剂和MRA,但可能为发生直立性低血压而不能耐受。由于低血压,β受体阻滞剂、地高辛、ACEI、ARB、ARNI均可能不耐受,其在淀粉样变治疗中的地位尚不确定,CCB类药物可能引起严重的低血压和乏力,或引发与淀粉样蛋白相关的并发症,应避免使用。有房颤病史的CA患者应接受抗凝治疗,控制或预防房颤首选胺碘酮。家族性TTR-CA终末期可考虑肝和/或心脏移植。
7.7 铁超载心肌病铁超载的成因主要有两种:一种是由于肠道对铁的吸收增加,引起的原发性铁超载(如遗传性血色素病);另一种是因为血液病需要多次输血造成的继发性铁超载(如β地中海贫血)。铁超载性心肌病(IOCM),可表现为限制型或扩张型,随着病情进展,限制型可演变为扩张型。通过使用铁螯合剂,包括去铁胺、去铁铜、地拉罗司可成功预防IOCM。明确诊断后,经强化或联合铁螯合剂治疗,IOCM可完全逆转。
7.8 成人先天性心脏病(ACHD)心衰是ACHD患者中常见的问题,是这一人群中的重要死亡原因。ACHD心功能不全的病理生理机制不同于非先天性心脏病患者,尤其是某些先天异常(动力型右室、单心室、外科手术相关损伤等)。指南认为,将现在的心衰指南直接用于ACHD可能不合适,对ACHD的处理策略多基于医生的临床经验或专家的立场声明。
目前指南仍然推荐以多学科协作的模式,进行长程管理心衰。除临床医生和护士的诊治、随访、监测外,还需要加强患者的健康教育,提高自我管理能力,以达到全面改善症状,减少心衰再住院率,降低心衰死亡率的目的。指南同时指出,虽然心衰的诊疗领域取得了飞跃式发展,但仍存在一些尚待解决的问题,如HFpEF的诊断及治疗,因此还需更多有价值的基础、临床研究成果来完善心衰指南的内容。

