香榧种实膨大过程中蔗糖代谢及其基因表达
王桂芳,索金伟,王 哲,成 豪,胡渊渊,张可伟,吴家胜
(1. 浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300;2. 浙江农林大学 林业与生物技术学院,浙江 杭州 311300;3. 浙江师范大学 化学与生命科学学院,浙江 金华 321004)
果实的生长发育一般具有较长周期,外形上表现为由小变大,内部伴随着营养物质的积累与代谢[1]。果实大小主要由细胞分裂和细胞膨大2个阶段决定,发育前期主要以细胞分裂为主,而细胞膨大主要是从细胞分裂结束后开始的[1]。不同物种果实的生长发育有着不同的特性。核桃Juglans regia、板栗Castanea mollissima等生长发育随时间变化呈现“S”形的生长曲线[2],桃Amygdalus persica、杏Armeniaca vulgaris等在生长中会有一个缓慢期,生长曲线呈双“S”形[3]。山核桃Carya cathayensis果实5月初开始膨大,6—7月果实快速生长[4]。银杏Ginkgo biloba授粉后40~80 d为快速膨大阶段,纵径和体积增长显著[5]。果实膨大过程涉及一系列生理生化变化[1]。果实内部光合同化物的积累与代谢是果实生长发育的调控中心环节,直接影响果实膨大过程。蔗糖是植物光合同化物的主要积累物质,是重要的能量载体,在果实中积累后会被分解为葡萄糖和果糖[6]。这些小分子还原糖进一步参与糖酵解、三羧酸循环等过程,为果实早期发育和细胞膨大提供能量和碳骨架[7]。同时,蔗糖、葡萄糖、果糖通过区隔积累于液泡中,使果实内部保持较高的膨压,促进水分吸收,从而促进果实细胞膨大[8]。此外,旺盛的蔗糖代谢也有利于果实内部内源激素的积累与分配,提高果实对营养物质的调运能力,使更多的光合同化产物、矿质元素源源不断地流入正在发育的果实细胞,满足果实生长发育的营养需求[8]。果实中的蔗糖主要源于叶片光合同化物的韧皮部输入,运输到库器官后通过其代谢过程被进一步利用[9]。蔗糖代谢过程涉及到多种酶,主要有蔗糖合成酶(sucrose synthase, SS),蔗糖磷酸合成酶(sucrose phosphate synthase, SPS)和蔗糖转化酶(invertase)。这些蔗糖代谢相关酶的活性变化对果实发育过程有着重要影响[10]。研究发现:果实中蔗糖磷酸合成酶活性与蔗糖积累呈正相关关系[11]。GALTIER等[12]在番茄Lycopersicon esculentum中过量表达蔗糖磷酸合成酶基因,转基因番茄中蔗糖磷酸合成酶蛋白含量升高,同时其含糖量也增加。蔗糖水解成己糖后可为果实发育提供能量,参与蔗糖水解的酶主要有蔗糖转化酶和蔗糖合成酶。蔗糖转化酶根据在细胞中的定位不同可以分为细胞壁蔗糖转化酶(cell wall invertase)、液泡蔗糖转化酶(vacuolar invertase)和细胞质蔗糖转化酶(cytoplasmic invertase)[10]。蔗糖转化酶活性高低可以作为衡量果实库活力的重要标志[13]。番茄转化酶活性在果实生长发育的整个阶段都有较高水平,有利于己糖积累[14]。蜜柑Satsuma mandarin果实快速膨大期液泡蔗糖转化酶活性较高[15]。蔗糖合成酶既可以合成蔗糖也可以分解蔗糖。在果实膨大过程中,蔗糖合成酶主要起着分解蔗糖的作用[16]。此外,果实内部蔗糖代谢过程也会受到植物激素、光照和水分等因子的影响。研究发现:吲哚-3-乙酸(indole-3-acetic acid,IAA)能够增强蔗糖运输,促进蔗糖向果肉细胞扩散[17]。葡萄Vitis vinifera果实发育前期,IAA和赤霉素(gibberellins,GAs)促进了果实中蔗糖的输入[18]。外源GA处理通过增强蔗糖转化酶编码基因表达,提高果实蔗糖转化酶活性,促进枇杷Eriobotrya japonica等果实膨大[19]。
香榧Torreya grandis ‘Merrillii’是红豆杉科Taxaceae榧树属Torreya植物,是中国特有的珍稀干果。香榧种仁营养丰富,具有很高的保健、药用和综合开发利用价值[20−22]。然而,人们在长期的生产实践中发现,香榧种实膨大率低,部分香榧林分膨大率不足5%,严重影响香榧的产量和栽培效益,成为限制香榧产业发展的瓶颈。本研究通过分析香榧种实膨大过程中蔗糖积累与代谢规律,探讨内源激素动态变化及其与蔗糖代谢之间的相关性,初步阐明蔗糖及其代谢对香榧种实膨大的影响。同时,筛选鉴定蔗糖代谢关键酶相关基因,分析蔗糖代谢对香榧种实膨大的调控作用。研究结果将为阐明香榧种实发育机制奠定基础,同时为提高种实产量、开展良种选育等提供理论支撑。
1 材料与方法
1.1 试验地概况
本研究试验地位于浙江省杭州市临安区锦源村香榧生态化种植示范基地(30°09′45″N,119°42′36″E)。该种植基地属亚热带季风气候,年均日照时数为1 710~2 100 h,年均气温为15.0~18.0 ℃,年均降水量为980.0~2 000.0 mm。基地内的香榧于2007年种植,每年施用复合肥2~3次,有机肥隔年施用1次。
1.2 种实形态观察及生长指标测定
本研究在香榧种实膨大期的不同阶段,分别于种实突破种鳞后的30 (5月1日)、60 (6月1日)和90 d时 (7月1日)进行香榧种实样品采集。选取长势一致、挂果良好的3株香榧实验树,分别于东、南、西、北方向各随机采集香榧种实10粒(3株树共120粒)。香榧种实采后放置在冰盒中,立即运回实验室,去除有损伤的种实。部分种实用于形态观察、拍照和含水率测定,其余种实分别取假种皮和种仁组织,切碎后立即用液氮速冻,在−80 ℃冰箱中保存备用。种实横纵径用游标卡尺测量,其中以种实中部横断面的直径作为横径;单粒质量用分析天平(0.001 g)测量,105 ℃杀青0.5 h后,置于80 ℃烘箱中烘至恒量以测定干质量,并计算相对含水率。体积采用排水法测定。根据香榧种实横纵径、单粒质量、体积变化,将香榧种实生长发育过程分为幼果期(授粉受精至翌年4月)、膨大期(5—7月)、成熟期 (7—9月)。
1.3 蔗糖、葡萄糖和果糖和淀粉质量分数测定
蔗糖、葡萄糖、果糖和淀粉质量分数参照蒽酮比色法测定。
1.4 香榧种实内源激素的测定
取0.1 g样品,液氮研磨至粉末,置2.5 mL甲醇溶液(甲醇∶水体积比为80∶20)中,于40 ℃下萃取2 h。15 000×g离心10 min,上清液用0.22 μm滤膜过滤并用氮气干燥,甲醇溶液(甲醇与水体积比为30∶70)复溶后4 ℃冰箱保存备用。采用液相色谱-质谱串联(LC-MS/MS)对植物激素进行分离和分析,使用Acquity UPLC BEH C18柱 (1.7 μm,2.1 mm×100 mm)在 40 ℃ 下以 0.3 mL·min−1的流速分离样品。IAA、GA3、GA4等质量分数参照ZHAO等[23]的方法测定。
1.5 糖代谢相关酶活性测定
蔗糖磷酸合成酶和细胞质蔗糖转化酶参照NIELSEN等[24]和LOWELL等[25]的方法提取和测定。液泡蔗糖转化酶和细胞壁蔗糖转化酶活性参照TANG等[26]的方法测定。酶活性单位为μmol·mg−1·min−1。
1.6 香榧种实转录组分析
使用RNAprep植物总RNA提取试剂盒(中国北京天根生化)提取各个发育阶段种仁的总RNA。使用 NanoDrop ND-1000分光光度计 (NanoDrop Technologies Inc.,美国)和琼脂糖凝胶电泳检测总 RNA 的浓度和质量。每个样品使用 3 μg RNA构建cDNA 文库,利用 Illumina Hi Seqogies平台进行测序。
对原始下机数据进行过滤去除低质量序列后,利用软件Trinity v.6.0组装mRNA序列,并使用美国国家生物信息中心(NCBI)非冗余蛋白质序列(Nr,http://www.ncbi.nlm.nih.gov/),NCBI非冗余核苷酸序列(Nt,http://www.ncbi.nlm.nih.gov/),瑞士蛋白数据库(SwissProt,http://www.uniprot.org/),同源蛋白质簇 (COG, http://www.ncbi.nlm.nih.gov/COG/),京都基因和基因组百科全书 (KEGG, http://www.genome.jp/kegg/)和GO数据库(GO, http://www.geneology.org/)进行单基因簇(unigene)的功能注释。利用FPKM法计算基因虚拟表达量,差异表达基因(differentially expressed gene, DEG)应满足差异倍数|log2A|≥2[A表示差异倍数或变化倍数(flod change)]、错误发现率[false discovery rate(FDR)]≤0.001、样本间的差异由抽样误差所致的概率小于0.05 (P<0.05)等条件,并通过GO和KEGG途径富集分析差异表达基因的功能。
1.7 数据分析
采用Excel 2016进行数据整理与分析,所有数据均是至少3次生物学重复的平均值±标准误;采用SPSS 22.0进行差异显著性和相关性分析,并利用Cytoscape 3.0软件构建相关性网络图。
2 结果与分析
2.1 香榧种实膨大过程中形态及生长指标变化
由图1可知:香榧种实膨大过程可分为3个阶段,分别是种实突破种鳞后的0~30、30~60和60~90 d,其中,种实突破种鳞后的30~60 d是香榧种实质量和体积增大的关键时期。这一阶段种实横径、纵径、单粒质量和体积都明显增大,种仁从半透明状逐渐固化变白,面积占据整个种实的绝大部分(图1A~C)。种实突破种鳞后的60~90 d是香榧种实内部种仁固化的重要阶段。这一阶段形态上,中种皮结构更为明显,种仁进一步固化充实;种实大小(横径、纵径)、单粒质量、体积虽然仍在增大,但趋势缓慢;种实突破种鳞后90 d时,种实大小和质量均与种实突破种鳞后60 d时,相差不大(图1A~C)。然而,香榧种实膨大过程中假种皮和种仁含水率变化有较大差异,假种皮含水率从种实突破种鳞后30~90 d呈缓慢上升至平稳趋势,而种仁含水率则逐渐下降,尤其是种实突破种鳞后60 ~90 d含水率显著(P<0.05)降低 (图 1D)。
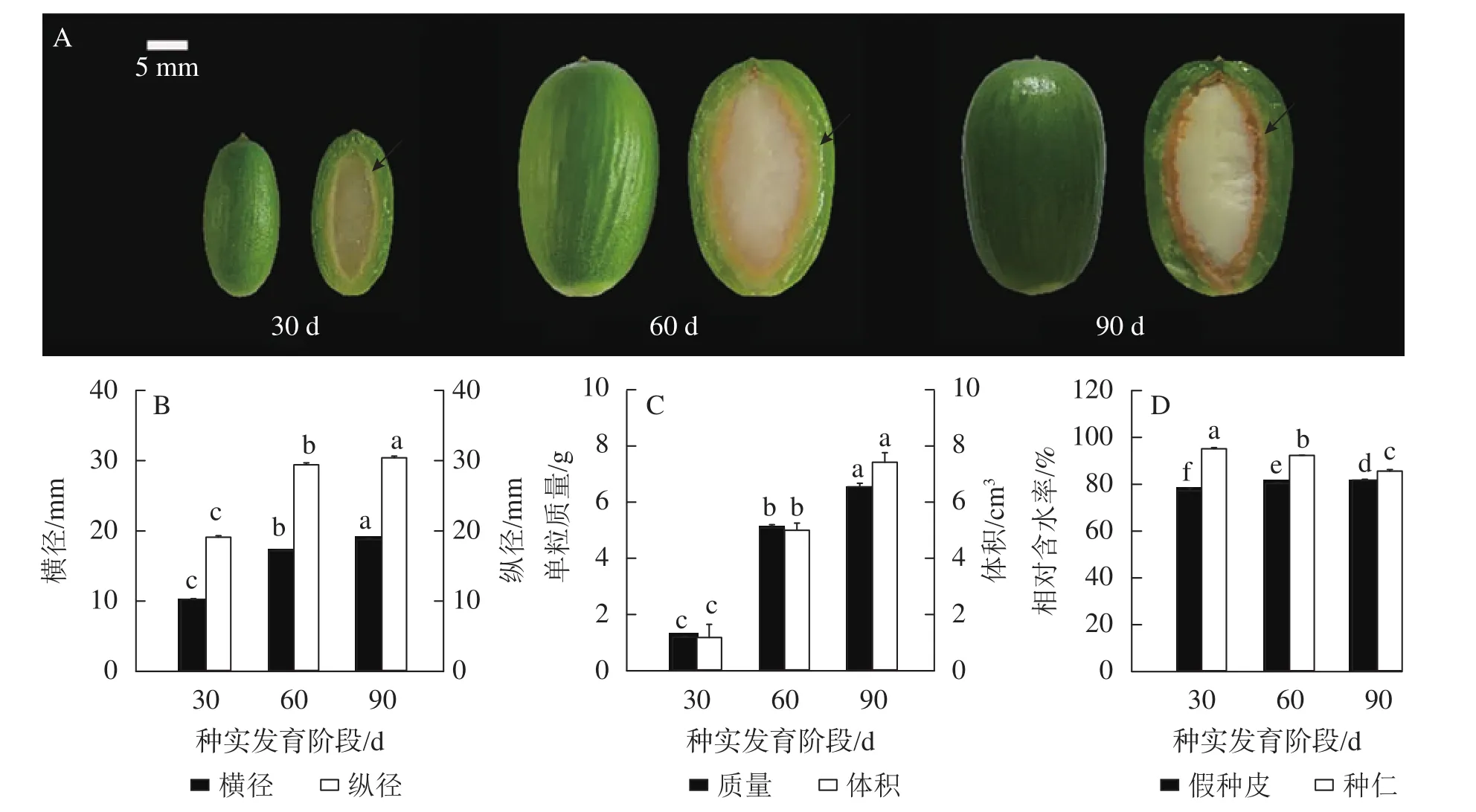
图1 香榧种实膨大期生长指标变化Figure 1 Changes of growth indexes during T. grandis ‘Merrillii’ seed expansion stages
2.2 种实膨大期糖质量分数及相关代谢酶活性变化
香榧种实膨大过程中,蔗糖、葡萄糖、果糖以及淀粉质量分数在假种皮和种仁中变化显著(P<0.05),且假种皮和种仁间各物质质量分数变化趋势不同(图2)。种实突破种鳞后30~90 d,假种皮中蔗糖质量分数从 49.70 mg·g−1上升至 75.83 mg·g−1,随后又下降至 57.14 mg·g−1;种仁中蔗糖质量分数则持续下降,在种实突破种鳞后 60~90 d 下降明显,从 82.89 mg·g−1下降至 55.82 mg·g−1(图 2A)。随着香榧种实的膨大,葡萄糖和果糖质量分数在假种皮中同样先上升后下降,至种实突破种鳞后90 d时分别为5.90和37.0 mg·g−1;种仁中两者质量分数均显著下降(P<0.05),从种实突破种鳞后60~90 d阶段下降了约50% (图2B~C)。假种皮中淀粉质量分数呈现逐渐下降趋势,从种实突破种鳞后30 d时的462.07 mg·g−1下降到 90 d 时的 254.05 mg·g−1,种仁中淀粉则在种实突破种鳞后 90 d 时显著积累(P<0.05) (149.72 mg·g−1),为 30 d 时的 1.5 倍 (图 2D)。

图2 香榧种实膨大期蔗糖(A)、葡萄糖(B)、果糖(C)和淀粉(D)质量分数变化Figure 2 Changes of sucrose (A), glucose (B), fructose (C) and starch (D) contents in aril and kernel during T. grandis ‘Merrillii’ seed expansion
蔗糖代谢相关酶活性分析发现:香榧种实膨大过程中,蔗糖磷酸合成酶在假种皮中一直呈现上升趋势,酶活性从 0.46 μmol·mg−1·min−1升高至 1.16 μmol·mg−1·min−1,种仁中蔗糖磷酸合成酶活性则逐渐下降,种实突破种鳞后 90 d时的活性仅为种实突破种鳞后 30 d时的28.82%(图3A)。参与蔗糖水解的细胞质蔗糖转化酶、液泡蔗糖转化酶和细胞壁蔗糖转化酶随着种实的膨大在假种皮中均呈现上升趋势,酶活性最大值分别为21.91、23.49以及4.93 μmol·mg−1·min−1,而三者在种仁中的活性均有所下降,其中细胞质蔗糖转化酶和液泡蔗糖转化酶活性在种实突破种鳞后30~60 d无显著差异,而从种实突破种鳞后 60~90 d 显著下降 (P<0.05),分别为 3.69和 4.63 μmol·mg−1·min−1,细胞壁蔗糖转化酶活性则持续下降,至种实突破种鳞后 90 d 时,活性仅 0.97 μmol·mg−1·min−1(图 3B~D)。

图3 香榧种实膨大期蔗糖磷酸合成酶(A)、细胞壁蔗糖转化酶(B)、液泡蔗糖转化酶(C)和细胞质蔗糖转化酶(D)活性变化Figure 3 Changes of sucrose phosphate synthase (A), cell wall invertase (B), vacuolar invertase (C) and cytoplasmic invertase (D) activities in aril and kernel during T. grandis ‘Merrillii’ seed expansion
2.3 种实膨大期内源激素质量分数变化
内源激素质量分数变化分析发现:随着香榧种实膨大,假种皮中GA4、GA3、水杨酸(SA)质量分数总体呈现显著积累,并在种实突破种鳞后90 d时达到最高值,分别为种实突破种鳞后30 d时的2、11和8倍,而IAA、脱落酸(ABA)、茉莉酸(JA)和茉莉酸异亮氨酸(JA-ILE)质量分数则显著降低(P<0.05)(表1)。此外,乙烯前体物质—1-氨基-环丙烷羧酸(ACC)和多种细胞分裂素(DHZ、tZR、IP等)质量分数也显著下降(P<0.05)。种仁中,GA3、SA、ABA也随着种实膨大逐渐积累,其中ABA质量分数为922.31 ng·g−1。而GA4、IAA、JA、JA-ILE和绝大多数细胞分裂素[DHZ、tZR、IP、反式玉米素(tZ)]质量分数则显著降低(P<0.05) (表1)。
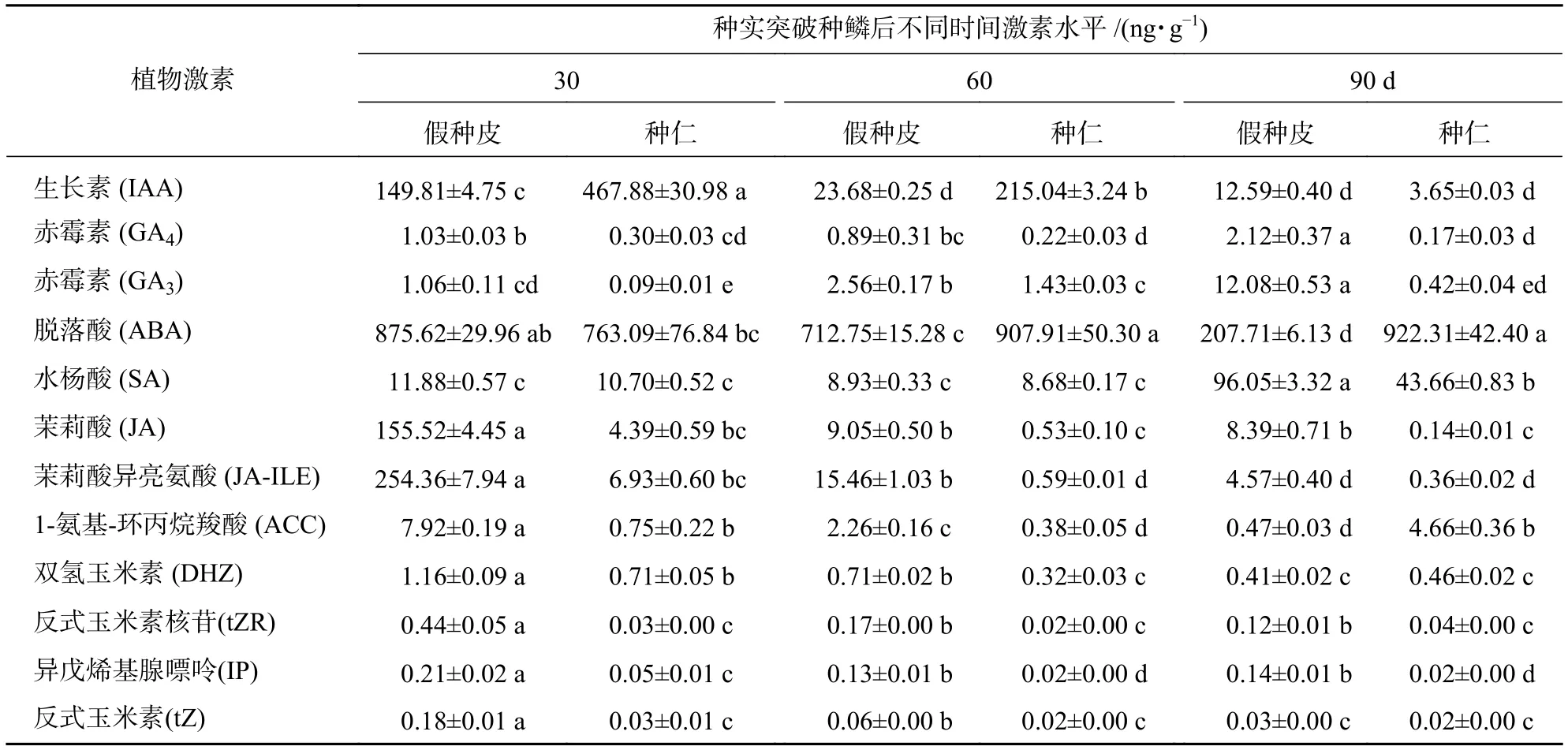
表1 香榧种实膨大期内源激素质量分数变化分析Table 1 Analysis of endogenous hormone contents in aril and kernel during T. grandis ‘Merrillii’ seed expansion
2.4 种实膨大期糖代谢及激素质量分数相关性分析
相关性分析发现:假种皮中葡萄糖、果糖、淀粉质量分数以及蔗糖代谢相关酶与种实大小密切相关,其中葡萄糖、果糖质量分数与种实横、纵径,单粒质量和含水率呈正相关关系,与淀粉质量分数则呈负相关关系;蔗糖转化酶和蔗糖磷酸合成酶均与种实大小正相关(图4A)。同时,假种皮中蔗糖、葡萄糖、果糖质量分数与细胞质蔗糖转化酶、液泡蔗糖转化酶及细胞壁蔗糖转化酶活性变化呈正相关,而淀粉质量分数与葡萄糖、果糖质量分数,细胞质蔗糖转化酶、液泡蔗糖转化酶、细胞壁蔗糖转化酶及蔗糖磷酸合成酶活性均呈负相关关系(图4A)。与激素质量分数相关性分析发现:大多数激素(GA3、IAA、JA、ACC、DHZ、TZR等)与蔗糖、葡萄糖、果糖质量分数以及各种糖代谢酶活性呈负相关,与种实大小也表现出负相关关系(图4A)。
随着香榧种实膨大,种仁中蔗糖、葡萄糖、果糖与淀粉质量分数呈负相关关系,与细胞质蔗糖转化酶、液泡蔗糖转化酶、细胞壁蔗糖转化酶和蔗糖磷酸合成酶活性呈正相关关系,同时淀粉质量分数与香榧种实单粒质量和体积也呈正相关关系(图4B)。与激素的相关性分析发现:GA4和IAA质量分数与蔗糖、葡萄糖、果糖质量分数和4种蔗糖代谢酶活性呈正相关,而与淀粉质量分数呈负相关(图4B)。此外,多种激素质量分数与种仁含水量呈正相关,SA与种实单粒质量和体积也呈正相关关系(图4B)。

图4 香榧种实膨大期假种皮(A)和种仁(B)中各生长指标、糖质量分数、酶活性和激素质量分数间相关性分析Figure 4 Correlation analysis of growth index, sugar content, enzyme activity and hormone content in aril (A) and kernel tissues (B) during T.grandis ‘Merrillii’ seed expansion
2.5 种实膨大期糖代谢相关酶基因表达分析
为了深入分析香榧种实膨大过程中,蔗糖代谢、淀粉代谢以及激素信号途径相关基因表达情况及其相互调控与种实的膨大关系等,本研究对各膨大阶段的香榧种实进行转录组测序。转录组分析发现:与种实突破种鳞后30 d相比,在种实突破种鳞后60 d时共鉴定到12 346个差异表达基因,其中,5 456个上调表达,6 884个下调表达。与种实突破种鳞后30 d相比,种实突破种鳞后90 d时共鉴定到22 668个差异表达基因,包括10 569个上调表达基因和12 099个下调表达基因(图5A)。KEGG代谢途径富集分析发现:在前20个被显著富集的代谢途径中,淀粉和蔗糖代谢、激素信号转导等途径均被显著富集(图5B)。

图5 香榧种实膨大期差异表达基因(A)及KEGG代谢途径富集(B)分析Figure 5 Analysis of differential expression genes (A) and KEGG pathway enrichment (B) during T.grandis ‘Merrillii’ seed expansion
进一步差异表达基因分析发现:36个单基因簇参与香榧种实中蔗糖的转运、合成和水解过程;16个单基因簇参与淀粉的合成与分解过程(图6A)。其中,蔗糖合成酶编码基因随着香榧种实膨大表达量逐渐降低(图6B);蔗糖结合蛋白 (sucrose-binding protein,SBP)和蔗糖转运蛋白 (sucrose transport protein,SUT)呈明显上调表达趋势,但参与蔗糖及葡萄糖和果糖运输的糖转运蛋白(sugar transporter sweet,Sweet)基因呈下调表达(图6B)。此外,参与蔗糖水解的细胞壁蔗糖转化酶、细胞质蔗糖转化酶和液泡蔗糖转化酶其编码基因随着香榧种实膨大既有上调又有下调情况。参与淀粉合成的可溶性淀粉合成酶 [soluble starch synthase (SSS)]、颗粒结合型淀粉合成酶 [granule-bound starch synthase (GBSS)]、淀粉分支酶[starch branching enzyme (SBE)]和异淀粉酶[isoamylase (ISA)]基因表达量均随着香榧种实膨大而呈现上调表达趋势(图6B);参与淀粉水解的α-淀粉酶(alpha-amylase,AMY)和β-淀粉酶(betaamytase,BAM)香榧种实膨大过程中则分别上调表达和下调表达。
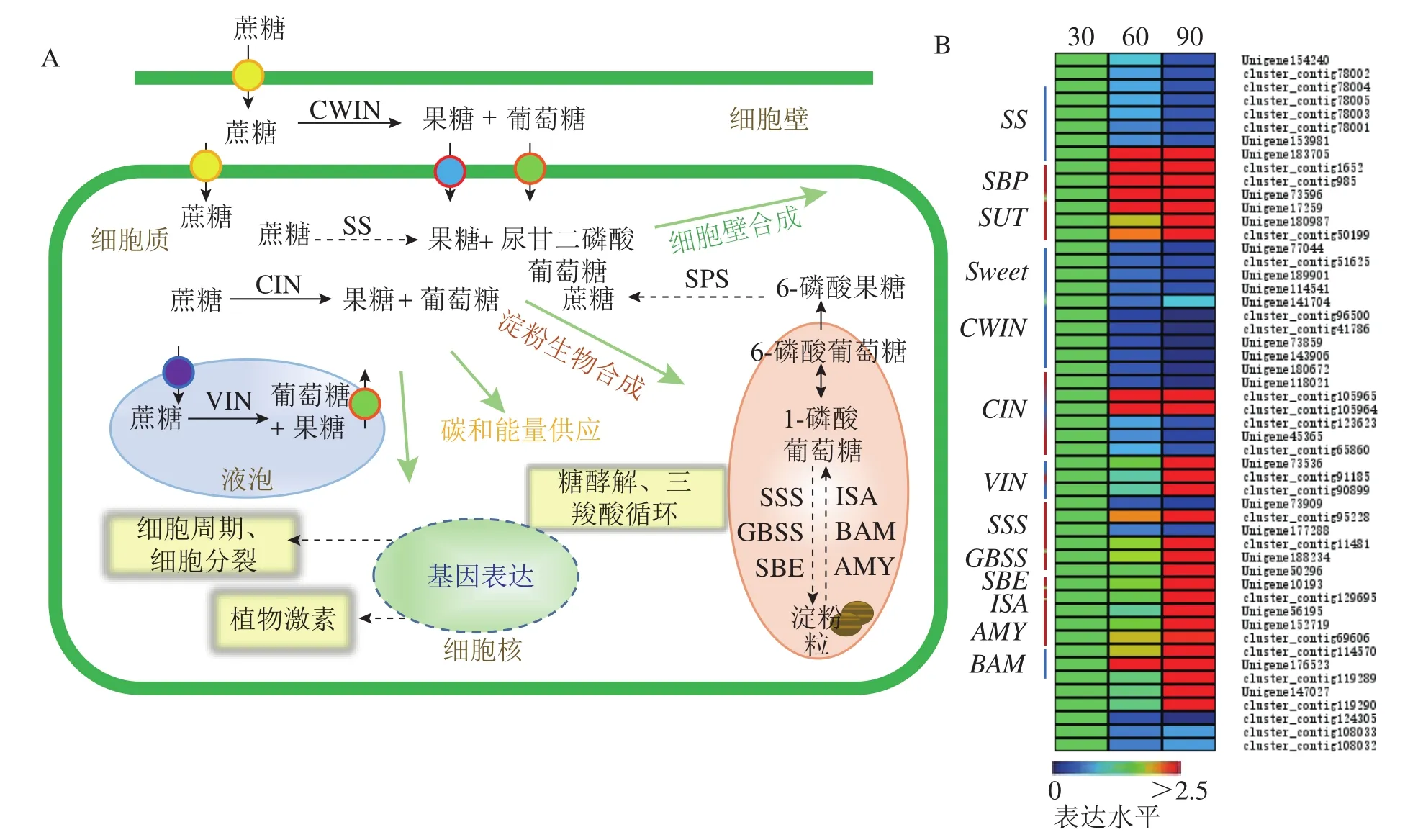
图6 香榧种实膨大过程中蔗糖代谢途径(A)及相关基因表达(B)分析Figure 6 Sucrose metabolism pathway (A) and the relative gene expression (B) analysis during T. grandis ‘Merrillii’ seed expansion
3 讨论
香榧种实从授粉到成熟跨2 a,历时17个月之久,其雌球花4月开花授粉,9月完成受精,形成的幼果对生并包裹在种鳞中。次年4月,幼果开始启动细胞分裂和膨大,5—7月进入快速生长期,种实横径、纵径、单粒质量和体积都明显增大,种仁逐渐固化,含水率降低。这一时期的变化是香榧种实产量和品质形成的重要基础,但由于各种内外因素的影响,绝大部分香榧幼果在种实膨大期生长缓慢,甚至停止生长,严重制约香榧产量。研究[27]已经证实:处于膨大期前的香榧幼果授粉受精状况良好,发育正常。因此,香榧种实发育过程中某些重要生理过程的变化是影响香榧种实膨大的关键因素,对这些生理过程的研究也是提高香榧产量的必要前提。
蔗糖作为光合同化物的主要积累形式,其在果实中积累后会被分解为葡萄糖和果糖。这些小分子还原糖进一步参与糖酵解、三羧酸循环等过程,为果实早期发育和细胞膨大提供能量和碳骨架[6]。同时,蔗糖水解产物也会进一步合成淀粉,以淀粉形式储藏[28]。有报道表明:在蚕豆Vicia faba种实发育过程中,葡萄糖可能调节细胞分裂,而蔗糖则调节细胞扩张和储备物沉积[29]。菠萝Ananas comosus幼果期蔗糖含量呈下降趋势,苹果Malus sieversii果实发育前期果糖和蔗糖含量较低[30];咖啡Coffea racemosa果实果皮和胚乳之间存在密切的蔗糖运输,并且果皮中可溶性糖和还原糖含量随着果实发育逐渐降低[31]。本研究发现:香榧假种皮中的蔗糖、葡萄糖、果糖随着种实膨大先上升后下降,淀粉质量分数不断下降;种仁中蔗糖质量分数则持续下降,淀粉逐渐积累。相关性分析发现:假种皮中葡萄糖、果糖质量分数与种实横纵径显著正相关,与淀粉质量分数显著负相关,种仁中各种糖质量分数与种实体积显著负相关,淀粉质量分数与种实体积正相关。以上结果表明:膨大前期香榧假种皮中的蔗糖以积累为主,而在种实膨大后期蔗糖和淀粉主要以分解为主,以满足种实的不断发育;种仁中蔗糖则一直以分解为主,供给香榧种实膨大和淀粉积累。
蔗糖代谢及其相关酶活性和基因表达量的高低是衡量果实库竞争能力强弱的重要指标,与果实大小和产量密切相关,但不同植物果实中起主导作用的酶不同。研究发现:蜜柑果实膨大期液泡蔗糖转化酶活性较高,蔗糖含量随着液泡蔗糖转化酶活性下降而逐渐积累[15]。较高活性的细胞壁蔗糖转化酶和细胞质蔗糖转化酶则有利于番茄和龙眼Dimocarpus longan果实发育过程中糖向果实中的分配及代谢过程[32−34]。梨Pyrus spp. 果实中蔗糖合成酶活性和蛋白质含量在发育期的梨果实中明显增加,催化蔗糖的分解代谢和果实干物质积累,促进果实增大[35]。糖转运蛋白和蔗糖磷酸合成酶基因的上调表达对苹果果实发育至关重要[33]。本研究中,随着香榧种实膨大,蔗糖磷酸合成酶在假种皮中活性上升,而在种仁中活性下降,蔗糖转化酶活性在香榧假种皮中也显著上升。相关性分析发现:蔗糖、葡萄糖、果糖、淀粉质量分数与3种蔗糖转化酶和蔗糖磷酸合成酶活性显著相关。结合基因表达分析发现:参与蔗糖及还原糖运输的SBP和SUT在种实膨大过程中显著上调表达,参与蔗糖水解的细胞质蔗糖转化酶、液泡蔗糖转化酶编码基因部分转录本也随着种实膨大显著上调,而细胞壁蔗糖转化酶和蔗糖合成酶编码基因则明显下调表达。进一步表明香榧种实膨大过程中假种皮和种仁之间,以及种仁内部存在活跃的碳水化合物运输和代谢过程,且负责蔗糖水解的酶主要是蔗糖转化酶,细胞质蔗糖转化酶和液泡蔗糖转化酶起到重要作用。同时,在种实膨大后期,种仁中参与淀粉合成的SSS、GBSS、SBE均显著上调表达,参与淀粉水解的ISA、AMY上调表达,BAM下调表达。上述结果表明:香榧种实膨大早期,蔗糖分解代谢活跃,主要用于香榧种实的快速膨大;膨大后期蔗糖代谢的同时伴随淀粉合成,有利于种实成熟过程中营养物质转化积累干物质。
此外,果实内部蔗糖代谢与激素含量变化存在显著互作关系,共同调控果实生长发育[36]。草莓Fragaria ananassa果实发育过程中,蔗糖可作为信号分子,诱导细胞内ABA合成途径基因NCEDs的表达,促进ABA的积累[37]。番茄果实发育早期,果实中生长素积累有利于蔗糖向果实中运输及代谢[38]。N-(2-氯-4-吡啶基)-N-苯基脲 (N-(2-chloro-4-pyridyl)-N′-phenylurea, CPPU)处理后的猕猴桃 Actinidia chinensis var. deliciosa‘Hayward’果实通过增加含水率,促进果实膨大[39]。1.25 mmol·L−1GA 处理能够显著增加桃果实大小以及蔗糖含量[40]。本研究发现:香榧种实膨大过程中,假种皮中GA4、GA3、SA质量分数总体呈显著积累模式,种仁中GA3、SA、ABA也随着种实膨大逐渐积累。相关性分析发现:种仁中GA和IAA质量分数与蔗糖、葡萄糖、果糖质量分数和4种蔗糖代谢酶活性显著正相关,表明香榧种实膨大过程中种仁内部激素质量分数变化与糖代谢密切相关。转录组代谢途径富集显示:激素信号转导和蔗糖代谢通路在香榧种实膨大过程中均被显著富集。结合基因表达分析发现:香榧种实膨大过程中伴随GA3和GA4等激素质量分数的增加,蔗糖转运相关蛋白、细胞壁蔗糖转化酶、细胞质蔗糖转化酶、液泡蔗糖转化酶编码基因均呈现不同程度的上调表达,表明这些基因的表达可能受到种实内部激素质量分数变化的调控。与之相似,外源GA处理增强了液泡蔗糖转化酶编码基因VvGIN1和VvGIN2在葡萄果实中的表达,明显提高蔗糖转化酶活性,促进糖在果实中的积累与代谢,增加果实体积[19]。同样,外源喷施细胞分裂素能够有效提高逆境下番茄果实蔗糖合成酶和细胞壁蔗糖转化酶活性,抑制转化酶抑制蛋白(Invertase inhibitor,INVINH)的表达,增强果实库活力,促进果实生长[41−42]。这表明香榧种实中激素质量分数变化可能参与调控蔗糖代谢相关基因的表达,促进蔗糖的积累与代谢过程,提高种实库活力,进而调控香榧种实的膨大,但具体的调控机制仍有待深入研究。
4 结论
本研究发现:膨大前期香榧假种皮中的蔗糖以积累为主,在种实膨大后期蔗糖和淀粉以分解为主,提供能量和碳骨架,以满足种实的不断发育;种仁中蔗糖则一直以分解为主,一方面供给香榧种实膨大,另一方面逐渐合成淀粉,为后期成熟过程中营养物质转化积累干物质。代谢相关酶活性及基因表达分析表明:香榧种实膨大过程中假种皮和种仁之间,以及种仁内部存在活跃的碳水化合物运输和代谢过程,且负责蔗糖水解的酶主要是蔗糖转化酶,细胞质蔗糖转化酶和液泡蔗糖转化酶起到重要作用。此外,假种皮中GA4、GA3、SA质量分数总体呈现显著积累模式,种仁中GA3、SA、ABA也随着种实膨大逐渐积累,且与蔗糖、淀粉质量分数和代谢酶活性呈现相关关系,表明蔗糖代谢的增强可能促进了这些激素的合成和积累,激素质量分数变化进一步调节香榧种实中蔗糖代谢活性和基因表达等。

