一氧化氮供体和阿霉素的共递送系统用于逆转肿瘤低氧耐药研究
郑云茹,陈红,魏欣琪,褚克丹,徐伟,刘剑
(福建中医药大学药学院,福建 福州 350122)
低氧作为一种重要的微环境因子,在肿瘤的发生和发展过程中起着重要的作用。与正常组织氧压(40~60 mmHg)(1 mmHg=0.133 322 kPa)相比,大多数实体瘤组织的氧中位数较低,约为10 mmHg[1-2]。肿瘤部位的低氧微环境不仅促进了肿瘤的生长与转移,而且大大降低抗肿瘤药物的治疗效果,其原因是:①药物不太可能以毒性浓度输送到低氧区;②低氧有助于p53抑癌蛋白的丢失,导致细胞自身凋亡能力的丧失;③低氧细胞可以下调DNA拓扑异构酶Ⅱ的表达,因此,阿霉素和依托泊苷等针对该蛋白或DNA的药物将是无效的;④低氧通过上调缺氧流导因子-1α(HIF-1α),调控与细胞增殖、药物外排、细胞凋亡、代谢和血管生成等有关蛋白的表达或基因的合成而引起化疗抗性,包括编码药物外流泵P-糖蛋白的多重耐药基因[3-7]。因此,低氧也常被认为是肿瘤治疗失败,导致肿瘤耐药产生的重要因素之一。
为了解决肿瘤低氧耐药性问题以及提高化疗对肿瘤的治疗效果,人们探索了许多方法。其中Graham课题组报道了低浓度的一氧化氮(NO)供体甘油三硝酸酯和异山梨醇二硝酸酯均能有效地解决肿瘤低氧诱导的耐药,其原因是低浓度的一氧化氮供体药物通过NO信号通路激活可溶性鸟苷酸环化酶(sGC),进而使环鸟苷酸(cGMP)累积, cGMP再激活下游的蛋白激酶G(PKG) ,从而导致调节细胞功能和基因表达的各种靶分子的磷酸化,改善肿瘤乏氧微环境[8]。随后,Stewar等[9]对抗癌药舒林酸进行了硝酸酯类一氧化氮供体修饰,得到的结合物能显著地抑制肿瘤细胞的增殖。但不幸的是,无论将一氧化氮供体与抗癌药进行简单的混合还是通过化学键连接,它们均不能有效地抑制体内肿瘤的生长,这主要因为低分子量的药物和一氧化氮供体具有循环半衰期短和水溶性差等缺点,且无法特异性识别肿瘤细胞。
二硫化钼(molybdenum disulfide,MoS2)是由中心对称的S-Mo-S三个原子层组成的二维材料。其中,MoS2中的S元素是生物中的一种常见元素,而Mo元素是细胞中几种酶发挥作用的必需微量元素,且在体内可被氧化成水溶性氧化物(如MnO42-等),通过尿液和粪便两种途径有效排泄,不会造成在体内的大量积累,避免毒副作用的发生[10]。在生物应用方面,MoS2因其卓越的表面等离子共振特性,丰富的化学反应位点,高的光热转换效率,强的组织穿透能力,以及良好的生物相容性而成为理想的光热材料[11]。除了可作为光热材料之外,MoS2还具有超薄的厚度,较大的表面积,丰富的化学反应位点及各向异性的光学和热学等特性,使其在生物医学领域内展现了独特的开发潜质,特别是在药物、基因、光敏剂、造影剂等装载和输送方面[12]。近几年,国内外学者积极地开发MoS2材料在生物医学上应用,特别是在药物输送方面和疾病诊断方面。其中,Liu等[13]用聚乙二醇化(PEG)的MoS2纳米片作为载体装载了几种抗癌药物,通过对比发现,MoS2的载药量远大于其他几个常见的纳米材料,如氧化石墨烯等。Yin等[14]构建了壳聚糖修饰的MoS2药物输送系统,实现了近红外光诱导的药物释放以及对肿瘤的光热和化疗的联合治疗。与此同时,本课题组制备了透明质酸修饰的MoS2纳米片,以此作为载体,完成了表皮生长因子受体酪氨酸激酶抑制剂吉非替尼和造影剂钆的靶向共输送,实现了磁共振成像指导下对肺癌的光热和药物治疗的联合治疗[15]。随后,我们又用PEG修饰的MoS2纳米片同时装载表皮生长因子受体酪氨酸激酶抑制剂厄洛替尼和化疗药物阿霉素,利用近红外光控制药物的释放,使它们按设定顺序作用于肿瘤,实现对肺癌的药物协同化治疗和光热的联合治疗,取得了不错的抑瘤效果[16]。这些证据充分说明了MoS2材料可以作为一种安全且有效的载体,实现单个或多个药物的装载,控制释放及输送。
因此,本研究设计了一种以MoS2纳米片作为载体,利用酰胺缩合反应将羧基化的一氧化氮供体单硝酸异山梨酯(isosorbide mononitrate,IM)与靶向配体透明质酸(hyaluronic acid,HA)结合,再凭借硫化学作用将结合物嫁接于MoS2纳米片上,最后通过疏水作用装载抗癌药物阿霉素(doxorubicin,DOX),构建一氧化氮供体和抗癌药物的共递送系统(MoS2-HA-IM-DOX)。我们不仅考察了此系统的理化特性,而且在细胞水平上研究其抗肿瘤效果。
1 仪器与材料
1.1 仪器 TECNAI G2F20场发射透射电子显微镜(美国FEI公司);Multimode8原子力显微镜(德国布鲁克公司);UV-2700i紫外/可见光分光光度计(日本岛津公司);尼高力360智能型傅立叶变换红外光谱仪(美国尼高力公司);Zetasizer Nano ZSE马尔文帕纳科纳米粒度及电位分析仪(英国马尔文仪器有限公司);MDL-N-808激光器(长春新产业光电技术有限公司);BD FACS AriaIII高端分选型流式细胞仪(美国BD公司);AX315红外成像仪(美国菲利尔公司);TCS SP8激光共聚焦显微镜(德国徕卡公司);Infinite M200Pro酶标仪(瑞士帝肯公司);HypoxyLab低氧细胞工作站(英国Oxford Optronix公司)。
1.3 细胞 人非小细胞肺癌细胞PC-9、人胚肺成纤维细胞HELF(中科院上海细胞库)。
2 实验与方法
2.1 MoS2-HA-IM的制备
2.1.1 HA-IM的制备 EDC和NHS加入HA(20 mg·mL-1,10 mL)PBS溶液,搅拌1 h后,逐滴加到胱胺溶液(56 mg·mL-1,20 mL)内,继续搅拌24 h后,加入冷乙醇,离心,将所得沉淀复溶于水,转置于透析袋(3.5 kDa),除杂72 h,冷冻干燥,可得固体HA-SS-NH2。
IM(1.92 g)溶解于二氯甲烷,加入4-二甲氨基吡啶(1.22 g)和琥珀酸酐(3 g)。无氧条件下,反应24 h,减压蒸发,依次加入饱和NaHCO3溶液和5%盐酸,萃取,收集有机相,再经硅胶柱色谱法纯化(洗脱剂:石油醚/乙酸乙酯=1∶1),即制得固体IM-COOH。
IM-COOH(10 mg)溶解于甲酰胺溶液,加入EDC和NHS,搅拌1 h。将活化的IM-COOH逐滴加入到HA-SS-NH2溶液(1 mg·mL-1)中。反应24 h后,加入冷乙醇,离心,将所得沉淀复溶于水,转置于透析袋(3.5 kDa),除杂72 h,最后冷冻干燥,即制得结合物HA-IM。
2.1.2 MoS2-HA-IM的制备 HA-IM(10 mg)溶解于水,加入等体积MoS2水溶液(0.5 mg·mL-1)。超声20 min取出搅拌过夜后,将混合液转入透析袋(100 kDa)内,透析72 h除去未结合的HA-IM,即制得MoS2-HA-IM溶液。
2.2 MoS2-HA-IM的表征 傅立叶变换红外光谱仪和紫外/可见光分光光度计分析MoS2-HA-IM的化学结构。场发射透射电子显微镜(TEM)观察MoS2-HA-IM表面形貌。原子力显微镜(AFM)测定MoS2-HA-IM的尺寸和厚度。Zeta电位与纳米粒度仪测定MoS2-HA-IM的粒径和电势电位。
企业信用管理部门在收集客户信用资料、运用信用评分模型等方面存在一定的局限性。然而术业有专攻,信用管理机构则由专门的财务、法律、经济专家组成,他们对企业信息收集的范围更广,对信用评级的数据依据更加全面,对不同行业的应收账款风险对应的客户有不同的评估系统,应对应收账款风险的预警机制也更加健全。
2.3 光热特性 移取1 mL不同浓度的MoS2-HA-IM溶液(0、12.5、25、50和100 μg·mL-1),加入比色皿中,调节808 nm激光器,使用1 W·cm-2的激光照射上述样品10 min。光照过程中,每隔1 min使用红外热成像仪记录一次样品的温度,收集数据并绘制光热升温曲线。
2.4 MoS2-HA-IM的细胞毒性 将PC-9细胞(6×103/孔)和HELF细胞(5×103/孔)分别接种于96孔细胞培养板,转入20% O2的普通培养箱或1% O2低氧工作站中培养。待细胞贴壁后,加入含不同浓度MoS2-HA-IM的细胞培养基。再孵育48 h后,使用MTT法测定细胞活性。
2.5 药物装载和释放 配置不同浓度的DOX溶液,向其中加入等体积的MoS2-HA-IM溶液(0.1 mg·mL-1),调节pH至8.0。避光搅拌24 h后,将溶液移入至超滤管(Millipore,MWCO 100 kDa)内,其在3 000 r·min-1转速下超滤离心10 min,并用去离子水反复洗涤离心至下层溶液无色,得到的MoS2-HA-IM-DOX溶液置于4 ℃冰箱保存,并根据装载DOX前后的MoS2-HA-IM在480 nm波长处的吸收度变化来计算DOX的装载量。
MoS2-HA-IM-DOX(1 mL)溶液封闭于透析袋内,随后沉浸于9 mL不同pH值的PBS溶液中。光照组样品受到808 nm激光(1 W·cm-2)照射10 min,而其他组避光处理。在随后46 h内,所有样品均避光处理。在设定的时间点,取出0.2 mL透析液,测定其在480 nm波长处的吸光度,随后将其放回至原来的释放体系中,维持该体系的体积恒定。48 h后,收集数据并绘制出药物的累计释放曲线。
2.6 细胞摄取 将PC-9细胞(3×105/皿)和HELF细胞(1×105/皿)分别接种于共聚焦小皿,随后转入1% O2的低氧工作站中培养。待细胞贴壁后,使用细胞培养基稀释MoS2-HA-IM-DOX溶液至设定浓度([DOX]=20 μg·mL-1),随后加入共聚焦小皿内,培养2 h。待细胞核染色完成后,置于共聚焦显微镜下观察细胞的荧光图像。细胞表面HA受体封闭实验是预先使用游离HA(4 mg·mL-1)孵育细胞2 h,然后加入MoS2-HA-IM-DOX稀释液按相同方法处理。与此同时,采用流式细胞仪定量考察了PC-9细胞和HELF细胞对MoS2-HA-IM-DOX的摄取。
2.7 IM逆转肿瘤低氧诱导的耐药 将PC-9细胞(6×103/孔)接种于96孔细胞培养板,再转入20% O2的普通培养箱或1% O2低氧工作站内。待细胞贴壁后,用细胞培养基将IM溶液稀释到设定的浓度,加入培养孔内。共孵育2 h后,用PBS清洗细胞3次,再加入含DOX的细胞培养基。另外孵育48 h后,用MTT法测定细胞的活性。
2.8 MoS2-HA-IM-DOX的细胞毒性 PC-9细胞(6×103/孔)接种于96孔细胞培养板,在低氧环境下培育24 h。随后将含有DOX或MoS2-HA-IM-DOX的细胞培养基加入培养孔内。孵育2 h后,用PBS溶液清洗细胞3次,每孔加入新鲜的细胞培养基。再孵育48 h后,用MTT法测定细胞的活性。
2.9 近红外光照射下MoS2-HA-IM-DOX对肺癌细胞的杀伤作用 PC-9细胞(6×103/孔)接种于96孔细胞培养板,转入1% O2低氧工作站中。待细胞贴壁之后,将细胞分为6组:①细胞培养基;②MoS2-HA-NH2;③MoS2-HA-IM;④DOX;⑤MoS2-HA-DOX;⑥MoS2-HA-IM-DOX([DOX]=20 μg·mL-1,[MoS2-HA-IM]=80 μg·mL-1)。待细胞与对应的材料共孵育2 h后,用PBS溶液清洗细胞3次,每孔加入新鲜的细胞培养基。光照组的细胞受到1 W·cm-2的808 nm激光照射10 min,而其他组的细胞避光处理。再孵育48 h后,用MTT法测定细胞的活性。
2.10 统计学分析 实验结果均使用GraphPad Prism 8.0软件进行统计学分析处理。实验数据以平均值±标准差(Mean±SD)表示。采用t检测分析两实验组间的差异;采用单因素方差分析方法(ANOVA)分析两组以上实验组间的差异。P<0.05被认为具有统计学差异。
3 结果与讨论
3.1 MoS2-HA-IM的制备及表征 MoS2纳米片是通过化学剥离法制备的[17-18],从图1b透射电镜图(TEM)和图1c~1d原子力显微镜图(AFM)可知制备的MoS2纳米片结构为层状,且平均厚度约为1.1 nm,表明其多为单层或少层。同时,我们也发现MoS2纳米片可以稳定地分散在水中,但由于电子屏蔽效应,在生理盐水溶液内会产生聚集,这严重影响了MoS2材料在生物医学上的应用。在我们之前的研究中,HA修饰的MoS2纳米片(MoS2-HA)具有较好的生理稳定性,能够在生理盐水内保持稳定达30 d以上[15],而在这个工作的体系中,我们将IM引入到这MoS2-HA纳米片内,以制备携一氧化氮供体纳米载体MoS2-HA-IM。
从图2a红外谱图可以看出,相比于IM,IM-COOH在1 720 cm-1处有明显的C=O伸缩振动峰,说明了IM中的羟基已转化成羧基。随后利用EDC/NHS技术,将HA-SS-NH2和IM-COOH结合起来。如我们预期所想,一些IM-COOH的特征峰出现在了HA-SS-NH2的红外图谱上,比如-NO2的伸缩振动峰(1 320 cm-1),说明了HA-SS-NH2和IM-COOH的成功结合。将HA-IM与MoS2反应后,一些HA-IM的特征峰便出现在了MoS2的红外光谱图上,比如N-H伸缩振动峰(1 660 cm-1)和C-O变角弯曲振动峰(1 150 cm-1),说明了HA-IM已成功地嫁接到了MoS2纳米片上。同时,从图2b MoS2-HA-IM的紫外-可见光-近红外吸收光谱中可以看出,其在紫外200~250 nm范围内的吸光度较MoS2高,进一步证实了HA-IM存在于MoS2纳米片上。
在证实MoS2-HA-IM的成功制备后,我们考察了其形貌特征。如图1f~1h所示,与MoS2纳米片相比,MoS2-HA-IM仍具有2D层状结构,平均厚度上升至4 nm,间接地提供了HA-IM存在于MoS2纳米片上的证据,而粒径却由180 nm降低至90 nm,这一结果也得到了DLS测试的证实,其原因为超声粉碎了纳米片,结果见图1i。

图1 (a)MoS2-HA-IM的制备示意图;(b~d)MoS2纳米片的TEM图,AFM图以及其厚度;(e)MoS2和MoS2-HA-IM在水、PBS溶液和细胞培养基放置30 d后的光学照片;(f~h)MoS2-HA-IM纳米片的TEM图,AFM图以及其厚度;(i)动态光散射(DLS)测试得到的MoS2和MoS2-HA-IM的水合粒径
3.2 MoS2-HA-IM的光热特性 由图2b可知,HA-IM的存在不影响MoS2在近红外区域的强吸收。为了研究MoS2-HA-IM的光热性能,配制了不同浓度的MoS2-HA-IM溶液,随后用1 W·cm-2的808 nm激光照射上述样品10 min。结果发现,激光照射前后水样的温度只增加了6 ℃左右。相比之下,MoS2-HA-IM溶液的温度在激光照射后出现明显的升高,且样品的浓度越大,溶液温度的升高速率越快,最高温度可达96 ℃,结果见图3a、3b。相比人体的正常体温为37 ℃而言,在近红外光的照射下,积累在肿瘤部位的MoS2-HA-IM可以提高肿瘤区域的温度至43 ℃以上,引起肿瘤细胞的消融和死亡,从而在一定程度上抑制肿瘤的生长[19]。
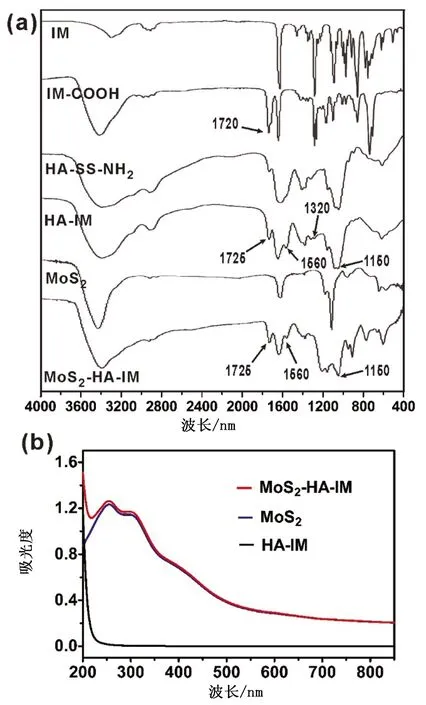
图2 (a)MoS2-HA-IM的傅立叶变换红外光谱图;(b)HA-IM嫁接前后MoS2的紫外-可见-近红外吸收光谱图

图3 (a)在功率密度为1 W·cm-2的激光照射下,水和不同浓度的MoS2-HA-IM溶液的光热升温曲线;(b)对应(a)中样品的热成像图
3.3 MoS2-HA-IM的细胞毒性 选取PC-9细胞和HELF细胞作为细胞模型,使用MTT法评估MoS2-HA-IM的细胞毒性。结果如图4a所示,当MoS2-HA-IM的浓度在12.5~400 μg·mL-1范围内时,PC-9细胞和HELF细胞的活性均保持在90%以上。同时,我们也考察了MoS2-HA-IM在低氧环境下的细胞毒性,由图4b中可知得到了与上述相似的结果,进一步说明MoS2-HA-IM具有较低的细胞毒性,具有在生物医学领域应用的前景。
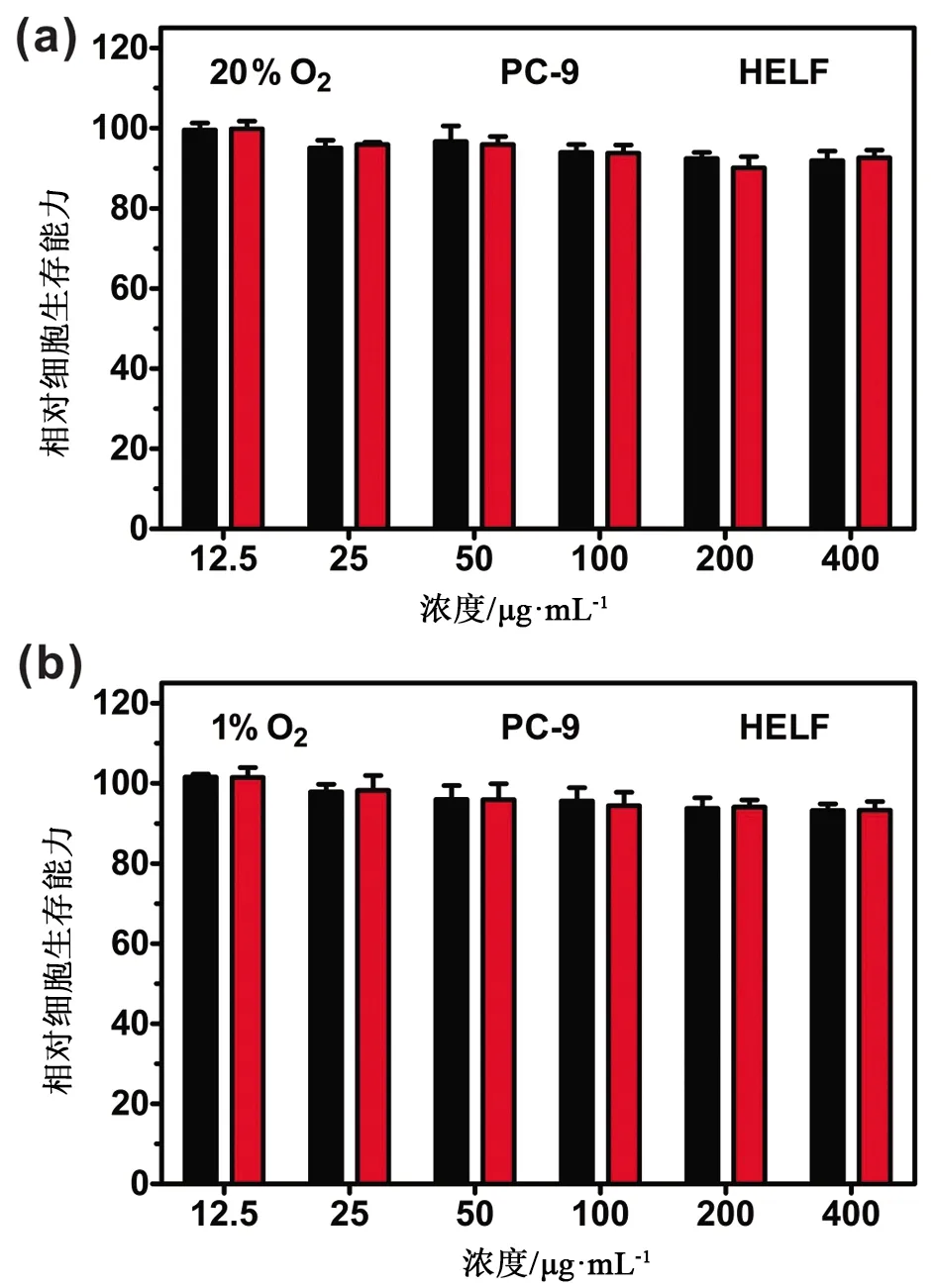
图4 在常氧环境(a)或低氧环境(b)下,与不同浓度的MoS2-HA-IM溶液孵育48 h后PC-9细胞和HELF细胞的活性
3.4 药物装载以及双重响应的药物释放 有文献报道,在弱碱(pH=8.0)环境下,DOX·HCI会脱盐而变得疏水,进而可通过疏水作用装载于MoS2纳米片上,实现药物的有效输送[13]。在本实验中,为了探究MoS2-HA-IM对DOX的装载能力,我们将MoS2-HA-IM溶液与不同浓度的DOX溶液相混合。搅拌24 h后,超滤以除去未装载的DOX。由图5a可知,DOX的吸收特征峰(480 nm)出现在了MoS2-HA-IM的紫外-可见光-近红外吸收光谱上,说明了DOX已经成功装载于MoS2-HA-IM上。同时可知,MoS2-HA-IM对DOX的装载量随着DOX浓度的增大而增加。然而,装载量一旦超过50%,MoS2-HA-IM-DOX在生理条件下的稳定性受到了严重的影响,甚至出现了局部聚沉的现象,这可能是由于DOX的大量存在改变了MoS2-HA-IM的Zeta电势。
实验考察了MoS2-HA-IM-DOX的药物释放动力学。由图5b可知,在pH为5.5的释放介质中,MoS2-HA-IM-DOX在48 h内的药物累计释放百分比为25.7%,是pH为7.4条件下(9.3%)的2.6倍,表现出pH响应的药物释放行为。这是由于DOX分子中的氨基在酸性条件下易发生质子化,提高了DOX在水中的溶解性,减弱了DOX与MoS2载体之间的疏水作用,进而加快DOX的释放速率[16]。经过近红外光照射10 min后,pH为5.5环境下的药物累计释放百分比从15.4%迅速上升至41.3%,增长了25.9%,远远大于未激光照射,说明了MoS2-HA-IM-DOX具有近红外光诱导药物释放的特性,综上所述,pH和近红外光双重药物释放特性能够有效地促使药物脱离载体,可增强MoS2-HA-IM-DOX的化疗效果。
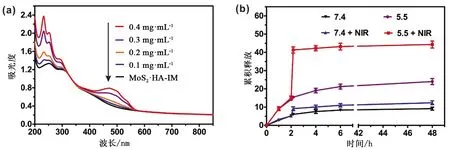
图5 (a)MoS2-HA-IM装载不同浓度的药物时的紫外-可见-近红外吸收光谱图;(b)在有/无近红外光照射(1 W·cm-2)和不同pH值的环境下,DOX的累计释放曲线
3.5 低氧环境下肺癌细胞对MoS2-HA-IM-DOX的摄取 图6a为激光共聚焦显微镜观察细胞的荧光图像,结果发现相较于HELF细胞而言,PC-9细胞显示出更强的DOX荧光,说明MoS2-HA-IM-DOX更容易进入PC-9细胞。且经过HA预处理的PC-9细胞显示出非常弱的DOX荧光,与HELF细胞相仿,这主要因为游离的HA与PC-9细胞表面的HA受体结合,占据了MoS2-HA-IM-DOX与细胞结合的位点,使此纳米复合物无法特异性识别细胞,导致其进入细胞内的效率大大降低。
使用流式细胞仪定量分析了PC-9细胞和HELF细胞内的荧光强度,结果见图6b。流式细胞仪测试得到的胞内量化荧光数据与激光共聚焦细胞荧光成像的结果相吻合,进一步证实了HA修饰的MoS2材料具有对HA受体过表达的肿瘤细胞特定的靶向识别能力,可将装载的药物有效地输送到肿瘤细胞内。
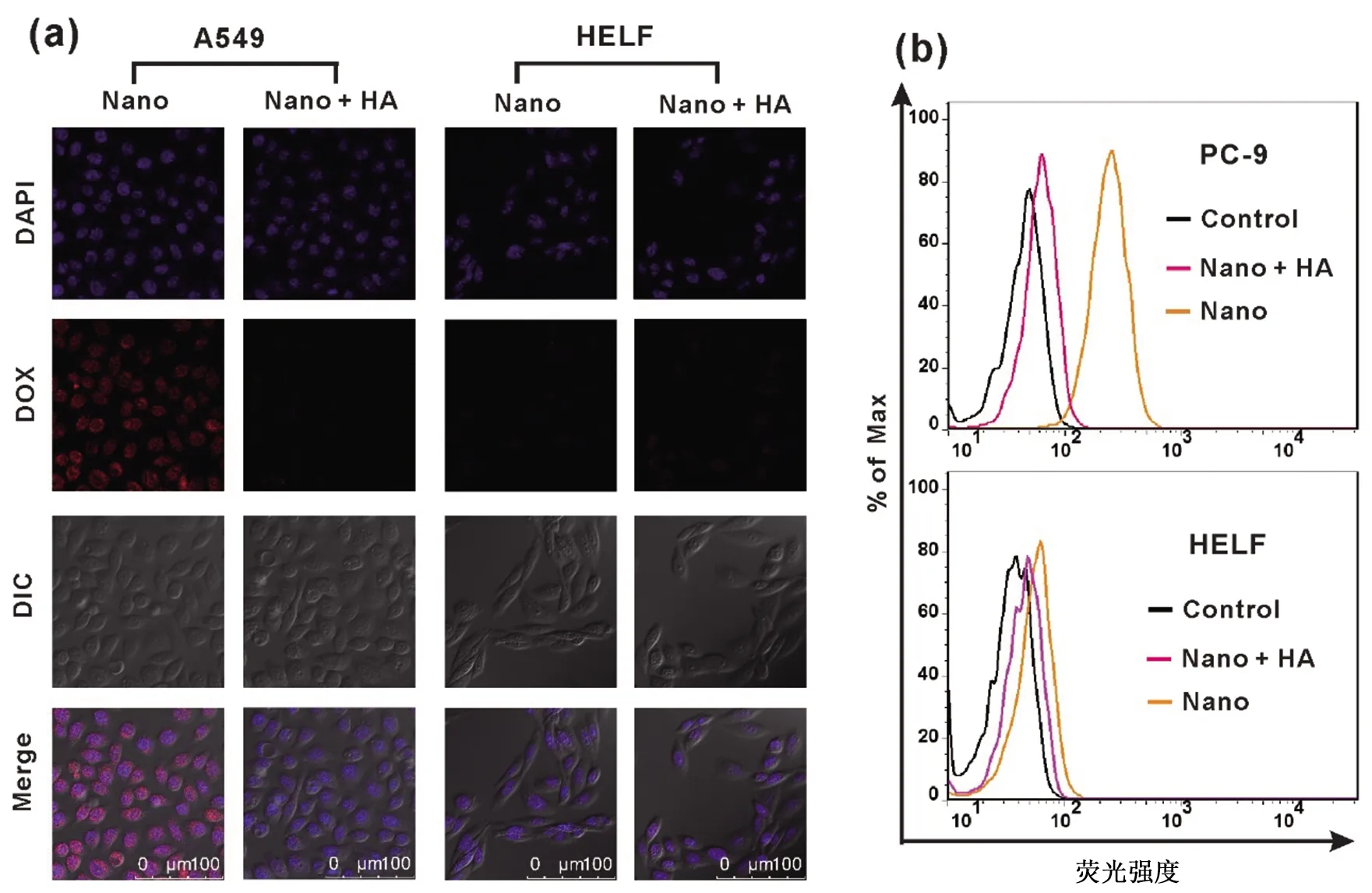
图6 Nano:MoS2-HA-IM-DOX注:(a)在低氧及有/无游离HA存在的条件下,PC-9细胞和HELF细胞与Nano共孵育2 h后的激光共聚焦荧光图像;(b)用流式细胞仪定量分析(a)中胞内DOX荧光强度
3.6 MoS2-HA-IM-DOX在细胞水平上的协同治疗 由图7a可知,在相同的DOX浓度下,低氧环境下PC-9细胞表现出较高的细胞活性,且低氧环境下DOX的IC50值是常氧环境下的3.2倍,表明肿瘤细胞在低氧环境下对DOX具有较强的耐受性。但当这些细胞与IM处理后,细胞的活性显著下降,见图7b。为了探究细胞活性变化的原因,考察了IM的细胞毒性,由图7c发现,在浓度0.01~10 μg·mL-1范围内,IM表现出无毒,且不会抑制肿瘤细胞的增殖。这一结果证实了IM+DOX组较低的细胞活性是因为IM能够有效地减弱肿瘤细胞在低氧环境下对DOX的耐受性,增强了DOX的细胞毒性所导致的。
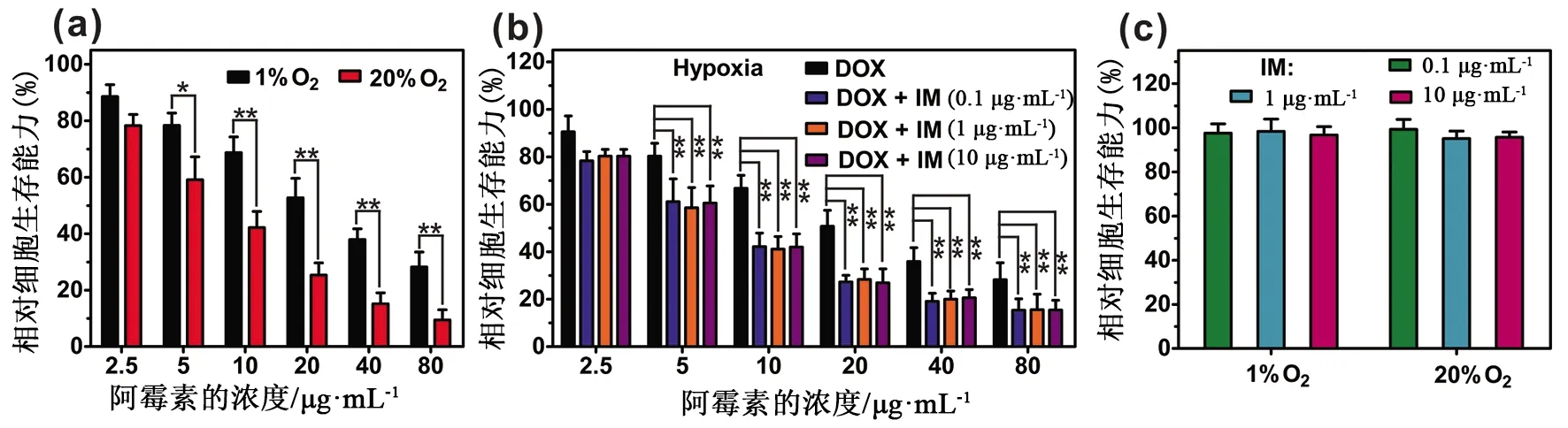
图7 (a)在不同的氧分压下,与不同浓度的游离DOX孵育后PC-9细胞的活性;(b)低氧环境下,PC-9细胞经IM处理后,再与DOX共孵育后的活性;(c)在不同的氧分压下,与不同浓度的IM孵育48 h后PC-9细胞的活性
为了进一步证实IM能够逆转肿瘤在低氧环境下的耐药性,紧接着,我们考察装载有IM的MoS2-HA-IM-DOX能否在低氧环境下具有较强的细胞毒性。由图8a可知,游离DOX、MoS2-HA-DOX、MoS2-HA-IM-DOX 3种材料都能在一定程度上抑制PC-9细胞的增殖,且均表现出明显的浓度依赖性。但在相同的DOX浓度下,相较于与MoS2-HA-DOX或DOX共孵育的细胞而言,与MoS2-HA-IM-DOX共孵育的细胞显示出较低的细胞活性,说明了IM能有效地增强MoS2-HA-DOX的细胞毒性,提高其化疗效果。
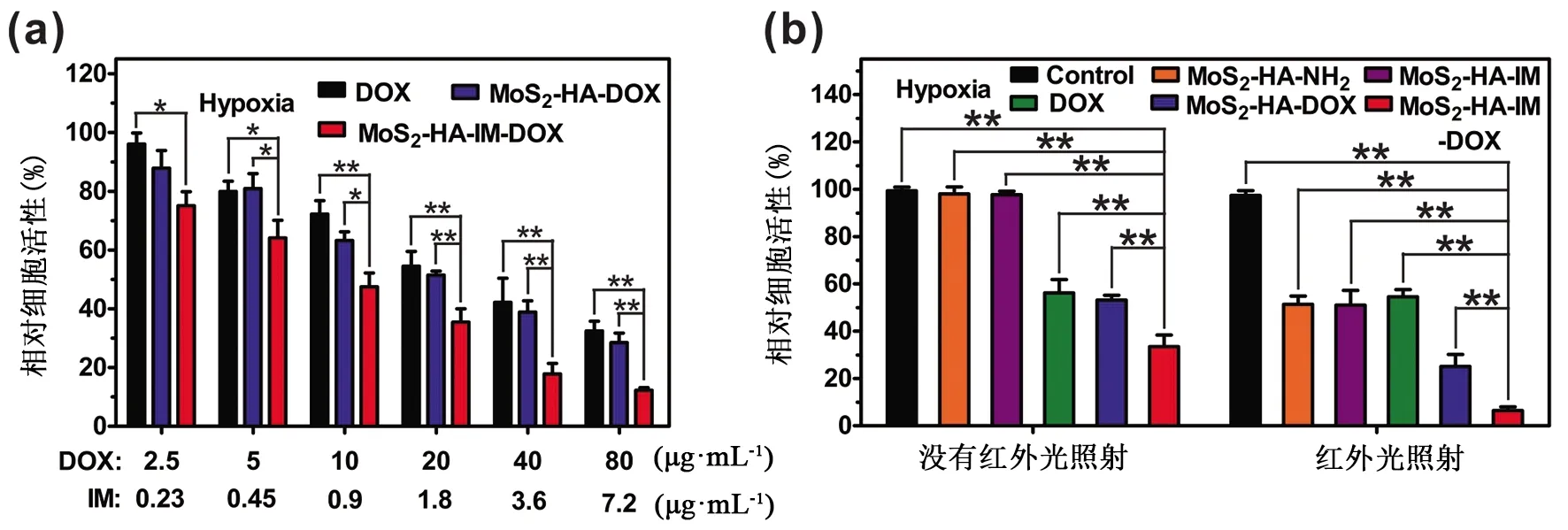
图8 (a)在低氧环境下,与不同浓度的MoS2-HA-IM-DOX孵育后PC-9细胞的活性;(b)在低氧环境下,经过不同方式处理后PC-9细胞的活性
考察MoS2-HA-IM-DOX对细胞的杀伤力是否在近红外光的照射下得到进一步的增强。由图8b可知,单独的近红外光照射不会对肿瘤细胞的增殖产生影响,也不会增强游离DOX的细胞毒性。但给予MoS2材料处理的肿瘤细胞经过近红外光照射后,其活性下降显著。这主要因为MoS2纳米材料可以将吸收到的近红外光转换成热能,引起肿瘤细胞的消融,并部分抑制其增殖。此外,载有DOX的MoS2材料在光照之后对肿瘤细胞杀伤能力得到显著的增强,特别是MoS2-HA-IM-DOX,仅有6.4%的细胞处于存活状态,明显低于其他实验组。出现这种结果的原因是:第一,MoS2材料经过光照之后产生的光热能有效地诱导DOX释放,提高细胞内游离DOX的浓度;第二,装载的IM削弱了肿瘤细胞对DOX的耐受性,增强了游离DOX的细胞毒性;第三,化疗和光热的协同效应。
4 结论
在本研究中,我们以胱胺为连接体,利用EDC/NHS技术,将IM与HA结合,再通过硫化学作用将其嫁接到MoS2纳米片上。制备的纳米载体MoS2-HA-IM具有较高的生理稳定性,优异的光热特性以及较低的细胞毒性,且通过疏水作用装载抗癌药物DOX,成功构建一氧化氮供体和阿霉素的共递送系统。此系统可凭借HA受体介导的内吞作用有效地将DOX输送到肿瘤细胞内。在近红外光和pH双重刺激下,药物尽可能地从载体中脱离出来,提高了MoS2-HA-IM-DOX的药物治疗效果,且装载的IM削弱肿瘤细胞在低氧环境下对药物的耐受性,进一步增强了药物治疗效果,再联合近红外光照射MoS2材料产生的光热,一起有效地抑制了肿瘤细胞的增殖。

