固相萃取-超高效液相色谱-串联质谱法测定斑马鱼暴露体系4 种双酚类环境激素的研究
韩 莹,费雨萌,杜尔登,王明新*,薛银刚,刘宇轩
1.常州大学环境与安全工程学院,江苏 常州 213164
2.江苏省石油化工安全与环保工程研究中心,江苏 常州 213164
双酚类化合物(bisphenol analogues,BPs)是一类与双酚A(BPA)结构相似,通过碳原子或者硫原子和氧原子将2 个羟苯基连接在一起的化合物,具有雌激素毒性、细胞毒性、基因毒性和生殖毒性等[1-3].随着许多国家和地区出台法规对BPA 加以限制,双酚C(BPC)、双酚F (BPF)、双酚S (BPS)、双酚Z (BPZ)等作为BPA 的潜在替代物相继出现,并且生产和使用量逐步增大[4-5].虽然这些BPs 与BPA 的理化性质相似,但其辛醇水分配系数更高,与BPA 相比具有类似或者更高的雌激素活性[6-8].目前这些BPs 已在多种环境介质中被检出,预计将有92%的BPs 主要存在于水体中[9-10].BPs 污染水体不仅影响鱼类的生长发育,而且有致畸、致癌、致突变作用,致使渔业水域生态环境进一步恶化[11-12].
近年来有关BPs 在环境水体和生物体中的检出率及浓度的报道越来越多[13-14],而环境样品中BPs 的含量较低,并且污染物之间较大的浓度差异以及基质效应对双酚类环境激素的前处理和检测方法均提出了较高的要求.目前检测双酚类环境激素的方法主要包括高效液相色谱法(HPLC)[15]、液相色谱-质谱法(LC-MS)[16]、气相色谱-质谱法(GC-MS)[17].前处理技术主要有液液萃取[18]、分散液液微萃取[19]、微波辅助萃取[20]、固相萃取[21]、基质分散固相萃取[22]等.传统的液液萃取等技术时间、精力、溶剂消耗均较大,而固相萃取操作简单、吸附剂种类多样、省时省力省溶剂,已被应用于多种环境介质的检测领域[23-25].目前使用液相色谱串联质谱进行水及鱼体中双酚类环境激素定量分析的研究还相对较少[26].
该研究选择4 种双酚类环境激素(BPC、BPF、BPS、BPZ)为研究对象,以BPA-13C12和BPS-13C12为内标校正溶液中共存离子的基质效应[27-28],建立固相萃取-超高效液相色谱-串联质谱(SPE-UPLC-MS/MS)的定量检测方法,实现斑马鱼暴露水体中多种双酚类环境激素的高效、快速测定,以期为生态系统中双酚类环境激素的检测及监控提供科学参考和技术支持.
1 材料与方法
1.1 仪器与试剂
旋涡混合器〔MX-S 型,大龙兴创实验仪器(北京)股份公司〕主要用于快速搅拌;超声波清洗机(UC-4600 型,深圳朗杰超声电器有限公司)用于提取液体中双酚雌激素;轨道式摇床(HT-20 式,上海沪析实业有限公司)用于混匀;高速离心机(LG20-W 型,北京京立离心机有限公司)用于超声波提取物的离心;小型超低温冰柜(DW-86W2 式,浙江捷盛制冷科技有限公司)用于低温除脂;智能数控自动固相萃取仪(YGC-8 型,郑州宝晶电子科技有限公司)用于富集提纯;水浴氮吹仪(CM-24 型,北京成萌伟业科技有限公司)用于加快蒸发甲醇洗脱液.
双酚类环境激素的检测采用三重四极杆质谱仪(TSQ Quantum Access MAX,美 国Thermo Fisher Scientific 公司)配置双三元高效液相色谱仪(Ultimate 3000 DGLC,美国Thermo Fisher Scientific 公司);超纯水机(UPR 台上式)购置于四川优普超纯科技有限公司;固相萃取柱(Generik H2P)〔200 mg/(6 mL)〕购置于美国Sepax 公司.
甲醇、乙腈均购置于美国Sigma 公司,均为色谱级,试验用水为超纯水.
标准品:BPF (98.0%)购置于上海麦克林生化科技有限公司;BPS (99.0%)、BPC (>98.0%)、BPZ (98.0%)均购置于上海阿拉丁试剂有限公司.同位素内标BPA-13C12(99.0%)和BPS-13C12(97.0%)均购置于美国Achemtek 公司.
1.2 标准溶液配制
单标贮备液:分别称取0.1 g 的BPF、BPS、BPC和BPZ,用甲醇溶解并定容至100 mL,配制成1 g/L的标准贮备液,于−20 ℃避光保存.
混标贮备液:分别吸取1.0 mL BPF、BPS、BPC和BPZ 标准贮备液于10 mL 容量瓶中,用甲醇定容,配制成100 mg/L 混合标准贮备液,于−20 ℃避光保存.使用前移取适量混合标准贮备液,逐级稀释得1 mg/L 混合标准使用液,再用甲醇稀释成适当浓度的系列标准溶液.
内标溶液:用甲醇稀释BPA-13C12和BPS-13C12内标溶液配制成1 mg/L 的内标贮备液.分别取BPA-13C12和BPS-13C12内标储备液,配成各物质质量浓度分别为1、2、5、10、50 μg/mL 的内标混合溶液,于4 ℃避光保存待用.
1.3 样品制备
1.3.1 样品采集
以斑马鱼为研究对象,BPF、BPS、BPC 和BPZ的半致死浓度(LC50)的1/100 和1/10 作为暴露浓度[29],即BPS 浓度分别为15.55 和1.55 mg/L,BPF 浓度分别为0.80 和0.080 mg/L,BPC 和BPZ 浓度均分别为0.20 和0.020 mg/L.斑马鱼体长(2.5±0.50)cm,体质量为0.17~0.30 g.将斑马鱼体表消毒后置于曝气72 h 的自来水〔pH 为7.74~7.83,硬度为91~108 mg/L(以CaCO3计),溶解氧浓度为7.45~7.60 mg/L,温度为(25±0.5)℃,昼夜时间分配为14 h∶10 h〕中,每2 d 喂食1 次,喂食饲料购置于潍坊意品宠物用品有限公司,属即食脱壳丰年虾卵,每天投喂鱼体质量1%~2%的饵料,喂食后1 h 内手动清除剩余的饲料和鱼类排泄物.试验前驯化斑马鱼至少1 个月,保证自然死亡率小于5%.暴露试验在1 L 烧杯内进行.设置空白对照组和暴露试验组,每组2 个平行,每个烧杯放入5 条斑马鱼,暴露8 d,暴露期间不喂食,每天光照结束后2 h 换水,换水前采集水样,同时测定换水前、后的溶解氧浓度、pH、温度,保证溶解氧浓度不得小于80%空气饱和值,温度稳定在控制范围内.第8 天在每个烧杯中随机各取3 条斑马鱼.
1.3.2 样品前处理
水样前处理:取500 mL水样加入40 μL 500 ng/mL 的内标混合液中.将固相萃取柱依次用10 mL甲醇和10 mL 超纯水活化,将样品过柱,用10 mL 含10%的甲醇水溶液(V/V)淋洗去除杂质,用真空泵将柱中的残余水分抽干,再用10 mL 甲醇溶液洗脱目标化合物,洗脱液用氮气吹干.最后用V甲醇:V水=1∶1的混合液复溶至1 mL,过膜后转移到2 mL 进样小瓶中,供UPLC-MS/MS 分析.
斑马鱼前处理:准确称取0.1 g 冻干样品,加入100 μL 500 ng/mL 的内标混合液.用6 mL 乙腈匀浆,超声萃取30 min,振荡混合30 min,8 000 r/min 下离心10 min,重复2 次,合并提取液置于−80 ℃除脂48 h.去除脂肪层,将提取液过滤并用超纯水稀释至500 mL过固相萃取柱,后续同水样前处理.
1.4 仪器条件
1.4.1 色谱条件
色谱柱为Waters Atlantis T3 Column 色谱柱(2.1 mm×50 mm,3 μm);柱温为25 ℃;进样量为10 μL;流速为0.2 mL/min;流动相A 为水,B 为甲醇.梯度洗脱程序:0~0.3 min,85%流动相A,15%流动相B;0.5~9 min,5%~85%流动相A,15%~95%流动相B;9~15 min,5%~85%流动相A,15%~95%流动相B.
1.4.2 质谱条件
电喷雾离子源(ESI),扫描方式为负离子扫描,选择反应监控(SRM);离子源温度为350 ℃.
2 结果与讨论
2.1 色谱条件的选择
分 别对BPF、BPS、BPC、BPZ、BPA-13C12和BPS-13C12标准溶液进行分析,确定它们的分子离子峰(m/z)分别为198.7、248.5、254.7、266.9、238.6 和260.3.在较低的能量下对各分子离子进行二级质谱扫描,确定特征离子峰.采用选择反应监控(SRM)模式进行数据采集,具体参数见表1,标准色谱图见图1.
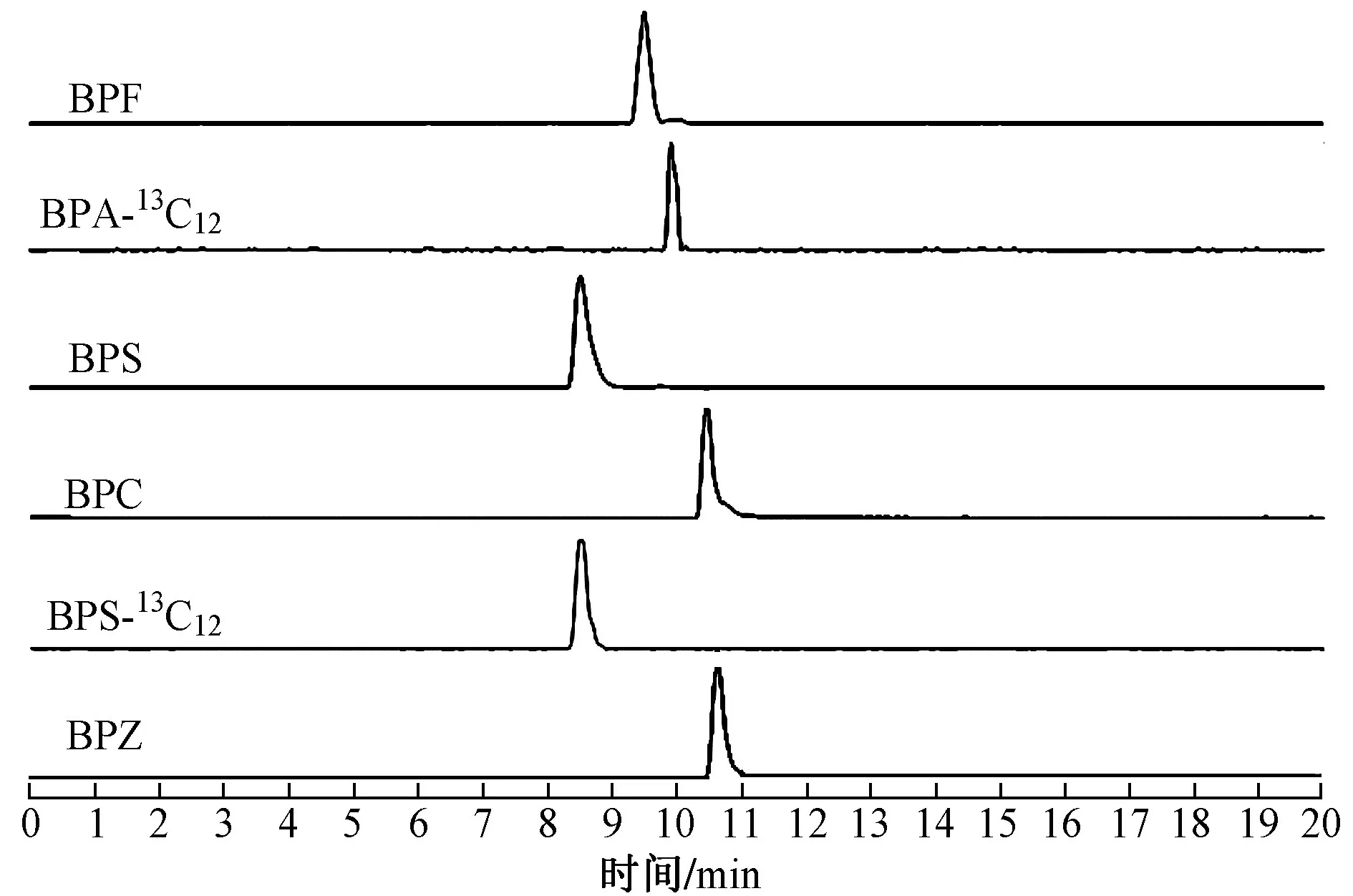
图1 6 种目标物标准色谱图Fig.1 Standard chromatograms of the six analytes

表1 4 种双酚类环境激素及同位素内标的质谱参数Table 1 MS parameters of the four BPs and isotopes
2.2 色谱柱及流动相的选择
采用Thermo Fisher Accucore™ aQ C18 色谱柱(50 mm×2.1 mm,2.6 μm)和 Waters Atlantis T3 Column色谱柱(2.1 mm×50 mm,3 μm)进行试验[30],发现C18色谱柱对BPs 的分离效果较差,而Waters Atlantis T3 Column 色谱柱可将6 种物质完全分离,所以最终选用Waters Atlantis T3 Column 色谱柱.
选择甲醇-水、甲醇-甲酸铵和甲醇-氨水作为流动相按不同比例进行等度洗脱和梯度洗脱,发现流动相为70%甲醇-甲酸铵时BPS 不出峰〔见图2(a)〕,流动相为70%甲醇-氨水时BPS 不出峰且部分物质的色谱峰拖尾严重〔见图2(b)〕,当流动相为70%甲醇-水溶液时,6 种待测物得到有效分离,但存在拖尾现象〔见图2(c)〕.将甲醇在流动相中的初始占比降至15%,发现峰形变好,拖尾情况有所改善(见图1),这可能是甲醇的容积效应引起.

图2 流动相分别为甲醇-甲酸铵、甲醇-氨水、甲醇-水时6 种待测物的色谱图Fig.2 Chromatograms of the six analytes for methanol-ammonium format,methanol-ammonia water,methanol-water as mobile phases
2.3 前处理条件的优化
2.3.1 固相萃取柱的选择
该试验探究C18 柱(RNSC500X6X-C18)、Florisil弗罗里硅土柱、亲水亲脂柱(Waters HLB 柱、Generik H2P SPE 柱)的萃取及回收效果[31-32].由图3 可知,亲水亲脂柱对4 种BPs 的萃取效率均较好(69.2%~102.7%).而Florisil 弗罗里硅土柱的萃取效率仅为31.0%~60.16%,C18 柱的萃取效率也仅为53.26%~79.28%.综合考虑萃取效率和萃取柱使用成本,选取Generik H2P SPE 柱用于BPs 的分离提取.

图3 不同固相萃取柱对4 种BPs 的回收率对比Fig.3 Recovery performance comparisons of various SPE cartridges for four BPs
2.3.2 洗脱提取溶剂的选择
BPs 的环境水平较低,需经过浓缩处理来进行测定.该试验选取甲醇和乙腈进行对比,发现2 种洗脱溶剂的回收率均高于75%,甲醇对BPS、BPC 和BPF 的洗脱效果优于乙腈,乙腈对BPZ 的洗脱效果略优于甲醇,但无明显差异(见图4).综合考虑环境二次污染和试剂成本,选用甲醇作为洗脱溶剂.

图4 不同洗脱溶剂对4 种BPs 的回收率对比Fig.4 Recovery performance comparisons of various extraction solvents for four BPs
2.3.3 提取溶剂体积的选择
前处理过程中,提取溶剂体积对提取效率影响较大,该研究比较了3 种不同提取溶剂体积(3、6、10 mL)的洗脱效果,发现当提取溶剂体积为3 mL 时,对BPZ 和BPF 的提取效率较低;当提取溶剂体积为6 mL 时,对BPZ 和BPC 的提取效率较低;当提取溶剂体积为10 mL 时,4 种BPs 的回收率均在90%以上(见图5).综合考虑试剂成本和提取效率,提取溶剂体积选择10 mL.
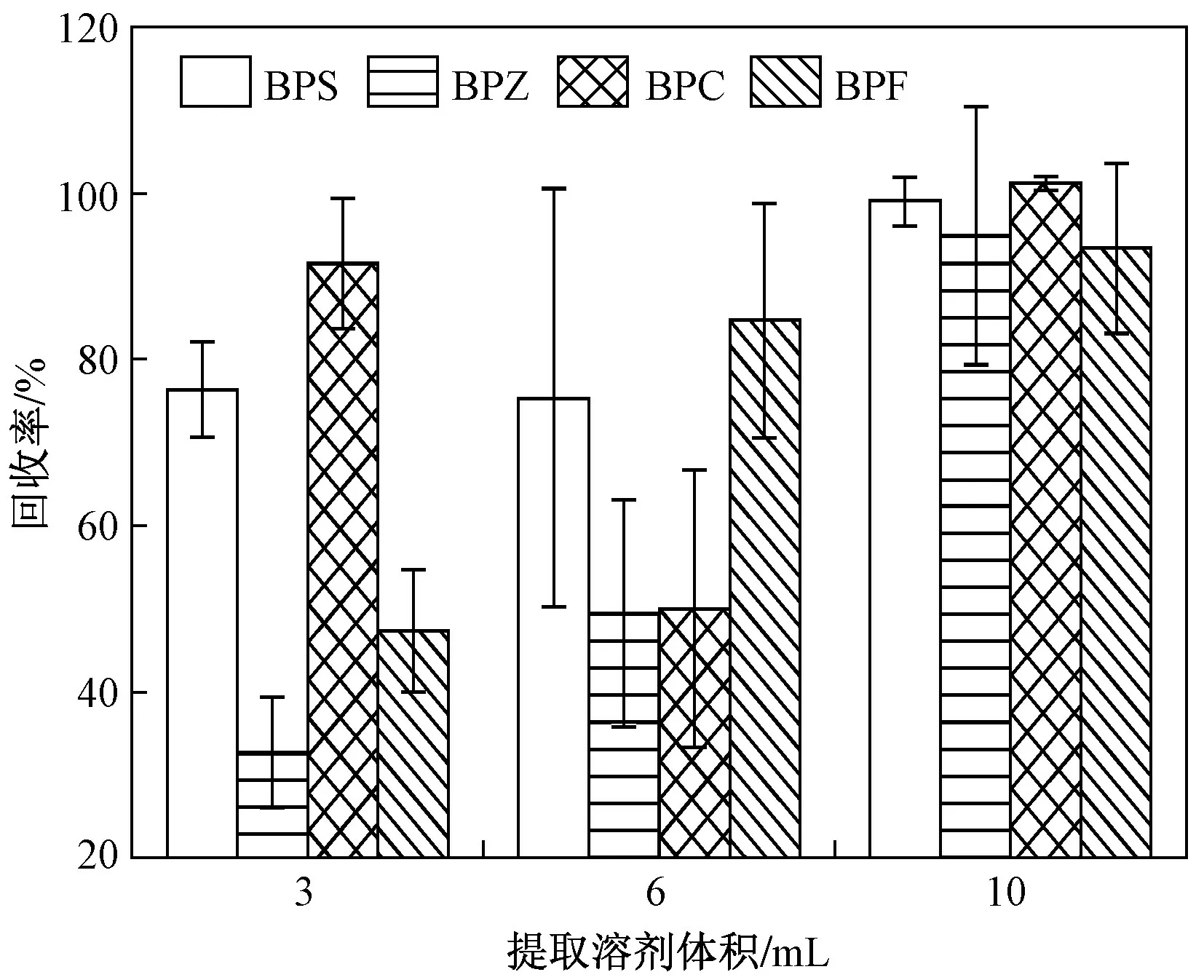
图5 不同提取溶剂体积对4 种BPs 的回收率对比Fig.5 Recovery performance comparisons of various extraction solvent volumes for four BPs
2.4 基质效应
基质效应是指样品中除分析物以外的组分在样品分析过程中会产生显著干扰,影响结果的准确性.基质效应(matrix effect,ME)=[(基质匹配校准曲线斜率/纯溶剂标准曲线斜率)−1]×100%[33-34].|ME|<20%为弱基质效应,可忽略,无需采取补偿措施;20%≤|ME|≤50%为中等程度基质效应,需采取补偿措施;|ME|>50%为强基质效应,也须采取补偿措施.按照1.2 节方法配制空白基质混合标准工作溶液,以50%甲醇为溶剂配制同浓度的标准溶液,按照上述公式计算ME,BPF、BPS、BPC 和BPZ 的ME 值分别为5.6%、1.5%、15.3%和13.7%,均低于20%,说明该试验的基质效应基本可以忽略,净化效果和质谱条件较为合理,有利于准确定量分析.
2.5 方法验证
2.5.1 标准曲线和检出限
配制0.5~100 μg/L 的系列标准溶液,在上述色谱条件和质谱条件下进行测定.以待测物与内标物定量离子峰面积之比为纵坐标,样品中待测物的质量浓度为横坐标绘制标准曲线.其中,BPF、BPC 和BPZ 以BPA-13C12为内标,BPS 以BPS-13C12为内标,内标添加量均为50 ng.采用空白样品中添加目标物的方法,确定检出限(LOD)和定量限(LOQ).由表2 可知:BPF、BPC 和BPZ 在1~100 μg/L 范围内线性关系良好,相关 系数R2>0.998 0,LOD 为0.12~0.60 μg/L,LOQ 为0.38~1.89 μg /L;BPS 在0.5~100 μg/L 范围内线性关系良好,相关系数R2为0.999 0,LOD 为0.019 μg/L,LOQ 为0.06 μg/L.

表2 4 种BPs 的线性范围、线性方程、相关系数、检出限和定量限Table 2 Linear ranges,linear equations,correlation coefficient (R2),LOD and LOQ of the four BPs
2.5.2 回收率和精密度
准确称取0.1 g 鱼样(500 mL 水样),加入50 ng(20 ng)内标混合物,分别进行1.5、4.5、15 μg/L BPs下的加标回收试验.同时做空白对照,每个浓度平行测定6 次,按照1.4.3 节操作步骤对鱼样和水样进行检测,计算回收率和相对标准偏差(RSD),结果如表3 所示.鱼样(水样)中BPs 的回收率范围在85.95%~97.45%(91.45%~102.91%)之间,相对标准偏差在4.63%~16.36%(1.47%~11.04%)之间,证明该方法对鱼样(水样)中BPs 的检测有较好的重复性和准确性,能够满足鱼样(水样)中BPs 的测定.

表3 斑马鱼及养殖水体中BPs 的加标回收率及精密度(n=6)Table 3 Spiked recoveries and RSDs of the BPs in zebrafish and cultured water (n=6)
2.5.3 稳定性试验
将15 μg/L 混合标准溶液在常温下避光保存,每隔2 h 测定其浓度.结果表明,BPF、BPS、BPC 和BPZ 峰面积的RSD(n=13)分别为1.24%、1.08%、0.43%和1.21%,说明在24 h 内溶液浓度无明显变化.
2.5.4 方法学比较
与其他已有文献数据相比,固相萃取-超高效液相色谱-串联质谱法有效降低了物质检出限水平,检测线性范围较宽,回收率和精密度较高.如张卓娜等[35]使用固相萃取-超高效液相色谱-串联质谱法测定尿液中6 种双酚类及烷基酚类物质,结果显示,该方法检出限为0.05~0.60 μg/L,加标回收率为81.4%~112%;吴春英等[36]使用超高效液相色谱-串联质谱法同时检测环境水体中27 种环境内分泌干扰物,结果显示,BPC、BPF、BPS 的检出限分别为0.18、0.17、0.26 μg/L,超纯水中BPC、BPF、BPS 的回收率分别为87.9%、98.2%、99.2%;华永有等[37]使用全自动固相萃取-超高效液相色谱-串联质谱法测定江水中8种酚类内分泌干扰物,结果显示,加标回收率为80.8%~91.8%,相对标准偏差为2.9%~12%.该研究中的4 种BPs 检出限为0.019~0.60 ng/L,鱼样(水样)中BPs 的回收率为85.95%~97.45%(91.45%~102.91%),相对标准偏差为4.63%~16.36%(1.47%~11.04%),说明固相萃取-超高效液相色谱-串联质谱法对于环境水体中BPs 的检测及控制研究具有重要意义.
2.5.5 实际样品的测定
将斑马鱼暴露于4 种不同浓度BPs 的溶液中,8 d 后对斑马鱼体内的双酚类环境激素残留进行测定,结果如表4 所示.由表4 可见:斑马鱼暴露在0.08 和0.79 mg/L 的BPF 溶液中,检测到鱼体内BPF 浓度分别为1.27 和12.52 mg/kg;在1.55 和15.56 mg/L 的BPS 溶液中,鱼体内BPS 浓度分别为6.03 和62.33 mg/kg;在0.02 和0.21 mg/L 的BPC 溶液中,鱼体内BPC 浓度分别为3.99 和26.44 mg/kg;在0.02 和0.20 mg/L BPZ 的溶液中,鱼体内BPZ 浓度分别为20.47和257.65 mg/kg.这4 种BPs 都在短时间内在斑马鱼体内产生富集,并且浓度越高,富集越强,在暴露浓度较大的介质中,鱼体内检测出更高浓度的BPs,并且斑马鱼体内检测出的BPF、BPS、BPC 在高浓度暴露组基本是低浓度暴露组的10 倍,与暴露浓度呈正相关.因此,有必要围绕BPs 在水环境中的富集作用及毒性机制开展深入研究.由于每天换水,养殖水体中4 种BPs 的浓度与本体浓度基本相同.该研究与已有文献报道相比,富集程度略有不同,可能是暴露溶液浓度或者是模式生物的不同所引起的[38].

表4 暴露8 d 后养殖水体和斑马鱼体内4 种BPs 的浓度Table 4 Concentrations of the four BPs in cultured water and zebrafish after exposure 8 d
此外,将固相萃取-超高效液相色谱-串联质谱法进行检测验证,分别采集两类实际景观水体样品,在进行1.3.2 节步骤前,所采水样经0.45 μm 玻璃纤维滤膜过滤[39].试验设3 组平行,分别测定4 种BPs 浓度,检测结果取平均值.景观水体一中检测出BPF(1.38 ng/L)和BPS(19.76 ng/L),BPZ 和BPC 未被检出;景观水体二中检测出BPF(9.70 ng/L)、BPS(58.04 ng/L)、BPZ(2.23 ng/L),BPC 未被检出.目前,GB 3838−2002《地表水环境质量标准》中对于BPS 还没有明确的限值要求,参考GB 5749−2006《生活饮用水卫生标准》[40],认为虽然固相萃取-超高效液相色谱-串联质谱法检测出的景观水体中BPS 低于标准限值 (0.01 mg/L),但仍需要引起重视.
3 结论
a)该研究建立了固相萃取-超高效液相色谱-串联质谱法,并用于检测斑马鱼暴露体系中的BPC、BPF、BPS 和BPZ.
b)固相萃取-超高效液相色谱-串联质谱法的LOD 为0.019~0.60 μg/L,LOQ 为0.06~1.89 μg/L,BPS在0.5~100 μg/L 范围内线性关系良好,BPZ、BPF 和BPC 在1~100 μg/L 范围内线性关系良好.
c)固相萃取-超高效液相色谱-串联质谱法的加标回收率为85.95%~102.91%,相对标准偏差为1.47%~16.36%,适用于水环境暴露体系双酚类环境激素残留的测定技术需求,其检出限低,灵敏度高,重现性好,具有较好的实用性.

