shRNA靶向抑制CD38的抗CD38 CAR-T细胞构建及其功能的初步鉴定
刘秀盈,冯娅茹,周雅婷,王建勋,2(.北京中医药大学 生命科学学院,北京 02488;2.深圳北京中医药大学研究院,广东 深圳 588)
嵌合抗原受体基因修饰T(CAR-T)细胞疗法是将T 细胞进行改造,使其表达一个包括抗原识别域、共刺激域和T 细胞激活域的融合蛋白,经过改造的CAR-T细胞可以特异性识别并消除表达靶抗原的肿瘤细胞,这项免疫疗法被誉为未来肿瘤治疗的希望[1-2]。2020年修订的《中国多发性骨髓瘤诊治指南》在难治复发多发性骨髓瘤治疗中增加了CAR-T细胞疗法[3]。人类CD38 抗原是一种Ⅱ型穿膜糖蛋白,在各种类型血液肿瘤细胞中表达[4-5],但也存在于T细胞表面,因此这些T 细胞在CAR-T 细胞治疗过程中可能发生自杀,影响抗CD38 CAR-T 细胞的抗肿瘤效果[5-8]。载体介导的短发夹状RNA(short hairpin RNA,shRNA)通过RNA干扰诱导稳定的靶向特异性抑制,由聚合酶Pol Ⅲ启动子驱动。shRNA长度相对较短,便于设计,具有较强的抑制效率和维持时间,容易被克隆并包装进入表达载体,在基因编辑领域有很广泛的应用[9-10]。本研究在实验室前期构建成功的抗CD38 CAR-T细胞[11]的基础上,构建了shRNA靶向抑制CD38 的抗CD38 CAR-T 细胞,并对其增殖和抗肿瘤能力进行观察,旨在为抗CD38 CAR-T细胞疗法治疗血液肿瘤提供新的思路。
1 材料与方法
1.1 细胞系及主要试剂
逆转录病毒包装细胞系以及人多发性骨髓瘤外周血B淋巴细胞RPMI-8226-luc购自美国ATCC细胞库,人Burkitt 淋巴瘤细胞Raji-luc购自北京维通达生物技术有限公司。RPMI 1640 培养基、AIM-Ⅴ培养基、胎牛血清(FBS)及PBS 均购自美国Gibco 公司,Fu Gene HD 转染试剂购自美国Promega 公司,淋巴细胞分离液购自北京友谊中联生物科技有限公司,IL-2、CD3 单克隆抗体(OKT-3)购自北京义翘神州科技股份有限公司,MluⅠ酶、NotⅠ酶、T4 连接酶、DH-5α感受态和质粒提取试剂盒、荧光素酶报告基因检测试剂盒、SYBR Green PCR 试剂盒、逆转录试剂盒购自北京兰博利德科技有限公司,胶回收试剂盒、RNA提取试剂盒购自上海优宁维公司,IFN-γ ELISA试剂盒购自北京百诺威生物公司,MYC-PE、CD38-APC、CD3-APC、PD-1-PE等抗体均购自美国BD公司。
1.2 shRNA靶向抑制CD38的抗CD38 CAR分子构建
实验室前期通过噬菌体展示技术筛选出亲和力较强的Anti-CD38-CAR,其结构为经典的第二代CAR 分子结构,将CD38 ScFv、CD8 铰链区和穿膜区、CD28 胞内区和CD3ζ 胞内区依次串联而成。通过GPP Web Portal 网址设计靶向CD38 CAR-T 的shRNA 序列,挑选评分最高的两条序列,并设计一段不针对任何靶点的无意义RNA 序列作为对照(shR-NC),在之前串联U6启动子序列,由通用生物公司合成。由此构建shRNA靶向抑制CD38的抗CD38 CAR分子,区别于添加了无意义RNA 序列的抗CD38 CAR(shR-NC-CD38 CAR),命名为shRNA1-CD38 CAR和shRNA2-CD38 CAR,具体分子结构见图1。

图1 CAR分子结构
1.3 pMFG-CD38 shRNA-MYC-CD38-CAR 质粒载体构建
shRNA 靶向抑制CD38 的抗CD38 CAR 分子构建完成后,将序列与载体由MluⅠ和NotⅠ双酶切,以凝胶电泳方式回收酶切后的目的片段与载体并纯化,16 ℃条件下用T4 连接酶连接1 h。用DH-5α 感受态进行转化,挑取单克隆加入有氨苄抗性的LB 培养基中,37 ℃摇床培养12~16 h。提取质粒DNA,酶切鉴定正确后进行测序,测序正确的质粒载体被命名为pMFG-shR-NC-MYC-CD38-CAR、pMFG-shRNA1 CD38-MYC-CD38-CAR 和pMFGshRNA2 CD38-MYC-CD38-CAR。
1.4 原代T细胞提取
抽取健康志愿者外周血10 mL,采用Ficoll 密度梯度离心法分离外周血单个核细胞(PBMC),重悬于AIM-Ⅴ完全培养基(添加10%FBS和1%青-链霉素溶液),同时加入终质量浓度为100 ng/mL OKT-3和100 U/mL IL-2 刺激T 细胞活化增殖,置于37 ℃、5%CO2细胞培养箱中无菌培养,此后每隔48 h 用含有100 U/mL IL-2的AIM-Ⅴ完全培养基传代。
1.5 CAR-T细胞制备
将培养48 h后的原代T细胞分为未转导T细胞、shR-NC-CD38 CAR-T、shRNA1-CD38 CAR-T 和shRNA2-CD38 CAR-T 细胞,共计4 组。将pMFGshR-NC-MYC-CD38-CAR、pMFG-shRNA1 CD38-MYC-CD38-CAR 和 pMFG-shRNA2 CD38-MYCCD38-CAR 质粒载体分别包装成逆转录病毒载体并转导人原代T 细胞即为shR-NC-CD38 CAR-T、shRNA1-CD38 CAR-T 和shRNA2-CD38 CAR-T。未转导T 细胞不做处理,正常传代。转导48 h 后用MYC-PE抗体通过FCM检测MYC抗原表达,计算转导效率(即MYC表达率)。转导效率=MYC-PE阳性细胞数/总活细胞数×100%。
1.6 qPCR 法检测CAR-T 细胞CD38 mRNA 的相对表达水平
在转导后24 h,3组细胞分别取5×106个活细胞提取RNA,电泳验证完整性后,将RNA逆转录为cDNA,采用SYBR Green进行qPCR实验。qPCR采用两步法,反应条件:95 ℃2 min,95 ℃15 s,60 ℃30 s,共计40 个循环。引物序列:GAPDH 上游为CATGTT CGTCATGGGTGTGAACCA,下游为ATGGCATGG ACTGTGGTCATGAGT;CD38 上游为CGCCCCTAG GAAGAGAGGCAGAAAGAAGCT,下 游 为 ATC GATGCGGCCGCTCATTATC。以GAPDH作为内参照基因,通过2-ΔΔCt方法计算CD38 mRNA的相对表达量。
1.7 显微镜计数法检测CAR-T细胞的增殖能力
以提取PBMC当天记为第0天,48 h时计数传代1 次,维持细胞密度为1×106个/mL,单次增殖倍数为计数时细胞密度与上次计数时细胞密度的比值,增殖倍数为单次增殖倍数的乘积,第0天单次增殖倍数和增殖倍数均定为1。分别计算CAR-T 细胞体外培养0~14 d的增殖倍数,并绘制增殖曲线。
1.8 CFSE 染色法检测CAR-T 细胞与靶细胞共培养时的增殖能力
将Raji-luc 和RPMI-8226-luc 细胞用CD38-APC抗体通过FCM 检测其细胞表面CD38 阳性率。将两种靶细胞用AIM-Ⅴ完全培养基(含IL-2)分别稀释至密度4×104个/100 µL,取100 µL 接种于96 孔板实验孔。取CAR-T 细胞,采用CFSE(用AIM-Ⅴ培养基稀释成10 µmol/mL)37 ℃避光染色30 min 后,调整细胞密度为1×104个/100µL;取100 µL加在铺有靶细胞的孔中,即效靶比为1∶4。继续培养24 h后,CD3-APC染色标记T细胞,以单独培养的T细胞为对照。通过CFSE信号强弱比较共培养后的细胞增殖情况,CFSE信号越弱(左移越明显)表明其增殖能力越强。
1.9 荧光素酶化学发光法检测CAR-T 细胞对靶细胞的杀伤能力
将Raji-luc 和RPMI-8226-luc 细胞制备细胞悬液,参照1.8 的方法进行实验铺板,CAR-T 细胞分别与Raji-luc和RPMI-8226-luc细胞以不同效靶比(1∶1、1∶2、1∶4、1∶8,4×104个/100µL靶细胞为1∶1)共培养,以仅有Raji-luc 细胞或RPMI-8226-luc 细胞的孔作为最大释放孔,以只有培养基的孔作为空白孔。12 h后每孔加入100µL 配置好的荧光素酶底物,室温避光培养3 min。设置化学发光模式(LUM),全白酶标板,震板5 s,PMT=500。计算杀伤效率,杀伤效率=1-(实验孔细胞死亡率-空白孔细胞死亡率)/(最大释放孔细胞死亡率-空白孔细胞死亡率)×100%。
1.10 ELISA 法检测CAR-T 细胞杀伤靶细胞时上清中IFN-γ水平
将CAR-T细胞与Raji-luc或RPMI-8226-luc细胞共培养12 h,效靶比为1∶1 和1∶4(4×104个/100µL 靶细胞为1∶1)。收集细胞后400×g离心5 min,吸取细胞上清,采用ELISA法检测上清IFN-γ水平。
1.11 FCM检测CAR-T细胞PD-1表达水平
取CAR-T 细胞悬液,400×g离心5 min,收集细胞。PBS 冲洗1 遍,CD3-APC、PD-1-PE 室温避光染色60 min,PBS 冲洗后重悬在PBS 中,FCM检测PD-1水平。
1.12 统计学处理
以上主要实验均重复3 次。采用GraphPad Prism 8统计学软件处理数据。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,以P<0.05或P<0.01表示差异有统计学意义。
2 结果
2.1 成功构建shRNA-CD38 CAR-T细胞
病毒滴度检测结果(图2A)显示,shR-NC-CD38 CAR、shRNA1-CD38 CAR 和shRNA2-CD38 CAR 逆转录病毒载体的滴度均有1×107拷贝/mL,滴度较高,可以进行T细胞转导实验。
FCM 检 测 结果(图2B)显 示,shR-NC-CD38 CAR-T、shRNA1-CD38 CAR-T 和 shRNA2-CD38 CAR-T 三组和未转导T 细胞的转导效率分别为60.3%、67.0%、57.4%和0.1%。结果表明,CAR 分子在T细胞表面成功表达。
qPCR 法检测结果(图2C)显示,shRNA2-CD38 CAR-T 组细胞中CD38 mRNA 的表达水平显著低于shR-NC-CD38 CAR-T 组(P<0.01),shRNA1-CD38 CAR-T 组细胞中CD38 mRNA 的表达水平与shR-NC-CD38 CAR-T 组比较差异无统计学意义(P>0.05)。结果表明,shRNA2 序列设计成功,RNA干扰效果较好。

图2 成功构建shRNA-CD38 CAR-T细胞
2.2 Raji-luc和RPMI-8226-luc细胞表面高表达CD38
FCM检测结果(图3)显示,Raji-luc或RPMI-8226-luc 细胞表面的CD38 阳性表达率分别为94.6%和92.0%。结果表明,此两种血液肿瘤细胞株表达CD38的比例高,可以作为抗CD38 CAR-T细胞的靶细胞。

图3 靶细胞表面CD38的表达水平
2.3 shRNA2-CD38 CAR-T细胞增殖能力明显增强
显微镜计数法实验结果(图4A)发现,与shRNC-CD38 CAR-T 组比较,shRNA2-CD38 CAR-T 组细胞增殖倍数显著升高(P<0.05),而shRNA1-CD38 CAR-T 组细胞增殖倍数差异比较无统计学意义(P>0.05)。
CFSE增殖实验检测结果(图4B)显示,CAR-T细胞分别与Raji-luc 或RPMI-8226-luc 细胞共培养组与未进行共培养处理组相比,共培养组细胞FITC 信号明显左移。shRNA-CD38 CAR-T 细胞在靶细胞的刺激下增殖更快,说明它们均可以被靶细胞激活。

图4 shRNA-CD38 CAR-T细胞的增殖情况
2.4 shRNA2-CD38 CAR-T细胞杀伤靶细胞能力增强
荧光素酶实验结果(图5A、B)显示,靶细胞是Raji-luc或RPMI-8226-luc时,与shR-NC-CD38 CAR-T组比较,shRNA2-CD38 CAR-T 组细胞的杀伤效率明显增强(P<0.01或P<0.05),而shRNA1-CD38 CAR-T组细胞的杀伤效率差异比较无明显增强(P>0.05)。结果表明,shRNA2-CD38 CAR-T 组细胞对靶细胞的杀伤能力更强。
2.5 shRNA2-CD38 CAR-T 细胞杀伤靶细胞时上清中IFN-γ水平更高
ELISA 法检测结果(图5C、D)显示,靶细胞是Raji-luc 或 者RPMI-8226-luc 时,与shR-NC-CD38 CAR-T 组比较,shRNA2-CD38 CAR-T 组细胞IFN-γ释放量显著升高(P<0.01),而shRNA1-CD38 CAR-T组差异比较无统计学意义(P>0.05)。结果表明,shRNA2-CD38 CAR-T组细胞杀伤靶细胞时IFN-γ的释放水平更高。

图5 shRNA-CD38 CAR-T细胞杀伤靶细胞的效率及IFN-γ释放量
2.6 shRNA2-CD38 CAR-T细胞表面PD-1 表达水平显著下降
FCM 检测结果(图6)显示,与shR-NC-CD38 CAR-T 组比较,shRNA2-CD38 CAR-T 组细胞PD-1表达水平显著下降(P<0.05),与未转导的普通T细胞表达水平相近(P>0.05),而shRNA1-CD38 CAR-T组PD-1 表达水平无明显变化(P>0.05)。结果表明,shRNA2-CD38 CAR-T 组比shRNA1-CD38 CAR-T 组细胞耗竭的水平更低。
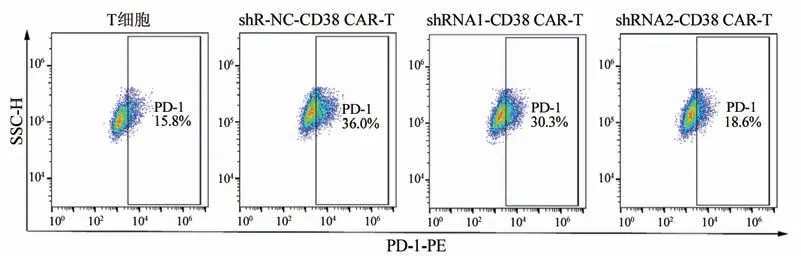
图6 shRNA-CD38 CAR-T细胞表面PD-1表达水平
3 讨论
近年来,B细胞非霍奇金淋巴瘤、多发性骨髓瘤、复发性急性淋巴细胞白血病等各种类型的血液肿瘤病死率不断攀升,尽管开发了许多治疗方法,包括放化疗、蛋白酶体抑制剂、免疫调节剂、耗竭性抗体和自体干细胞移植等,但是仍很难治愈这些疾病,大多数患者最终都会复发。2021 年6 月中国国家药品监督管理局(NMPA)最新公示,复星凯特CD19 CAR-T细胞治疗产品益基利仑赛注射液(又称阿基仑赛,代号:FKC876)已正式获得批准。这款细胞治疗产品将用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者,包括弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)非特指型、原发性纵隔B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL。早在2018 年8 月,该产品就已在欧洲获批准上市。随着抗CD19 CAR-T 细胞疗法在B 细胞异常引起的恶性血液肿瘤治疗中获得成功,其他血液肿瘤的治疗研究也陆续展开。多项研究表明,抗CD38 CAR-T细胞对各种血液系统恶性肿瘤有显著的细胞毒性[12-13];但因为T 细胞自身表达CD38,这在一定程度上影响了靶向CD38 的CAR-T细胞的抗肿瘤效能[14-15]。有研究结果[5,16]显示,采用抗体封闭预处理CD38 CAR-T 细胞后,CAR-T 细胞的增殖能力增强,而耗竭因子PD-1 表达下降。肿瘤中耗竭性T 细胞常见的高表达的胰岛素受体底物包括PD-1、CTLA-4、TIM-3、LAG-3 和T 细胞免疫球蛋白和TIM结构域(TIGIT)等,这些在免疫反应中具有抑制性免疫调节作用的位点,也被称为免疫检查点。PD-1 及其配体(PD-L1)是T 细胞耗竭中最主要的抑制性受体,两者的相互作用可以抑制下游信号转导和T 细胞的生物学功能,包括细胞增殖和细胞毒性,这种相互作用导致肿瘤特异性T细胞耗竭和凋亡,从而限制其抗肿瘤作用[17],故而通过检测T细胞表面的PD-1的表达水平可以评估细胞的耗竭状态。
本研究在前期实验构建的抗CD38 CAR-T 细胞的基础上,通过RNA 干扰技术,构建了shRNA 靶向抑制CD38的抗CD38 CAR分子,通过逆转录病毒载体进行包装并成功转导人原代T 细胞,成功构建shRNA-CD38 CAR-T细胞。实验结果发现,shRNA2-CD38 CAR-T 组细胞CD38 mRNA 的表达水平显著低于shR-NC-CD38 CAR-T 组细胞,而shRNA1-CD38 CAR-T组与shR-NC-CD38 CAR-T组细胞CD38 mRNA表达水平差异比较无统计学意义,结果表明shRNA2 序列靶向性更强,RNA 干扰成功,shRNA2-CD38 CAR-T组细胞CD38表达被抑制。同时在体外培养的条件下,shRNA2-CD38 CAR-T 细胞的增殖明显优于shR-NC-CD38 CAR-T 细胞,且在CD38 阳性的靶细胞共培养的刺激下增殖增快。为了验证shRNA-CD38 CAR-T 细胞杀伤CD38 阳性肿瘤细胞的能力,本研究选用了2 种CD38 阳性表达的细胞模型,即Raji-luc 和RPMI-8226-luc 细胞。研究结果显示,shRNA2-CD38 CAR-T 细胞对2 种肿瘤细胞的杀伤效率均强于shR-NC-CD38 CAR-T 组,此结果也可以在IFN-γ 水平检测实验中得到验证。结合shRNA2-CD38 CAR-T 组 比shR-NC-CD38 CAR-T 组的PD-1表达水平有所下降,提示抑制CAR-T细胞自身CD38 表达可以提高其增殖和杀伤肿瘤细胞的能力,可能是通过减少T细胞“自杀”及减缓耗竭起作用的,这与此前的通过抗体封闭的一项研究[16]得出的结果相一致。但本研究构建的CAR-T细胞无需进行预处理,过程更加简便,且未来无需在人体实验中进行抗体封闭浓度和时间的摸索。
CD38作为近年来CAR-T细胞研究的热门靶点,其抗肿瘤作用已经得到验证,目前的研究重点在于减少T 细胞被“自杀”的方法[18]。本研究通过shRNA技术,成功构建一种shRNA 靶向抑制CD38 的抗CD38 CAR-T 细 胞,为 抗CD38 CAR-T 细 胞 走 出“CAR-T 细胞-自噬和自我刺激”循环提供一种新的方法,有助于在后续的研究中进一步增强抗CD38 CAR-T细胞的扩增、持久性和抗癌功能。

