爬行动物肠道微生物研究进展
钟春英 谭 茵 唐三淇 刘亚婷 武正军*
(1.广西师范大学,珍稀濒危动植物生态与环境保护教育部重点实验室,桂林,541006;2.广西师范大学,广西珍稀濒危动物生态重点实验室,桂林,541006)
肠道是动物机体重要的消化吸收器官,其中栖息着一个数量庞大的微生物群落,称为肠道微生物或肠道菌群[1]。据估计,成人肠道内的微生物可达1012~1014数量级,远大于人体表面微生物和人体自身细胞数量[2]。肠道微生物极其多样,具有独特的功能特征,在宿主的免疫代谢[3-5]、营养吸收[6-7]、行为[8-10]等方面起着十分重要的作用。动物肠道是一个动态的生态系统,宿主本身和外界环境都会影响肠道微生物的组成和结构。目前普遍认为,宿主的饮食、生理状态和宿主基因型是影响肠道菌群多样性的重要原因,而宿主饮食对肠道微生物的群落结构影响最大[11-12]。肠道微生物与宿主动物相互作用、相互影响。
肠道微生物在脊椎动物中的研究主要集中在哺乳动物[11,13-17],而非哺乳动物研究占比不到10%[18],爬行动物的相关研究较少。爬行动物作为较古老的动物类群,具有复杂和多样的生理生态和行为特征[19],而作为外温动物,受环境影响较大。爬行动物的这些特征使其肠道微生物的组成结构和多样性更具独特性和复杂性。
1 肠道微生物的研究手段
巴斯德(L.Pasteur)和柯赫(R.Koch)提出的纯培养法技术开启了动物肠道微生物的研究。肠道微生物的主要研究手段有:传统培养方法,该法是一种非常有效的分离目的菌种的方法,即通过筛选菌种和观察形态来达到研究目的;此外还有分子生物学方法,包括荧光原位杂交(fluorescence in situ hybridization,FISH);变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE);末端限制性片段长度多态性技术(terminal-restriction fragment length polymorphism,T-RFLP);实时荧光定量PCR(real-time fluorescence quantitative PCR,QRT-PCR);生物芯片和正流行的高通量测序技术(high throughput sequencing)等。16S rRNA基因已被证明是细菌鉴定的快速、准确的工具[20-21]。细菌16S rRNA基因和高通量测序技术的结合使肠道微生物研究得以快速发展。目前,该方法已成为免培养研究微生物的重要手段。肠道微生物研究主要基于宿主的粪便样本和泄殖腔样本,均为无损伤取样,其中Colston等[22]对利用泄殖腔拭子对泄殖腔采样的方法进行了详细介绍。
在早期,纯培养技术是爬行动物肠道微生物研究的主要手段。施曼玲等[23]通过平板培养分析各类微生物(细菌、霉菌、放线菌、酵母菌)在北草蜥(Takydromusseptentrionalis)和中国石龙子(Plestiodonchinensis)的消化器官中的数量分布;李能树等[24]通过平板培养探讨乌龟(Mauremysreevesii)排泄物对鱼病病原菌的抑制作用。而后,分子生物学方法开始运用到爬行动物肠道微生物的研究中。Rawski等[25]运用荧光原位杂交技术评估膳食益生菌对龟胃肠道微生态的影响;时云朵等[26]利用变性梯度凝胶电泳和实时荧光定量PCR分析蛇的肠道菌群结构。现阶段爬行动物肠道微生物最主要的研究手段是高通量测序,又称为下一代测序(next generation sequencing,NGS),其主流平台有Roche 454和Illumina Miseq/Hiseq。Roche 454平台的测序原理为焦磷酸测序(pyrosequencing),该技术已被运用在蛇类[22,27]、蜥蜴类[28]、龟类[29]和鳄类[30]的肠道微生物研究中。Illumina Miseq/Hiseq平台的测序原理为边合成边测序(sequencing by synthesis,SBS),研究者们对蛇类[31-33]、蜥蜴类[34-42]、龟类[43-53]和鳄类[54-56]肠道微生物的研究应用了此种方法。由于Illumina Miseq/Hiseq平台的测序费用更低,且效果相差不大,因此得到了更多人的认可。
2 爬行动物肠道微生物的分布特点
一般来说,脊椎动物的胃肠道主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)组成,这是一个相对保守的细菌组合,其他菌门的相对丰度则较低[57]。目前,研究发现蛇类[22,26-27,31-33,58]、蜥蜴类[28,36-38,41-42,59-61]和龟鳖类[43-47,50-53]动物肠道微生物的优势菌群也基本为这3个门。与哺乳动物和其他爬行动物不同,在鳄类[30,54-56]动物肠道微生物菌群中,梭杆菌门(Fusobacteria)的占比明显提高,占有重要地位(表1)。
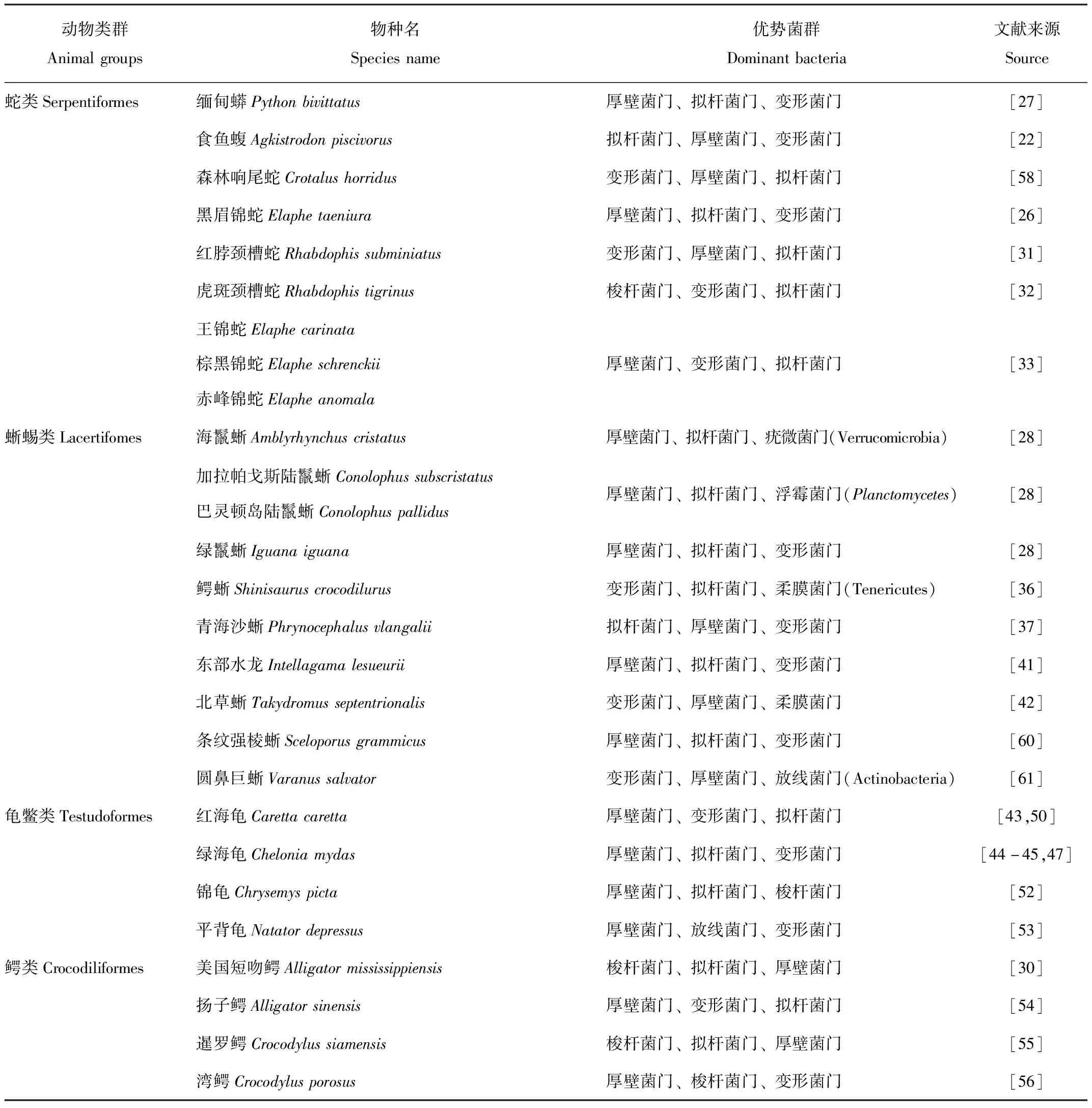
表1 爬行动物各类群肠道微生物的优势菌群
微生物在爬行动物肠道的不同区段具有差异性。黑眉锦蛇(Elaphetaeniura)的肠道微生物菌群丰度沿肠道头部向尾部方向呈现先增加后降低的趋势[26]。野生红脖颈槽蛇(Rhabdophissubminiatus)胃肠道上段(食管和胃)与胃肠道下段(大肠和泄殖腔)的微生物多样性具有显著差异[31]。对澳大利亚咸水鳄,即湾鳄(Crocodylusporosus)的研究结果也表明沿肠道纵向的微生物群落组成和结构存在显著差异[56]。美国短吻鳄(Alligatormississippiensis)同样具有沿胃肠道纵向的异质性微生物群,研究还揭示了其组成的差异与器官或组织以及饮食显著相关[30]。但是,在野生虎斑颈槽蛇(Rhabdophistigrinus)的研究中,微生物的丰富度和多样性在肠道不同区域(大肠、小肠和泄殖腔)并不存在显著差异[32]。
3 爬行动物肠道微生物的影响因素
3.1 生殖状态和方式
生殖状态和方式与肠道微生物密切相关。利用16S rRNA基因测序技术,Trevelline等[62]发现受精卵孕育晚期的蜥蜴(Sceloporusundulatus)肠道细菌丰富度比未怀卵雌性蜥蜴低,且随着孕育期的延长,个体间变异程度越高,但是肠道细菌群落的这些变化在产卵后是否会恢复还未知。在人类中,母体肠道细菌群落的变化至少在产后一个月内持续存在[63],蜥蜴是否与人类一致?有研究表明,生殖期的蜥蜴免疫功能下降[64-65],这是否与肠道微生物丰富度降低有关?这些问题都值得进一步探究。研究发现,多个配偶的雌性蜥蜴的细菌多样性比单个配偶的雌性高,这可能是多个配偶性传播的细菌所导致,表明雌性交配策略影响泄殖腔细菌群落,这对雌性的健康存在潜在影响[66]。
一个多世纪以来,脊椎动物胚胎被认为是在无菌环境中发育的,通过出生后与母体和外部环境的接触获得原始的肠道微生物群[67],而Trevelline等[68]发现鸟卵和蜥蜴卵含有彼此不同的细菌群落,且同窝蜥蜴卵的细菌群落结构彼此更相似,而非无关个体,表明野生卵生脊椎动物可能通过破壳前接种卵黄获得了母体微生物群。
3.2 圈养、饮食和环境
肠道微生物常常受饮食和环境的影响,反过来,肠道微生物的组成也反映了宿主的饮食和生活环境[31]。而肠道和微生物群是高度动态的,可以进行灵活调整,以满足生物体的需求[69]。
圈养和饮食对肠道微生物的影响一直受到重点关注。Kohl等[39]利用16S rRNA基因测序技术,探究饮食、环境和圈养等对蜥蜴肠道细菌群落组成的影响,研究发现性别和季节对细菌群落组成和结构都没有显著影响,饮食类型(杂食性和草食性)和宿主物种对这2个指标均有显著影响;当地土壤样品与任何宿主物种肠道中发现的细菌类群没有明显的重叠,圈养则显著改变了宿主物种的细菌群落组成和结构。关于北草蜥的研究也表明圈养对肠道微生物群落结构和多样性有显著影响[42]。Jiang等[36]在比较野生与圈养鳄蜥(Shinisauruscrocodilurus)的粪便微生物时,发现喂养不同食物的蜥蜴的肠道微生物群有显著差异,饮食改变了肠道中细菌群落丰富度和相对丰度。另一项对鳄蜥的研究表明,与野生同类相比,圈养增加了鳄蜥肠道微生物群的群落丰富度,研究还发现年龄对肠道微生物无影响[59]。饮食不仅对肠道菌群结构和多样性产生影响,还能改变动物肠道的结构。Kohl等[35]以动植物混合食物和高植物含量食物分别喂养一种自然杂食性蜥蜴(Liolaemusruibali),结果表明2组肠道形态和肠道微生物群结构均有差异,富含植物的饮食使蜥蜴含有更多样化微生物群落,说明生理和微生物并不严格限制草食动物从杂食祖先进化,生态环境对食草动物的进化可能比生理限制更重要。
环境和饮食相互作用于动物肠道微生物。不同的环境为动物提供不同的食物,所以动物处于不同环境中时其肠道微生物可能不同。绿海龟(Cheloniamydas)经历了从表层远洋分布和杂食性饮食向浅海分布和草食性饮食的明显转变。在远洋和浅海生境之间,亚成体绿海龟的细菌群落存在显著差异,这表明环境和饮食因素支持这些生境的绿海龟拥有不同的细菌群落[45]。对于取食藻类的海鬣蜥(Amblyrhynchuscristatus)和取食陆地植被的加拉帕戈斯陆鬣蜥(Conolophussubscristatus),其饮食差异有助于肠道微生物群落的分化[28]。城市生活可以极大地影响蜥蜴个体的肠道微生物群,突出了肠道微生物可塑性在动物对人类改变的景观中所起的作用[41]。热带海龟的微生物多样性高于亚热带地区[47]。Ahasan等[44]调查并比较了野生捕获和搁浅的绿海龟粪便细菌群落,结果显示野生捕获绿海龟的细菌多样性和丰富度高于搁浅海龟,群落组成差异显著,这可能是因为搁浅海龟通常只能吃到海草,它们虚弱的状态使得条件致病菌在胃肠道内繁殖和过度生长。通过对比入院前和康复后的海龟肠道微生物群落发现,不论海龟在入院前的微生物组成如何,所有康复后的绿海龟都表现出相似的细菌群落;入院前和康复后海龟肠道细菌群落的显著差异表明康复过程中饮食、管理和环境变化对肠道微生物产生了影响[46]。同样的,另一项研究也表明亚成体绿海龟的粪便微生物群在康复过程中由于饮食变化而改变[51]。红海龟(Carettacaretta)为食肉动物,主要以底栖软体动物为食[70]。与系统发育相近但食草性海龟相比,红海龟与食肉性海洋哺乳动物的肠道微生物群特征更相似,这是肠道微生物群对饮食和环境适应功能的体现[48]。
海拔和温度也成为影响蜥蜴肠道微生物的重要因素。在高海拔地区,蜥蜴的饮食多样性和数量急剧下降,有限的食物资源迫使蜥蜴开发其他食物资源,使其肠道微生物群具有降解能力和解毒能力[60]。Zhang等[37]利用16S rRNA基因测序技术,研究了生活在不同海拔高度的3个蜥蜴种群的肠道菌群,结果显示不同海拔的种群的肠道微生物组成存在显著差异,而缺氧可能是引起青海沙蜥(Phrynocephalusvlangalii)肠道菌群沿海拔梯度变化的主要因素。已经有研究表明,高原动物(青海沙蜥)的肠道质量与海拔成正比[71]。Bestion等[38]采用半自然试验研究了温度对野生蜥蜴肠道微生物区系的影响,发现温度升高将导致微生物多样性降低,升高2~3 ℃会导致34%的种群微生物多样性丧失,对宿主的生存可能产生较大的负面影响,这也反映了全球变暖可能会对爬行动物等变温动物产生不利影响。此外,Bestion的研究是采用直接升温的方式,若换成缓慢升温的方式,给予动物适应的过程,也许不会导致如此高的微生物多样性丧失。
3.3 禁食行为
关于禁食,Kohl等[34]做了相关研究:使用16S rRNA基因测序记录了5类脊椎动物的代表动物在4个时间点的结肠和盲肠微生物群的变化,发现禁食引起的微生物群在宿主物种和肠道区域之间的变化存在差异。鱼类对禁食表现出最显著的变化,而壁虎在禁食28 d内可保持稳定的群落。肠道微生物在禁食期间的稳定性可能暗示宿主对微生物群落的高度控制。McCue等[72]对此进行了更进一步地研究,发现禁食导致的肠道末端微生物多样性和群落结构的变化与肠道末端结构变化并不匹配。研究表明,一些蜥蜴物种似乎适应了饥饿[73-74],依靠尾巴中储存的脂质,能够在饥饿100 d后存活下来[75]。
爬行动物在禁食期间仍能保持稳定的肠道微生物群,其内在机理值得深入研究。大部分爬行动物还会进行冬眠,在冬眠期间具有禁食行为,若冬眠前后肠道微生物不发生变化,这将为爬行动物出眠后保持身体一致性并直接捕食提供保证。爬行动物肠道微生物与冬眠的关系还有许多值得探讨之处,应对其进行更深一步地研究。
3.4 健康状态
在不同健康状态下,爬行动物的肠道微生物具有差异性。此外,研究发现部分爬行动物的肠道微生物存在条件致病菌或潜在致病菌。在耐药性分析时,发现爬行动物的粪便中含有耐药性菌群和耐药性基因。爬行动物肠道微生物不仅具有耐药性,同时具有抗肿瘤性和杀菌活性的成分。
肠道微生物与动物健康息息相关。在同一养殖条件下,几乎不患肠道疾病的王锦蛇(Elaphecarinata)粪便样本中志贺氏菌(Escherichia-Shigella)的相对丰度高于其他2种锦蛇,这表明志贺氏菌含量可能与肠道健康相关[33]。汤文娇等[32]在野生虎斑颈槽蛇肠道内检测到柠檬酸杆菌属(Citrobacter)、明串珠菌属(Trichococcus)和丹毒丝菌属(Erysipelothrix)等潜在的致病菌。Tang等[31]也在野生红脖颈槽蛇肠道中发现大量潜在致病菌。还有研究表明人工饲养的蜥蜴富集了一些人类或其他动物的致病菌或条件致病菌[36],这可能是人的近距离接触所导致。Lin等[55]比较了健康和患有厌食症的亚成体暹罗鳄(Crocodylussiamensis)的肠道微生物群落的组成和功能,发现厌食鳄鱼肠道微生物多样性明显低于健康个体,鳄鱼肠道细菌组成和功能的改变可能与厌食症有关。为评估在临床上应用(包埋)噬菌体消除靶向肠道细菌作为广谱抗生素(恩诺沙星)替代品的可行性,Ahasan等[49]分析了2种处理的海龟粪便样品中肠道细菌群落,结果显示噬菌体处理后的样品细菌多样性和组成无显著差异,相比之下,抗生素处理的样品在第15天后细菌多样性显著降低,表明噬菌体对海龟肠道细菌群落的组成和结构的影响很小,研究为噬菌体治疗概念提供了有力证据。Pace等[76]通过细菌培养法和FLOTAC寄生虫学技术,提供了地中海地区红海龟肠杆菌科(Enterobacteriaceae)和寄生虫组成的基础数据:78.3%的粪便样品都分离到了肠杆菌科,而复殖吸虫(digenetic trematodes)是这些动物中最常见的寄生虫;47.8%的海龟只有肠杆菌科寄生,而30.4%的海龟同时有肠杆菌科和寄生虫寄生。
爬行动物肠道菌群具有耐药性。Sala等[77]对从健康圈养蛇类群体微生物中分离出的铜绿假单胞菌(Pseudomonasaeruginosa)的患病率和抗生素耐药性进行评价,发现铜绿假单胞菌的患病率较高(59.9%),其中35.5%为多重耐药菌株。分析结果显示养殖场规模、卫生条件和蛇种类等与患病率相关。Nieto-Claudin等[78]通过对圣克鲁斯岛加拉帕戈斯象龟(Chelonoidisporteri)泄殖腔粪便进行耐药性基因(antimicrobial resistance gene,ARG)分析,发现100%的象龟粪便中都含有ARG,35.7%的象龟微生物群具有多重抗性;与许多其他野生动物不同,陆龟通常与农田重叠,增加了摄入和传播耐药性(antimicrobial resistance,AMR)的风险。从欧洲池塘圈养的海龟泄殖腔中分离出来的微生物对用于治疗动物和人类的主要抗菌类药物也表现出广泛的耐药性,说明被圈养的欧洲池塘海龟是多抗细菌的载体[79]。
爬行动物肠道微生物不仅具有耐药性,同时具有抗肿瘤性和杀菌活性的成分。Soopramanien等[61]研究了以有机废物和动物尸体为食的圆鼻巨蜥(Varanussalvator)肠道细菌产生的代谢物的抗肿瘤特性,利用条件培养基和质谱联用技术(LC-MS)筛选和识别潜在的抗肿瘤分子,结果表明存在几种具有抗肿瘤活性的分子。在另一项对圆鼻巨蜥的研究中,也发现其肠道微生物产生了具有显著杀菌活性的分子[80]。圆鼻巨蜥的抗肿瘤性和杀菌活性可能与其长期的生活环境和食物有关。
4 其他相关研究
动物在接触有害物质后,其肠道微生物也会受到影响。绿海龟接触草甘膦后,其肠道细菌生长减少或存活率降低,说明草甘膦可能对海龟的消化和整体健康产生不利影响[81]。这是首个评估草甘膦除草剂对爬行动物胃肠道菌群影响的研究,说明在沿海环境中使用草甘膦可能会通过皮肤接触、海洋植物群落的变化或胃肠道微生物区系的改变对非目标海洋物种产生有害影响。此外,肠道微生物组成的可预测变化可以为特定化学暴露提供一个易于分析的、无创的生物标志物,为军事设施的风险评估提供更有力的科学支持[40],肠道微生物还可作为判断圈养动物放归的参考条件[82]。冯定龙[54]的研究发现扬子鳄(Alligatorsinensis)捕食期与非捕食期胃内菌群差异性显著,非捕食期胃内微生物具有更高的丰富度和均匀度;刚孵化出的幼鳄其胃内已存在大量细菌菌群,且具有很高的物种丰富度和均匀度。另有研究[25]表明膳食益生菌对龟的生长性能、壳矿化、十二指肠组织形态学和微生物区系有积极作用,说明益生菌在龟营养中是有用的。Scheelings等[53]尝试探究微生物组成在确定平背龟(Natatordepressus)的一些血液参数方面的作用,发现肠道微生物组成与血液分析物没有任何相关性。
5 结语与展望
研究表明,爬行动物肠道微生物:现阶段的研究手段以高通量测序为主;在肠道的不同区段具有差异性;影响因素有寄主生殖状态、圈养、饮食、环境和行为等;具有耐药性和抗肿瘤性等特性;当动物在接触有害物质后,其肠道微生物也会受到影响。现阶段对爬行动物肠道微生物的研究主要还是以菌群组成及多样性分析为主,但近年来已经开始深入到了菌群功能分析,且还涉及了很多其他的方面,然而对于肠道微生物与宿主间相互影响的作用机制还不明确。全球气温升高、生境丧失和破碎化、环境污染等人类干扰活动,导致爬行动物生存环境发生变化,可能使爬行动物的肠道微生物发生相应变化,从而使爬行动物种群受到不利影响。所以,未来应充分利用宏基因组、宏蛋白组和宏代谢组的高通量测序和分析技术,深度发掘和揭示肠道微生物和宿主之间的关系,加强人类干扰导致的爬行动物肠道微生物发生变化的情况和机理方面的研究,以便有针对性地采取措施保护相应物种。

