老年髋部骨折术后死亡的危险因素△
王成刚,麻 彬,施 静,王 欣
(同济大学附属同济医院骨科,上海 200065)
老年髋部骨折是指从股骨头平面至股骨小转子下5 cm处的骨折,临床上分为股骨颈骨折和股骨粗隆间骨折,可发生在任何年龄阶段,但以65岁以上的老年人群最为多见[1]。老年人骨量流失严重、机体能力衰退,加之髋部肌肉薄弱,低能量的创伤就可诱发髋部骨折[2],据报道,随着人口老龄化的加剧[3],我国每年约增加120万例老年髋部骨折者。老年人身体抵抗力差,伴有各种基础疾病,一旦发生髋部骨折,生活质量严重受损,长时间的卧床将导致肺炎、褥疮及尿路感染等并发症,死亡率大大增加[4,5]。Kes⁃mezacar等[6]研究显示,股骨粗隆间骨折术后1年的死亡率高达26.8%,由此可见,老年髋部骨折具有高发病率、高死亡率的特点,给老龄化日益加剧的现代社会带来沉重负担[7,8]。老年髋部骨折的治疗不仅要促进骨折愈合,降低术后死亡率,更要恢复日常生活能力,提高生存质量[9]。基于此,本研究回顾分析了本院2017年1月—2019年1月177例老年髋部骨折手术后的随访资料,评估患者日常生活能力的改变,统计生存情况,分析影响生存的危险因素,为改善老年髋部骨折的长期预后提供理论依据。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)年龄≥65岁;(2)结合病史、体征及辅助检查诊断为一侧髋部骨折;(3)骨折原因为低能量损伤;(4)骨折前ADL评分>20分;(5)已完成手术治疗,包括内固定或关节置换手术。
排除标准:(1)合并多部位骨折或多发伤;(2)病理性骨折,如转移性肿瘤所致骨折;(3)影像学诊断为股骨粗隆下骨折;(4)临床及随访资料不全。
1.2 一般资料
本文为回顾性研究,分析2017年1月—2019年1月本院收治的246例老年髋部骨折的临床资料,按照上述标准,共纳入177例患者,术后患者通过普通门诊或电话进行定期随访,规定随访时间为术后3、6、12个月和2年,每次随访记录患者生存情况。本研究得到同济大学附属同济医院伦理委员会批准,所有患者均知情同意。
1.3 手术方法
麻醉方式由麻醉医师综合评估后选择,采用全身麻醉或局部神经阻滞麻醉。手术医师根据骨折部位选择闭合复位髓内钉内固定术或人工髋关节置换术。髓内钉手术过程:患者置于牵引床,于外展外旋体位人工牵引复位,后微创切口置入髓内钉,内收内旋固定,C形臂X线机透视见骨折端复位满意;关节置换手术过程:患者平卧手术床,显露关节,切断股骨颈,打磨髋臼置入假体,复位后检查关节稳定性。术后均严格止血,逐层缝合伤口。
1.4 评价指标
记录患者一般资料,包括年龄、性别、BMI、骨密度(bone mineral density,BMD)、生活状态、骨折类型、损伤至手术时间、基础疾病数量、ASA分级、日常生活能力(activities of daily living,ADL)评分,其中ADL评分以MBI(modified Barthel index)量表为评测标准[10,11]。检验指标,包括术前的血红蛋白、白蛋白、D-二聚体。术中情况,包括麻醉方式、手术方式、术中出血量、手术时间、是否进入ICU,以及手术后住院时间。
1.5 统计学方法
所有数据采用IBM SPSS22.0进行统计分析。资料呈正态分布时,两组间比较采用独立样本t检验;资料呈非正态分布时,采用秩和检验。计数资料采用x2检验或Fisher精确检验。等级资料两组比较采用Mann-whitneyU检验。以生存的二分类变量作为因变量,其他观察指标为自变量,行Cox生存分析,步入方法选择基于最大似然估计的向前逐步回归法。P<0.05为差异具有统计学意义。
2 结果
2.1 临床结果
177例患者中,共147例获得完整随访,30例失访,失访率为16.95%。平均随访时间(18.59±7.70)个月,术后1年时生存123例,生存率为83.67%;术后2年时生存109例,生存率为74.15%。对38例患者的死亡病因分析,肺部感染为主要病因,占44.74%,其次为心功能衰竭,占31.58%。Kaplan-Meier生存曲线见图1。

图1 147例患者Kaplan-Meier生存曲线
2.2 生存组与死亡组的单项因素比较
将获得完整随访的147例患者资料按照是否死亡,分为死亡组和生存组。对各指标进行组间单项因素比较,见表1。结果显示:与生存组相比,死亡组患者的年龄更大、合并基础疾病数量更多、家庭陪护比例更低、术前的ADL评分更差且术前血红蛋白、白蛋白含量更少,差异具有统计学意义(P<0.05)。但两组间在性别构成、侧别、BMI、BMD、骨折类型、损伤至手术时间、手术方式、术前ASA评级、麻醉方式、术前D-二聚体、手术时间、术中出血量、术后是否进入ICU和术后住院时间的差异均无统计学意义(P>0.05)。
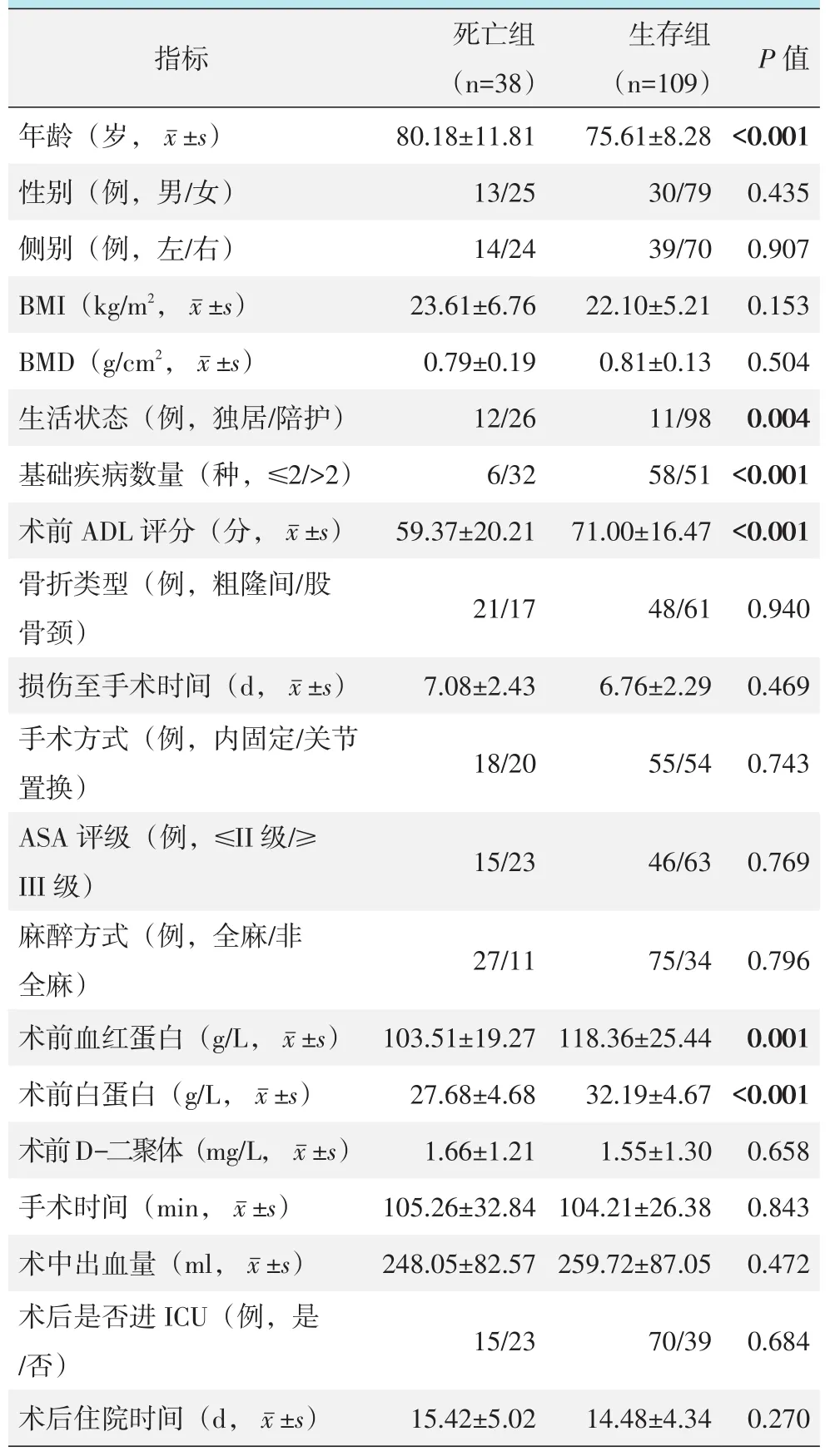
表1 死亡组与生存组的单因素比较
2.3 Cox生存分析
以是否发生死亡为因变量,生存时间为时间变量,其他因素为自变量,对所有随访数据(177例患者)建立Cox回归分析模型,纳入方法选择向前步进法。模型分类能力为88.70%,经卡方检验模型有效(x2=26.519,P<0.001),具体见表2。结果显示:家庭陪护 (OR=0.382,P=0.008)、术前 ADL评分(OR=0.982,P=0.023)、术前血红蛋白量(OR=0.978,P=0.004)和术前白蛋白量(OR=0.845,P<0.001)为老年髋部骨折术后死亡的保护因素,而术前的基础疾病数量(OR=3.926,P=0.002)为老年髋部骨折术后死亡的危险因素。
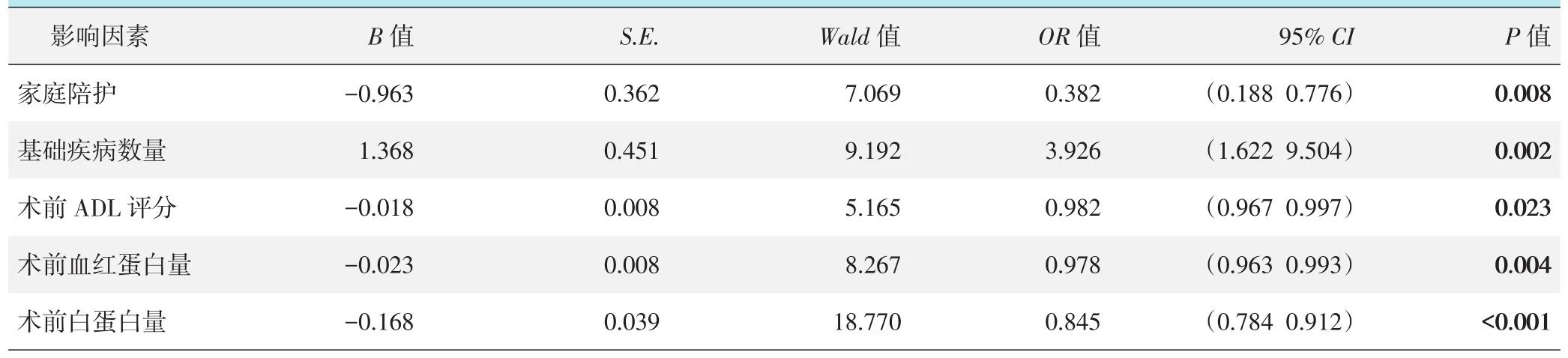
表2 是否死亡的Cox分析结果
3 讨论
随着我国人口老龄化的加剧,老年性髋部骨折的发生率逐年增高,对家庭和社会的负担日益加重[12]。研究推测2020年我国用于老年髋部骨折的医疗费用达600亿美元,到2040年约增长到2 400亿美元[13]。一旦发生髋部骨折,站立行走功能严重受损,极大影响生存质量。因此,目前无论是股骨颈骨折还是股骨粗隆间骨折都积极主张手术治疗[14]。然而老年患者身体机能衰退,抵抗力下降,骨折术后的生存率和生活质量低下[15,16]。本研究结果显示,老年髋部骨折手术后1年死亡率为16.33%,术后2年死亡率为25.85%,其中术后1年生存率结果与国内张宇、孙奇等[17,18]随访结果一致,主要死亡原因则为肺部感染和心功能衰竭。
本研究通过对老年髋部骨折患者的临床随访资料进行单因素分析和Cox生存分析,结果显示生活状态、术前ADL评分、血红蛋白、白蛋白及基础疾病数量为老年髋部骨折术后死亡的独立影响因素。其中在单因素分析中,生存组与死亡组的年龄也具有显著性差异,而Cox生存分析并未将年龄纳入独立因素,可能与纳入的样本量不足或随访时间过短有关[19]。
生活状态对老年髋部骨折的预后影响巨大,在满2年随访的109例患者中,有家庭陪护的占90.83%。家庭陪护意味着更细致的照料和精神上得到支撑,术后功能可以更好地恢复,生存时间也更长[20]。ADL是指处理日常生活、照顾自身起居的能力,能反映出个体的健康状态,老年髋部骨折患者术后的ADL功能会大幅度降低,甚至生活不能自理,完全依赖他人,危及生存[21]。Schwartz 等[22]研究表明,约有50%老年髋部骨折术后的日常生活功能发生障碍。因此,对于术前ADL评分低下的患者,可预判性加强术后护理和康复锻炼。人体血红蛋白和白蛋白指标反映机体的营养状态,虽然随着年龄增长,蛋白水平呈现下降趋势,但低蛋白血症仍与老年髋部骨折的死亡率增加相关[23]。Lu等[24]研究指出术前白蛋白水平可以用来评估老年髋部骨折的手术风险,低白蛋白血症者术后1年死亡率较正常组显著增加。Puckeridge等[25]分析261例患者资料,发现术前的贫血程度与住院时间、术后死亡率及再入院率等指标密切相关。对于老年髋部骨折群体,术前积极纠正贫血,改善营养状态,有助于改善术后生存状态。基础疾病的数量与患者术后死亡密切相关,风险比为3.926,从本组38例患者的死亡原因分析,主要为呼吸系统疾病与心血管系统疾病导致,因此在术前及术后针对性治疗基础疾病,可提高长期生存率。
综上所述,老年髋部骨折患者的病情复杂,具有发病率高、手术风险高及术后死亡率高等特点。本研究通过对临床资料进行回顾性分析发现,生活状态、术前ADL评分、血红蛋白、白蛋白为老年髋部骨折术后死亡的保护因素,基础疾病数量则为老年髋部骨折术后死亡的危险因素。因此,对于老年髋部骨折患者,应积极治疗术前基础疾病,纠正贫血和低白蛋白血症,倡导家庭陪护,制定针对性的康复训练,以改善骨折预后。此外,本研究为单中心回顾性研究,纳入的病例数量有限,数据收集中存在一定局限,无法排除人为习惯、手术条件等潜在干扰因素。因此,未来需要开展多中心合作和扩大样本量的前瞻性研究,以寻找更多循证医学证据。

