细胞色素P450诱导剂对Gibberella intermedia CA3-1双羟化去氢表雄酮的影响
石维利,李 会,史劲松,许正宏
(1.江南大学 药学院,江苏 无锡214122;2.江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡2141222;3.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122)
甾体激素类药物是仅次于抗生素的第二大类药物,被广泛应用于抗炎、利尿、合成代谢、避孕、抗雄激素、孕激素和抗癌等方面[1-3]。3β,7α,15α-三羟基雄甾-5-烯-17-酮(7α,15α-diOH-DHEA)是合成新一代女用口服避孕药“优思明”的活性成分屈螺酮的关键中间体,可以通过微生物产生的羟化酶对去氢表雄酮(DHEA)的双羟化作用获得[4-5]。一 些 真 菌,如 中 间 型 赤 霉 菌(Gibberella intermedia)[6]、尖孢镰刀菌(Fusarium oxysporum)[7]和亚麻刺盘孢(Colletotrichum lini)[8]可以将DHEA转化为7α,15α-diOH-DHEA。
生物体内行使甾体羟化功能的是细胞色素P450酶(CYP450)[7],因此CYP450表达量的高低是影响甾体底物羟化效率的关键因素[9]。胡东莉等[10]和Carballeira等[11]研究发现,包括甾体化合物、苯巴比妥盐类和含氧化合物在内的多种有机化合物可作为CYP450的诱导剂,这些诱导剂大多数是CYP450的底物或底物类似物,如DHEA可以使Colletotrichum liniST -1中细胞色素P450的含量以及双羟产物7α,15α-diOH-DHEA的摩尔得率分别提高40%和26.9%[1]。其他诱导剂(如苯巴比妥、苯、己烷和乙醇等)对各种CYP450的诱导作用[12-14]也得到了广泛的研究。
本课题组在前期研究中筛选获得的一株丝状真菌G.intermediaCA3-1[6]能够双羟化DHEA生成7α,15α-diOH-DHEA,当DHEA质量浓度为8 g/L时,7α,15α-diOH-DHEA的摩尔得率为45.3%。为了进一步提高G.intermediaCA3-1对DHEA的双羟化效率,本研究考察不同诱导剂对G.intermediaCA3-1转化DHEA生成7α,15α-diOH-DHEA生物转化过程的影响,并筛选确定最适诱导剂的添加浓度和诱导时间。在以上工作基础上,在5 L发酵罐中比较添加苯的新工艺和不添加苯的传统工艺对G.intermediaCA3-1双羟化DHEA生成7α,15α-diOH -DHEA的影响,以期为7α,15α-diOHDHEA的工业化生产提供基础数据。
1 材料与方法
1.1 材料
1.1.1 菌种
Gibberella intermediaCA3-1,中国微生物菌种保藏管理委员会普通微生物中心(CGMCC 4903)。
1.1.2 试剂
DHEA(纯度为99%)、7α,15α-diOH-DHEA(纯度为98.4%),浙江仙居君业药业有限公司;乙醇、丙酮、己烷、苯、巴比妥和其他常用化学品,上海国药化学试剂有限公司。
1.1.3 培养基
斜面培养基(用于活化)(g/L):葡萄糖10、酵母粉7.5、NaCl 1.5、KH2PO42.5、琼脂20;pH 7.0~7.2。
种子培养基(g/L):葡萄糖10、酵母粉7.5、NaCl 1.5、KH2PO42.5;pH7.0。
转化培养基(g/L):葡萄糖15、酵母粉15、玉米浆2.0;pH 6.5。
1.2 方法
1.2.1 培养和转化方法
将保藏的G.intermediaCA3-1菌株进行活化培养后,将菌种接种至装有50 mL种子培养液的500 mL三角瓶中,在30℃、200 r/min的恒温摇床上培养。待菌体进入快速生长期(接种后24 h),将种子液以体积分数为10%的接种量接种至装有30 mL转化培养基的250 mL三角瓶中,在相同条件下进行转化培养。准确称取8 g/L的DHEA添加到已转化培养24 h的菌液中,在相同条件下继续转化72 h。
1.2.2 诱导剂对G.intermediaCA3-1生物转化的影响
G.intermediaCA3-1转化培养12 h后,分别将不同诱导剂(己烷、苯、丙酮、无水乙醇、DHEA和巴比妥)添加至培养基中进行诱导。其中,己烷、苯、丙酮和乙醇的添加体积分数为0.6%,DHEA和巴比妥的添加体积分数为0.2%,同时以不添加诱导剂时的生物转化过程作为对照。
1.2.3 分析方法
CYP450的含量用Guengerich等[15]研究的CO差异光谱法测定,具体计算见式(1)。
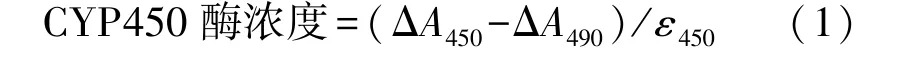
式中:ΔA450为通入CO后添加连二亚硫酸钠的样品在450 nm处的吸光度之差;ΔA490为只添加连二亚硫酸钠的样品在490 nm处的吸光度之差;ε450为CYP450酶的摩尔吸光系数(91 mmol/(L·cm))。分别比较添加最佳诱导剂和对照组的CYP450含量。
采用干质量法测定菌体生物量。将发酵液以12 000 r/min的转速离心10 min,然后收集沉淀的菌丝体用蒸馏水洗涤2次,将洗涤过的菌丝体样品在80℃下干燥至恒质量。
采用高效液相色谱法(HPLC)分析转化产物。测试条件:色谱柱为Agilent C18柱;流动相V(乙腈)∶V(水)=70∶30;流速为0.5 mL/min;进样量为10 μL;柱温为30℃;检测波长为206 nm。产物7α,15α-diOH-DHEA摩尔得率的计算见式(2)。
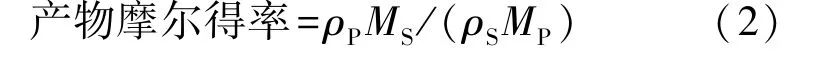
式中:ρP为产物7α,15αdiOHDHEA的质量浓度(g/L);ρS为投加底物质量浓度(8 g/L);MS为底物DHEA的 摩 尔 质 量(288 g/mol);MP为 产 物7α,15α-diOH-DHEA的摩尔质量(320 g/mol)。
1.2.4 统计学分析
本研究中的数据均采用SPSS软件进行分析,利用ANOVA来验证统计分析结果,用平均值±标准差的方式(mean±SD)来显示统计结果的处理,当结果中的P<0.05时,表示数据具有统计学意义。
2 结果与讨论
2.1 不同诱导剂对G.intermedia CA3-1生物转化DHEA的影响
DHEA的羟化与微生物体内的CYP450有关,而CYP450可以通过DHEA、己烷、巴比妥等化合物进行诱导[1,12-14]。因此,考察6种已被证实可作为CYP450诱导剂的有机化合物(己烷、苯、丙酮、乙醇、DHEA和巴比妥)对G.intermediaCA3-1生物转化DHEA的影响,结果如表1所示。

表1 不同诱导剂对G.intermedia CA3-1生物转化DHEA的影响Table 1 Effects of different inducers on the DHEA bioconversion by G.intermedia CA3-1
由表1可知:与对照组相比,在添加水溶性诱导剂丙酮、乙醇和巴比妥后,7α,15α-diOH-DHEA的摩尔得率降低;而在添加脂溶性诱导剂己烷、苯和DHEA后,7α,15α-diOH-DHEA的摩尔得率与对照组相比分别提高了8.5%、17.8%和14.2%。其中,在苯的诱导下,7α,15α-diOH-DHEA的最高摩尔产率达到54.0%±1.43%,因此选择苯作为最佳诱导剂。
2.2 苯的添加量对G.intermedia CA3-1生物转化DHEA的影响
诱导剂的添加量对细胞的生长及产品的产量是至关重要的,如果诱导的用量过低起不到诱导作用,若用量过高则会抑制菌体的生长和代谢。因此,考察不同体积分数的苯对菌株生物量和7α,15α-diOH-DHEA摩尔得率的影响,结果见图1。图1可知:当苯的体积分数>1.0%时,细胞的生长受到显著抑制,导致产物7α,15α-diOH-DHEA的摩尔得率较低;当苯的体积分数为0.2%~0.8%时,苯对细胞几乎没有毒性,特别是当苯的体积分数为0.8%时,7α,15α-diOH-DHEA的摩尔得率达到最高(57%±1.24%),比对照组提高了24%。因此,确定苯的最佳添加体积分数为0.8%。
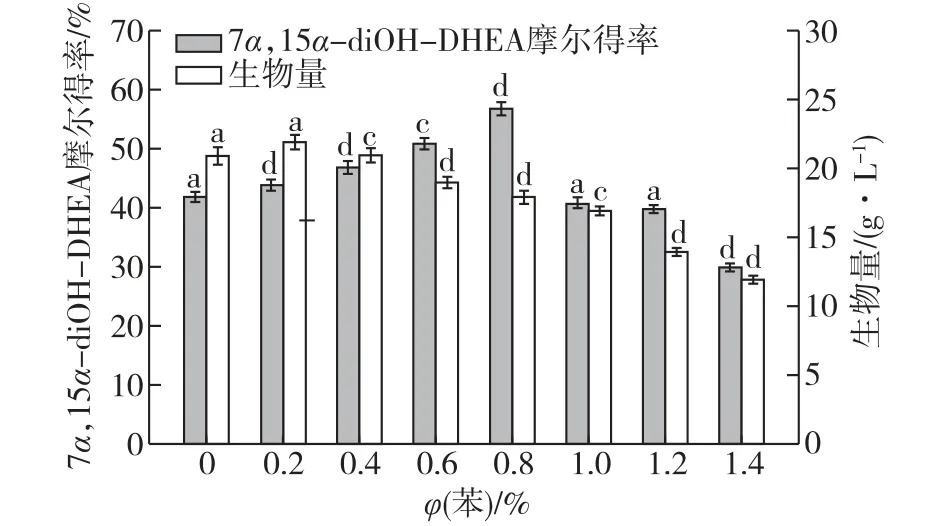
图1 苯体积分数对G.intermedia CA3-1生物转化DHEA的影响。Fig.1 Effects of benzene concentrations on the DHEA bioconversion by G.intermedia CA3-1
2.3 苯的添加时间对G.intermedia CA3-1生物转化DHEA的影响
由于酶的活性随细胞的生长期变化而变化,所以诱导剂的添加时间通常在对数生长期[16]。本研究前期对G.intermediaCA3-1的生长曲线进行测定,结果发现,G.intermediaCA3-1接种后0~12 h为菌体生长的延滞期,16~28 h为对数生长期,28 h进入稳定期。在此基础上,为了确定苯诱导CYP450转化生成7α,15α-diOH-DHEA的最佳添加时间,在G.intermedia生长不同时期(接种后0、4、8、12、16和20 h)添加体积分数0.8%苯进行诱导,在对数生长结束时(转化24 h)添加8 g/L DHEA进行转化,结果如图2所示。
由图2可知:当苯的添加时间为接种后12 h时,7α,15α-diOH-DHEA的摩尔得率达到最高(59%±0.97%),这可能是这时菌体开始进入对数生长期,生长速度快,因此诱导效果较好;当苯的添加时间晚于12 h时,7α,15α-diOH-DHEA的摩尔得率明显下降。因此,对于苯诱导生物转化过程的最适条件:在接种后第12小时后添加0.8%苯,对数生长期结束时(转化24 h)添加8 g/L DHEA进行转化。

图2 苯的添加时间对G.intermedia CA3-1生物转化DHEA的影响Fig.2 Effect of the time point of addition of benzene on the DHEA bioconversion by G.intermedia CA3-1
2.4 5 L发酵罐中苯诱导生物转化过程
在5 L发酵罐中进一步研究苯诱导G.intermediaCA3-1的生物转化过程,结果如图3所示。
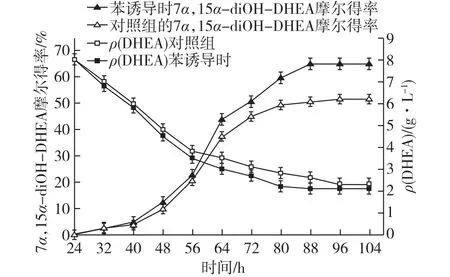
图3 苯诱导G.intermedia CA3-1生物转化DHEA的时间曲线Fig.3 Time curves of benzene induction process from DHEA by G.intermedia CA3-1
由图3可知:在苯诱导的生物转化过程中,G.intermediaCA3-1的双羟化效率显著提高,7α,15α-diOH-DHEA的摩尔得率在88 h时达到最高(68.7%±1.37%),比对照组提高了29.6%。此外,转化周期比对照组的(96 h)缩短了8 h。
2.5 苯的诱导对CYP450表达的影响
虽然Gut等[17]研究发现,苯对动物细胞的CYP450有诱导作用,但苯对微生物的CYP450诱导作用的研究较少,因此考察苯对丝状真菌CYP450的诱导作用。为了确认苯是否会影响G.intermediaCA3-1中CYP450的浓度,所以分别测定对照组以及苯诱导过程中CYP450的浓度,结果见图4。
由图4可知:在苯诱导的生物转化过程中,CYP450的含量显著提高,并且在80 h时达到最高(263 pmol/L),比对照组的提高了43%。研究证实,苯对CYP450的诱导表现为自诱导作用,即苯为所诱导产物CYP450的底物[18]。因此推测,苯可作为CYP450的底物诱导CYP450的表达进而提高CYP450的浓度。
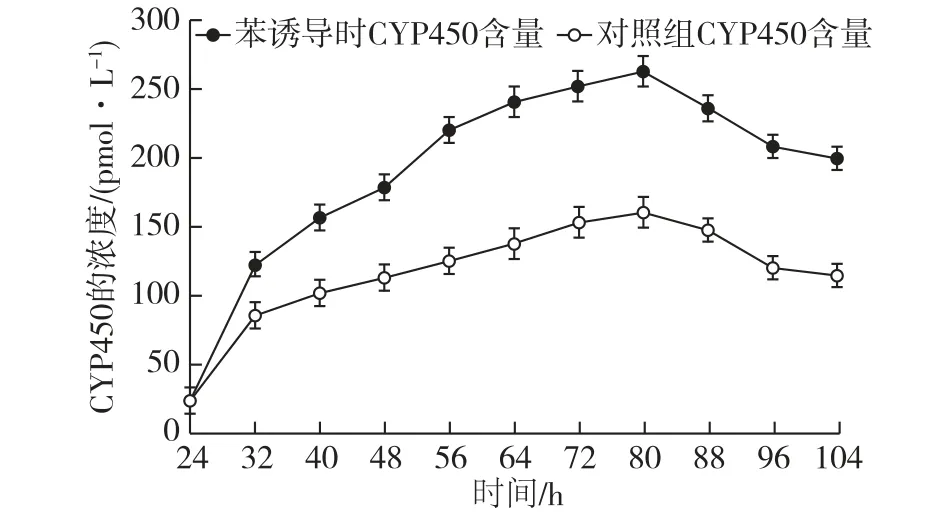
图4 苯诱导生物转化过程对CYP450浓度的影响Fig.4 Effects of the benzene induction biotransformation process on the concentration of CYP450
3 结论
将苯作为丝状真菌G.intermediaCA3-1中CYP450的诱导剂并研究其对G.intermediaCA3-1双羟化DHEA的影响。通过单因素试验确定基于苯诱导的新型生物转化工艺的最适条件:接种量为10%(体积分数)、苯的添加体积分数为0.8%、苯的添加时间为接种后12 h、底物的添加时间为转化24 h后,此时产物摩尔得率达到最高的59%±0.97%。基于以上工作基础,在5 L发酵罐上进行放大研究,结果发现,在苯诱导下,CYP450的浓度比对照组的提高43%,7α,15α-diOH-DHEA的摩尔得率提高到68.7%±1.37%,同时转化期缩短8 h。本研究为工业化生产7α,15α-diOH-DHEA奠定了良好的基础。然而,对于苯诱导CYP450表达的具体机制还有待进一步明确,这将是我们今后研究的方向。

