添加洋葱汁和二氧化硫的赤霞珠红葡萄酒发酵的比较
袁梦,马雷,李杰,付冬梅,孙玉梅
(大连工业大学 生物工程学院,辽宁 大连,116034)
抑菌和防氧化对葡萄酒酿造非常重要。SO2的抑菌和抗氧化活性使其成为葡萄酒酿造中的基本添加剂[1-2]。但SO2对人体健康有负面影响,因此,研究者们努力寻找合适的SO2替代品以尽量减少SO2用量,诸如:抗坏血酸、谷胱甘肽、二碳酸二甲酯[3]、酚类物质[4]和胶体银[5]等化合物,以及对环境友好和食用安全的天然替代品,包括酵母泥、酵母衍生物[3]、黑萝卜提取物[6]、葡萄籽、葡萄梗以及葡萄藤枝条的提取物[7-9]、壳聚糖[10-11]、溶菌酶[3-4]、那他霉素和细菌素[3,12]。胶体银处理的葡萄酒在化学及感官特性方面与SO2处理效果相似[5]。黑萝卜提取物不仅对红葡萄酒的抗氧化活性和挥发酸与SO2处理效果相似,还改善了酒的感官特性,可降低SO2用量[6]。但目前仍未找到能完全替代SO2的物质。
百合科葱属的洋葱种植广泛,不仅含有蛋白质、碳水化合物、粗纤维、脂肪、维生素等植物营养素,还含有有机硫化物(比如亚磺酸酯、蒜素类化合物)、甾体皂苷类、黄酮类、苯丙素酚类等化合物和前列腺素等活性组分[13]。这些成分使洋葱具有降低血栓、血糖和血脂、稳定血压、抑菌、消炎、抗氧化以及抑制癌细胞等作用[13],其中的多酚、粗多糖、类黄酮化合物、含硫化合物(比如亚磺酸酯、蒜素类化合物)能有效抑制革兰氏阳性菌和革兰氏阴性菌,对酿酒酵母、白假丝酵母、新生隐球菌、黑曲霉、黄曲霉、红曲霉和青霉等真菌有较强抑制作用,最低抑菌浓度为0.25%~0.50%[13-18]。洋葱含有的花青素、类黄酮、酚类化合物、槲皮素和多糖具有抗氧化能力[13,19]。但是目前还未见关于洋葱汁替代SO2在葡萄酒发酵中应用的报道。
基于洋葱的抑菌活性和抗氧化活性,本实验室前期对添加2、5和8 g/L洋葱汁的葡萄酒发酵进行了对比实验[20]。本文通过测定在赤霞珠葡萄酒自然发酵和商业活性干酵母接种发酵的过程中微生物种群、还原糖、乙醇、pH值、总酸度、色度和氧化还原电位的动态,以及最终葡萄酒的褐变程度和挥发酸,分析比较了添加洋葱汁和SO2的葡萄酒发酵效果。
1 材料与方法
1.1 原料
酿酒用赤霞珠葡萄,2015年10月采自河北昌黎;普通红皮洋葱,大连农贸市场;葡萄接种发酵所用ST商业酵母(Zymaflore ST),辽宁五女山米兰酒业有限公司。实验用化学试剂分别为化学纯、分析纯及色谱纯化学试剂。
1.2 仪器
PHS-3C型精密pH计、722S型分光光度计以及ORP复合电极,上海精密科学仪器有限公司;HITACHI CR21 GⅢ离心机,日本日立工机株式会社;Agilent6850气相色谱仪、DB-FFAP(30 m×0.25 mm×0.25 μm)色谱柱以及7697A顶空进样器,安捷伦科技有限公司;SHP-350生化培养箱,上海精宏实验设备有限公司;WYT-5折射计,上海光学仪器厂。
1.3 洋葱汁制备
选取新鲜普通红皮洋葱,剥去外皮,切成小块后用料理机粉碎混匀,获得洋葱汁。
1.4 商业活性干酵母活化
活性干酵母(2 g)溶解在10 mL无菌水中,40 ℃保温15 min,每5 min轻轻搅拌1次,随后补加10 mL葡萄汁,于25 ℃保温1 h,每30 min轻轻搅拌1次。最后的混合物作为酵母接种物。
1.5 葡萄酒发酵
将未病、未破裂的新鲜葡萄去梗、压碎后,将果浆和果渣均匀分装到1 000 mL锥形瓶,每瓶装450 mL葡萄浆,用棉塞封瓶,发酵48 h后用发酵栓取代棉塞。在不接种的自然发酵和接种了200 mg/L商业酵母(即2 mL/L酵母活化液)的情况下,于15 ℃静置发酵。两种发酵分别补充50 mg/L SO2、50 g/L新鲜圆葱汁和无菌水,加无菌水的作为对照,3种补充均以加入洋葱汁的体积为准,不足的体积均用无菌水补齐,以保证对葡萄汁发酵体系的稀释程度相同。每个处理1式3份,每天2次手动摇匀30 s,定期取样。直到测定指标变化较小结束发酵测定。
1.6 化学成分测定
发酵葡萄浆或葡萄酒在4 ℃、10 640×g无菌离心10 min获得的上清液,经适当稀释后进行化学分析。采用滴定法测定总酸度(以酒石酸计算);用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法检测还原糖含量[1]。
采用气相色谱法定量测定乙醇和乙酸。将10 mL样品和2 g NaCl加入20 mL顶空瓶中,磁力搅拌至NaCl完全溶解。进样前,将样品在90 ℃下平衡30 min。将2 μL样品注射到进样口,加热到250 ℃。定量回路维持在100 ℃,传输管温度110 ℃,采样时间0.5 min。火焰离子化检测器(flame ionization detector,FID)温度250 ℃,载气为氮气,流速10 mL/min,柱压7.2 psi,空气流速300 mL/min,氢气流速30 mL/min,分流比10∶1。色谱柱起始温度40 ℃,维持5 min,5 ℃/min上升至190 ℃,维持1 min,然后以20 ℃/min升温至230 ℃,维持2 min[1]。
1.7 pH和氧化还原电位测定
采用502环形ORP复合电极测量样品的氧化还原电位,以白金环为指示电极,以银-氯化银为参比电极,并配以PHS-3C酸度计。测量前,用饱和醌氢醌对电极进行校准。每个样品在3 min内完成测量。
1.8 色度和褐变度测定
用722S分光光度计进行色度分析[21]。用去离子水(10倍)稀释样品,在1 cm的比色皿中,在420、520和620 nm处测定吸光度A420、A520和A620。样品的色强为A420、A520和A620之和。褐变度为420 nm处的吸光度[22]。
1.9 微生物计数测定
采用菌落计数法。用8.5 g/L NaCl溶液连续稀释的0.1 mL样品均匀涂布在无菌的琼脂平板上,30 ℃培养至菌落数量基本稳定,以CFU/mL进行活细胞计数。
分别用肉汤琼脂培养基、酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YEPD)和察氏琼脂培养基对细菌、酵母和霉菌进行计数。所有培养基在121 ℃灭菌20 min,然后加入0.22 μm微孔膜过滤灭菌的抗生素。肉汤琼脂培养基中添加0.012 5%的霉菌素,分别在YEPD琼脂培养基和察氏琼脂培养基中添加32 000 U/L青霉素和40 000 U/L链霉素[1]。
1.10 统计分析
使用SPSS 17.0软件包对数据进行差异显著性统计分析。数据采用方差分析,均数之间的差异采用Tukey检验,概率水平为0.05。
2 结果与分析
2.1 不同处理的葡萄酒发酵过程的微生物种群量比较
葡萄酒发酵系统的微生物构成复杂,包括酿酒酵母、非酿酒酵母、细菌和霉菌等。由图1可见,在接种发酵整个过程中,不同处理的各种微生物量均无显著差异(P>0.05),细菌(图1-b)和霉菌(图1-c)量不断下降,远小于自然发酵,而酵母菌量(图1-a)在发酵初期明显大于自然发酵(P<0.05),且始终高于自然发酵。对于自然发酵,与对照相比,添加洋葱汁和SO2的发酵前期酵母菌量和细菌量增长较慢,霉菌量减少较快(P<0.05);添加SO2的发酵前期酵母菌量增长比对照慢,比添加洋葱汁快,而添加SO2始终比对照和添加洋葱汁发酵的细菌量和霉菌量少(P<0.05)。

a-酵母菌;b-细菌;c-霉菌 C-自然发酵对照,S-自然发酵加SO2,O-自然发酵加洋葱汁;C+-接种发酵对照,S+-接种发酵加SO2,O+-接种发酵加洋葱汁(下同)图1 红葡萄酒发酵过程中菌群变化Fig.1 Changes of microflora during red wine fermentation
由图1可见,接种酵母主导接种发酵过程,显著抑制内源微生物生长,且远大于添加SO2和添加洋葱汁的抑制作用。内源酿酒酵母主导自然发酵过程,洋葱汁和SO2均抑制内源微生物的早期生长,而SO2比洋葱汁对内源细菌和霉菌的生长抑制更强,对内源酵母的生长抑制更弱。
在本研究葡萄酒酿造的生态环境下,加入洋葱汁对内源酵母菌、细菌和霉菌表现出抑制作用,与洋葱汁在其他应用环境的相关研究结果相似[13-18]。在葡萄酒酿造的生态环境下,添加胶体银以及添加壳聚糖比添加SO2的酵母量小[5,10],与本研究结果相似。
2.2 不同处理方式下葡萄酒发酵过程的还原糖含量比较
在葡萄酒发酵过程中,还原糖因用于微生物生长、繁殖和代谢而减少。图2显示接种发酵明显比自然发酵耗糖快;添加SO2和洋葱汁均减缓耗糖(P<0.05)。与对照相比,添加洋葱汁和SO2的接种发酵终点残糖较高,添加洋葱汁的自然发酵终点残糖较高,而添加SO2的自然发酵终点残糖较低(P<0.05)。
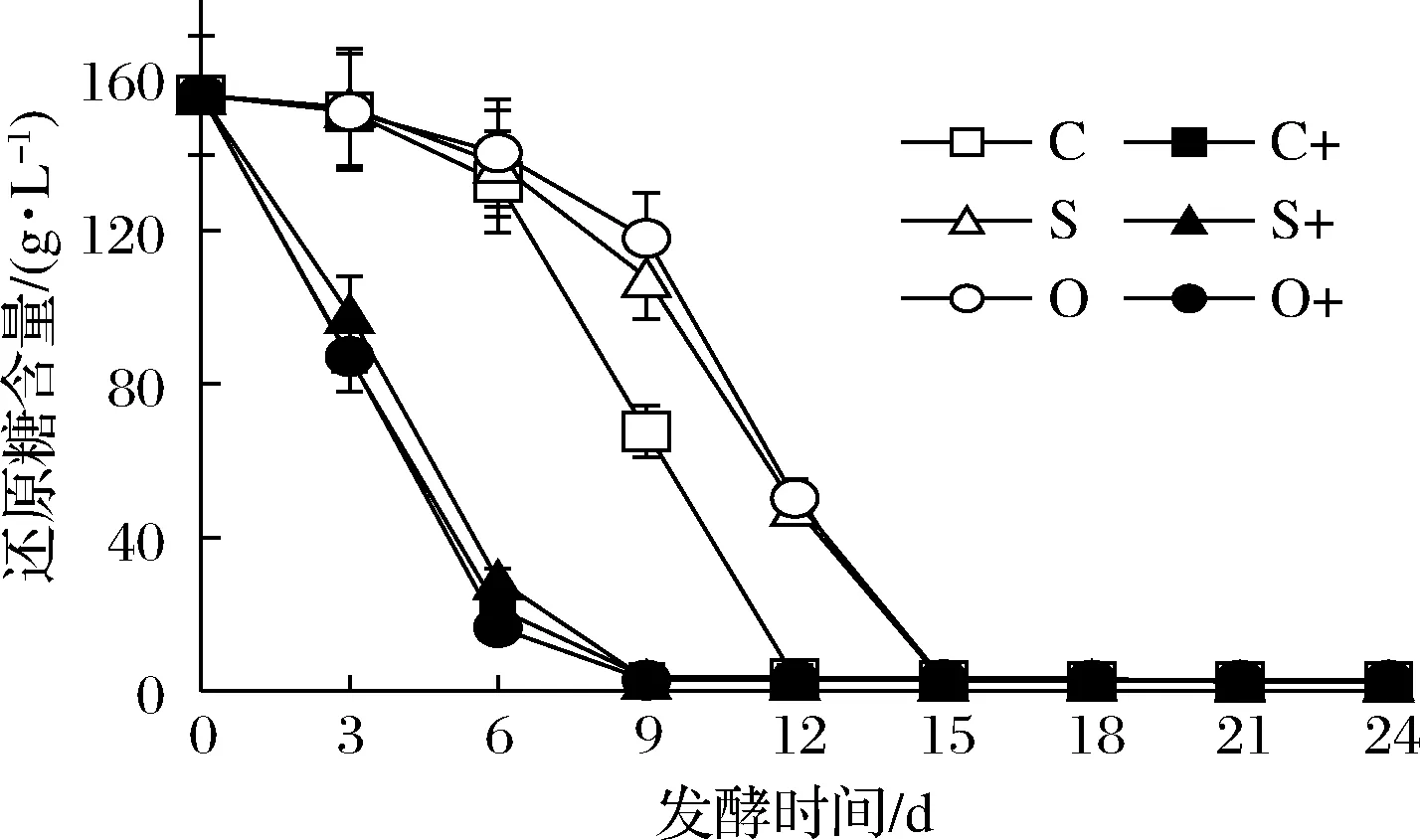
图2 红葡萄酒发酵过程中还原糖含量变化Fig.2 Changes of reducing sugar content during red wine fermentation
结果表明,接种酵母非常显著地加快耗糖,远大于添加洋葱汁和SO2对耗糖的影响,添加SO2和洋葱汁因抑制内源微生物生长而减慢耗糖,添加洋葱汁因较强地抑制酵母生长而耗糖较慢较少。
2.3 不同处理方式下葡萄酒发酵过程的乙醇含量比较
由图3可知,接种发酵比自然发酵生成乙醇较快。对自然发酵,添加洋葱汁和添加SO2均抑制前期产乙醇,添加洋葱汁的抑制作用更大(P<0.05);添加洋葱汁和添加SO2终点乙醇产量无显著差异,但均比对照发酵的终点乙醇产量低(P<0.05)。对接种发酵,添加SO2抑制前期产乙醇;但不同处理发酵终点的乙醇产量无显著差异(P>0.05)。虽然接种发酵比自然发酵过程中乙醇含量高,但接种发酵和自然发酵终点的乙醇产量无显著差异(P>0.05)。
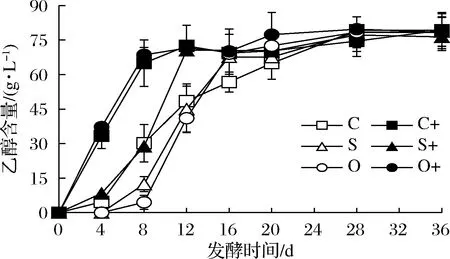
图3 红葡萄酒发酵过程中乙醇含量变化Fig.3 Changes of ethanol content during red wine fermentation
可见,接种发酵速度较快,乙醇生成较快,但不影响乙醇总产量;添加洋葱汁和添加SO2均抑制自然发酵产乙醇,且二者差异不显著。SO2和黑萝卜提取物在Carbernet Sauvignon和Mourvèdre红葡萄酒发酵中的应用结果表现出前者比后者的乙醇产量高[6],与本研究的产乙醇结果不同,可能与添加剂的化学组成和用量有关,也与添加剂对微生物的作用效果有关。
2.4 不同处理方式下葡萄酒发酵过程的乙酸含量比较
由图4可知,接种发酵比自然发酵产乙酸快,明显降低乙酸终浓度(P<0.05)。对自然发酵,添加洋葱汁和添加SO2均抑制发酵前期产乙酸,添加SO2的抑制作用更大;添加SO2比对照的发酵终点乙酸量低,而添加洋葱汁比对照的发酵终点乙酸量高(P<0.05)。对接种发酵,添加洋葱汁和添加SO2对发酵前期产乙酸也均有抑制(P<0.05);添加SO2比对照的发酵终点乙酸量低(P<0.05),而添加洋葱汁比对照的发酵终点乙酸量略高。
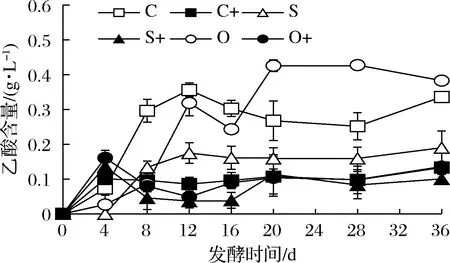
图4 红葡萄酒发酵过程中乙酸含量变化Fig.4 Changes of acetic acid content during red wine fermentation
可见,接种发酵能降低乙酸产量。添加洋葱汁和添加SO2均抑制发酵初期产乙酸,添加洋葱汁能提高乙酸产量,添加SO2能降低乙酸产量。
接种发酵速度较快,虽然乙酸生成较快速,但接种酵母及接种发酵的产物能有效抑制产醋酸的内源微生物的生长和代谢,从而使接种发酵比自然发酵的乙酸产量低。自然发酵比接种发酵的内源微生物多,但酵母总量较少,可能对产乙酸的微生物抑制作用较弱,使发酵后期的乙酸含量较高,虽然添加洋葱和SO2都能抑制发酵前期产乙酸,但在发酵后期表现出添加洋葱促进产乙酸,可能与洋葱不抑制(或促进)产醋酸菌的生长与代谢有关[23];而添加SO2仍然强烈抑制产乙酸,可推测SO2显著抑制产乙酸微生物的生长与代谢,降低了自然发酵的产乙酸量,也同样降低接种发酵乙酸产量。与HENICK-KLING[24]研究发现50 mg/L SO2对接种发酵产乙酸无影响的结果有别。本研究添加洋葱的自然发酵和接种发酵终点的挥发酸[(0.57±0.08),(0.28±0.04)g/L]都与对照无显著差异(P>0.05),添加SO2的自然发酵和接种发酵终点的挥发酸[(0.35±0.03),(0.25±0.03)g/L]却明显较低(P<0.05),与对乙酸的影响结果一致。SO2和黑萝卜提取物在Carbernet Sauvignon和Mourvèdre红葡萄酒发酵中的应用结果表现出前者比后者的乙酸产量低[4],与本研究的产乙酸结果相似。
2.5 不同处理方式下葡萄酒发酵过程的总酸和pH值比较
由图5-a可知,接种发酵普遍比自然发酵终点总酸度高(P<0.05)。添加SO2和洋葱汁会使总酸升高减慢(P<0.05),添加SO2作用更显著,但添加洋葱汁和添加SO2都会提高发酵终点总酸度(P<0.05)。接种发酵和自然发酵的pH值(图5-b)变化趋势相同,接种发酵始终比自然发酵的pH值低(P<0.05),而添加洋葱和添加SO2对pH值的影响较小(变化在0.1以内,P>0.05)。

a-总酸;b-pH值图5 红葡萄酒发酵过程中总酸和pH值变化Fig.5 Changes in total acidity and pH value during red wine fermentation
葡萄酒的总酸度和pH值与其中的有机酸种类有关,对葡萄酒口感有重要影响。发酵初期,酸性较强的酒石酸、柠檬酸和苹果酸等被微生物分解或利用较多[25],使pH值上升;随着代谢生成的乳酸、醋酸和琥珀酸等有机酸量增加,pH值又逐渐降低;发酵后期的苹果酸转化成酸性较弱的乳酸以及酒石酸产生沉淀[26],使pH值升高。接种发酵产酸较多,pH值较低;自然发酵则相反。添加洋葱汁和添加SO2可能促进了内源微生物代谢产酸。
2.6 不同处理方式下葡萄酒发酵过程的氧化还原电位比较
由图6可知,接种发酵和自然发酵过程中的氧化还原电位均先降低后升高,接种发酵比自然发酵氧化还原电位变化更快,但2种发酵点的氧化还原电位差异不显著(P>0.05)。与对照相比,添加洋葱汁和SO2的整个发酵过程中的氧化还原电位均较低,降低幅度更大;添加SO2比添加洋葱汁的最低氧化还原电位低(P<0.05)。
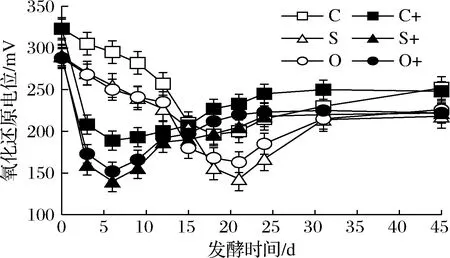
图6 红葡萄酒发酵过程中氧化还原电位变化Fig.6 Changes of redox potential during red wine fermentation
在葡萄酒发酵系统中添加洋葱汁降低氧化还原电位可能是其中酚类化合物及多糖的还原作用[18]。在本研究的发酵前期,葡萄浆中的溶解氧被微生物的生长和代谢迅速消耗,又被产生的CO2进一步驱除,随着发酵时间的延长和生成越来越多的乙醇,葡萄皮中具有还原性的花色苷逐渐浸渍到发酵浆,此外,发酵液中有较多的游离SO2,这些作用使氧化还原电位快速降低。当乙醇含量最大时氧化还原电位最低,说明乙醇是决定氧化还原电位的重要因素,其次是溶解氧和花青素浓度。在发酵后期,采样操作把氧气带到发酵系统,浸出的花青素在一定程度上被氧化,SO2被氧化或与其他化合物相结合,以及随着发酵的进行营养物质消耗和代谢产物生产,导致氧化还原电位上升到210~240 mV,低于初始氧还电位。与自然发酵相比,接种发酵的酵母数量更多,活性更高,代谢更强烈,氧化还原电位更早下降到最低。研究发现,在红酒发酵过程中增加空气控制氧化还原电位在高于自然水平的215 mV,能显著增加酵母细胞生存能力和维持活细胞比率,加快葡萄酒发酵[27],这也解释了本研究结果。此外,氧化还原电位最低出现的时间早于还原糖降至最低的时间,说明早期氧化还原电位下降主要因为溶解氧被大量消耗。氧化还原电位的最小值与最大发酵速率(即还原糖消耗速率)相吻合,这与KILLEEN等[27]的表述一致。高氧化还原电位可能导致葡萄酒具有陈化或氧化味。氧化还原电位的降低有利于香气的形成。经具有还原性的SO2和洋葱汁处理可有效降低葡萄酒氧化还原电位,从而保证葡萄酒的质量。添加洋葱汁比添加SO2的自然发酵初期酵母生长量较少,耗糖较慢,可能耗氧也较少,使氧化还原电位较高。
2.7 不同处理方式下葡萄酒发酵过程的色度和褐变度比较
由图7可知,接种发酵比自然发酵过程中的色度大(P<0.05),但2种发酵终点色度差异不显著(P>0.05)。无论自然发酵还是接种发酵,与对照相比,添加SO2的发酵前期色度较低,而后期色度较高,而添加洋葱汁的发酵过程色度始终较低(P<0.05)。添加洋葱汁和SO2的接种发酵均比对照的终点褐变度低(0.80±0.03,0.55±0.04,0.78±0.01);添加洋葱汁和SO2的自然发酵均也比对照的终点褐变度低(0.74±0.03,0.52±0.11,0.71±0.01)。接种发酵比自然发酵褐变度高,添加洋葱汁的褐变度最低,组间差异显著(P<0.05)。
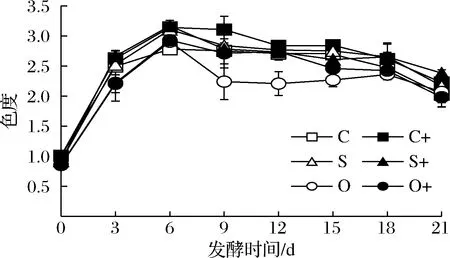
图7 红葡萄酒发酵过程中色度变化Fig.7 Changes of color intensity during red wine fermentation
影响葡萄酒色度的主要因素有花色苷的量和结构、pH值以及多酚化合物等[28-29]。发酵所产有机酸和醇类化合物会促进果皮中色素物质浸提到发酵液中,从而提高葡萄酒色度。添加洋葱汁和SO2对微生物的抑制作用,使代谢产物生成较慢、较少,致使多酚、单宁以及花色苷浸出较慢、较少,使发酵前期色度较小。接种发酵代谢产物产生较快,多酚、丹宁以及花色苷浸出较快、较多,因此色度较高。添加洋葱汁降低葡萄酒色度,而添加SO2提高葡萄酒色度,其原因还有待进一步研究。
葡萄酒褐变主要是酚类化合物(多酚、单宁和花色苷)氧化造成的。在葡萄酒发酵过程中,酚类化合物会被氧化,发生氧化聚合反应,产生深色物质,使葡萄酒颜色变暗[29-30]。接种发酵的氧化还原电位较高,所以褐变度较高。洋葱汁和SO2均具有抗氧化作用,会抑制酚类化合物氧化,所以添加洋葱汁和SO2的接种发酵和自然发酵褐变度都较低。添加洋葱汁比添加SO2发酵的褐变度低,可能与添加洋葱汁较强的抗氧化作用有关[19],其原因也有待进一步研究。
3 结论
接种的酵母对葡萄酒发酵环境中的细菌、霉菌和内源酵母均有抑制作用,其抑制作用明显强于添加洋葱汁和SO2。在葡萄酒发酵的生态环境中,添加50 g/L洋葱汁和60 mg/L SO2均抑制内源微生物的早期生长,减慢耗糖,均抑制自然发酵产乙醇和发酵初期产乙酸,降低氧化还原电位和褐变度以及发酵初期的色度。添加SO2比添加洋葱汁对内源细菌和霉菌的生长,氧化还原电位降低更多;添加洋葱汁比添加SO2耗糖更慢,并提高乙酸产量,而添加SO2降低乙酸产量。在防褐变方面,添加洋葱汁更有优势;在提高色度和抗氧化性、抑菌、降低乙酸方面,添加SO2更有优势。虽然添加洋葱汁发酵初期具有辛辣刺激味,但随着发酵的进行,洋葱的刺激味逐渐减弱,可能是洋葱中的蒜素类化合物逐渐被分解,发酵结束后,葡萄酒的洋葱味十分微弱,而且表现出比添加SO2更圆润的口感。所以,在葡萄酒酿造过程中,洋葱汁有可能取代或部分取代SO2。本研究的洋葱汁用量较大,对葡萄汁的稀释作用较大,可考虑对洋葱汁进行适当的低温真空浓缩,或者用其他方法进行浓缩,对于洋葱汁的具体用法以及作用机理还需要做进一步深入研究。

