北美鹅掌楸LtuHMGS基因的克隆与生物信息学分析
张成阁,戈瑶瑶,刘换换,宗亚仙,吴栩佳,杨立春,李火根
(南京林业大学 a.林木遗传与生物技术教育部重点实验室;b.南方现代林业创新中心;c.林学院,江苏 南京 210037)
北美鹅掌楸Liriodendron tulipifera是自然条件下鹅掌楸属Liriodendron植物现仅存的两个种之一,其干形通直,叶型优美,花色鲜艳,是良好的园林观赏树种和工业用材[1]。花香是影响北美鹅掌楸昆虫传粉的重要因素[2],其成分非常复杂,包括酯类、萜类、醛类和醇类等化合物,而萜类物质是其重要组成成分。
萜类化合物由数个异戊二烯结构单位构成,属于植物次级代谢物,其种类包括类胡萝卜素、脱落酸等植物激素,在植物生长发育、抵御胁迫、昆虫授粉等方面起重要作用[3-6]。萜类物质主要通过甲羟戊酸途径(MVA)和2-C-甲基-D-赤藻糖醇-4-磷酸途径(MEP)合成,其合成由不同的酶基因协调共同完成[8]。羟甲基戊二酰辅酶A 合酶(HMGS)是MVA 途径中的关键反应酶,催化乙酰辅酶A(Acetoacetyl-CoA)生成HMG-CoA,再由HMG-CoA 还原酶(HMGR)将其还原为甲羟戊酸(mevalonic acid),接着进行一系列反应生成异戊烯焦磷酸(IPP),作为三萜和倍半萜类化合物合成的通用前体[9]。HMGS基因是萜类物质生物合成MVA 途径中第二个合成酶,对从分子层面研究MVA 途径合成萜类物质具有重要意义。目前白木香Aquilaria sinensis[10]、茶Camellia sinensis[11]、冬凌草Isodon rubescens[12]、杜仲Eucommia ulmoides[13]等植物的HMGS基因全长已被克隆并鉴定出来。
1 材料与方法
1.1 试验材料
南京林业大学下蜀林场种源为佐治亚州的北美鹅掌楸,采集不同组织的样品并将样品放入液氮中带回实验室,存储在-80℃超低温冰箱中。
1.2 RNA 的提取和cDNA 的合成
在进行RNA 提取之前,先将器具进行无菌无酶处理,减少RNA 污染。根据RNA 提取试剂盒的说明步骤,在超净工作台中提取北美鹅掌楸不同组织的RNA,用超微量分光光度计检测总RNA浓度,为700~800 ng·μL-1,琼脂糖凝胶电泳检测可知28 S 和18 S RNA 条带无异常,且OD260/230和OD260/280的值为1.8~2.0,RNA 质量良好,可以进行后续试验(图1)。将提取的RNA 反转录为cDNA 第一链用于后续试验。

图1 各个组织RNA 凝胶电泳Fig.1 RNA gel electrophoresis
1.3 含ORF 的LtuHMGS 基因全长克隆
通过Oligo7 软件在转录组数据中得到的HMGS 序列上设计中间片段引物(表1),进行PCR 扩增[14]。收集琼脂糖凝胶电泳检测后正确的目的片段,然后将回收到的序列连接到pEASYBlunt 载体后进行大肠杆菌转化试验,将转化的大肠杆菌放在37℃恒温培养箱过夜,然后挑取8 个阳性克隆进行菌检,将3 个菌检正确的菌液送到上海杰李生物公司测序。用Oligo7 软件在测序得到的正确序列上设计3'RACE 和5'RACE 引物,使用巢式PCR扩增方法扩增3'RACE和5'RACE片段。将扩增得到的产物按照上面所用方法操作,扩增得到3'RACE 和5'RACE 片段,然后将得到的中间片段、3'RACE 和5'RACE 片段拼接一起得到基因全长。

表1 引物序列Table 1 Primer sequences
1.4 LtuHMGS 基因的生物信息学分析
通过NCBI ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)网站在线分析LtuHMGS基因的开放阅读框(ORF)和其编码的氨基酸序列;LtuHMGS 蛋白的保守结构域由NCBI conserved domain(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) 和Pfam(Pfam:Home page (xfam.org))在线预测得到;利用Expasy ProtParam(http://web.expasy.org/protparam/)分析LtuHMGS 蛋白质氨基酸组成、分子量、理论等电点等;采用signalP 4.1 Sever 在线分析LtuHMGS 蛋白质信号肽。通过SOPMA 和SWISS-MODEL 在线预测工具分析LtuHMGS 蛋白的二级结构和三级结构;在NCBI 数据库中比对LtuHMGS基因编码蛋白并下载分值较高的几个物种的HMGS 氨基酸序列,使用DNAMAN 进行比对,然后用MEGA 7.0 软件进行系统进化树的构建[15]。
1.5 LtuHMGS 基因组织表达谱
将北美鹅掌楸的根、茎、叶、萼片、花芽、花瓣、雄蕊、雌蕊这8 个组织的RNA 反转录合成cDNA 后,将cDNA 模板统一稀释到500 ng·uL-1。利用Oligo7 软件设计RT-qPCR 引物,采用本实验室自己筛选的并经过多次验证无误的LcActin97作为内参基因,且该内参基因相较于筛选出的eIF3等其他几个内参基因更适合不同组织的荧光定量试验[16]。参考试剂盒说明步骤设置反应体系并设置4 个重复来进行实时荧光定量反应。
1.6 LtuHMGS 基因亚细胞定位
为了更深入地研究LtuHMGS基因,使用生物信息学分析网站TargetP 1.1 Server 来预测LtuHMGS基因的亚细胞定位。为了验证这些预测,用pBI121 载体构建了包含绿色荧光蛋白(GFP)标记和LtuHMGS 蛋白的重组质粒。用Quick Cut酶(Takara Biomedical Technology,大连,中国)通过Xbar I 和Bam HI 位点酶切pBI121 载体。然后,将LtuHMGS基因的ORF 插入到pBI121载体。将LtuHMGS::GFP 融合载体转化到根癌农杆菌GV3101 中,并注入本氏烟草Nicotiana benthamiana叶片中。两天后,使用LSM 710 共聚焦显微镜(Zeiss,耶拿,德国)观察并成像GFP荧光信号[17]。
2 结果与分析
2.1 北美鹅掌楸LtuHMGS 基因全长的克隆及命名
在转录组数据库检索得到的HMGS 序列上设计扩增引物,扩增出中间片段,然后在此基础上设计5'RACE 和3'RACE 引物,扩增得到5'RACE 和3'RACE 片段。通过琼脂糖凝胶电泳可知中间片段、5'RACE 和3'RACE 片段长度分别为957、241 和607 bp(图2)。将扩增的所有片段拼接到一起可得LtuHMGS基因,全长为1 805 bp,然后在NCBI ORF finder 网站预测LtuHMGS基因的ORF 为1 425 bp,3'端和5'端的非翻译区长度分别为181 bp和199 bp。为了验证预测得到的ORF 的正确性,在ORF 的两端设计引物进行PCR 扩增,将扩增得到的序列与预测的ORF 序列比对,结果两序列长度大小无差别。根据扩增得到的序列与其他物种的HMGS 蛋白序列比对结果,把扩增得到的序列确认为北美鹅掌楸HMGS基因的cDNA 序列,并将其命名为LtuHMGS(登录号:MW326776)。

图2 cDNA 凝胶电泳Fig.2 Electrophoresis of cDNA
2.2 LtuHMGS 基因生物信息学分析
2.2.1 LtuHMGS 蛋白序列分析
在水环境治理与修复技术方面,引进了河流“水华”控制、大型渠道清污、深水疏浚、污泥处理、水面垃圾清除、微菌生物污水处理等技术和仪器38项;创新转化技术和产品67项,开发了清污辅助决策系统,改进了深水和水面清污设备,取得专利22项,成果在广东、江苏、天津、上海等地进行成功运用;不仅促进了对污染源的控制能力,提高了水环境机械治理水平,而且提升了水环境生物修复能力,为从根本上治理我国水环境污染,建设环境友好型社会提供了技术支撑。
在Expasy ProtParam 网站上对LtuHMGS基因编码蛋白的理化性质进行预测分析,结果可知该基因共编码474 个氨基酸,分子式为C2340H3608N614O721S24,理论分子量为52.65 kD,等电点为6.10,带负电荷(Asp+Glu)54,带正电荷(Arg+Lys)49,不稳定系数为41.05,因此推测该蛋白为不稳定蛋白。该蛋白的脂肪族氨基酸指数和Gravy 的值分别为71.81 和-0.287,因此认为该蛋白为亲水性蛋白。在predict protein 网站上预测分析LtuHMGS 蛋白的氨基酸组成,结果可知丝氨酸、亮氨酸、丙氨酸、甘氨酸、赖氨酸等为LtuHMGS 蛋白的几类主要氨基酸(图3)。使用signalP5.0 程序和TMHMM 分析LtuHMGS 蛋白质信号肽和跨膜螺旋,发现其不同位点的分值都没有变化且该蛋白无跨膜螺旋,因此推测LtuHMGS蛋白不存在信号肽,不进行跨膜转运,是一种非分泌型蛋白。在NCBI conserved domain 和Pfam网站中分别对LtuHMGS 蛋白的氨基酸序列进行保守结构域预测分析,NCBI 预测结果表明该蛋白含有羟甲基戊二酰辅酶A 合酶、羟甲基戊二酰辅酶A 合成酶C 末端和“引发”缩合酶等结构域,且5 aa-466 aa 皆为羟甲基戊二酰辅酶A 合酶保守结构域(图4)。Pfam 结果表明该蛋白具有羟甲基戊二酰辅酶A 合成酶N 末端和羟甲基戊二酰辅酶A 合成酶C 末端保守结构域,因此可以证明LtuHMGS 蛋白具有羟甲基戊二酰辅酶A 合酶功能。
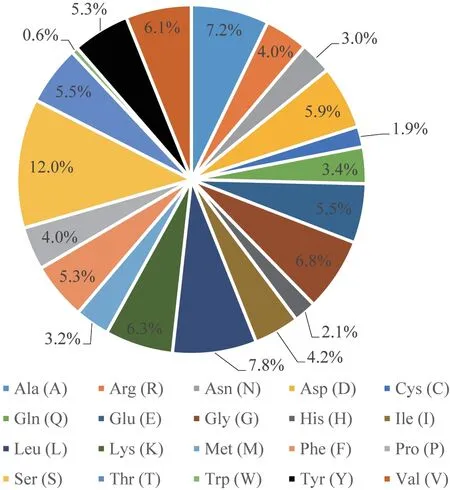
图3 LtuHMGS 蛋白的氨基酸组成Fig.3 Amino acid composition of LtuHMGS protein
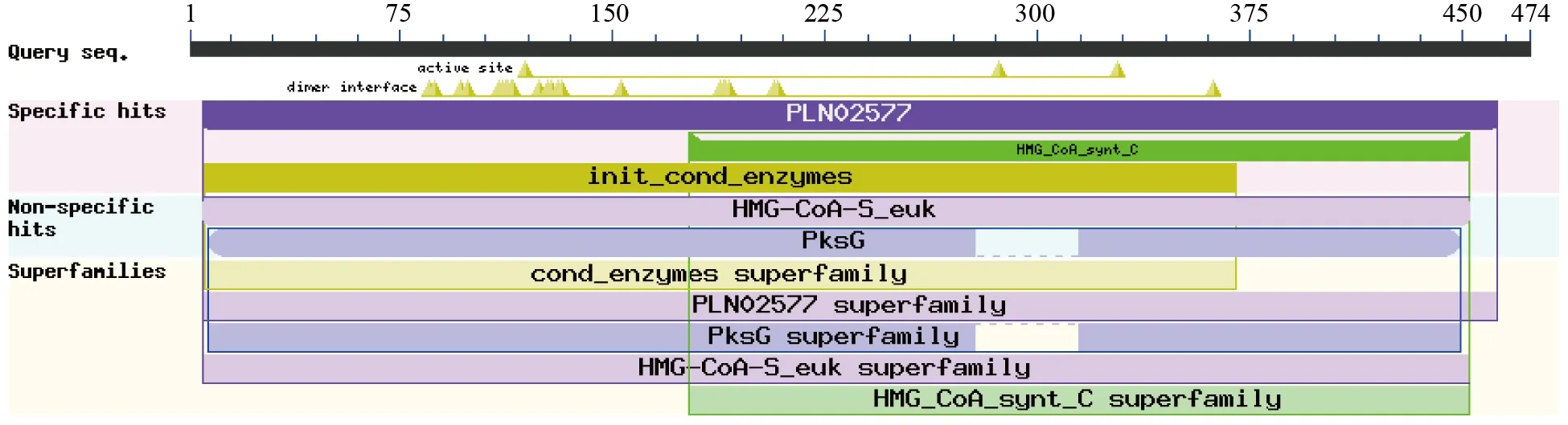
图4 LtuHMGS 保守结构域Fig.4 Conserved domains in LtuHMGS
2.2.2 LtuHMGS 基因编码蛋白二、三级结构预测
通过SOPMA 网站预测分析LtuHMGS 蛋白的二级结构,结果可知:α-螺旋(Hh)、无规则卷曲(Cc)、β-转角(Tt)和延伸链(Ee)为LtuHMGS 蛋白的主要构象,贯穿了整个蛋白链。其中Hh 含有212 个氨基酸,占44.73%,占比最高;Tt 含有23 个氨基酸,占4.85%,占比最低。而Cc 和Ee 各含有171 和68 个氨基酸,分别占比36.08%和14.35%(图5)。在SWISS-MODEL网站上,以多物种的HMGS 蛋白结构做模板对LtuHMGS 蛋白的三级结构进行建模,结果表明该模型的GMQE 为0.86,QMEAN 为-1.18,且LtuHMGS 蛋白与芥菜Brassica juncea等其他同源模型的相似性达81.07%。因此LtuHMGS 蛋白属于羟甲基戊二酰辅酶A 合酶(图6)。

图5 LtuHMGS 蛋白二级结构预测Fig.5 The prediction of secondary structure in LthHMGS protein
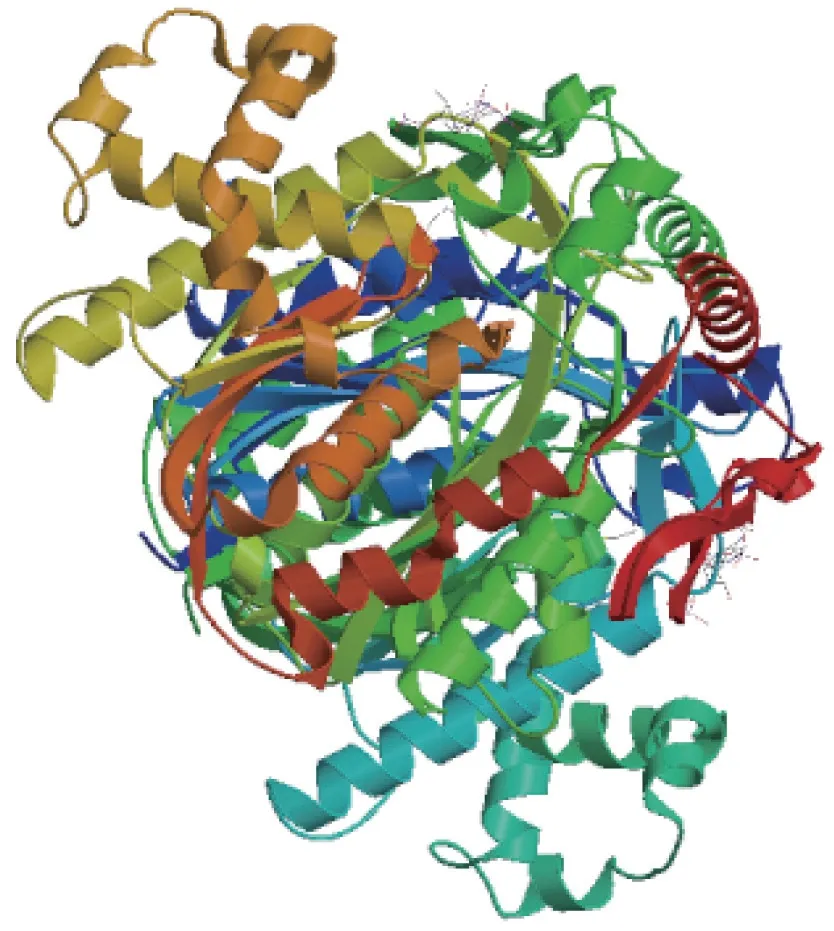
图6 LtuHMGS 蛋白三维模型Fig.6 The three-dimensional model of LtuHMGS protein
2.2.3 LtuHMGS 蛋白亚细胞定位
使用TargeP 1.1 Server 在线预测LtuHMGS 蛋白的亚细胞定位,预测结果可知LtuHMGS 蛋白的线粒体(mTP)分值为0.030,分泌通路(SP)分值为0.206,其他(other)分值为0.879,且可靠性级别(reliablity class)为2,说明该蛋白可能较多分布在除线粒体和分泌通路之外的其他位置(表2)。为了进一步确认该蛋白在细胞中的位置,在本氏烟草叶中进行了瞬时表达实验。通过共聚焦显微镜可以观察到具有GFP 标签的LtuHMGS 蛋白信号与细胞质质膜的信号重合,说明LtuHMGS蛋白可能定位于细胞质膜上(图7)。
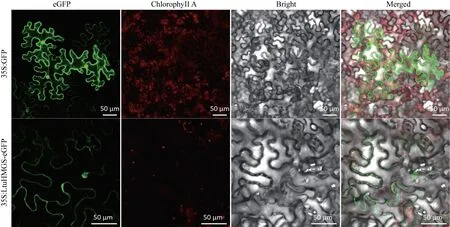
图7 LtuHMGS 蛋白在烟草下表皮细胞中的亚细胞定位Fig.7 Subcellular localization of LtuHMGS protein in tobacco lower epidermal cells

表2 LtuHMGS 蛋白亚细胞定位Table 2 Prediction of subcellular localization of LtuHMGS protein
2.3 LtuHMGS 基因编码蛋白序列同源性比对及系统进化树分析
在NCBI 数据库中下载与LtuHMGS 蛋白序列同源性较高的植物HMGS 蛋白序列进行同源对比分析,结果表明LtuHMGS 蛋白序列与沉水樟Cinnamomum micranthum、山鸡椒Litsea cubeba、海枣Phoenix dactylifera、小果野蕉Musa acuminata、油棕Elaeis guineensis的蛋白序列相似度均大于83%,其中与山鸡椒的相似度最高,达到了87.16%(图8)。因此可以得知LtuHMGS 蛋白的功能域与其他植物的功能域相似度较高,且蛋白的功能域具有较高的保守性,具有一个羟甲基戊二酰辅酶A 合成酶的保守结构域(IPR000590),且具有半胱氨酸(C)活性位点,证明LtuHMGS蛋白具有羟甲基戊二酰辅酶A 合酶的功能。

图8 不同物种HMGS 蛋白序列比对Fig.8 Alignment of HMGS protein sequences from different species
为分析LtuHMGS基因编码蛋白的系统进化关系,在NCBI 数据库中下载沉水樟、山鸡椒、海枣、小果野蕉、油棕、水仙Narcissus tazetta、凤梨Ananas comosus、野蕉Musa balbisiana、石刁柏Asparagus officinalis、中华猕猴桃Actinidia chinensis、石斛Dendrobium nobile、莲Nelumbo nucifera、可可Theobroma cacao、橡胶树Hevea brasiliensis、陆地棉Gossypium hirsutum、喜树Camptotheca acuminata、拟南芥Arabidopsis thaliana、石榴Punica granatum、大豆Glycine max这19 个物种的同源蛋白序列。通过MEGA7.0 软件构建LtuHMGS基因编码蛋白系统进化树(图9),结果可知北美鹅掌楸与樟科植物中的沉水樟和山鸡椒的进化关系最为接近。通过Pfam 网站预测分析参与构建系统进化树的蛋白序列,发现这些序列皆含有HMG_CoA_synt_N 和HMG_CoA_synt_C保守结构域,序列中还均含有IPR000590 保守结构域和半胱氨酸(C)活性位点。

图9 LtuHMGS 系统进化树Fig.9 A phylogenetic tree of LtuHMGS
2.4 LtuHMGS 基因组织表达谱
对LtuHMGS基因在不同组织中的RT-qPCR实验结果表明,LtuHMGS基因在雌蕊中的表达量最高,是其他组织的数倍,而在雄蕊中的表达量略高于花瓣且二者接近,在叶片中的表达量约为雌蕊的1/5,但高于在萼片中的表达量。该基因其他组织中表达量较低,在根中的表达量约为茎中的1/2(图10)。LtuHMGS基因的表达量顺序为:雌蕊>雄蕊>花瓣>叶片>萼片>花芽>茎>根。

图10 LtuHMGS 基因在不同组织中的相对表达量Fig.10 The relative expression of LtuHMGS gene in different tissues
3 讨 论
植物花香的成分十分复杂,以往对花香的研究主要集中在花香成分和影响昆虫传粉等方面,对其生物合成途径的研究相对较少[18]。萜类物质分为挥发性萜类和非挥发性萜类,是花香化合物的重要成分之一,一直是研究的重点[19]。自1958年Bloch 等[20]首次在动物和酵母中发现萜类合成的MVA 途径,该途径长期以来就一直被认为是萜类合成的唯一途径,直到1993年Rohmer 等[21]首次在真核生物中发现了萜类合成的MEP 途径。羟甲基戊二酰辅酶A 合酶是MVA 途径中的关键酶,对萜类物质合成的前体异戊烯焦磷酸合成具有重要的催化作用,目前已有多方面的研究表明其在萜类物质合成中的作用。Wang 等[22]通过在拟南芥中过表达芥菜的HMGS基因,提高了转基因拟南芥中甾醇的含量;Ren 等[23]在细菌中过表达灵芝的HMGS基因,发现相对于野生型菌株而言,过表达菌株中的灵芝酸含量明显提高了;Balasubramaniam 等[24]研究发现,提高萜类产物的含量会抑制HMGS基因的表达。
本研究通过RACE 技术成功克隆鉴定出LtuHMGS基因,并通过简单的生物信息学分析可知,该基因的ORF 全长1 425 bp,编码474 个氨基酸,LtuHMGS 蛋白的分子量为52.65 kD,预测分析该蛋白具有亲水性,蛋白中无信号肽和跨膜螺旋,是一种非分泌型蛋白,这与李清等[25]在金钗石斛中和李科等[26]在水仙中的研究结果一致,这些理化性质是LtuHMGS 蛋白行使其功能的重要组成单位。HMGS基因在植物中可能存在包括小基因家族在内的多种形式,比如巴西橡胶树Hevea brasiliensis有2 个HMGS基因,分别为HbHMGS1和HbHMGS2[27],拟南芥中已经鉴定到了17 个HMGS基因[28],大戟科植物中也存在多个HMGS基因[29],而北美鹅掌楸中LtuHMGS基因是否有其他拷贝,还有待进一步研究。不同的HMGS 蛋白可能在亚细胞器中的分布也不同,如人的HMGS 存在线粒体和细胞质中,王淋等[30]研究发现杜仲EuHMGS1 定位在细胞质膜上。本研究通过亚细胞定位预测得知LtuHMGS 蛋白位于细胞质中,但是在线粒体中也有分布,通过烟草瞬时转化试验,表明LtuHMGS 蛋白可能位于细胞质膜上,这与萜类化合物MVA 合成途径存在于细胞质中的报道吻合。通过结构域预测分析可知LtuHMGS 蛋白具有典型的羟甲基戊二酰辅酶A 合酶的结构域IPR000590,且具有半胱氨酸(C)活性位点。然后构建编码蛋白的系统进化树并与其他物种做同源序列比对,可知LtuHMGS 蛋白序列与其他物种HMGS 蛋白序列相似度达到83%以上,且LtuHMGS 蛋白与樟科Lauraceae 的沉水樟和山鸡椒的进化关系较近,而樟科植物中的挥发油成分多为萜类物质[31],据此表明LtuHMGS基因编码蛋白具有羟甲基戊二酰辅酶A 合酶蛋白的功能,且参与萜类物质的合成。
研究表明植物HMGS基因的表达具有组织特异性,如CnHMGS基因在果香菊Chamaemelum nobile倍半萜类成分含量较高的花和根中的表达量高于茎和叶中的表达量,丹参Salvia miltiorrhiza的SmHMGS基因在叶中的表达量远高于在根中的表达量,陆英Sambucus chinensis的HMGS基因在花与根状茎中的表达量就要高于叶片,冬凌草IrHMGS基因在冬凌草甲素含量较高的叶中表达量最高[12,32-33]。由LtuHMGS基因组织表达谱可知,其表达量在不同组织中存在着明显差异,在雌蕊中表达量远高于其他组织,在根中的表达量最低。总体而言LtuHMGS基因在萜类代谢物含量较高的花器官中表达量较高,推测其可能参与北美鹅掌楸花香物质的合成。
由于HMGS基因多以基因家族的形式存在,本研究并未对LtuHMGS基因的其他拷贝形式进行克隆鉴定,而且本研究仅是通过生物信息学方法和亚细胞定位对基因进行了初步验证,下一步准备通过遗传转化,将萜类合成酶基因转入矮牵牛中,对其进行具体的功能验证。
4 结 论
萜类化合物作为植物花香主要成分之一,是影响植物传粉和观赏的重要因素,越来越受到研究者的关注。因此,在分子水平上探究植物萜类物质合成代谢已成为热点。本研究成功地从北美鹅掌楸中克隆出LtuHMGS基因,通过生物信息学分析、亚细胞定位和组织表达分析等方法对LtuHMGS基因进行分析研究,结果表明LtuHMGS基因编码蛋白质具有羟甲基戊二酰辅酶A 合酶蛋白的功能,并且该基因在花香的主要合成器官中的表达量更高,因此我们推测该基因可能参与北美鹅掌楸萜类化合物的合成,这些结果都为北美鹅掌楸萜类化合物的合成和调控提供了理论依据。

