角质酶的异源表达和超声辅助下降解PET塑料
娄文勇 吴有权 郭泽望 宗敏华
(华南理工大学 食品科学与工程学院,广东 广州 510640)
塑料是一种由碳和氢聚合而成的材料,不仅与我们的日常生活息息相关,而且广泛应用于工业上[1- 12]。据不完全统计,2018年全球塑料产量达到3.59亿吨,平均每秒就卖出二十万个塑料瓶,然而只有9%被重新回收利用[13]。其中,聚对苯二甲酸乙二醇酯(PET)是最重要的热塑性塑料之一,相比于其他传统材料(如木材、混凝土和金属),PET拥有许多显著的优势,如不易断裂,轻便,耐腐蚀等[14- 20]。然而,在PET需求日益增长的同时,也造成了固体废弃物的堆积,PET占据了城市固体垃圾的很大一部分[21- 24],一旦处理不当,便会带来一系列的健康和环境问题,比如地下水污染、温室气体排放、火灾和人体疾病等[25]。目前处理废弃PET的主要方法有填埋、焚烧、再生造粒和热解[26],其中不论是填埋还是焚烧,都会对环境造成巨大的破坏[27],而再生造粒和热解等方法所需反应条件苛刻,工艺成本高昂等[28- 29]。因此,寻找绿色的降解方法迫在眉睫!
近年来,利用生物法降解PET塑料引起了广泛的关注,其实质是利用酶降解塑料。生物降解法具有反应条件相对温和、环境绿色友好的优点,降解后得到的产物能够被回收利用,符合可持续发展的理念,被认为是最理想的PET废弃物处理方法。Yoshida等[30]从废弃PET回收点的土样中,分离到一株可消化分解PET的细菌——坂井艾德昂菌(Ideonellasakaiensis)。该菌首先分泌PET水解酶将PET降解成对苯二甲酸甲基- 2-羟乙酯(MHET),再将MHET转运入体内,并在MHET水解酶的作用下最终降解为单体对苯二甲酸(TPA)和乙二醇(EG)。此后,又有多个性能不同的PET降解酶陆续被报道。其中,叶分支堆肥角质酶(LCC)经过两步级联催化,可以将PET直接降解为TPA和EG单体[31],因此将LCC用于PET的生物降解具有很大潜能。
LCC(EC 3.1.1.74)属于丝氨酸水解酶家族[32],具有典型的丝氨酸-组氨酸-天冬氨酸催化三联体[33- 37],来源于不同细菌的角质酶水解PET的活性大相径庭,但是都很低[38]。超声波是一种频率为20~106 kHz的机械波,它可以加速某些化学反应,如促进化学物质的水解效率。超声广泛应用于辅助天然产物的提取[38]、脂质的催化酯化和酯交换[39- 41]、食品加工[42]、以及生化工程/生物技术如生物废水处理和生物修复[43- 45]。然而,应用超声波辅助生物降解PET的研究却鲜见报道。在本项研究中,首次使用超声波来辅助LCC生物降解PET,再优化重要的反应条件,如温度、pH超声功率和超声时间,以期获得最佳的催化效果。
1 材料和方法
1.1 菌株与质粒
pET- 26b(+)-LCC由生工生物工程(上海)股份有限公司合成,大肠杆菌BL21(DE3)购自生工生物工程(上海)股份有限公司。
1.2 试剂材料
肉汤(LB)培养基原料及其他常规试剂均为分析纯,乙腈、甲酸为色谱纯,溴化钾为光谱纯,均购自广州市丛源仪器有限公司;异丙基β-半乳糖苷(IPTG)、卡那霉素、苯二甲酸(TPA),均购自上海阿拉丁生化科技股份有限公司;PET购自东莞市腾扬翔实业有限公司。
1.3 实验设备
YY- 040HAL2型超声波清洗机,上海允延仪器有限公司生产;T27型傅里叶变换红外光谱及红外显微镜,德国布鲁克公司生产;EVO18型扫描电子显微镜,德国蔡司公司生产;UltiNate3000型高效液相色谱仪,美国Waters公司生产;TENSOR27型圆二色光谱,英国Applied Photophysics公司生产;SCIENTZ-IID型超声细胞破碎仪,宁波新芝生物科技股份有限公司生产;Five Easy Plus型pH计,梅特勒-托利多仪器有限公司生产;Gel Doc TM XR+型凝胶成像系统,美国Bio-Rad公司生产;Mini-PROTEIN Tetra 1658003型垂直蛋白电泳槽、Bio-ScaleTMMini NuviaTMIMAC型Ni离子亲和层析柱,美国Bio-Rad公司生产;UV- 2550型紫外可见光光度计,日本岛津公司生产。
1.4 试验方法
1.4.1 角质酶LCC的诱导表达与纯化
取2 μL重组质粒,加入到100 μLEscherichiacoliBL21(DE3)感受态细胞中,轻柔混匀后冰浴30 min后,取出后置入42 ℃恒温水浴90 s,然后立即冰浴5 min,再加入1 mL LB培养基,在摇床中振荡复苏培养1 h(37 ℃、180 r/min)。复苏结束后,取100 μL涂布在含有卡那霉素(50 μg/mL)抗性的LB固体培养基中,37 ℃培养过夜,所得单菌落即为E.coliBL21(DE3)-pET- 26b(+)-LCC。挑取单菌落至含有卡那霉素(50 μg/mL)的LB中培养12 h,作为种子液。接种1%体积的种子液于含有卡那霉素(50μg/mL)的LB中,37 ℃、180 r/min扩大培养至菌液D(600)在0.6~0.8,冷却至室温后,加入终浓度为0.2 mmol/L的IPTG,于16 ℃、160 r/min培养20 h进行诱导表达。角质酶LCC的分离纯化及鉴定参考文献[46]和《分子克隆》[47]。
1.4.2 TPA的检测与LCC酶活测定
使用高效液相色谱检测TPA,色谱柱为Ec-lipse Plus-C18柱(5 μm,4.6×150 mm,Agilent),柱温30 ℃。流动相A为0.1%体积比的甲酸水溶液,B为纯乙腈,流速为0.8 mL/min,采用梯度洗脱,95%A和5%B在15 min内缓慢改变成54.5%A和45.5%B,紫外检测波长为254 nm[48]。LCC酶活单位定义为:在特定的反应条件下,每分钟水解BHET产生相当于1 μmol TPA,所需要的酶量为 1个活性单位(1 U)。
1.4.3 PET表面结构分析
采用扫描电子显微镜(SEM)对不同超声反应条件下PET的表面性能的变化进行微观形貌观察,电压为10 kV,用高能电子束在PET表面扫描,产生不同信号,通过这些信号检测PET表面形貌。
1.4.4 LCC的二级结构检测
配制1 mg/mL的LCC溶液,在不同功率超声5 h后,采用圆二色光谱仪(CD)测定LCC在190~260 nm处的圆二色光谱,再用圆二色光谱分析软件Pro-Data和CDNN来计算LCC的二级结构含量;将超声后的LCC样品冷冻干燥,按质量比1:10与光学纯溴化钾研磨混合压片,采用傅里叶红外光谱仪(FT-IR)测定LCC在400~4 000 cm-1处的红外光谱,再用PeakFit v4.12计算LCC的二级结构含量。
1.4.5 LCC动力学常数的测定方法
PET的单体对苯二甲酸二乙酯(BHET)被用作测量PET降解酶活性的替代品[48]。在5 mL螺口血清瓶中加入不同浓度(1、2、4、6、8、10、15、20 mmol/L)的BHET、终质量浓度为0.02 mg/mL的酶液,再用100 mmol/L pH8.0 K2HPO4-KH2PO4的缓冲液补足至5 mL,65 ℃精确反应10 min,沸水浴15 min终止反应,用第1.4.2节的方法检测TPA的浓度,用GraphPad Prism7来模拟出回归方程,得出最大反应速度Vmax和动力学参数Km,LCC的分子质量为28.84 ku,再算出转化数kcat。
1.4.6 数据统计处理
所有数据均重复测定3次,使用Excel2017和GraphPad Prism7处理数据和作图。
2 结果与分析
2.1 LCC的诱导表达和分离纯化
将表达载体pET- 26b(+)-LCC转化到菌株E.coliBL21(DE3)后,利用诱导剂IPTG进行诱导表达。LCC的表达量和活性不仅与表达载体、菌株相关,还与诱导表达条件密切相关。通过对单一因素设置系列梯度,来对诱导条件进行优化。IPTG浓度分别为0.05、0.10、0.20、0.30、0.40、0.50 mmol/L、诱导温度分别为12、16、20、25、30 ℃、诱导时间分别为16、20、24、28 h。
2.1.1 诱导条件的优化
不同IPTG浓度、诱导温度、诱导时间都对LCC表达有所影响,IPTG浓度过低,LCC的表达量低,导致LCC的比活偏低;而IPTG对pET- 26b(+)来说具有一定毒性,浓度过高会抑制细胞生长,影响生物量的积累。相比于其他IPTG浓度组的重组LCC的相对活性,IPTG浓度为0.2 mmol/L条件下重组LCC的相对活性最高,因此,选择IPTG浓度为0.2 mmol/L。诱导温度过低,细胞的生长缓慢,生物量偏低,LCC的表达量相应地也会降低;诱导温度过高,细胞生长迅速,蛋白质大量表达以至于部分LCC不能正确折叠而形成无活性的包涵体。相比于其他诱导温度组的重组LCC的相对活性,诱导温度为16 ℃条件下重组LCC的相对活性最高,因此,选择诱导温度为16 ℃。诱导时间过短,生物量和蛋白表达量都很低;诱导时间过长,培养基营养枯竭,有害物质积累,细胞死亡,生物量和蛋白表达量因此而降低。相比于其他诱导时间组的重组LCC的相对活性,诱导时间为20 h条件下重组LCC的相对活性最高,因此,选择诱导时间为20 h。
2.1.2 LCC的分离纯化
由于LCC携带了6个组氨酸标签,所以使用Ni亲和层析柱分离纯化在最优条件下诱导表达的LCC。SDS-PAGE电泳结果如图1所示,在35和25 ku之间出现单一条带,与理论值28.84 ku相符合。使用Brad-Ford试剂盒测定纯化前后的蛋白浓度,再测定纯化前后的酶活等,结果见表1。纯化后的酶活为320.27 U/mg,酶活回收率为64.29%,纯化倍数为5.13。

泳道M—预染蛋白Marker;泳道1—含空载体pET- 26b(+)的E.coli BL21(DE3)全蛋白;泳道2—含载体pET- 26b(+)的E.coli BL21(DE3)全蛋白;泳道3—经蛋白纯化仪纯化后的LCC图1 LCC纯化的SDS-PAGE分析Fig.1 SDS-PAGE analysis of LCC during purificatuion
2.2 LCC的最适温度和pH值
在生物催化反应中,温度是一个重要的参数,高温或低温环境下,都会影响LCC的活性和反应效率。因此,确定最适反应温度显得尤为重要。
在不同温度下测定LCC的活性,如图2(a)所示。在50~65 ℃之间,TPA浓度随着温度升高而升高,65 ℃时,LCC活性达到最高,随着温度进一步升高,LCC活性降低甚至失活。此外,PET结晶度也会随温度升高而升高,而结晶度越高,PET被降解的效率就越低[49- 50]。70 ℃和75 ℃条件下,达到65 ℃时PET结晶度的两倍分别需要15 h和5 h[31]。与温度类似,较高和较低的pH都会影响LCC的活性,LCC在pH=8.0时具有最高活性(见图2(b))。

表1 LCC的纯化Table 1 Purification of LCC
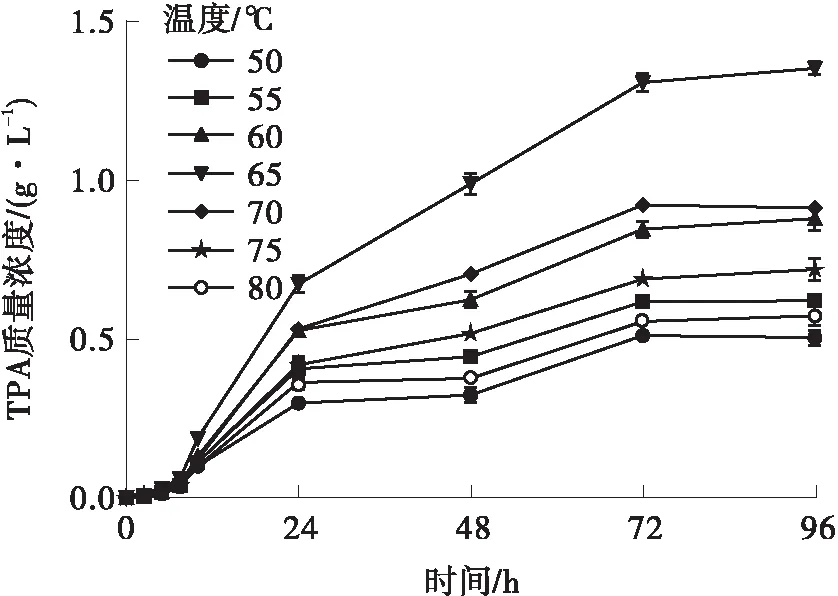
(a)温度

(b)pH值图2 温度和pH值对LCC活性的影响Fig.2 Effect of temperature and pH on the activity of LCC
2.3 超声处理对LCC的影响
超声波穿透能力极强、能量很大,在介质中具有加热功能、机械传质作用、空化作用。由超声引起的空化现象会产生大量包含反应液蒸气的微气泡,微气泡在PET和反应液之间的宽界面(大于200 μm)处不对称塌陷,并以高速(大于100 m/s)向PET表面产生微射流[51],而且微气泡的瞬时破裂也会产生高达103MPa的强烈冲击波[52],反应液朝着或远离微气泡的剧烈运动形成的微对流可以加剧反应液与PET之间的碰撞,从而促进LCC对PET的解聚作用[53]。另一方面,由空化现象引起的LCC的结构变化拓宽了LCC的底物通道。然而,超声功率过高、时间过长,LCC的结构进一步改变,趋向于不合理构象,导致LCC失活。与此同时,较高功率的超声所产生的瞬间空化作用会形成大量的高能量自由基,其会攻击LCC发生化学变化,影响LCC结构,使LCC活性降低。不仅如此,高强度的微射流和冲击波会破坏LCC结构,甚至会把LCC剪切成小碎片,而使其活性降低甚至失活,变得不利于PET的降解。
2.3.1 超声功率和时间对LCC活性的影响
LCC在不同超声功率和时间下的活性如图3所示,在超声功率为25 W时,超声2.5~10.0 h都会加速PET的降解,其中超声5.0 h效果最好,超声7.5 h和10.0 h降解48 h后的效果还不如未经超声处理的。其原因可能是超声时间过长,导致酶结构被破坏,稳定性受到影响;在超声功率为150 W时,超声对于LCC降解PET来说已经是一个不利因素。分析所有数据后得到,LCC降解PET的最佳超声辅助条件是超声功率25 W、超声时间5 h,降解24 h后,TPA质量浓度从0.72 g/L提升到0.87 g/L。米氏常数只与LCC的性质有关,而与浓度无关。因此,米氏常数的变化说明超声波处理改变了LCC的结构。LCC降解PET的动力学参数见表2。超声功率为25 W时,最大反应速度Vmax是未超声的1.67倍,Km是未经处理的0.85倍,说明超声功率为25 W时,LCC与PET的亲和力更高,降解效率有所提高,反应更快。

(a)25 W

(b)50 W

(c)75 W
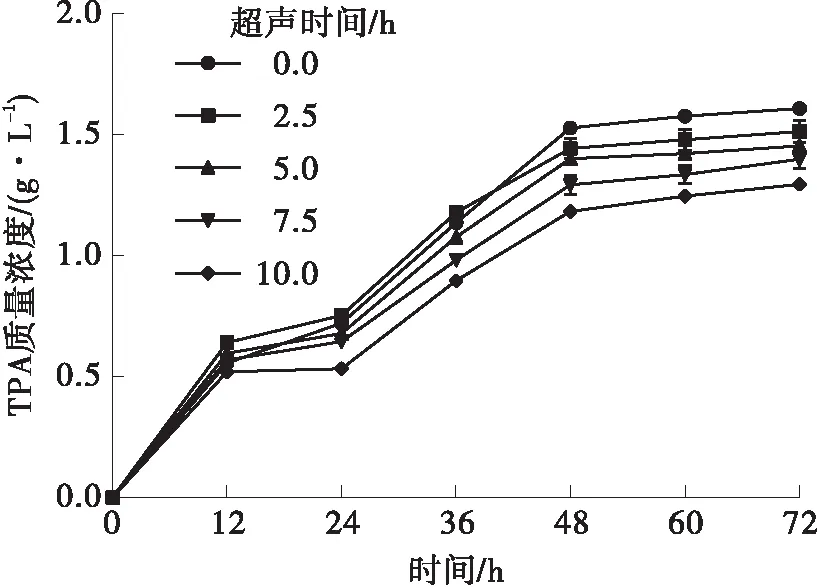
(d)100 W
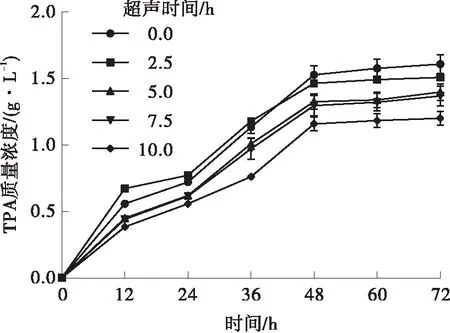
(e)125 W

(f)150 W图3 超声功率和超声时间对LCC活性的影响Fig.3 Effect of ultrasonic power and ultrasonic time on the activity of LCC
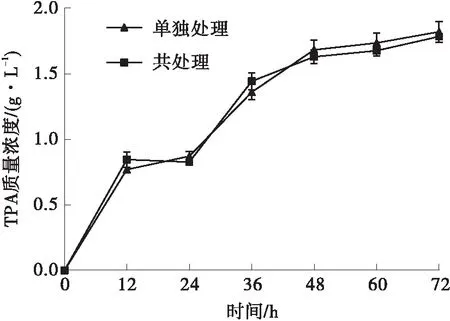
图4 单独超声处理和共超声处理对LCC降解PET的影响Fig.4 Effect of ultrasonic treatment alone and co-ultrasonic treatment on degradation of PET by LCC
2.3.2 单独超声处理和共超声处理对LCC降解PET的影响
研究了单独超声处理和共超声处理对LCC降解PET的影响,单独超声组是先在最佳超声条件(25 W超声5 h)下处理后再用于降解反应,共超声处理是在最佳超声条件(25 W超声5 h)下进行降解反应,结果如图4所示。两种处理方式的降解效率相近,说明单独超声处理和共超声处理对LCC降解PET的影响相同。
2.4 PET的表面结构
为进一步说明超声加速了LCC降解PET,利用SEM分析了超声功率为25 W、超声时间为5 h时的PET表面降解情况,结果如图5所示。未经任何处理的PET表面光滑无凹痕(见图5(a)),超声和未加LCC都不会改变PET的结构(见图5(b)

表2 LCC降解PET的动力学参数Table 2 Kinetics parameters for PET biodegradation by LCC
和5(c))。加入LCC但未经超声处理条件下降解5 h后,其表面出现明显凹凸不平的裂痕、凹槽、颗粒感(见图5(d)),而在25 W超声辅助下,PET的表面破坏更加明显,出现了更多的裂痕、凹槽和碎片化(见图5(e)和5(f))。这说明相比于未超声,25 W超声加速了LCC对PET的降解。

(a)未经任何处理

(b)缓冲液中未加酶也未超声

(c)25 W超声未加酶

(d)加酶未超声

(e)25 W超声加酶(100×)

(f)25 W超声加酶(500×)图5 不同处理条件下的PET表面扫描电镜图Fig.5 SEM photos of PET surface under different processing conditions
2.5 不同超声功率对LCC二级结构的影响
蛋白质的二级结构是指多肽链主链在空间中的规则折叠和缠绕,这取决于氨基酸残基的非侧链基团之间的氢键[54];LCC二级结构的变化可以说明超声辅助降解PET的原因。主要的蛋白质二级结构有α-螺旋、β-转角、β-折叠和无规则卷曲,就支撑蛋白结构的稳定性而言,α-螺旋>β-转角>β-折叠>无规则卷曲,但就功能而言,酶的活性中心通常是在无规则卷曲结构中[55]。
2.5.1 圆二色光谱分析
采用CD来检测和计算不同超声功率超声5 h后的二级结构的差异,结果如图6所示。与未经处理的结果相比,超声功率为25 W时,无规则卷曲结构所占比例为45.4%,明显高于未经处理的34.2%,β-折叠结构所占比例为23.3%,降低了35.6%,β-转角结构所占比例为14%,降低了15.5%,而α-螺旋结构所占比例为17.3%,高于其他超声处理组。结果说明,25 W超声时,不仅会加速降解效率,而且对LCC的稳定性影响较小。

(a)圆二色光谱
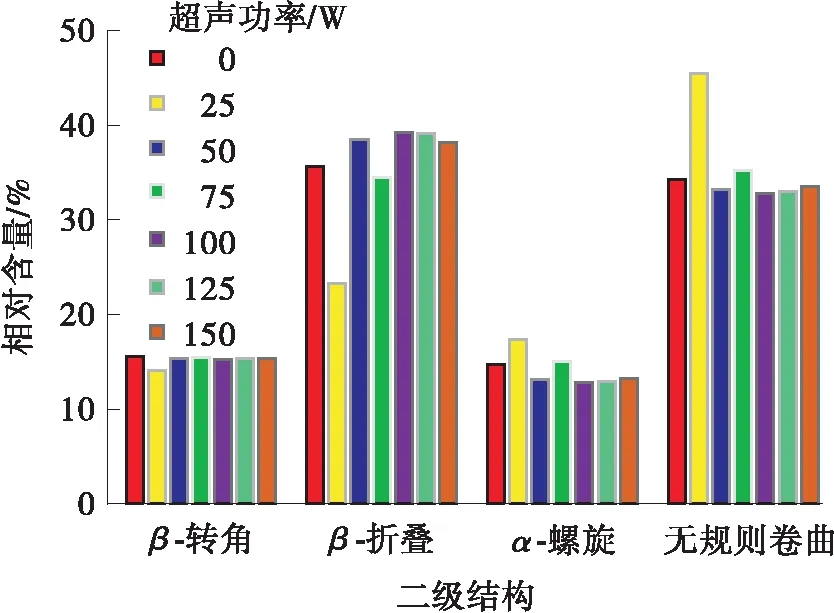
(b)二级结构占比图6 不同超声功率处理后LCC的CD和二级结构占比Fig.6 CD and the proportion of secondary structure of LCC after treatment with different ultrasonic power
2.5.2 傅里叶变换红外光谱分析
采用FT-IR来检测和计算不同超声功率超声5 h后的二级结构的差异,在LCC的红外光谱图中,主要由LCC二级结构的红外吸收子峰叠加而形成的酰胺Ⅰ带是LCC二级结构变化的敏感区域。因此,选择酰胺Ⅰ带(1 600~1 700 cm-1)谱图,使用PeakFit v4.12软件,进行基线校正、Savitsk-Golay函数平滑、高斯去卷积和多次二阶导数拟合处理,不同超声功率下超声5 h后的LCC二级结构定性定量信息如图7所示。未经处理时,无规则卷曲结构所占比例为27.4%,低于所有超声处理组,说明超声处理后,LCC二级结构逐渐转向无序化;未经超声处理时,α-螺旋结构所占比例为32.8%,β-折叠结构所占比例为20.3%,都高于所有超声处理组,说明超声处理后,LCC二级结构整体有从α-螺旋、β-折叠向无规则卷曲转变的趋势,进而说明超声会加速LCC降解PET,但其稳定性会受到一定程度的影响。
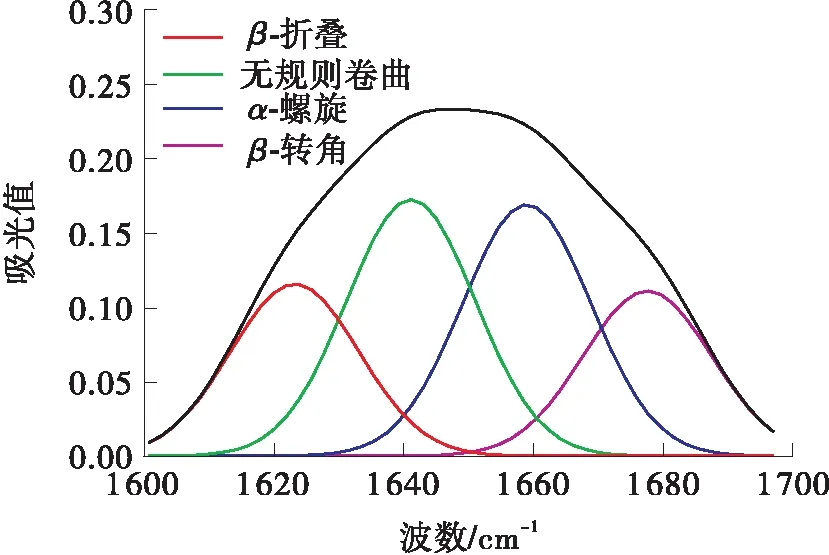
(a)0 W
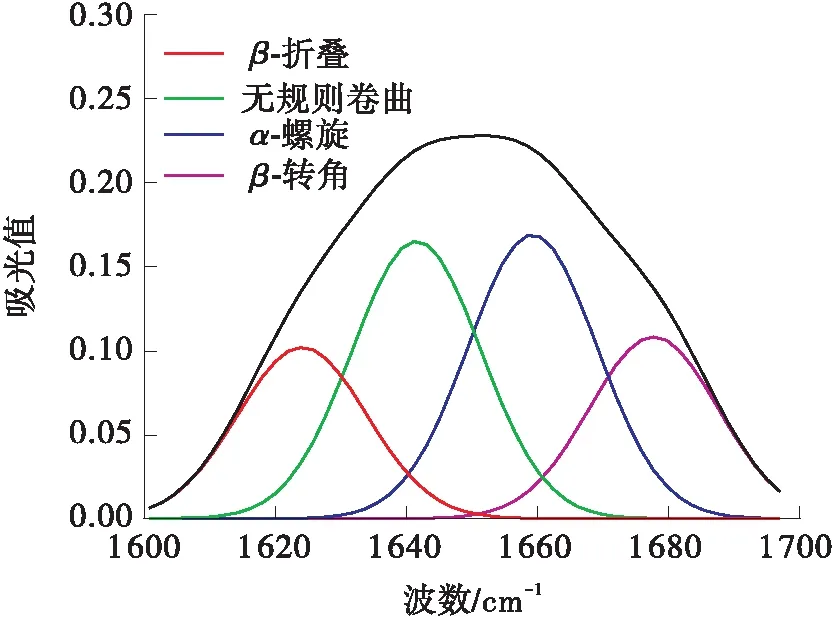
(b)25 W

(c)50 W

(d)75 W
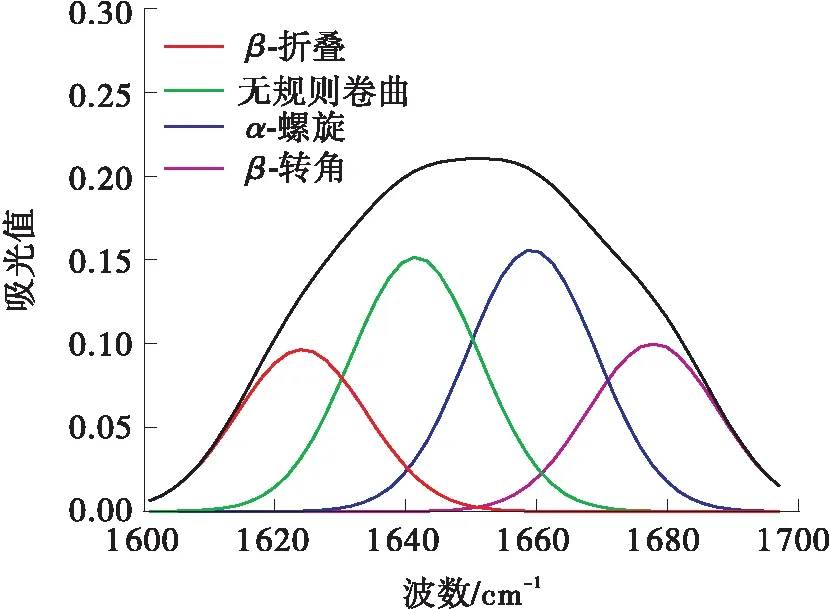
(e)100 W

(f)125 W
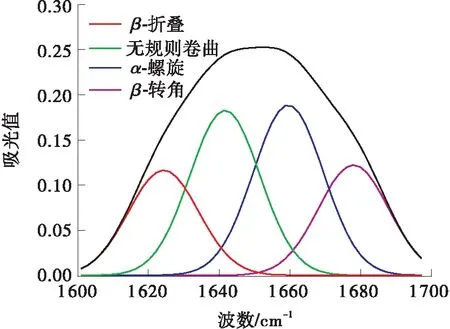
(g)150 W

(h)二级结构占比图7 不同超声功率处理后LCC的FT-IR谱图和二级结构占比Fig.7 FT-IR spectra and the proportion of secondary structure of LCC after treatment with different ultrasonic power
李冰等[56]研究了超声对过氧化氢酶二级结构的影响,研究结果显示,超声处理后过氧化氢酶的α-螺旋、β-折叠结构均有下降,其中β-折叠结构下降明显,下降了12.3%;β-转角、无规则卷曲结构含量增加,过氧化氢酶的二级结构整体呈现出由有序向无序变化的趋势。本研究中,经超声处理后的LCC二级结构由α-螺旋、β-折叠向无规则卷曲转变;这说明经过超声作用后LCC的结构变得更加无序,LCC的性质也因此发生了相应的变化。
3 结论
结果表明,超声可以加速LCC降解PET,最佳反应条件为65 ℃,pH=8.0,超声功率为25 W,超声时间5 h。在此超声辅助条件下,降解24 h后PET的降解效率是未超声的1.21倍,TPA质量浓度从0.72 g/L增加到0.87 g/L,值得高度重视。
通过扫描电镜证实了超声对LCC降解PET的影响,相比于未经处理,25 W超声功率下超声5 h确实可以加速PET的降解。此外,圆二色光谱和傅里叶变换红外光谱检测LCC二级结构的变化可用于解释超声加速LCC降解PET的原因,即LCC二级结构整体上从α-螺旋和β-折叠向无规则卷曲转变,进而造成其活性的变化。这为超声加速降解提供了一定的理论依据,同时也可作为超声辅助的其他酶促反应的参考,也为白色污染的生物降解开创了新思路。

