补肾益肺消癥方对肺纤维化上皮间质转化中瘦素相关因子的影响
金译涵 张迪 贺晋芳 郑佳昆 李金桐 张亚楠 宋洁 晏军

摘要 目的:明确肺纤维化上皮-间质转化(EMT)对瘦素相关因子的影响,对瘦素加速EMT的分子机制进行初探,并观察补肾益肺消癥方对EMT过程中瘦素相关因子的作用。方法:将A549细胞根据干预手段不同分为正常组、模型组[转化生长因子-β1(TGF-β1)]、中药组(TGF-β1+补肾益肺消癥方)、尼达尼布组(TGF-β1+尼达尼布),免疫荧光观察α-平滑肌肌动蛋白(α-SMA)、E-钙黏附蛋白(E-cadherin)的表达,酶联免疫吸附试验(ELISA)检测细胞上清中的瘦素水平,Western Blotting检测瘦素受体(LEPR)、过氧化物酶体增殖物激活受体γ(PPAR-γ)的蛋白含量以及STAT3的活化程度。结果:与正常组比较,模型组细胞上清中瘦素水平升高(P<0.01),中药组、尼达尼布组出现不同程度的下降(P<0.001);与正常组比较,模型组LEPR蛋白表达升高(P<0.001),PPAR-γ表达下降(P<0.05),STAT3活化水平降低,中药组、尼达尼布组LEPR蛋白表达下调(P<0.001),PPAR-γ表达上调(P<0.05),中药组STAT3活化程度与模型组比较差异无统计学意义(P>0.05),尼达尼布组与模型组比较,STAT3活化水平升高(P<0.01)。结论:EMT可促进细胞内源性肺瘦素的分泌,增加细胞表面LEPR的表达,下调与瘦素有拮抗作用的PPAR-γ的含量,減少STAT3的活化,为瘦素加速EMT进程提供物质基础。而补肾益肺消癥方则可能通过降低内源性肺瘦素分泌,减少LEPR,提高PPAR-γ的水平逆转此过程。
关键词 补肾益肺消癥方;肺纤维化;上皮间质转化;瘦素;A549细胞;瘦素受体;过氧化物酶体增殖物激活受体γ;转化生长因子-β1
Abstract Objective:To clarify the effect of epithelial mesenchymal transition(EMT) on leptin-related factors in pulmonary fibrosis,explore the molecular mechanism of leptin accelerating EMT,and observe the effects of Bushen Yifei Xiaozheng Formula on leptin-related factors in the process of EMT.Methods:A549 cells were divided into a control group,a model group(TGF-β1),a Chinese medicinal group(TGF-β1+Bushen Yifei Xiaozheng Formula),and Nintedanib group(TGF-β1+Nintedanib) according to different intervention methods.The expressions of α-smooth muscle actin(α-SMA) and E-cadherin were observed by immunofluorescence.The leptin level in cell supernatant was detected by ELISA,and the protein content of LEPR,PPAR-γ and the activation degree of STAT3 were detected by Western blot.Results:Compared with control group,leptin level in cell supernatant of model group was increased(P<0.01),and decreased in Chinese medicine group and Nintedanib group(P<0.001).Compared with control group,the expression of LEPR protein in model group was increased(P<0.001),the expression of PPAR-γ was decreased(P<0.05),the activation level of STAT3 was decreased,the expression of LEPR protein in Chinese medicine group and Nintedanib group was down-regulated(P<0.001),and the expression of PPAR-γ was up-regulated(P<0.05).The activation level of STAT3 in Chinese medicinal group was not significantly different from that in model group(P>0.05),but the activation level of STAT3 in Nintedanib group was increased compared with that in model group(P<0.01).Conclusion:This study confirmed that EMT can promote the secretion of endogenous lung leptin,increase the expression of LEPR on the cell surface,down-regulate the content of PPAR-γ,which has the antagonistic effect of leptin,and reduce the activation of STAT3,providing material basis for leptin to accelerate the process of EMT.However,Bushen Yifei Xiaozheng Formula may reverse this process by reducing endogenous leptin secretion,reducing LEPR and increasing PPAR-γ level.
Keywords Bushen Yifei Xiaozheng Formula; Pulmonary fibrosis; Epithelial mesenchymal transition; Leptin; A549 cell; LERP; PPAR-γ; TGF-β1
中图分类号:R289.5文献标识码:A doi:10.3969/j.issn.1673-7202.2022.01.013
肺纤维化是慢性肺部疾病的基本病理过程或是最终转归,由肺部损伤过度修复形成细胞外基质(Extracellular Matrix,ECM)堆积,阻碍肺泡毛细血管屏障气血交换,并导致肺顺应性下降,引发限制性通气障碍,出现肺换气和肺通气功能双重瘫痪,不可逆转,从而对患者生命健康构成威胁[1]。
瘦素是一种由ob基因编码,产生于脂肪组织,具有降低食欲、增加机体能耗、在固定范围内维持脂肪量稳定的激素[2]。近年来已被证实在肝纤维化、肾纤维化中发挥重要作用。瘦素可与瘦素受体(Leptin Receptor,LEPR)结合后,激活肝星状细胞,促进库普弗细胞中转化生长因子-β(Transforming Growth Factor-β,TGF-β)的合成,加速ECM沉积[3-4];在肾纤维化中,瘦素刺激肾内皮细胞增殖,上调系膜细胞表面TGF-β Ⅱ型受体,使得Ⅳ型胶原和纤维连接蛋白表达增加[5]。与此同时,瘦素因高度参与上皮-间质转化(Epithelial Mesenchymal Transformation,EMT),是一种驱动EMT的关键生物分子[6]。众所周知,肺泡Ⅱ型上皮细胞(Alveolar Type Ⅱ Cell,AT Ⅱ)EMT是肺纤维化早期的基本病理过程之一,Gui等[7]研究表明瘦素通过抑制自噬,通过PI3K/AKT/mTOR途径加速A549细胞的EMT,促进肺纤维化的发展。而瘦素与AT Ⅱ EMT的具体关系尚未完全清楚,且以往研究多着重于瘦素加重EMT的分子机制,EMT对瘦素的分泌和瘦素相关因子表达的影响不甚明晰。本研究旨在明确EMT对瘦素相关因子的影响,对瘦素加速EMT的分子机制进行初探,并观察补肾益肺消癥方对EMT过程中瘦素相关因子的作用。
1 材料与方法
1.1 材料
1.1.1 细胞
A549细胞,中国医学科学院细胞库提供。
1.1.2 试剂与仪器
重组人TGF-β1活性蛋白(Abcam公司,美国,货号:ab50036);尼达尼布(BIBF1120)(Medchem Express,美国,货号:14002);蛋白质常规分子量标记(10~180 kDa)(Proteintech,货号:PL00001);LEPR多克隆抗体(Proteintech,货号:20966-1-AP);PPARγ单克隆抗体(Abcam公司,美国,货号:ab178860);p-STAT3单克隆抗体(Abcam公司,美国,货号:ab76315);STAT3单克隆抗体(Abcam公司,美国,货号:ab68153);山羊抗小鼠IgG H&L(HRP)(Abcam公司,美国,货号:ab6789);山羊抗兔IgG H&L(HRP)(Abcam公司,美国,货号:ab6721);BCA试剂盒(Thermo公司,美国,货号23227);α-SMA(Abcam公司,美国,货号:ab124964);CD324(E-cadherin)单克隆抗体(eBioscience公司,美国,货号:Cat.53-3249-80);人瘦素ELISA试剂盒(FineTest公司,货号:EH0216)。
倒置相差显微镜(OLYMPUS公司,日本,型号:BX60);二氧化碳培养箱(SANYO公司,日本,型号:MCO-5M);垂直层流洁净工作台(ESCO公司,新加坡,型号:ACB-6E1);低温高速离心机(Eppendorf公司,德国,型号:5424)(离心半径为8.46 cm);全自动连续光谱酶标仪(Thermo公司,美国,型号:MULTISKANMK3);电泳仪(北京六一公司,型号:DYCZ-25D);电转仪(北京六一公司,型号:DYCZ-40D);倒置荧光显微镜(Nikon公司,日本,型号:Eclipse Ti-SR);全景扫描仪(3D HISTECH公司,匈牙利,型号:PannoramicMIDI)。
1.2 方法
1.2.1 中药冻干粉的制备
将饮片(补肾益肺消癥方,内含当归、熟地黄、陈皮、法半夏、浙贝母、水蛭、炙甘草)置于双蒸水中,充分浸泡,纳入煎药壶中煎煮至沸腾,并持续30 min后倒出药液,重复以上操作得到二煎。合并2次药液过滤后上锅浓缩。将放凉至室温的药液加入无菌培养皿中,平放于-20 ℃ 24 h后,转移至-80 ℃继续冷冻24 h。迅速从低温冰箱中取出培养皿,置于真空冷冻干燥机中进行干燥。当水分完全蒸发后,收集冻干粉密封保存于-20 ℃备用。
1.2.2 分组及造模、给药
收集对数生长期A549细胞,37 ℃、5%CO2培养24 h后,换成基础培养基饥饿过夜。弃基础培养基,不同组别加入不同药物。正常组:基础培养基;模型组:TGF-β1(终浓度为5 ng/mL,下同);中药组:TGF-β1+中药冻干粉溶液(终浓度为200 μg/mL);尼达尼布组:TGF-β1+尼达尼布(终浓度为3 μmol/L),作用24 h。
1.2.3 免疫荧光检测细胞中α-SMA、E-cadherin表達情况
取出指数生长期的A549细胞,消化后将细胞悬液种在激光共聚焦培养皿中。干预后,弃上清液,磷酸盐缓冲液(Phosphate-buffered Saline,PBS)清洗3次。取用预冷的4%多聚甲醛固定细胞30 min,PBS清洗3次。5%BSA封闭细胞1 h后,更换封闭液为E-钙黏附蛋白(E-cadherin)一抗,室温孵育1 h。随后PBS清洗3次。0.1%TritonX100透膜15 min,PBS清洗3次。孵育α-平滑肌肌动蛋白(α-Smooth Muscle Actin,α-SMA)一抗,室温孵育1 h,PBS清洗3次。加入TRITC荧光二抗避光孵育1 h。PBS清洗3次后加入DAPI染核,5 min后取出,PBS清洗,置于激光共聚焦显微镜下观察。利用Image J软件测算荧光密度值。
1.2.4 酶联免疫吸附试验(ELISA)检测细胞上清液中瘦素含量
样品制备同前。收集细胞上清液,离心除去不溶性杂质和细胞碎片后备用。将标准品、样品、对照(空白)孔分别置于预涂板上,记录其位置。在加入标准品、样品和对照(空白)孔之前,清洗预涂板2次。分别从0管、1管、2管、3管、4管、5管、6管及空白管中取出100 μL液体,加入标准孔中。向样品孔中加入100 μL适当稀释过的样品。37 ℃孵育90 min。弃板中液体,用洗涤缓冲液清洗2次。在标准、样品及对照(空白)孔每孔加入100 μL生物素标记抗体工作液。37 ℃孵育60 min。用洗涤缓冲液清洗孔板3次。在标准、样品及对照(空白)孔每孔加入100 μL SABC工作液,37 ℃孵育30 min。用洗涤缓冲液清洗孔板5次。在标准、样品及对照(空白)孔每孔加入90 μL TMB底物。37 ℃避光孵育10~20 min。然后每孔加入50 μL停止溶液。将孔板置于酶标仪中,波长设定为450 nm,测量OD值。再根据已知浓度的标准品OD值,绘制标准曲线,求出样品浓度。
1.2.5 Western Blotting检测细胞中LEPR、PPAR-γ、STAT3、p-STAT3表达水平
取出干预后的细胞,提取并变性蛋白样品。配制SDS-PAGE凝胶。上样后,于电泳液中电泳,电压值设定为70 V,稳压电泳30 min,直至溴酚蓝提示蛋白样品已经越过积层胶,将电压改为110 V,继续稳压电泳。随后取出凝胶,制作电转三明治,于电转液中稳流冰上电转2 h,电流值设定为200 mA。TBST中漂洗后在合适的封闭液中室温封闭1 h。随后更换目标蛋白一抗4 ℃孵育过夜。TBST清洗3次,室温孵育对应二抗1 h。TBST漂洗清除多余抗体,在避光的情况下,将充分浸泡过曝光液的PVDF膜置于发光仪中曝光,获得条带。应用Image J软件获得曝光后条带上各样品的灰度值。
1.3 统计学方法
采用SPSS 25.0统计软件进行数据分析。计量资料均数±标准差(±s)表示,符合正态分布并通过方差齐性检验,则适用单因素方差分析,反之则采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 补肾益肺消癥方对肺纤维化EMT模型α-SMA、E-cadherin表达量的影响
模型组的α-SMA含量明显高于正常组(P<0.05),而E-cadherin则相反(P<0.05),TGF-β1干预A549细胞制作EMT模型成功。中药组及尼达尼布组α-SMA表达量低于模型组(P<0.05),E-cadherin较之增高(P<0.05)。见表1,图1~2。
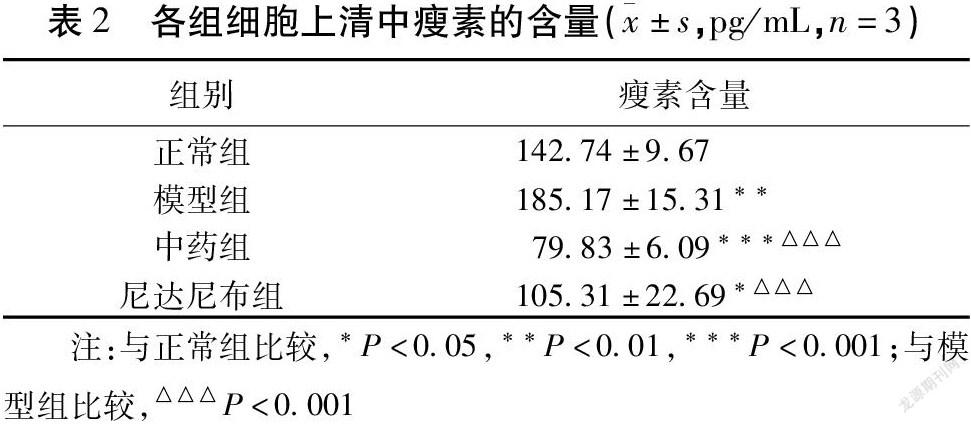
2.2 补肾益肺消癥方对肺纤维化EMT模型细胞上清中瘦素含量的影响
模型组细胞上清液瘦素含量高于正常组,差异有统计学意义(P<0.01)。中药组与模型组比较,细胞上清所含瘦素较低(P<0.01),尼达尼布组亦然(P<0.01)。补肾益肺消癥方可降低AT Ⅱ因EMT释放的瘦素水平。见表2。
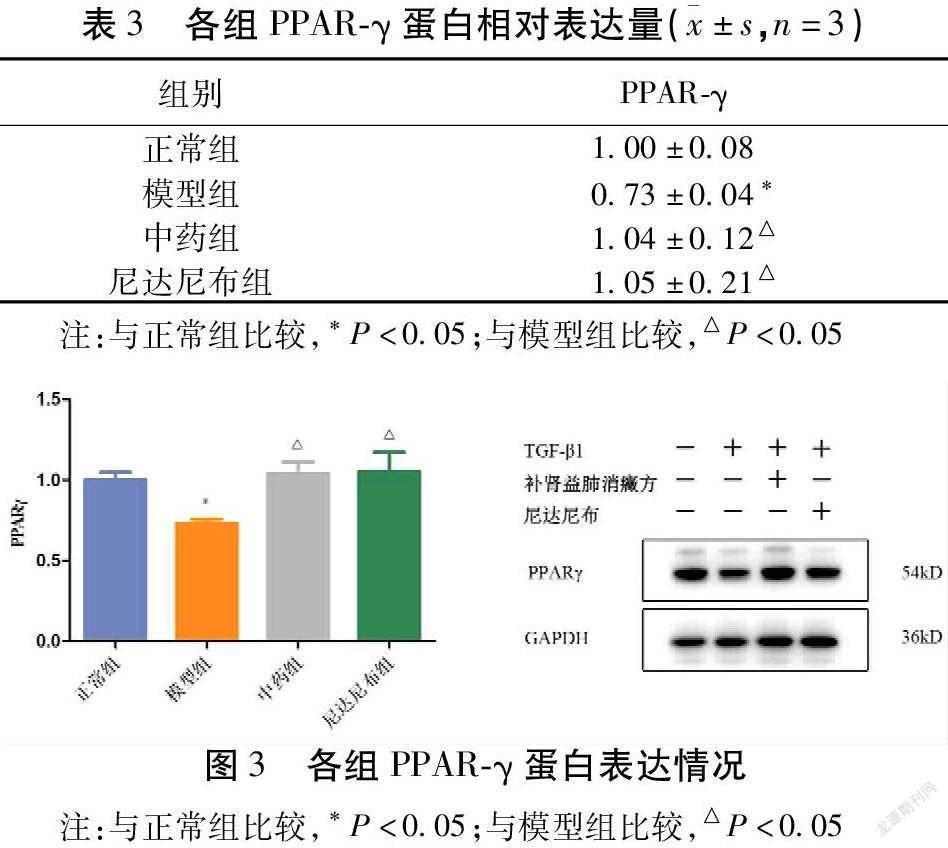
2.3 补肾益肺消癥方对肺纤维化EMT模型LEPR及PPAR-γ蛋白表达量、p-STAT3/STAT3比值的影响 模型组PPAR-γ表达水平明显低于正常组(P<0.05)。而中药组(P<0.05)、尼达尼布组(P<0.05)与模型组比较,PPAR-γ表达水平升高。见表3,图3。
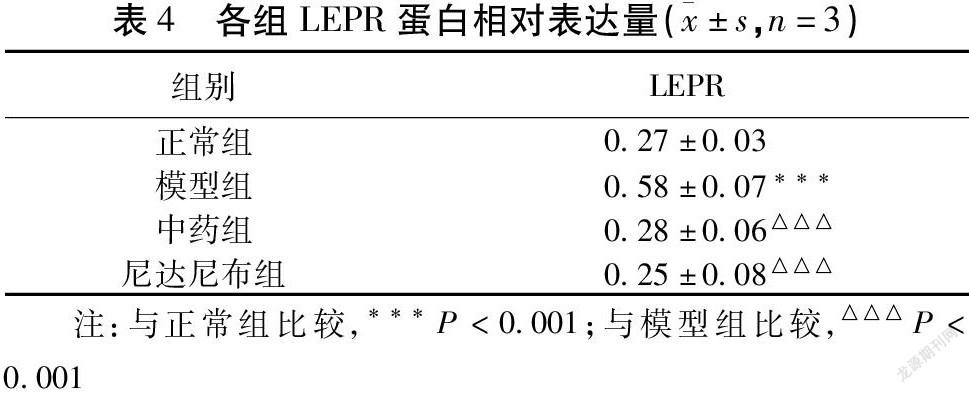
正常组LEPR蛋白相对表达量明显低于模型组(P<0.001)。与模型组比较,中药组、尼达尼布组LEPR蛋白含量有所降低,且差异有统计学意义(P<0.001)。见表4,图4。
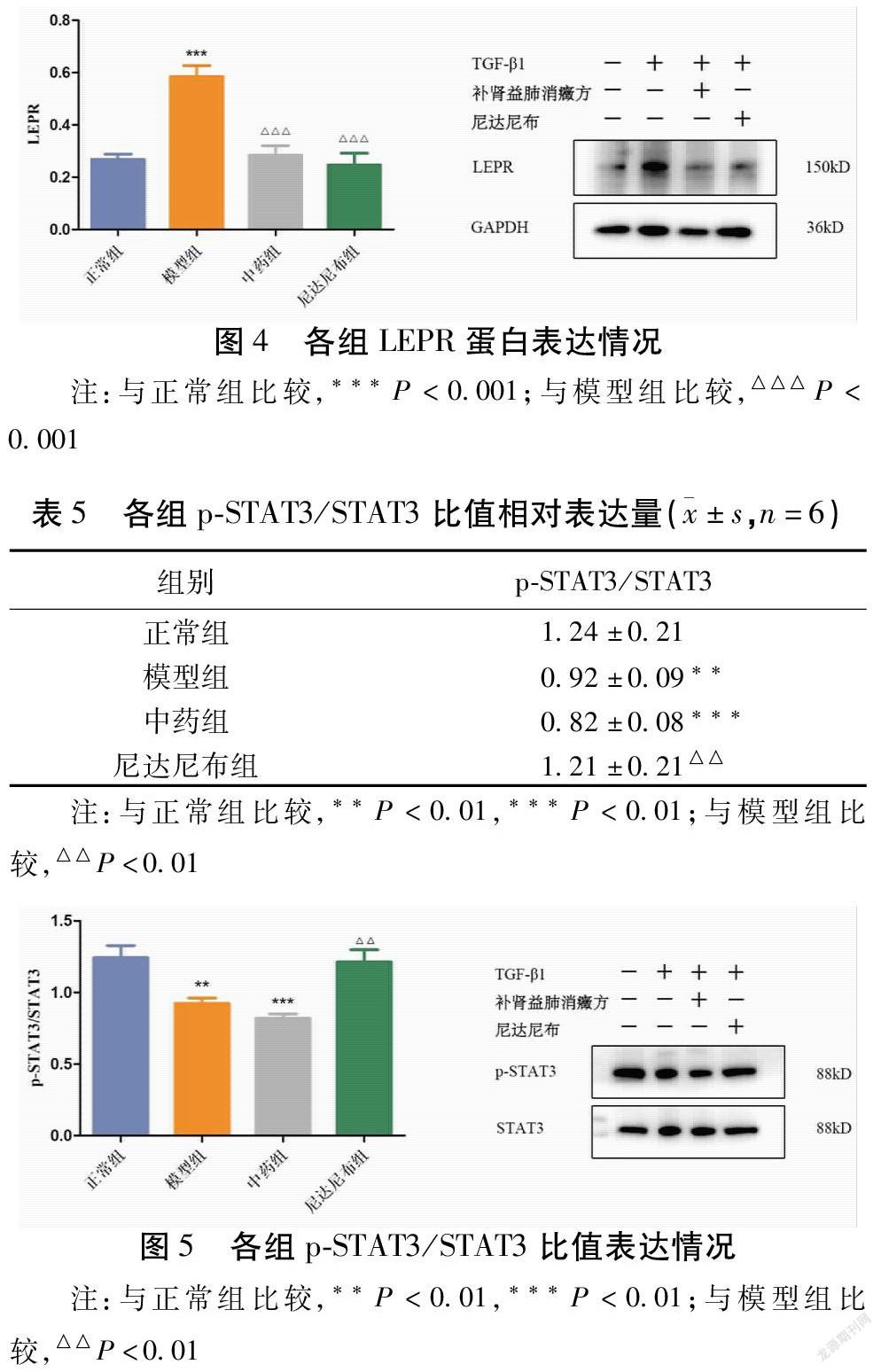
模型組p-STAT3/STAT3比值明显低于正常组(P<0.01)。而与模型组比较,尼达尼布组p-STAT3/STAT3比值较高(P<0.01),中药组p-STAT3/STAT3比值与模型组相当(P>0.05)。见表5,图5。
3 讨论
EMT是肺纤维化病理演变中的重要一环,是AT Ⅱ因各种原因引起的肺部损伤而出现细胞连接断裂(E-cadherin减少),出现间质细胞表型(α-SMA增加),进一步影响下游成纤维细胞增殖,分化为肌成纤维细胞的过程[8]。研究证实瘦素可加速EMT,以促进肺纤维化的发生发展。
晏军主任医师依据多年临床经验,基于“肺络微型癥瘕”的学说,认为肺纤维化的基本病机为肺肾两虚,痰瘀互结为癥瘕,痹阻肺络,治疗肺纤维化应以补益肺肾为本,自拟补肾益肺消癥方,包含当归、熟地黄、陈皮、法半夏、浙贝母、水蛭、炙甘草7药。该方以景岳名方“金水六君煎”为底方,当归、熟地黄为君滋阴养血,补肾培元;陈皮、半夏、浙贝母化痰止咳;水蛭、浙贝散结消癥;炙甘草培土生金,调和诸药,以奏补肾益肺、化痰消癥之功。基础实验表明“补肾益肺消癥方”可通过调控炎症[9-10]、凋亡[11-13]、自噬[14]通路以延缓肺纤维化病理学发展,从而达到治疗的目的。
瘦素作为一种参与甚至可以调节先天性及适应性免疫,自身分子结构与IL-6相似的细胞因子[15],硅沉着病大鼠肺纤维化组织中瘦素的表达明显升高,外源瘦素的添加可以增加胶原蛋白在肺组织中的沉积,瘦素与HIF-1α正相关[16]。使用博来霉素诱导小鼠肺损伤,模型组小鼠支气管灌洗液中瘦素含量高于db/db组(瘦素受体基因缺陷)。在体外实验中,瘦素可上调人肺成纤维细胞通过TGF-β介导产生的几种纤维化基因的表达,并能诱导TGF-β本身的自分泌[17]。由此可见瘦素与肺纤维化的发生发展相关。由于在肝纤维化中发现,活化的肝星状细胞可自分泌瘦素以进一步加重肝损伤及肝纤维化[18],而AT Ⅱ被证实是肺瘦素的来源之一,因此本研究用ELISA法检测细胞上清液中瘦素的含量以观察TGF-β1诱导下,A549细胞瘦素分泌情况。结果提示模型组细胞上清液瘦素明显高于正常组,可见EMT可能促进AT Ⅱ自分泌瘦素。而中药组、尼达尼布组低于模型组,表明补肾益肺消癥方及尼达尼布可抑制EMT中自分泌瘦素水平。LEPR是分布于细胞表面的瘦素受体,AT Ⅱ表面也存在它的踪影,肺瘦素通过与LEPR结合方可影响细胞功能。PPAR-γ是Smad依赖性的TGF-β通路的关键抑制剂,功效包括抑制TGF-β表达、胶原蛋白合成、成肌纤维细胞分化和EMT[17]。瘦素与PPAR-γ则在功效上相互拮抗[19]。Western Blotting检测模型组LEPR水平高于正常组,可知EMT可导致A549细胞表面LEPR表达增多,更多瘦素可与之结合产生效应;PPAR-γ水平下降,可见EMT抑制了PPAR-γ的功能,为肺瘦素进一步干预AT Ⅱ功能提供帮助。而补肾益肺消癥方可降低EMT模型中细胞表面LEPR的含量、提高PPAR-γ的表达,可能在一定程度上阻止肺瘦素加速EMT的进程。以往的研究证实瘦素于胞外与LERP结合,激活STAT3,发挥作用[20],但是结果提示与正常组比较p-STAT3/STAT3比值降低,这看起来不符合常理。然而Wang等[21]发现EMT模型中,STAT3和Smad3直接相互作用,干扰其与Smad4结合,抑制TGF-β1信号通路,敲低STAT3基因可促进TGF-β1诱导的EMT标志蛋白的表达。所以有别于癌症中针对瘦素干预肿瘤细胞EMT需要激活STAT3,TGF-β1诱导的EMT模型中STAT3反而是被抑制的。而中药组似乎与STAT3的磷酸化无关。
以往的文献研究证实瘦素可以促进肺纤维化EMT进程,而EMT对瘦素相关因子的影响尚未可知。本研究通过实验证实EMT可增加细胞表面LEPR的表达,下调与瘦素有拮抗作用的PPAR-γ的含量,减少STAT3的活化,为瘦素加速EMT提供物质基础。而补肾益肺消癥方则可能通过降低内源性肺瘦素分泌,减少LEPR,提高PPAR-γ的水平逆转此过程。
参考文献
[1]刘娜,王杰鹏,鲁辰希,等.当归补血汤对博莱霉素致肺纤维化大鼠PKD1/NF-κB/MnSOD信号通路的影响[J].中国实验方剂学杂志,2020,26(13):66-72.
[2]Triantafyllou GA,Paschou SA,Mantzoros CS.Leptin and Hormones:Energy Homeostasis[J].Endocrinol Metab Clin North Am,2016,45(3):633-645.
[3]Saxena NK,Anania FA.Adipocytokines and hepatic fibrosis[J].Trends Endocrinol Metab,2015,26(3):153-161.
[4]Buechler C,Haberl EM,Rein-Fischboeck L,et al.Adipokines in Liver Cirrhosis[J].Int J Mol Sci,2017,18(7):1392.
[5]Wolf G,Ziyadeh FN.Leptin and renal fibrosis[J].Contrib Nephrol,2006,151:175-183.
[6]Olea-Flores M,Juárez-Cruz JC,Zuiga-Eulogio MD,et al.New Actors Driving the Epithelial-Mesenchymal Transition in Cancer:The Role of Leptin[J].Biomolecules,2020,10(12):1676.
[7]Gui X,Chen H,Cai H,et al.Leptin promotes pulmonary fibrosis development by inhibiting autophagy via PI3K/Akt/mTOR pathway[J].Biochem Biophys Res Commun,2018,498(3):660-666.
[8]Jolly MK,Ward C,Eapen MS,et al.Epithelial-mesenchymal transition,a spectrum of states:Role in lung development,homeostasis,and disease[J].Dev Dyn,2018,247(3):346-358.
[9]柴立民,刘涓,王珍,等.补肾益肺消癥方干预肺纤维化大鼠TGFβ信号通路的作用机制[J].中国中医基础医学杂志,2013,19(9):1022-1024,1030.
[10]刘涓,柴立民,王珍,等.补肾益肺消癥方对肺纤维化大鼠IL-4信号通路关键分子表达的影响[J].中华中医药杂志,2013,28(2):520-522.
[11]杨颖溪,柴立民,吴甜甜,等.补肾益肺消癥方对特发性肺纤维化大鼠Caspase-12信號通路关键分子基因和蛋白表达的影响[J].北京中医药大学学报,2016,39(7):575-579.
[12]陆青兰,黄世稳,韦雪平,等.黄根多糖对大鼠矽肺纤维化的作用[J].中草药,2020,51(4):1031-1036.
[13]王丽娟,董小鹏,杜弢.当归、川芎联合应用对肺纤维化模型大鼠TGF-β1/Smad信号通路的影响[J].中成药,2021,43(6):1451-1456.
[14]张沂.基于自噬通路调控探讨补肾益肺消癥方对IPF作用机制的研究[D].北京:北京中医药大学,2020.
[15]Procaccini C,Pucino V,Mantzoros CS,et al.Leptin in autoimmune diseases[J].Metabolism,2015,64(1):92-104.
[16]裴厚霜,李永斌,范德龙,等.瘦素对矽肺大鼠肺组织纤维化的影响及与HIF-1α的相关性分析[J].细胞与分子免疫学杂志,2014,30(7):700-703.
[17]Jain M,Budinger GR,Lo A,et al.Leptin promotes fibroproliferative acute respiratory distress syndrome by inhibiting peroxisome proliferator-activated receptor-γ[J].Am J Respir Crit Care Med,2011,183(11):1490-1498.
[18]Potter JJ,Womack L,Mezey E,et al.Transdifferentiation of rat hepatic stellate cells results in leptin expression[J].Biochem Biophys Res Commun,1998,244(1):178-182.
[19]Makled MN,Sharawy MH,El-Awady MS.The dual PPAR-α/γ agonist saroglitazar ameliorates thioacetamide-induced liver fibrosis in rats through regulating leptin[J].Naunyn Schmiedebergs Arch Pharmacol,2019,392(12):1569-1576.
[20]Olea-Flores M,Juárez-Cruz JC,Mendoza-Catalán MA,et al.Signaling Pathways Induced by Leptin during Epithelial Mesenchymal Transition in Breast Cancer[J].Int J Mol Sci,2018,19(11):3493.
[21]Wang G,Yu Y,Sun C,et al.STAT3 selectively interacts with Smad3 to antagonize TGF-β signalling[J].Oncogene,2016,35(33):4388-4398.
(2021-06-08收稿 本文编辑:张雄杰)

