鸡冠刺桐花色素提取条件及黄酮成分的研究
杨志阳 熊超超 乔奇 林润瑞 叶光斌








摘 要:以鸡冠刺桐(Erythrina crista-galli)花瓣为研究材料,通过单因素及正交试验优化色素提取条件;通过超高效液相色谱串联质谱(UPLC)技术对色素粗提物的黄酮类物质组成进行相关定性、定量研究。结果表明:鸡冠刺桐花色素提取的最佳条件为:以pH为6的50%乙醇为浸提剂,在70℃中水浴60min,辅以100%(40KHz)超声功率处理40min时,色素中总黄酮(以芦丁计)的提取率最高;提取率最高可达71.2mg/g干花,比初始提取条件提高了3.34倍。鸡冠刺桐花色素内至少含有37种黄酮类化合物(相对含量低于0.1%的色素成分不计),它们分别是黄酮类(占82.16%)、黄酮醇类(占6.15%)、黄烷酮类(占6.07%)和花青素類(占3.08%),其中芹菜素衍生物类的黄酮是鸡冠刺桐花色素的主要成分,占比达到71.6%,表明鸡冠刺桐花色素有着重要的药用开发价值。
关键词:鸡冠刺桐;花色素;提取条件;超高效液相色谱串联质谱;黄酮成分
中图分类号 S681.9 文献标识码 A 文章编号 1007-7731(2022)02-0027-06
Abstract: The petals of Erythrina crista-galli were used as research materials, the pigment extract condition was optimized by single factor test and orthogonal test. The qualitative and quantitative research of components of flavonoids in the crude pigment extract were studied by ultra-high performance liquid chromatography tandem mass spectrometry (UPLC-MS-MS). The results showed that the optimum extraction condition of flower pigment of Erythrina crista-galli was as follows: the extraction rate of total flavonoids (calculated by rutin) was the highest when 50% ethanol with pH 6 was used as the extractant, water bath at 70 ℃ for 60 min and ultrasonic power at 100% (40KHz) for 40 min; The highest extraction rate was 71.2mg/g dry flower, which was 3.34 times higher than the initial extraction conditions. The results of pigment composition showed that there were at least 37 flavonoids (pigment components with relative content less than 0.1% were not calculated) in the flower pigment of Erythrina crista-galli, which were flavonoids (82.16%), flavonols (6.15%), flavanones (6.07%) and anthocyanins (3.08%). Among them, apigenin-derived flavonoids were the main component of the flower pigment, accounting for 71.6%. The results show that the flower pigment of Erythrina crista-galli have important medicinal development value.
Key words: Erythrina crista-galli; Flower pigment; extract condition; UPLC-MS-MS; Flavonoids component
1 前言
刺桐属于豆科(Leguminosae)蝶形花亚科(Papilionoideae)植物,刺桐属约有200种,多分布于热带和亚热带地区[1]。刺桐属植物不仅具有观赏性,还具有重要的药用价值[2]。国内外学者在刺桐属植物中分离得到了上百个生物碱成分[3-6],为该类生物碱的结构研究及药物开发利用提供了物质和理论基础。唐峥嵘等[7]总结了刺桐属植物的生物碱类成分在药理方面的研究,其中主要是抗焦虑,促进睡眠,抗痉挛,杀虫和抗乙酰胆碱酯酶等作用。除生物碱外,刺桐属植物还含有大量的黄酮类化合物[8-10]。
近年来,随着人们对健康生活的不断追求,植物来源天然色素的提取与应用开发研究越来越多[11-13]。广义的黄酮类化合物是指2个具有酚羟基的苯环通过中央三碳原子相互连结而成的一系列化合物,基本母核为2-苯基色原酮;黄酮类化合物结构中常连接有酚羟基、甲氧基、甲基和异戊烯基等官能团,所以根据连接位置、氧化程度、是否成环等的不同,将黄酮类化合物分为黄酮(即狭义的黄酮)、黄酮醇、异黄酮、查耳酮、黄烷酮、花青素和橙酮等七个亚类[14]。丁利君等[12]对刺桐花色素的提取条件及色素稳定性开展了相关研究。Nouran M. Fahmy等人[13]对从刺桐属植物中分离出的370多种黄酮类化合物的结构多样性和生物活性进行了研究总结,阐明了刺桐属植物的黄酮类成分,可作为治疗各种疾病的先导化合物,包括氧化应激、炎症、糖尿病和癌症等。
鸡冠刺桐(Erythrina crista-galli)原产于巴西,在中国台湾、云南(西双版纳)、广东、四川等均有栽培。花色为橙红色,花形独特,花期长,可达3个月[1],是一种良好的天然红色素。目前未见鸡冠刺桐花色素提取条件优化及花色素成分特别是黄酮类成分的相关研究。本试验选取在四川地区行道树、校园、公园等地具有广泛分布的鸡冠刺桐为研究对象,通过单因素和正交试验,优化刺桐花色素的提取条件,并结合超高效液相色谱-串联质谱(UPLC-MS/MS)技术,对其红色素提取液的组成成分进行定性和定量分析,为进一步推进珊瑚刺桐花色素的开发与利用提供参考。
2 材料与方法
2.1 试验样本及前处理方法 鸡冠刺桐花鲜花与干燥花对比如图1,a为采摘前,b为烘干前,c为烘干后。鸡冠刺桐的花瓣采集自四川轻化工大学宜宾校区校园内。根据《中国植物志》[1]的描述,尤其是通过其花瓣特征进行鉴定,确认所研究的植物为鸡冠刺桐。
刺桐花的预处理:摘取新鲜花瓣,洗净后在电热鼓风干燥箱内60℃烘干72h至花瓣恒重,再利用粉碎机将干花瓣粉碎至粉末状备用。由于不同植株、不同生理期的花瓣色素分布及含量存在差异,不用湿花瓣提取色素;预实验结果表明,花瓣在80℃下烘干,色素提取率明显下降,结合色素提取优化实验结果,在60℃以下烘干花瓣。
2.2 试剂与设备 主要试剂:盐酸、氢氧化钠、九水硝酸铝、亚硝酸钠、无水乙醇、甲醇和苯等均为分析纯,购买自成都市科隆化学品有限公司;芦丁标准品(UV≥98%),购自天津希恩思生化科技有限公司。
主要仪器:色素提取所需设备数控超声波清洗机KQ-700DE(昆山市超声仪器有限公司)、高速多功能粉碎机800Y(永康市铂欧五金制品有限公司)、电热恒温水浴锅HWS-12(上海齐欣科学仪器有限公司)、离心机5430(德国艾本德股份有限公司)、MSS全波长酶标仪(芬兰费希尔科技有限公司)、紫外可见光分光光度计UV2100(尤尼柯仪器有限公司)等,色素成分检测所需超高效液相色谱-串联质谱平台由武汉迈特维尔生物科技有限公司提供。
2.3 色素提取方法
2.3.1 色素提取得率的评估方法 早期的试验结果已经证明刺桐花色素的主要成分为黄酮[8-9],芦丁常用于检测色素中总黄酮含量,常见的芦丁有两种最大吸收波长370nm和510nm[15-17]。本试验通过芦丁标准品的标准曲线来计算色素中总黄酮的提取得率。
色素原液制备:本试验初始色素提取条件参考文献[12]的方法,具体步骤为:准确称取0.5g的干花粉末,以1/40的物料比加入20mL浸提液(0.1%HCL 50%乙醇),在60℃水浴锅中恒温浸提60min。分装到离心管中,12000r/min离心20min,吸取上清液,用微孔滤膜过滤,并保存于试样瓶中,保存备份。
最佳吸收波长確定:对芦丁溶液和刺桐花色素提取液做一定倍数的稀释(具体的稀释倍数依赖于实际检测的OD值,当OD值在0.1~1的有效范围内时,稀释倍数合理),以50%乙醇为空白对照,在370~600nm范围内进行了全波段扫描,每个浓度平行测3次。
芦丁标准品的制备及标准曲线的绘制:芦丁标准品的制备参照文献[15]的NaNO2-Al(NO3)3显色法制备,但具体的处理措施略有不同,具体制备方法如下:准确称量芦丁标准品10.0mg,50%乙醇溶解,转移至容量瓶内,用50%乙醇准确定容至25mL,得到浓度为0.4mg/mL的标准溶液。精确量取标准溶液0、0.4、0.8、1.2、2.0mL,分别置于10mL的比色管中,再分别加入2.0、1.6、1.2、0.8、0mL的50%乙醇,摇匀,再分别向各个比色管中加入5%亚硝酸钠溶液0.3mL,混匀,静置6min;再分别在比色管中加入10%硝酸铝溶液0.3mL,混匀,静置6min;再分别向比色管加入1mol/L氢氧化钠溶液4.0mL,混匀,用50%乙醇定容至刻度,混匀,静置15min。在最大吸收波长370nm处测定其吸光度,以吸光度为纵坐标,芦丁质量浓度为横坐标,绘制标准曲线,得出芦丁质量浓度x(mg/mL)与吸光度A之间的线性回归方程:A=Kx+c(截距)。
刺桐花色素总黄酮含量的测定:取1.0mL提取液至10mL具塞比色管内,按照上述芦丁标准品的方法处理色素样本。稀释合适的倍数后,在370nm处测定其吸光度,平行3组,取平均值。根据吸光度和标准曲线算出黄酮含量:W=(ρ×V1×n)/(m×1000)×100。式中:W为色素总黄酮含量,单位%;ρ为样品中黄酮的测出浓度,单位mg/mL;V1为色素提取液总体积,单位mL;n为稀释倍数;m为刺桐干花粉末的质量,单位g。
2.3.2 单因素试验 除了辅助超声处理的单因素试验以外,所有的单因素实验都是在参考文献[12]初始提取方法的基础上变更某一个变量因素。分别对浸提剂(苯、甲醇、25%乙醇、50%乙醇、75%乙醇、无水乙醇、0.1% HCL-50%乙醇、0.2% HCL-50%乙醇、蒸馏水),物料比(花粉克数/浸提液体积分别为1/30、1/40、1/50、1/60、1/70、1/80、1/90、1/100、1/110),不同pH值的50%乙醇(1、3、3.5、4、4.5、5.0、5.5、6、6.5、7、9、11、13),不同水浴温度(25℃、40℃、50℃、60℃、70℃、80℃、100℃),水浴时间(10min、20min、30min、40min、50min、60min)开展单因素试验。
丁建英等人[18]采用了超声波辅助提取线叶金雀花色素,说明超声波能够辅助提高色素提取率,故优化实验增加了超声辅助提取工艺。初始条件同前,分别用不同超声功率(50%、60%、70%、80%、90%、100%)和超声时间(20min、25min、30min、35min、40min、45min、50min、55min、60min)开展单因素试验。通过比较370nm处吸光值的大小确定刺桐花色素提取的最优条件。
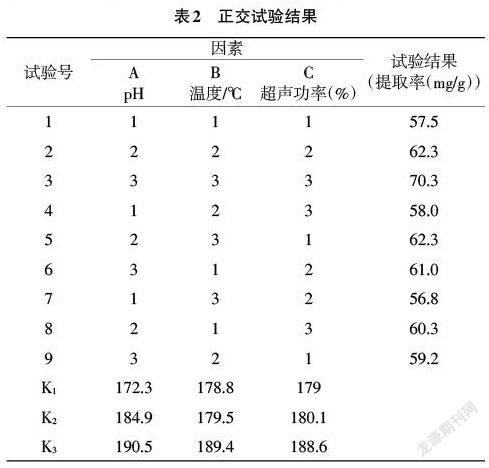
2.3.3 正交试验优化提取条件及验证 单因素试验结果表明:浸提剂pH、水浴温度和超声功率对刺桐花色素的提取影响较大,故对浸提剂pH(A)、水浴温度(B)和超声功率(C)设计了三因素三水平的正交试验(鸡冠刺桐花色素总黄酮提取因素水平表见表1,正交试验设计表见表2),以确定刺桐花色素的最优提取条件。最后通过验证试验,测量其色素提取得率。
2.3.4 花色素提取液中黄酮成分的检测分析 将鸡冠刺桐花样本送至武汉迈特维尔生物科技有限公司,利用UPLC-MS/MS技术进行色素成分分析。将实验室最优工艺提取的色素样本,真空冷冻干燥后,溶于70%的甲醇水溶液后,4℃过夜,10000g离心10min,微孔滤膜过滤于进样瓶中用UPLC-MS/MS分析。具体的检测与数据分析由武汉迈特维尔生物科技有限公司完成。
其中UPLC-MS/MS的液相条件为:色谱柱:Waters ACQUITY UPLC HSS T3 C18 1.8µm,2.1mm×100mm;流动相:A相为超纯水(0.04%的乙酸),B相为乙腈(0.04%的乙酸);洗脱梯度:0min水/乙腈(95:5V/V),11.0min为5:95V/V,12.0min为5:95V/V,12.1min为95:5V/V,15.0min为95:5V/V;流速0.4mL/min;柱温40℃;进样量2μL。
基于武汉迈维公司自建数据库MWDB(metware database)及代谢物信息公共数据库,对质谱检测数据进行定性、定量分析。
3 结果与分析
3.1 色素最大吸收波长的确定及芦丁标准品标准曲线的制备 芦丁及刺桐花红色素粗提液在370nm~600nm内的光谱扫描结果见图2,可以看出芦丁与刺桐花红色素在370nm处均有最大吸收峰,刺桐花色素和标准品芦丁的最大吸收波长一致,均为370nm,再次表明刺桐花色素内主要成分为黄酮类物质。在本次试验中芦丁的最大吸收波长与刺桐花色素提取液的最大吸收波长相同,故选择370nm作为本试验的检测波长。
芦丁标准曲线见图3,芦丁浓度(mg/mL)与吸光度A呈现良好的线性关系,标准曲线回归方程有:y=11.794x-0.0126,相关系数为:R2=0.9986,其中x为芦丁标准溶液的浓度,y为对应浓度下的吸光度。以初始方法提取的色素样品在370nm处测出平均吸光度为0.471,通过回归方程计算,得出样品内总黄酮的质量浓度为ρ=0.0410mg/mL,故总黄酮含量(以芦丁计)w(%)=(x×10×20)/0.5=16.4mg/g,即每1g刺桐干花粉末中含有16.4mg总黄酮。
3.2 单因素试验 浸提剂对刺桐花色素吸光度的影响见图4。结果表明,当以苯、甲醇、不同浓度乙醇和水作为提取剂时,50%乙醇作为提取剂时OD最高,表明其提取效果最好。由于酸度会显著影响红色素的呈现效果,比较不同HCL含量下50%乙醇浸提液的OD值,发现它们之间的存在差异,因此有必要研究pH对刺桐花色素提取效率的影响。
物料比和pH对色素提取率的影响见图5。当料液比为1∶40时吸光度最大,故选择1∶40为最优物料比。花色素提取液在碱性条件下呈绿色,且吸光值稳定。在pH值为3.5以下,OD值下降明显。提取液在酸性条件下呈黄红色,pH值为5.5时颜色最深,吸光度最大,故選择pH5.5为最优pH提取条件。
水浴温度和水浴时间对色素提取率的影响见图6。随着水浴温度的升高,吸光度逐渐提高,当温度为60℃时吸光度达到最大,当温度超过60℃后吸光度剧烈下降,故选择60℃作为最优水浴温度。水浴时间从25min到60min条件下吸光度持续增加,当水浴时间超过40min以上时,吸光值间差异不大。由于水浴60min时吸光度最高,故选择60min为最优的水浴时间。
不同超声功率及超声时间下的色素提取液在370nm处的OD检测值见图7。随着超声功率的增加,吸光度也在持续增加,超声波加快了机械振动,增大了接触面积,在功率为100%((40KHz)时吸光度最高,故选择100%为试验的最优超声功率。由于受制于设备本身功率,未能检测更高超声功率对色素提取的影响。随着超声时间的增加,吸光度呈现先增加后减小的趋势,100%功率超声处理40min时吸光度最大,故将超声处理40min作为最佳超声处理时间。
3.3 正交试验优化提取工艺及提取得率验证 单因素试验结果表明:浸提剂pH、水浴温度和超声功率对刺桐花色素的提取影响较大,故对浸提剂pH(A)、水浴温度(B)和超声功率(C)设计了3因素3水平的正交试验。正交试验结果如表2所示。根据极差的大小,可以得出在试验中影响刺桐花色素提取的因素主次为A>B>C,即pH>水浴温度>超声功率;根据k3>k2>k1,可以得出最优组合为A3B3C3。由表3的方差分析结果可知:pH、温度和超声功率这3个因素各水平之间没有显著性差异。原因可能在于选择正交因素水平时,这些条件本身已接近最优条件,所以差异不明显。故本试验的色素提取最佳工艺为:以pH为6的50%乙醇为浸提剂,在70℃下水浴60min,再辅以100%(40KHz)超声功率处理40min。
根据上述正交试验得出的最优条件进行验证,得出刺桐花色素的提取率为71.2mg/g干花,相较于初始提取条件下的色素提取率16.2mg/g提高了3.43倍。黄琼等[16]使用优化后的桑葚叶黄酮提取工艺,得到的黄酮提取得率为50.2mg/g。本试验结果比上述试验结果还要高41.8%,说明鸡冠刺桐花色素含有较高的黄酮成分。
3.4 鸡冠刺桐花色素成分 基于UPLC-MS/MS检测得到的鸡冠刺桐花色素中黄酮类物质成分信息见表4,相对含量低于0.1%的物质未参与统计。结果表明鸡冠刺桐花色素提取液内含有37种黄酮类化合物,其中主体成分为黄酮(狭义的黄酮),占到了82.16%,其余依次为黄酮醇(占6.15%)、黄烷酮(占6.07%)、花青素(占3.08%)和异黄酮类(占0.56%)等。将原始数据与https://pubchem.ncbi.nlm.nih.gov/数据库进行比对后发现,黄酮中有多达12个物质是芹菜素衍生物,占比达到71.6%。其中有7类芹菜素衍生物相对含量较高,按从高到低的排序,主要包括异夏佛塔苷(Isoschaftoside),占14.47%;夏佛塔苷(Schaftoside),占13.41%,维采宁-3(Vicenin-3),占10.90%;异牧荆素(Isovitexin),占9.75%;芹菜素C-己糖基C-戊糖苷(C-hexosyl-C-pentoside Apigenin),占9.22%;芹菜素C-葡萄糖苷(C-glucoside Apigenin),占7.14%;芹菜素-6,8-二-C-葡萄糖苷(6,8-di-C-glucoside Apigenine),占6.71%。鸡冠刺桐花色素中为何含有如此高比例的芹菜素类衍生物有待更进一步的研究。
芹菜素在自然界广泛分布,主要存在于瑞香科、马鞭草科、卷柏科以及温、热带蔬菜和水果中[19]。芹菜素及其衍生物有多种药理作用,包括抗炎、抗痉挛、抗细菌感染、治疗皮肤疾病、抗肿瘤侵袭和转移、保护肝功能、预防骨质疏松、防辐射损伤、抗动脉硬化和脑血栓、降压和镇静抗焦虑等[20-21]。广金钱草内存在大量互为同分异构体的夏佛塔苷和异夏佛塔苷,它们有抗炎、清热祛湿、利尿通淋的活性[22-23];梁枫等[24]证明异夏佛塔苷具有明显的抗肿瘤活性;Gomes A等[25]的研究证明异夏佛塔苷可以保肝护肝和治疗高血压。三角草和小叶榕都含有大量的异牧荆素[26,27];Choo C Y等[28]证明口服少量的异牧荆素能够降低糖尿病的发病几率;Lin C M等[29]发现异牧荆素具有抗氧化性。Aseervatham G等[30]认为芹菜素C-葡萄糖苷能够抗癫痫和保护神经;Tomasz M. Karpiński等[31]发现芹菜素C-葡萄糖苷能抑制细菌,且结构相似的芹菜素苷元的抗菌活性差异不大。这些黄酮化合物在鸡冠刺桐花色素提取液中含量丰富,进一步说明鸡冠刺桐具有潜在的药用开发价值。
4 结论
本研究通过全波段扫描发现,鸡冠刺桐花色素提取液的最大吸收波长为370nm。通过对浸提剂种类、物料比、pH、水浴温度、水浴时间、超声功率和超声时间等条件的优化,得出了最佳提取条件:以pH为6的50%乙醇为浸提液,物料比为1/40,在70℃水浴60min,辅以100%超声功率超声40min。此时的黄酮提取得率达到71.2mg/g干花(以芦丁计),较初始条件提高了3.43倍。通过UPLC-MS/MS技术对鸡冠刺桐花色素提取液中的黄酮类物质组成分析,检测出至少37种黄酮类化合物的存在,其中71.6%的黄酮类化合物是芹菜素类衍生物。因此,对于鸡冠刺桐的花色素内芹菜素及其衍生物值得進一步的研究与开发。
参考文献
[1]李树刚.中国植物志41(0)[M].北京:科学出版社,1995.
[2]李晓莉,王乃利,姚新生.刺桐化学成分的研究[J]. 中草药,2005,36(07):975-978.
[3]Zhao HE,Wu J,Xu FQ,et al. Alkaloids from flowers of Erythrina Corallodendron[J].Natural Product Research,2019,33(9):1298-1303.
[4]Fahmy NM,Al-Sayed E,El-Shazly M,et al. Alkaloids of genus Erythrina:An updated review[J].Natural Product Research,2019,33(1):1-22.
[5]Rambo DF,Biegelmeyer R,Toson NSB,et al. The genus Erythrina L. A review on its alkaloids,preclinical,and clinical studies[J].Phytotherapy Research,2019,33(5):1258-1276.
[6]Haston E. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants:APG IV.2019.
[7]唐峥嵘,王利勤,叶广达.刺桐属植物的生物碱成分及其药理作用研究进展[J].广州化工,2012,40(2):43-46.
[8]李晓莉,王乃利,姚新生.刺桐化学成分的研究[J].中草药,2005,36(7):975-978.
[9]丁雯倩,史国茹,庾石山.龙牙花根中化学成分的研究[J].中国中药杂志,2019,44 (14):3064-3069.
[10]Tanaka H,Hirata M,Etoh H,et al. Eryvarins F and G,Two 3-phenoxychromones from the Roots of Erythrina variegata[J],Phytochemistry,2003,62(8):1243-1236.
[11]张长贵,董加宝,王祯旭.原花色素及其开发应用[J].食品与发酵科技,2006:042(001),8-12.
[12]丁利君,纪东阳.刺桐花红色素的稳定性研究[J].广州食品工业科技,1999,15(3):22-25.
[13]Fahmy N M,Al-Sayed E,El-Shazly M,et al. Comprehensive review on flavonoids biological activities of Erythrina plant species[J]. Industrial Crops and Products,2018,123:500-538.
[14]Romagnolo D F,Selmin O I. Flavonoids and Cancer Prevention:A Review of the Evidence[J]. Journal of Nutrition for the Elderly,2012,31(3):206-238.
[15]黎彧,邝守敏,叶勇,等.紫外光分光光度法测定食品包装纸用天然色素虎杖黄酮含量的研究[J].包装工程,2006,27(2):23-24.
[16]黄琼.桑葚叶黄酮类化合物提取工艺的优化[J].食品研究与开发,2016,37(7):82.
[17]孟永海,马智超,佟颖,等.正交试验法优化刺玫果总黄酮提取工艺[J].化学工程师,2019,44(1):17-18.
[18]丁建英,朱颖越,毛广进,等.线叶金雀花色素的超声辅助提取工艺研究[J].食品研究与开发,2021,42(18):49-55.
[19]孙斌,瞿伟菁,张晓玲.芹菜素的药理作用研究进展[J].中药材,2004(07):531-534.
[20]付海洋,姜良勇,齐亚军,等.芹菜素药理作用的研究进展[J].国际药学研究杂志,2020,47(10):787-792+797.
[21]邢志华.芹菜素及其衍生物药理作用研究新进展[J].中国药学杂志,2018,53(15):1241-1247.
[22]蒲晓辉,赵辉,袁琦,等.RP-HPLC法同时测定广金钱草中夏佛塔苷和异夏佛塔苷[J].中成药,2014,036(009):1909-1912.
[23]李锐.广金钱草化学成分及分析方法的研究进展[J].中国药业,2009,18(16):86-87.
[24]梁枫,于丽丽,汪荣斌,等.异夏佛塔苷对人非小细胞肺癌A549细胞抗肿瘤的活性及其作用机制[J].牡丹江医学院學报,2019,40(06):33-36.
[25]Gomes A C C,Sampaio L D S,Paulo André da Silva,et al. In vitro effect of isoschaftoside isolated from Syngonium podophyllum on pig kidney Na+,K+-ATPase[J]. Química Nova,2014,37(10).
[26]陈冠,王蕾,王宏,等.HPLC法同时测定三角草中黄酮类成分异荭草苷和异牡荆素的含量[J].海峡药学,2021,33(09):27-29.
[27]韦建乔.高效液相色谱法测定咳特灵片中牡荆素含量[J].中国药业,2016,25(05):57-59.
[28]Choo C Y,Sulong N Y,F Man,et al. Vitexin and isovitexin from the Leaves of Ficus deltoidea with in-vivo α-glucosidase inhibition[J]. Journal of Ethnopharmacology,2012,142(3).
[29]Lin C M,Chen C T,Lee H H,et al. Prevention of Cellular ROS Damage by Isovitexin and Related Flavonoids[J]. Planta Medica,2002,68(4):365-367.
[30]Aseervatham G S B,Suryakala U,Doulethunisha,et al. Expression pattern of NMDA receptors reveals antiepileptic potential of apigenin 8-C-glucoside and chlorogenic acid in pilocarpine induced epileptic mice[J]. Biomedicine & Pharmacotherapy,2016,82:54-64.
[31]Tomasz M. Karpiński,A. Adamczak,and M. Oarowski. “Antibacterial activity of apigenin,luteolin,and their C-glucosides.”5th International Electronic Conference on Medicinal Chemistry 2019.
(责编:王慧晴)

