基于数据库挖掘探究JAK3在头颈鳞状细胞癌中的预后评估价值
王珍珍,沈毅,郝文娟,黄钧涛,成立新
头颈鳞状细胞癌(HNSCC)是一类发生在头颈部的恶性肿瘤,为发病率前十的恶性肿瘤之一,其预后较差且患者的5年生存率低于50%。传统HNSCC的治疗方法主要为手术治疗结合放化疗,早期HNSCC患者治疗效果尚可,晚期且伴有远处转移者,治疗效果却不太理想[1-2]。有研究发现以PD-1、PD-L1及CTLA4等免疫检查点抑制剂为主的免疫治疗对于肿瘤具有较好的效果[3]。然而,由于肿瘤免疫微环境的不同,部分患者对免疫治疗无反应[4]。Janus激酶3(JAK3)是非受体酪氨酸激酶JAK家族成员之一[5],在肿瘤的侵袭和迁移过程中起到一定作用[6],已有研究发现JAK3磷酸化后参与前列腺癌和乳腺癌的发生发展[7]。因此,本研究拟通过生物信息学方法分析JAK3在HNSCC中的表达和预后评估中的价值,现报道如下。
1 资料与方法
1.1 HNSCC相关数据的获取 从美国国家癌症研究所(NCI)和国家人类基因组研究所(NHGRI)合作建立的TCGA数据库中下载HNSCC相关基因数据集(TCGA-HNSC),总计504例肿瘤样本及44例正常癌旁组织样本,包括其相关临床数据(生存时间、生存状态、临床病理分型及人口学资料)。
1.2 方法
1.2.1 JAK3基因表达与临床相关性分析 使用TIMER 2.0数据库(http://timer.cistrome.org)分析JAK3基因在不同肿瘤中的情况。对TCGA数据库中TCGA-HNSC队列的504例肿瘤样本及44例正常癌旁组织样本进行差异分析,分析JAK3的表达差异。根据JAK3表达量的中位值,将TCGA-HNSC队列的肿瘤样本分为高表达组和低表达组,分析高低组间的临床症状差异,并绘制热图。采用Survival和Survminer R软件包进行Kaplan-Meier分析,评估JAK3高低表达组总体预后及无进展生存期的差异。
1.2.2 基因共表达及生物功能分析 使用“limma”等R软件包对肿瘤样本行基因公表达分析,使用Pearson相关性检验筛选共表达基因,筛选标准为|Person R|≥0.4<0.001,分别选取相关系数最大的前5个正/负共表达基因,绘制共表达热图,并绘制相关性关系图。使用GSEA算法,通过它们在GO和KEGG集合中的富集(h.all.v.7.4.symbols.gmt)来识别并揭示HNSCC患者JAK3高/低表达组中信号通路的差异,分析确定JAK3参与的生物学过程及功能。
1.2.3 免疫微环境分析 通过CIBERSORT算法对肿瘤免疫细胞浸润情况进行量化,测定免疫细胞浸润与JAK3表达的关系,分析JAK3基因与免疫检查点基因表达量的相关性,使用Estimate包对肿瘤样本免疫微环境打分,并分析其在不同表达组中的差异。分析JAK3基因表达量与免疫检查点基因表达的相关性。
1.2.4 免疫治疗及化疗疗效预测 通过分析TCIA数据库中的数据评估JAK3高/低表达组中的PD-1、CTLA4疗效差异。使用pRRophetic包计算4种HNSCC常用化疗药(顺铂、紫杉醇、多西他赛、吉西他滨)的药物半抑制浓度(IC50),评估不同表达组对化疗药物的药物敏感性。
1.3 统计方法 采用R软件进行数据分析,分类变量和连续变量分析采用2检验和Wilcoxon符号秩检验;采用Pearson相关分析基因表达量间的相关性,采用Spearman检验评估基因表达量与其他特征值的相关性。<0.05表示差异有统计学意义。
2 结果
2.1 JAK3的表达情况 相较于正常组织样本,JAK3在HNSCC中存在高表达,且差异有统计学意义(均<0.05),见封二彩图1。

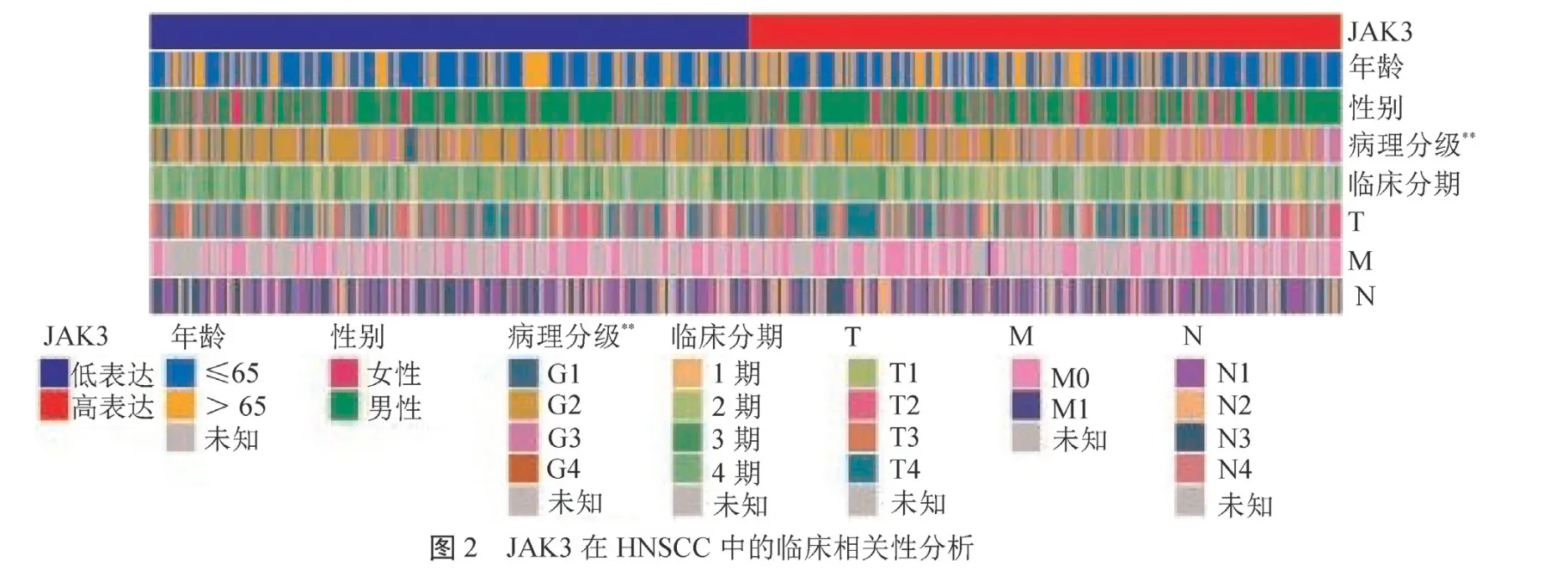
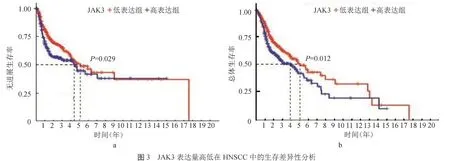
2.2 JAK3表达量高低的临床相关性及预后分析JAK3表达量在年龄、性别、临床分期、淋巴结转移及远处转移中差异均无统计学意义(均>0.05),与肿瘤细胞的病理分级呈正相关(<0.05)(封二彩图2)。分析JAK3的表达高低与HNSCC患者中总体生存期(OS)和无进展生存期(PFS)的关系,显示JAK3高表达组的OS和PFS均高于JAK3低表达组(均<0.05),见封二彩图3。
2.3 JAK3的共表达基因 通过TCGA-HNSC队列基因矩阵进行分析,检索出JAK3的共表达基因,其中正相关性及负相关性较大的共11个基因,有涉及免疫系统中淋巴细胞的CD6、LCK等相关基因,JAK3表达量高低与SPOCK2、CORO1A、ZAP7O、LCK、CD6、RASAL3的相关性系数分别为0.79、0.79、0.79、0.78、0.77和0.78。
2.4 JAK3参与的生物学过程及功能 利用GSEA算法提示JAK3高表达的HNSCC组织中体液免疫的功能较为活跃,包括细胞因子受体相互作用,参与B细胞的活化和B细胞介导的免疫。在研究的前5条通路中,与JAK3高表达量相关的通路有3条,主要包括原发性免疫缺陷通路、细胞因子受体相互作用通路和IgA介导的肠道免疫系统通路。
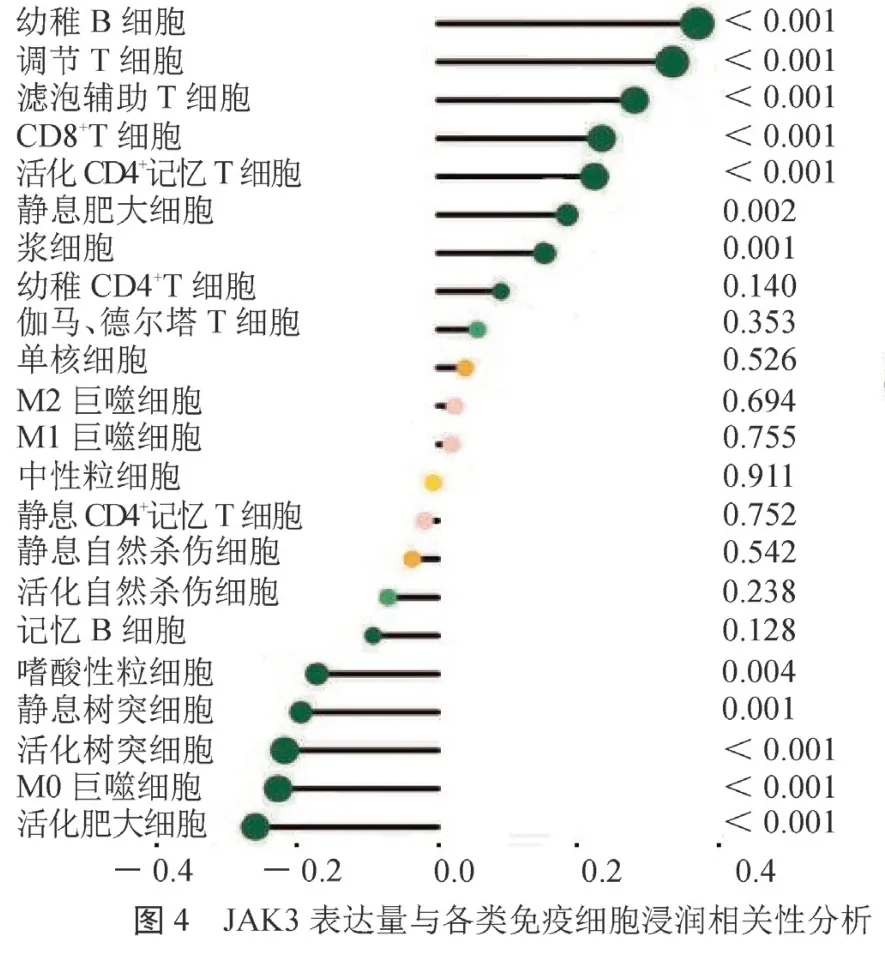
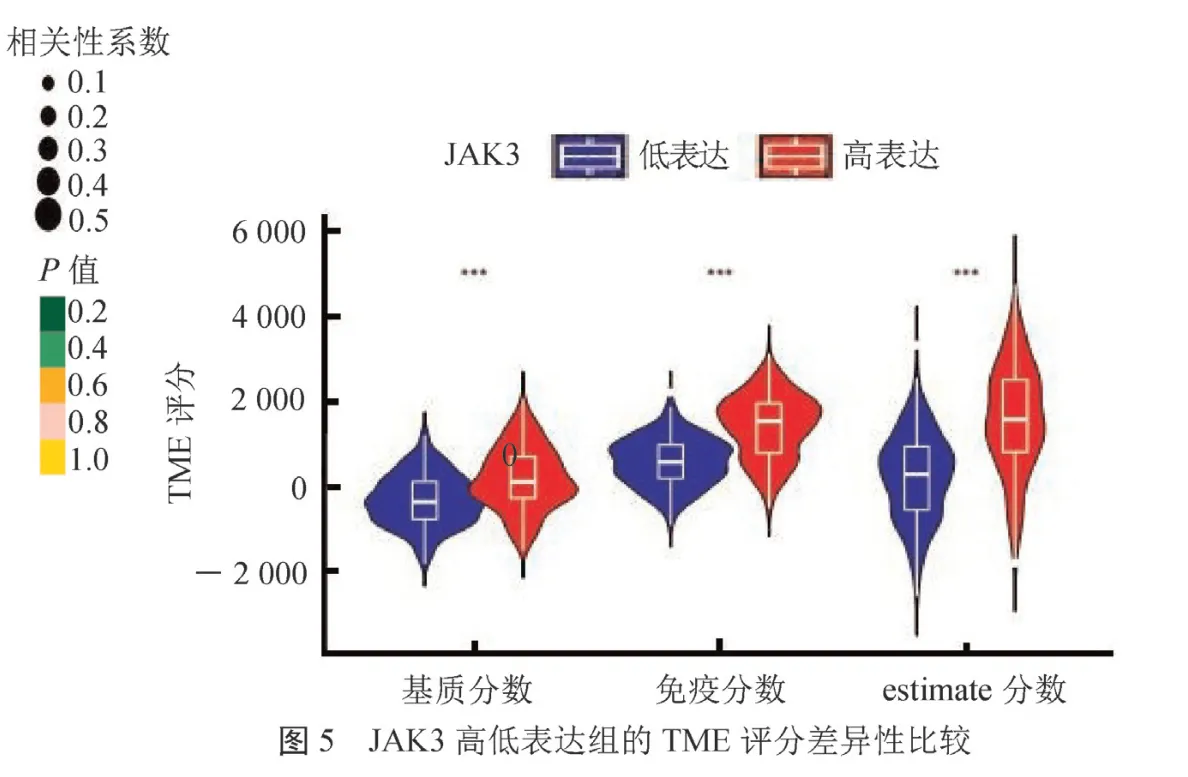
2.5 JAK3与肿瘤免疫微环境的相关性 通过CIBERSORT对肿瘤微环境中的免疫细胞浸润情况进行量化评估,显示高表达组中调节性T细胞、CD8+T细胞、初始B细胞浸润显著增加,相关性分析显示JAK3表达量与其呈正相关;JAK3低表达组中巨噬细胞M0、活化的肥大细胞、活化的树突细胞浸润增加,相关性分析显示这些细胞的浸润与JAK3的表达呈负相关(封二彩图4)。用ESTIMATE对免疫微环境进行打分,JAK3高表达组的TME评分均高于低表达组,差异有统计学意义(封二彩图5)。JAK3表达量与PDCD1、CTLA4、LAG3等基因的表达呈正相关(=0.68、0.65、0.59,均<0.05)。
2.6 JAK3表达量与免疫治疗的疗效分析及化疗药物敏感性比较 选取两个免疫治疗检查点PD-1抑制剂、CTLA4抑制剂与JAK3表达量进行分析,发现单用PD-1抑制剂治疗,高表达组的IPS得分更高(<0.05)。单用CTLA4抑制剂治疗,两组IPS得分差异无统计学意义(>0.05)。联合两种免疫治疗,高表达组得分高于低表达组(<0.05)。单用PD-1抑制剂,或者PD-I抑制剂联合CTLA4抑制剂治疗在JAK3高表达组的疗效优于低表达组(封三彩图1)。4种化疗药物中,多西他赛的敏感性在JAK3高低表达组中无明显差异,顺铂、吉西他滨、紫杉醇药物敏感性均与JAK3表达量高低存在相关性,低表达组对顺铂更敏感,高表达组对吉西他滨和紫杉醇更敏感(封三彩图2)。
3 讨论
HNSCC为一种发病率高且预后较差的肿瘤,目前尚缺乏高效、准确的方法来预测患者的预后;因此,仍需进一步探究并构建新的预测模型。JAK激酶属于细胞内酪氨酸激酶家族,通过作用于JAK-STAT信号通路,加速肿瘤细胞的增殖,从而加快肿瘤进展,其中JAK3是JAK家族中唯一与细胞因子受体c链相关联的家族成员,近来在各类肿瘤中都有发现和研究[8-9]。因此,本研究分析JAK3基因的表达与HNSCC的预后、免疫微环境及免疫治疗疗效的相关性。通过TIMER2数据库下载的数据分析可以发现,JAK3在绝大多数肿瘤中均有不同程度的表达,在包括HNSCC等肿瘤组织中的表达量明显高于正常组织。生存分析表明,JAK3高表达组的NHSCC患者中OS和PFS均明显高于JAK3低表达组,这也表明JAK3是潜在的保护性基因,高表达有助于延长患者生存时间,可作为一种预测NHSCC患者预后的有效手段。此外,有研究表明HPV感染与NHSCC,尤其是口腔、口咽部鳞癌的发生率密切相关,且在一定程度上影响其预后[10]。
本研究通过TCGA-HNSC队列基因矩阵分析检索出11个与JAK3相关性较大的共表达基因,如SPOCK2、CORO1A、ZAP7O、LCK、CD8、RASAL3等,其中正相关性基因6个,负相关性基因5个基因。LCK基因产物一般存在于成熟的静止期T细胞,通过促进底物分子上酪氨酸残基的磷酸化而对T细胞激活信号的传导过程产生调节效应[11]。CD8通过辅助T细胞受体识别抗原从而参与T细胞活化信号的转导,活化的T细胞进而分化为能够特异性杀伤靶细胞的细胞毒性T细胞[12-13]。JAK3与这些参与免疫系统中淋巴细胞活化的基因表达呈正相关,一定程度上也意味着JAK3高表达的组织中其细胞免疫活性较高。在JAK3的生物学功能的探索中,本研究利用GSEA算法,结果发现JAK3参与B细胞的活化,通过细胞因子相互作用,经过B细胞受体通路、抗原受体介导的信号通路,促使组织中体液免疫的功能达到活跃状态。
肿瘤微环境近来受到国内外学者的广泛关注,肿瘤细胞与其微环境的相互作用影响着肿瘤的侵袭性和相关治疗抵抗性。在肿瘤微环境中存在大量淋巴细胞浸润,主要包括T淋巴细胞、巨噬细胞和树突状细胞等,这些免疫细胞影响着肿瘤的生长、侵袭和转移[14]。有研究表明CD8+T淋巴细胞是T淋巴细胞的主要组成细胞,主要与MHC-I相结合,靶向作用于穿孔素和颗粒酶,从而裂解肿瘤细胞,是人体内抗肿瘤功能最强的免疫细胞[15]。有研究发现CD8+T淋巴细胞高度浸润的HNSCC患者中,其预后相对较好[16-17]。本研究通过CIBERSORT对NHSCC患者肿瘤微环境中的免疫细胞浸润情况进行量化评估,发现与JAK3低表达组相比,高表达组中CD8+T细胞浸润显著增加,这也说明JAK3高表达者其相关抗癌类免疫细胞增加。采用ESTIMATE对免疫微环境进行打分,JAK3高表达组的TME评分均高于低表达组,这也表示JAK3高表达患者免疫活性强,暗示JAK3高表达组对免疫治疗反应性更高。
免疫细胞的表面存在着大量的共抑制性和共刺激性信号分子,其中共抑制性信号分子包括PD-1、PD-L1、CTLA4和LAG3[18]。PD-1免疫检查点抑制剂作为一种常见的免疫抑制剂被广泛用于各种实体肿瘤的研究及治疗中。另一种共抑制性信号分子CTLA4,通过与其特定的配体B7分子结合后,可降低T细胞的反应性,参与免疫反应的负调节作用,目前CTLA4抑制剂主要作为联合疗法进行研究[19-20]。本研究结果发现与单用CTLA4抑制剂相比,单用PD-1抑制剂治疗或者PD-I抑制剂联合CTLA4抑制剂治疗,JAK3高表达组的疗效优于低表达组。这也说明了JAK3高表达的NHSCC患者对PD-1抑制剂治疗效果好。HNSCC患者的治疗一般以手术、放疗、化疗及免疫治疗等多种方法结合进行,本研究结果发现多西他赛的敏感性在JAK3高低表达组中无明显差异,顺铂、吉西他滨及紫杉醇药物敏感性均与JAK3表达量高低存在相关性,低表达组对顺铂更敏感,高表达组对吉西他滨、紫杉醇更敏感。故JAK3高表达的NHSCC患者可考虑选用吉西他滨、紫杉醇,JAK3低表达者可考虑选用顺铂。

