二甲双胍对犬精液冷冻保存效果的影响
潘彩霞
(中国刑事警察学院警犬技术学院,辽宁沈阳 110000)
近年来,伴随着宠物犬行业兴起,犬人工授精技术发挥越来越重要的作用,而犬精液保存技术大大提高了人工授精技术的效率。与精液常温和低温保存技术相比,精液冷冻保存技术不仅能将精液长期保存,还能实现优良的公犬精液长距离运输,提高公犬生产性能,加快品种改良,提高犬精液冷冻保存技术对犬业发展意义重大。
尽管精液冷冻保存技术越来越普及,但解冻后的犬精液的授精效果仍不稳定,主要原因是正常情况下精液自身具有完善的抗氧化系统,但经过冷冻处理精液的抗氧化平衡被打破,解冻后的精子细胞内存在高浓度的活性氧(ROS),会与精子质膜发生脂质过氧化反应,降低精子的运动性能及受精能力,甚至导致精子死亡。除此之外,相比于牛、羊等动物的精子,犬精子细胞膜中的胆固醇∶卵磷脂比例更高,更多的不饱和脂肪酸会使精子对脂质过氧化反应更加敏感,抗冻能力更差。
为减少精液冷冻保存过程中的过氧化损伤,在精液稀释液中加入适量的抗氧化物质可以提高精子的总抗氧化能力。二甲双胍是一种已被广泛应用的II型糖尿病以及糖代谢综合征的有效口服双胍类抗高血糖药。最新研究显示,二甲双胍在抗氧化性方面同样具有显著效果,其作用机理普遍认为是通过促进细胞内相关抗氧化酶的表达而产生作用。在小鼠精液冷冻保存中,二甲双胍可以提高精子的体外受精率,减少异常受精卵数量。也有研究显示,在同羊精液冷冻保存稀释液中添加二甲双胍可以降低精子在冷冻保存过程中的氧化损伤,提高冷冻-解冻后精液品质。然而,目前关于二甲双胍对犬精液冷冻保存效果的影响尚不清楚。本试验尝试用含有一定比例二甲双胍的稀释液冷冻保存犬精液,分析二甲双胍对冷冻-解冻后犬精液品质的影响,以期为二甲双胍在犬精液冷冻保存技术中的应用提供技术支持。由于在不同类型细胞中用于限制线粒体呼吸链复合体的二甲双胍浓度一般<100 µmol/L,且在接受治疗的糖尿病患者体内二甲双胍含量检测值一般为40~70 µmol/L。因此本研究选择0~100 µmol/L的二甲双胍浓度开展试验,确保在获取最佳添加浓度的同时,减少可能对生殖细胞造成的副作用。
1 材料与方法
1.1 实验材料 选择相貌体型好、3~5岁、有过配种经验的优秀德国牧羊犬种公犬5头,由公安部沈阳警犬基地提供。采精前后保证其正常日粮供应及饮水。Tris、柠檬酸、葡萄糖、二甲双胍、各类检测试剂盒等均购自于生工生物工程(上海)股份有限公司。
1.2 实验方法
1.2.1 精液采集与处理 采用手握按摩法对犬进行精液采集,并收集富含精子段精液。精液量3~5 mL,最低精子密度1.0×10个/mL,精子活力在85%以上才能用于冷冻保存。Tris-卵黄稀释液配制:Tris 2.4 g,柠檬酸1.4 g,葡萄糖 0.8 g,链霉素 0.1 g,青霉素 0.06 g(0.3 mL双蒸水中),甘油 7 mL,卵黄 20 mL,用双蒸水定容至100 mL。将每次采集的精液混合均匀以消除个体差异。将精液平均分为4等份,在37℃下700 r/min离心10 min,去除上层精清,然后分别加入含有不同浓度(0、25、50、100 µmol/L)二甲双胍的Tris-卵黄稀释液,调整精液密度至1.0×10个/mL,其中0 µmol/L为对照组。
1.2.2 冷冻与解冻 用自动化细管灌装机将稀释后的精液灌注到0.5 mL精液细管中并封口,在4℃冰箱内平衡2 h。将平衡好的细管精液置于距液氮面4 cm处,盖盖熏蒸10 min后,直接投入液氮中。解冻时,将细管精液取出,迅速投入37℃水浴锅中,轻轻晃动30 s,使精液快速溶解。擦拭干净细管表面水分,剪去细管两端,把精液倒入离心管中,进行精液品质检测。
1.2.3 冷冻-解冻后精子活力的测定 用移液枪取10 μL精液放在经37℃恒温载物台预热过的载玻片上,盖上盖玻片置于400倍相差显微镜下观察,相差显微镜配备北昂医学图像软件(BEION V4.20),对精子活力进行分析计算。每次随机选择5个视野,每个视野中精子数在200以上。
1.2.4 冷冻-解冻后精子质膜完整率的测定 采用SYBR-14/PI双荧光染色法对精子质膜完整率进行检测。SYBR-14是膜通透的核酸染料,能快速穿过细胞膜,进入活精子后与核酸结合发绿色荧光,而PI是一种膜不通透的核酸染料,它只能与死精子的核酸结合而发出红色荧光。取解冻后精液100 μL置于离心管中,加入0.1 μL SYBR-14工作液混合均匀后置于37℃恒温水浴锅孵育10 min。然后再加入0.5 μL的PI工作液,混合均匀后置于37℃水浴锅孵育10 min。孵育结束后置于荧光显微镜下检测。绿色荧光表示精子头部质膜完整,红色荧光残缺或无荧光表示精子头部质膜受损。
1.2.5 冷冻-解冻后精子顶体完整率的测定 采用异硫氰酸酯荧光素标记的花生凝集素(FITC-PNA)染色法检测。取精液50 μL均匀涂抹于载玻片,自然风干。风干后使用无水甲醇固定10 min并风干。取30 μL FITCPNA染液覆盖样品,置于37℃避光孵育30 min。孵育结束后用PBS冲洗2~3次,自然风干,无色指甲油封片后置于荧光显微镜下观察。
1.2.6 冷冻-解冻后精液中ROS、MDA含量的测定 使用ROS和丙二醛(MDA)试剂盒分别检测解冻后精液中的ROS和MDA含量。
1.2.7 冷冻-解冻后精子ATP含量测定 采用ATP检测试剂盒对精子ATP含量进行测定。检测原理是ATP能够为萤火虫荧光素酶(Firefly Luciferase)催化荧光素产生荧光提供能量。在萤火虫荧光素酶和荧光素都过量的条件下,一定的浓度范围内ATP浓度与体系中产生荧光的强度具有线性关系,因此反应后可通过荧光酶标仪读取检测体系的荧光强度,进一步计算体系中ATP含量。
1.2.8 冷冻-解冻后精子内线粒体膜电位(MMP)测定 采用线粒体膜电位检测试剂盒(荧光探针JC-1)对精子内线粒体膜电位进行检测。JC-1是一种能够在线粒体内聚集的新型阳离子羰花青荧光染料,具有较高的膜通透性,能够通过精子的质膜与线粒体外膜而与线粒体内膜特异性结合。当线粒体内膜内外两侧电位差较大时,JC-1会发生聚集,形成聚合体而发出红色荧光,当细胞开始凋亡,细胞中的线粒体膜电位开始降低,内外两侧电位差较小时,JC-1无法聚集而发出绿色荧光。使用荧光酶标仪对精子内线粒体膜电位状态进行检测,JC-1的单体与聚合体的激发与发射波长分别为490 nm/530 nm与525 nm/590 nm。
1.3 统计分析 试验结果用平均值±标准差表示。采用SPSS 19.0软件对试验数据进行单因素方差分析(LSD),<0.05表示差异显著。
2 结果
2.1 二甲双胍对精子冷冻-解冻后活力的影响 由表1可知,解冻后对照组的精子活力低于其他各组(<0.05),50 µmol/L二甲双胍组的精子活力高于其他各组(<0.05)。25 µmol/L二甲双胍组(33.03%)与100 µmol/L二甲双胍组(35.54%)无显著差异。
2.2 二甲双胍对精子冷冻-解冻后质膜完整率的影响由表1可知,解冻后对照组的精子质膜完整率(39.59%)低于其他各组(<0.05),50 µmol/L二甲双胍组的精子质膜完整率最高(52.99%)(<0.05)。25 µmol/L二甲双胍组(45.70%)与100 µmol/L二甲双胍组(45.98%)无显著差异。
2.3 二甲双胍对精子冷冻-解冻后顶体完整率的影响由表1可知,解冻后50 µmol/L二甲双胍组(54.91%)的顶体完整率最高(<0.05)。对照组(39.81%)、25 µmol/L二甲双胍组(44.73%)、100 µmol/L二甲双胍组(44.02%)组间均无显著差异。
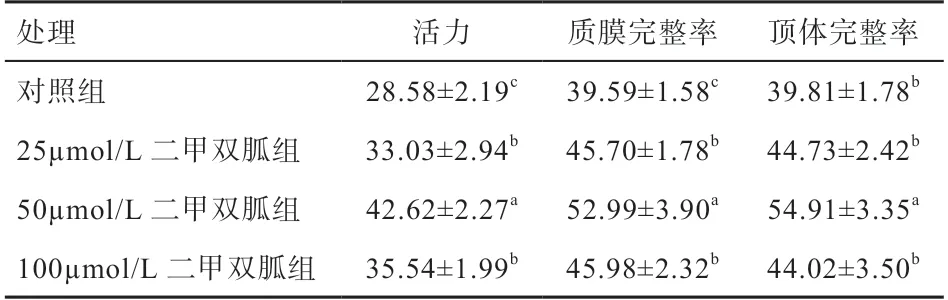
表1 不同浓度二甲双胍对精子冷冻-解冻后活力、质膜完整率、顶体完整率的影响 %
2.4 二甲双胍对精子冷冻-解冻后ROS的影响 由表2可知,50 µmol/L二甲双胍组冷冻-解冻后精液中ROS水平(270.77 U/mL)低于其他各组(<0.05),对照组的ROS水平(462.11 U/mL)最高(<0.05)。25 µmol/L二甲双胍组(392.01 U/mL)与100 µmol/L二甲双胍组(358.77 U/mL)无显著差异。

表2 不同浓度二甲双胍对冷冻-解冻后精液中ROS、MDA、ATP、MMP的影响
2.5 二甲双胍对精子冷冻-解冻后MDA的影响 由表2可知,50 µmol/L二甲双胍组冷冻-解冻后精液中MDA水平低于其他各组(<0.05),而对照组最高(<0.05)。25 µmol/L二甲双胍组(7.03 nmol/L)与100 µmol/L二甲双胍组(6.62 nmol/L)无显著差异。
2.6 二甲双胍对精子冷冻-解冻后ATP的影响 由表2可知,精子冷冻-解冻后ATP水平由高到低为50 µmol/L二甲双胍组>100 µmol/L二甲双胍组>25 µmol/L二甲双胍组>对照组(<0.05)。
2.7 二甲双胍对精子冷冻解冻后MMP 的影响 由表2可知,添加二甲双胍的试验组中高线粒体膜电位的精子比率高于对照组(<0.05)。50 µmol/L二甲双胍组的高线粒体膜电位的精子比率最高,且显著高于其他两个试验组。25 µmol/L二甲双胍组的MMP显著低于100 µmol/L二甲双胍组。
3 讨 论
在犬精液冷冻保存过程中,造成精液品质下降的最主要因素之一是冷冻保存过程中累积的ROS与精子膜中不饱和脂肪酸发生脂质过氧化反应,破坏精子膜的结构与功能完整性,使精子活力、质膜完整率和顶体完整率降低。而精子活力、质膜完整率、顶体完整率是评估精子受精能力的重要指标,精子质膜和顶体的完整可以确保精子与卵细胞透明带中的特异性蛋白结合以发生精卵结合。本实验结果显示,在犬精液冷冻稀释液中添加50 µmol/L二甲双胍,冷冻-解冻后精子活力、质膜完整率及顶体完整率分别为42.62%、52.99%和54.91%,与对照组相比显著提高。Nguyen等研究结果显示,将1 mmol/L二甲双胍加入到鸡精液冷冻稀释液,可以显著提升冷冻-解冻后精液品质,精子活力达到58.8%,这与本试验的结果相似。二甲双胍的添加量不同可能是由于不同物种精子的最适环境渗透压不同。同时,本研究还发现,当二甲双胍浓度为50 µmol/L时,精液冷冻-解冻后的保存效果最佳,而当二甲双胍浓度高于该浓度时精液品质反而有所降低,这可能是因为高浓度二甲双胍使精子处于一种高渗透压溶液中,精子细胞膜结构和完整性受到破坏与损伤,从而对精液品质造成一定负面影响。
ROS为细胞内的正常代谢产物,然而当细胞抗氧化系统受损时,ROS含量将大幅度增加并对细胞造成一定程度的损伤。MDA是生物体内脂质过氧化的主要产物,细胞内脂质过氧化程度越高,则MDA含量越高。因此通过检测冷冻-解冻后犬精液中ROS和MDA含量可知二甲双胍对犬精液抗氧化能力的影响。本研究结果显示,犬精液冷冻稀释液中加入二甲双胍可以显著降低冷冻-解冻后精液中MDA和ROS含量,提升精子的总抗氧化能力,当二甲双胍添加量为50 µmol/L时,MDA和ROS的含量处于最低状态。与杨雄发现的二甲双胍能够有效阻止细胞中MDA水平的增加和SOD活性的下降这一结果相似。这可能是因为一方面二甲双胍能够减少细胞中3-磷酸甘油醛脱氢酶(GADPH)的表达以降低精子膜的脂质过氧化反应,进而减轻氧化应激;另一方面二甲双胍能够改善精子细胞的抗冻抵抗,间接减少氧化应激,恢复精子细胞内的抗氧化应激储备。
线粒体膜电位是线粒体生产ATP的直接驱动力,正常细胞中线粒体的膜电位处于较高状态,而线粒体膜电位较低时,说明细胞很可能发生凋亡。已有研究报道二甲双胍能够保护并维持线粒体的正常功能。本研究发现二甲双胍的添加有利于保持精子高线粒体膜电位,50 µmol/L二甲双胍浓度时,精子处于高线粒体膜电位的状态最多。精子活力的维持需要大量能量的支持,作为最重要的能量分子,ATP在精子的各种生理、生化进程中发挥着重要作用,精子内ATP含量也一定程度上代表了精子能量代谢的活性。本研究结果表明,二甲双胍的添加有利于精子ATP的维持,二甲双胍添加组的ATP含量均显著高于对照组。
4 结 论
本研究显示,犬精液冷冻稀释液中二甲双胍的添加可有效提高冷冻-解冻后的精液品质,50 µmol/L的二甲双胍能显著提高精子活力、质膜完整率、顶体完整率,同时对提高冷冻-解冻后犬精液的抗氧化能力及能量代谢都有显著效果。

