胃癌患者血清S100P、ILF3和PARP1水平与肿瘤病理特征的相关性分析
吕春燕,彭捷,龚啟斌,郑曼飞
(宁德师范学院附属宁德市医院检验科,福建宁德 362100)
胃癌发病率高、恶性程度高,患者预后差,临床大量研究指出,早期对胃癌病情进行准确评估是保证临床针对性治疗、疾病治疗效果及预后的重要基础[1-2]。临床报道显示,S100钙结合蛋白(S100 calcium binding protein,S100P)在多种肿瘤中均有异常表达,且多为高表达状态,与预后呈负相关[3-4]。白细胞介素增强结合因子3(Interleukin enhancer-binding factor 3,ILF3)是近年新发现的参与机体炎性反应的因子,其可能通过调控炎性因子水平参与胃癌的发生、发展[5]。此外,聚腺苷酸二磷酸核糖聚合酶1[Poly (ADP-ribose) polymerase 1,PARP1]是存在于真核细胞中催化聚ADP核糖化的细胞核酶,与胃癌病情及预后关系密切[6-7]。通过筛选敏感性和准确性更高的血清生物标志物仍然是胃癌诊断的重要途径。鉴于此,本研究探讨胃癌患者血清S100P、ILF3和PARP1水平与肿瘤病理特征的相关性,为胃癌诊断提供敏感性生物标志物。
1 资料与方法
1.1 一般资料
选取2017年10月至2019年1月本院胃癌患者93例为研究对象。纳入标准:(1)符合胃癌诊断标准[8],并经组织病理学诊断确诊;(2)自主行为能力良好;(3)首次发现;(4)无消化系统手术史;(5)临床资料完整;(6)患者知晓本研究,已签署同意书。排除标准:(1)严重抑郁、焦虑等精神疾病;(2)合并其他恶性肿瘤;(3)全身感染性疾病;(4)严重心脑血管疾病;(5)肝肾功能障碍;(6)胃癌终末期。另选取同期收治的93例胃部良性肿瘤患者为对照。纳入标准:(1)经组织病理学诊断确诊为胃部良性病变;(2)无精神系统疾病;(3)无其他消化系统疾病;(4)患者知晓本研究,已签署同意书。排除标准同研究组。两组一般资料比较差异均无统计学意义(P>0.05),见表1。
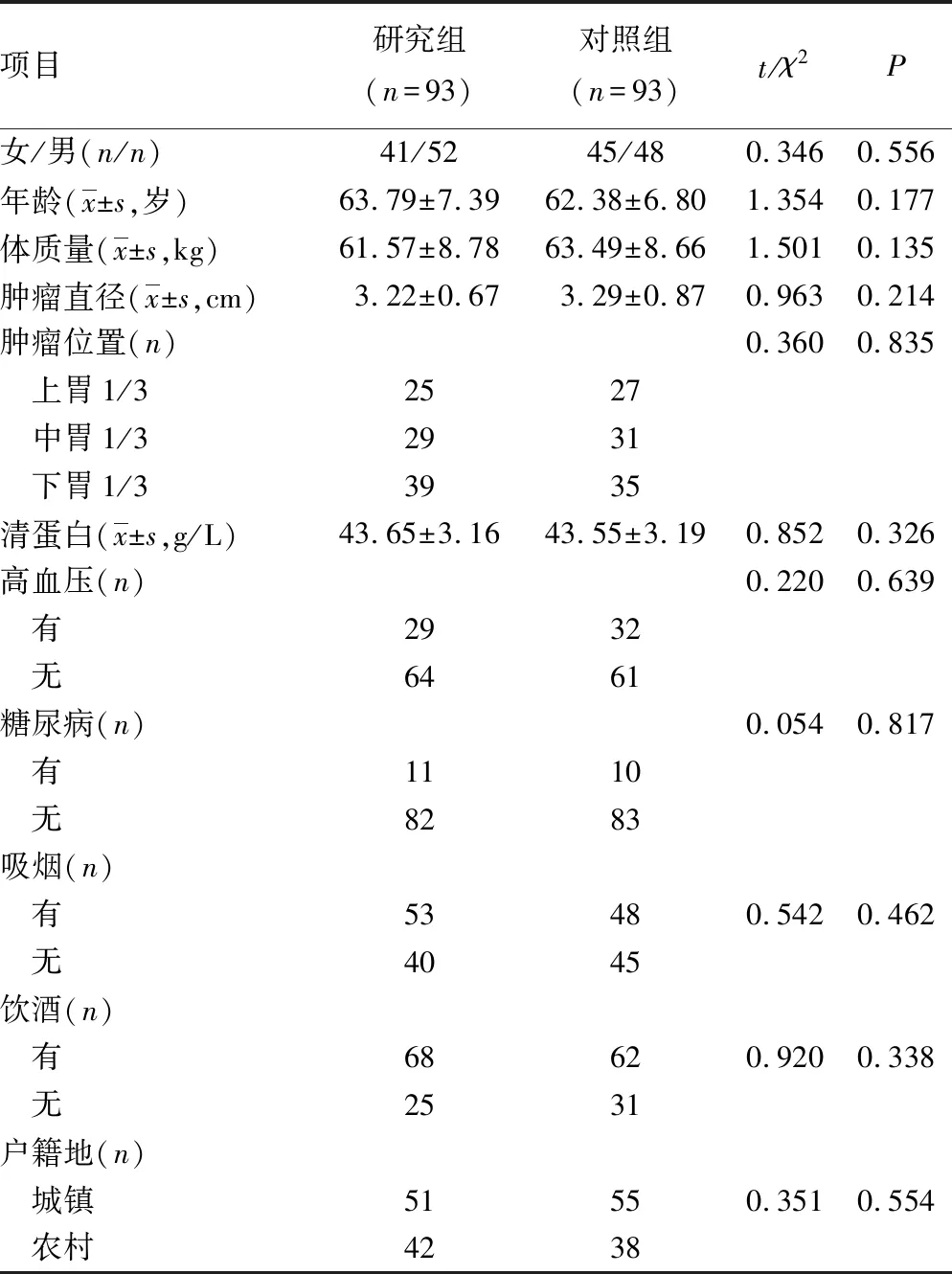
表1 两组患者一般资料对比
1.2 方法
所有患者入组12 h内采集空腹静脉血5 mL,采用长沙湘智离心机仪器有限公司的HC-35离心机[批准文号:湘长食药监械(准)字2009第1410001号],以3 500 r/min离心处理5 min,取血清置于-70 ℃冷藏室内待检,由专业检测师采用ELISA检测血清S100P、ILF3、PARP1水平,试剂盒购自南京基蛋生物科技股份有限公司(批准文号:苏械注准20152400405,规格:100人份/盒),相关操作均严格按照试剂盒说明书进行。研究组根据患者临床分期及是否发生转移,合理选择治疗方法,包括手术治疗、放疗和化疗,治疗后随访1年,记录患者死亡和存活情况。
1.3 观察指标
(1)两组治疗前血清S100P、ILF3和PARP1水平。(2)研究组不同病理特征患者血清S100P、ILF3和PARP1水平,以及相关性分析,病理特征包括分化程度、临床分期、淋巴结转移,均参照相关指南[9]进行判定。(3)研究组死亡与存活患者血清S100P、ILF3和PARP1水平。(4)分析血清S100P、ILF3和PARP1水平单独及联合预测胃癌患者死亡的效能。
1.4 统计学处理
2 结 果
2.1 两组血清S100P、ILF3和PARP1水平比较
治疗前研究组血清S100P水平较对照组降低,ILF3和PARP1水平较对照组升高(P<0.05),见表2。

表2 两组血清S100P、ILF3和PARP1水平对比
2.2 不同病理特征胃癌患者血清S100P、ILF3、PARP1水平比较
胃癌低分化患者血清S100P水平低于中高分化患者,ILF3和PARP1水平升高,差异有统计学意义(P<0.05);临床Ⅰ~Ⅱ期患者血清S100P水平高于Ⅲ~Ⅳ期患者,ILF3和PARP1水平降低,差异有统计学意义(P<0.05);淋巴结转移阳性患者血清S100P水平低于阴性患者,ILF3和PARP1水平升高,差异有统计学意义(P<0.05),见表3。

表3 不同病理特征胃癌患者血清S100P、ILF3、PARP1水平比较

续表3 不同病理特征胃癌患者血清S100P、ILF3、PARP1水平比较
2.3 血清S100P、ILF3、PARP1水平与肿瘤病理特征的相关性分析
经Pearson分析发现,胃癌分化程度、临床分期与血清S100P水平呈正相关,与ILF3和PARP1水平呈负相关;淋巴结转移与血清S100P水平呈负相关,与ILF3和PARP1水平呈正相关(P<0.05),见表4。
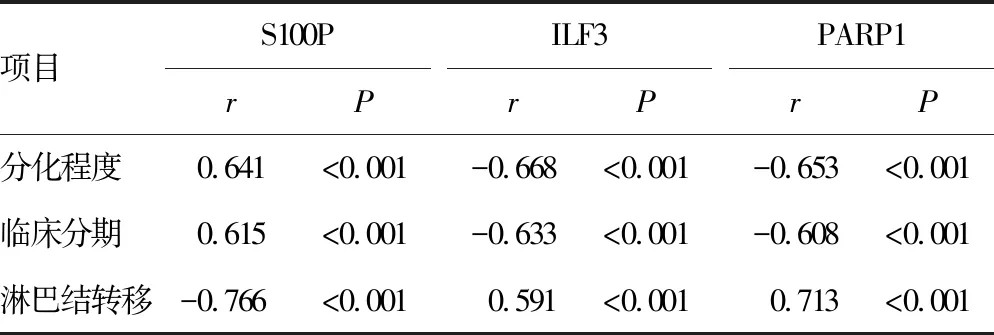
表4 血清S100P、ILF3、PARP1水平与肿瘤病理特征的相关性分析
2.4 胃癌不同预后血清S100P、ILF3、PARP1水平
随访1年,胃癌患者死亡13例,存活80例,死亡患者血清S100P水平低于存活患者,血清ILF3和PARP1水平升高(P<0.05),见表5。

表5 胃癌不同预后血清S100P、ILF3、PARP1水平
2.5 血清S100P、ILF3、PARP1水平预测胃癌预后的效能
血清S100P的AUC为0.804,95%CI:0.709~0.879,P<0.001,截断值≤9.9 μg/L,灵敏度为84.62%,特异度为72.50%;血清ILF3的AUC为0.821,95%CI:0.728~0.893,P<0.001,截断值>643.72 pg/mL,灵敏度为69.23%,特异度为86.25%;血清PARP1的AUC为0.792,95%CI:0.696~0.869,P<0.001,截断值>6.0 μg/L,灵敏度为69.41%,特异度为78.75%。联合预测胃癌患者预后的AUC为0.871,95%CI:0.785~0.931,P<0.001,灵敏度为84.62%,特异度为86.26%;联合预测的AUC高于S100P、ILF3、PARP1单独效能(Z=6.231、5.985和6.639,P<0.001),见图1、2。
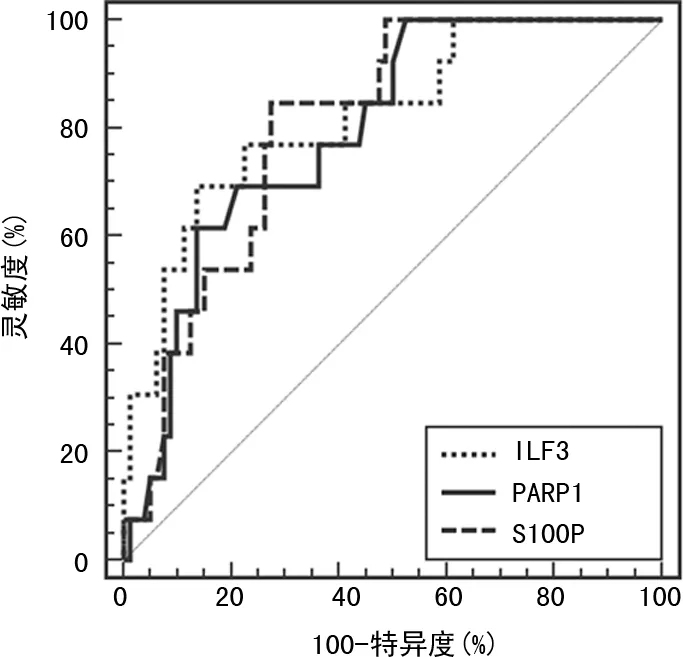
图1 血清S100P、ILF3、PARP1单独预测 胃癌预后的ROC曲线
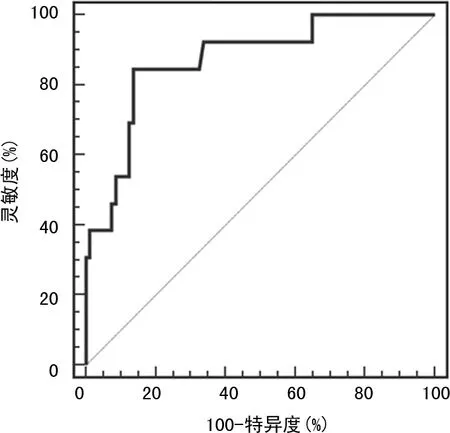
图2 血清S100P、ILF3、PARP1联合预测 胃癌预后的ROC曲线
3 讨 论
胃癌是我国最常见恶性肿瘤之一,近年来随着我国医疗技术水平的提高,早期胃癌患者的5年生存率已达到90%以上,但晚期胃癌患者的5年生存率仍较低,仅为15%左右[10-11]。寻找能准确评估胃癌患者病情及判断预后的指标,一直是临床研究的重点。
S100P是一种具有典型EF手型结构的钙结合蛋白,可与钙离子结合而改变构象,通过靶蛋白发挥介导细胞间连接、蛋白质磷酸化、转导钙离子信号及转录等功能,参与细胞的异常增生和恶变,并与肿瘤的发生、发展、临床分期、转移、预后相关[12]。胰腺癌患者血清S100P水平明显升高,与其临床病理参数与恶性程度存在一定关系[13]。刘京运等[14]通过对胃癌患者的一项研究发现,胃癌组织中S100P水平明显降低,可能参与了胃癌的浸润和转移过程。本研究结果中,胃癌患者血清S100P水平明显低于胃部良性病变患者,与上述研究结果相符,提示血清S100P水平降低可能参与胃癌的发生。正常S100P水平降低可导致细胞间连接、蛋白质磷酸化、转导钙离子信号及转录等功能发生紊乱,从而影响细胞的正常分化、增殖,促进胃癌的发生。研究表明,炎性反应在胃癌的发生、发展中发挥重要作用,多种炎性因子,如肿瘤坏死因子α、白细胞介素6等均参与其中[15]。ILF3是白细胞介素在T细胞中表达所需的转录因子,参与白细胞介素的表达,在炎症反应中同样具有重要作用[16]。本研究发现,胃癌患者血清ILF3水平明显升高,与LIU等[17]研究结果一致,提示血清ILF3表达增加可能促进胃癌的发生。ILF3可通过转录调控功能参与肿瘤细胞的增殖、侵袭及转移,其血清水平升高,对上述机制的作用增强,同时反映出机体炎性反应程度增加,可促进胃癌的发生。本研究还发现,胃癌患者血清PARP1水平明显升高。PARP1可通过参与DNA修复过程,对细胞的生物学行为产生调控作用,其表达水平升高可能促进肿瘤细胞的增殖、迁移等恶性生物学行为,促进胃癌的发生和发展[18]。
胃癌的分化程度、临床分期及是否有淋巴结转移,是决定治疗方法及患者预后的重要因素。本研究发现,随着分化程度降低、临床分期增高、发生淋巴结转移,胃癌患者血清ILF3、PARP1水平逐渐升高,S100P水平逐渐降低,进一步经相关性分析发现各血清指标与胃癌患者病理特征间存在密切相关性,说明血清中S100P、ILF3、PARP1表达水平可能在反映胃癌患者分化程度、临床分期及是否有淋巴结转移等恶性生物学行为方面发挥一定作用,从而帮助医生评估患者病情,开展针对性治疗措施。相关研究指出,生物学标志物水平能反映胃癌的恶性程度,与患者预后关系密切,且对预测患者预后情况具有重要意义[19-20]。本研究还发现,血清S100P、ILF3、PARP1在预测胃癌患者预后方面具有一定价值,尤其是各指标联合预测的AUC高达0.871,可有效改善预测效能,为医生判断患者预后提供更准确结果。
本研究也有一定局限性:样本量和随访时间有限,需要更大样本量和更长随访时间的临床前瞻性对照研究;此外,本研究仅检测了患者治疗前单一时间点的血清指标,不能动态了解不同治疗方式对患者血清指标的影响;3个血清指标是如何通过内在机制参与胃癌的发生和发展过程还需要进一步体外细胞和动物模型进行验证。
综上所述,胃癌患者血清S100P水平明显降低,血清ILF3、PARP1水平异常升高,且均与患者分化程度、临床分期、淋巴结转移密切相关,且在预测患者预后方面具有较高临床价值,监测血清S100P、ILF3、PARP1水平可辅助医生对患者病情及预后进行判断,指导相关治疗措施的制订和开展。

