微孔Noria聚合物用于二甲苯异构体吸附分离研究
钱庆玲,朱晴,杨正金,徐铜文
(中国科学技术大学化学与材料科学学院,安徽 合肥 230026)
引 言
二甲苯异构体包括邻二甲苯(OX)、间二甲苯(MX)和对二甲苯(PX)三种异构体,主要来自原油催化重整生产的C8芳烃混合物[1-2]。二甲苯异构体的分离已经被列为“改变世界的七大化学分离”之一[3],每一种二甲苯都是化工和医药领域不可或缺的原材料或中间体。但是这三种二甲苯异构体沸点相近(PX、MX 和OX 的沸点分别是138.4、139.1 和144.4℃),传统的精馏方法能耗高且效率低[4]。基于二甲苯之间凝固点不同的特点(PX、MX 和OX 的凝固点分别是13.4、-50.5 和-25.0℃),低温结晶法被用来分离PX,但二甲苯异构体在低温下会形成低共熔点,而且还需要维持仪器在-50℃左右运行,耗能高,所以这种方法仅可用于高浓度对二甲苯原料(>80%)中PX 的分离[5-6]。因此,亟需找到替代的分离方法来提高分离效率,降低经济和能源成本。其中,吸附分离效率高、能耗低,是一种很有前途的分离方法[7-8]。开发稳定和高性能的吸附剂是实现二甲苯异构体吸附分离的关键,除了已被商业化使用的分子筛材料[9-11],目前金属有机框架材料(MOF)[12-20]、无孔有机分子晶体[21-24]、金属络合物[4,25]等都已被广泛研究用于二甲苯异构体的分离。然而这些材料无法兼具高吸附性能、稳定性和低成本,所以开发新的综合性能优异的吸附剂材料仍然是研究重点。
微孔有机聚合物(MOP)种类繁多、制备路线简单、使用成本低,且兼具高物理化学稳定性和优异的吸附能力[26-28],已广泛应用于水净化[27,29]和碳捕集[28]等领域,是二甲苯异构体吸附材料的新研究方向。Tan 等[30]使用类三蝶烯微孔有机聚合物POP-1作为气相色谱柱的固定相,在0.6 min内实现了三种二甲苯异构体的完全分离,且POP-1 对MX 的吸附容量最高(290 mg·g-1)。此外,聚合物还可以通过分子筛分原理完全分离OX、MX 和PX 异构体。Li等[31]制备了一种堆叠的锰基一维配位聚合物,可以选择性地识别PX,在363 K 下对PX/MX/OX 等摩尔三元气相混合物的竞争吸附测试中,获得了70.4/2.5/1的高选择性。
尽管以往的二甲苯分离研究和材料开发取得了不错的成果,但由于PX 动力学尺寸较小(PX、MX和OX 的动力学尺寸分别是6.7、7.1 和7.4 Å,1 Å=0.1 nm),目前大部分材料通过孔径筛分只能实现PX 的优先吸附,优先吸附OX 的材料较少[13]。OX 可被广泛用于生产邻苯二甲酸酐,进一步生产油漆、药物和增塑剂等,所以具有OX 选择性的吸附剂也具有重要作用,这种吸附剂不仅可以取代能源密集型蒸馏技术,而且可以避免下游工艺过程中OX 和MX的分离挑战[20]。因此,开发一种兼具高选择性和吸附容量的OX选择性吸附剂具有重要意义。
Noria是一种梯状连接的双环低聚物,其内部形成近似圆柱状的疏水空腔(图1)[32],该空腔形状尺寸与OX 分子相近。因此,Noria 有希望实现OX 的选择性吸附。为了提高吸附剂的稳定性和OX 吸附分离性能,本文拟采用Noria 分子与2, 3, 5, 6-四氟对苯二腈(TFTPN)进行亲核取代反应,制备具有高比表面积的微孔Noria 聚合物(MNP),研究MNP 对二甲苯异构体的吸附分离能力。通过静态液相吸附实验,研究单组分二甲苯异构体在MNP 上的吸附动力学和吸附等温线,以及二元和三元二甲苯混合液在MNP 上的竞争吸附。为了探究MNP 的实际应用潜力,本文通过实验室自制的小型柱吸附装置,得到二甲苯混合液在吸附剂上的动态穿透曲线,并探究了MNP选择性吸附的机理。
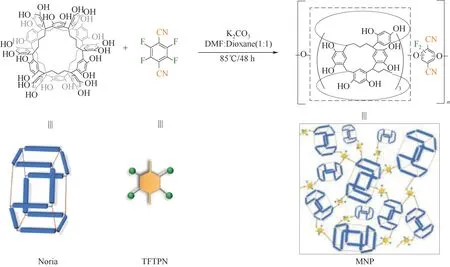
图1 MNP合成路线示意图Fig.1 Schematic diagram of the synthesis of MNP
1 实验材料和方法
1.1 材料
对二甲苯(PX,99%)、邻二甲苯(OX,99%)、间二甲苯(MX,99%)、正庚烷(>99%)、1, 4-二氧六环[99.9%,水含量≤0.005%(质量)]和N,N-二甲基甲酰胺[DMF,99.8%,水含量≤0.005%(质量)]购自上海安耐吉化学有限公司,无须进一步操作即可使用;间苯二酚(98%)和戊二醛[50%(质量)水溶液]购自日本东京化成工业株式会社(TCI);四氢呋喃(THF,99.5%)、二氯甲烷(99.5%)、碳酸钾(K2CO3,>99%)和浓盐酸溶液(36%~38%)购自上海国药化学试剂有限责任公司;2, 3, 5, 6-四氟对苯二腈(99%)购自上海阿拉丁生化科技股份有限公司,并在聚合前重结晶。
1.2 吸附剂的制备
1.2.1 Noria 的合成 在文献[32]报道的方式基础上稍加修改来合成Noria。将间苯二酚(0.2 mol,22 g)和戊二醛溶液(10 g,0.05 mol)置于250 ml 圆底烧瓶中并溶解在45 ml 乙醇中,逐滴加入30 ml 浓盐酸。溶液在80℃下连续搅拌48 h 后,将反应混合物冷却至室温。然后将其倒入150 ml 的冷甲醇中,离心收集沉淀。随后分别用水、甲醇和乙醚洗涤多次,抽滤后在80℃下真空干燥24 h,得到的产物为淡黄色Noria固体粉末。
1.2.2 微孔Noria 聚合物的制备 采用文献[33]报道的方式合成MNP,并对其稍加修改。将Noria(200 mg,0.12 mmol)和TFTPN(141 mg,0.71 mmol)加入到50 ml 密封的Schlenk 管中。再加入5 ml 无水DMF溶剂和5 ml无水1, 4-二氧六环溶剂,单体搅拌溶解后加入碳酸钾(421 mg,3.05 mmol)。然后在氮气气氛下以85℃搅拌48 h。冷却至室温,使用1 mol·L-1的稀盐酸溶液除去碳酸钾,进行淬灭反应,抽滤后收集沉淀。分别用甲醇、DMF、四氢呋喃和二氯甲烷洗涤,将得到的棕色固体在90℃下真空干燥,得到MNP。
1.3 微孔Noria聚合物的表征
采用核磁共振波谱仪(Bruker AVANCE Ⅲ HD 400 M)对TFTPN 和Noria 进行核磁共振碳谱(13C NMR)的表征;采用固态核磁共振波谱仪(Bruker AVANCE AV Ⅲ400WB)对MNP 进行交叉极化魔角自旋固态核磁共振碳谱(13C CP/MAS solid-state NMR)的分析;采用傅里叶变换红外光谱仪(FT-IR,Nicolet iS10)对TFTPN、Noria和MNP进行结构表征;采用粉末X 射线衍射仪(PXRD,PHILIPS X’Pert MPD)对MNP 进行结构分析;采用扫描电子显微镜(SEM,Gemini SEM 500)对MNP的形貌进行表征;采用热重分析仪(TGA Q5000IR)在100~800℃的范围内N2气 氛 下 以10℃·min-1的 升 温 速 率 对Noria 和MNP 进行热稳定性测试;采用比表面积和孔径分析仪(JW-BK200C)测定Noria 和MNP 在77 K 下的N2吸附和解吸等温线和孔径分布。
1.4 液相静态吸附实验
在吸附实验之前,将MNP 吸附剂在90℃真空下过夜活化。对于25℃的单组分批量吸附实验,首先用正庚烷将每种异构体稀释到一系列浓度。然后分别在一个装有0.04 g 活化MNP 的5 ml 样品瓶和一个空的参比样品瓶中装入2.0 ml 相同浓度二甲苯异构体的正庚烷溶液。25℃下在摇床振荡6 h后,用0.45 μm 尼龙66 过滤器过滤吸附溶液。通过气相色谱(GC,Agilent 6890N,配备DB-WAX 毛细管柱)的输出数据来分析吸附后的溶液浓度和参考样品瓶中的溶液浓度。平衡吸附容量Qe的计算公式如下:

其中,Ce和C0分别是吸附后溶液的浓度和参比瓶中溶液的浓度,mol·L-1;V是溶液的体积,L;M为二甲苯的相对分子质量,g·mol-1;m为吸附实验中所用吸附剂的质量,g。
1.4.1 吸附动力学 将活化后的MNP 添加到0.1 mol·L-1的单组分PX、OX 或MX 正庚烷溶液中,在25℃下放置在摇床上振荡。在不同吸附时间取样后,通过GC 分析溶液的浓度。为进一步研究吸附过程,采用准一级动力学模型、准二级动力学模型和颗粒内扩散模型三种模型拟合吸附动力学数据。
准一级动力学模型公式如下:

其中,Q和Qe分别是MNP 在取样时和吸附平衡时的吸附量,mg·g-1;k1是准一级动力学模型的速率常数,g·mg-1·h-1。式(2)积分可得:

准二级动力学模型公式如下:

其中,k2是准二级动力学模型的速率常数,g·mg-1·h-1。式(4)积分可得到线性方程如下:

颗粒内扩散模型的速率方程如下:

其中,k3是颗粒内扩散系数,g·mg-1·h-1;c是与边界层等相关的常数,mol·L-1。
1.4.2 吸附等温线 通过Langmuir 吸附等温线模型和Freundlich 吸附等温线模型对单组分二甲苯在MNP上的吸附等温线进行拟合。
Langmuir吸附等温线模型方程如下:

其中,Qe是平衡吸附量,mg·g-1;Ce是二甲苯的平衡浓度,mol·L-1;Qm是MNP 的最大吸附容量,mg·g-1;KL为Langmuir 等温线模型的吸附平衡常数,L·mol-1。式(7)的线性形式如下:

其中,KF是Freundlich 等温线模型的吸附平衡常数,mg·g-1·(L·mol-1)1/n;1/n是吸附指数。通过式(9)等式两边同取对数可得到式(10):

1.5 多组分竞争吸附实验
多组分竞争吸附实验类似于25℃下的单组分液相静态吸附实验,不同之处在于将溶液替换为二元或三元等摩尔二甲苯溶液。通过GC 分析以确定各组分的浓度。多组分竞争吸附实验的选择性(αij)计算方程如下:

其中,qi和qj是单组分二甲苯异构体i和j的吸附容量,mg·g-1;ci和cj是溶液中二甲苯异构体i和j的浓度,mol·L-1。
1.6 柱吸附分离实验
使用1 ml 的玻璃注射器来制备小型吸附柱,方法是在底部放置一小块棉花,然后加入0.4 g MNP吸附剂作为固定相,并且使用注射泵来控制流速。进料液是三元等摩尔二甲苯的正庚烷溶液(10 mmol·L-1),流速为0.1 ml·min-1。每分钟手动采集一次洗脱液样品,并使用GC 测定每个洗脱液样品中的二甲苯浓度。
2 实验结果与讨论
2.1 MNP的表征
2.1.1 结构表征 图2(a)是MNP、Noria 和TFTPN 的红外光谱图。MNP 的红外光谱中有来自于TFTPN的—CN 伸缩振动吸收峰(2246 cm-1)以及来自Noria的—OH红外特征峰(3403 cm-1)[32],1095和1250 cm-1处的峰表明了芳香族亲核取代反应中C—O—C 键的形成[33]。图2(b)比较了MNP 的固态13C CP/MAS NMR 谱 图 与Noria 和TFTPN 的 溶 液 态(D6-DMSO)13C NMR 谱图。在MNP 的固态13C CP/MAS NMR 谱图中,化学位移27 和35 处的尖峰分别对应Noria 中的—CH—和—CH2—,110 左右的峰源于TFTPN 中—CN 的碳原子,从116 到140 的宽峰来自TFTPN 和Noria 的芳香族碳原子,而在152 左右的共振峰则表明了芳基C—O 键的形成[33]。因此,红外光谱图和核磁碳谱图证实了聚合物MNP 的成功制备。
由图2(c)可知,Noria分子本身具有一定结晶性,但聚合后MNP 形成了无定形的聚合物,其XRD 谱图中低强度的宽峰证实了这一点。图2(d)的SEM 图可观察到MNP 表面疏松多孔,这表明MNP 与吸附质接触面积大,极具成为吸附剂材料的潜质。
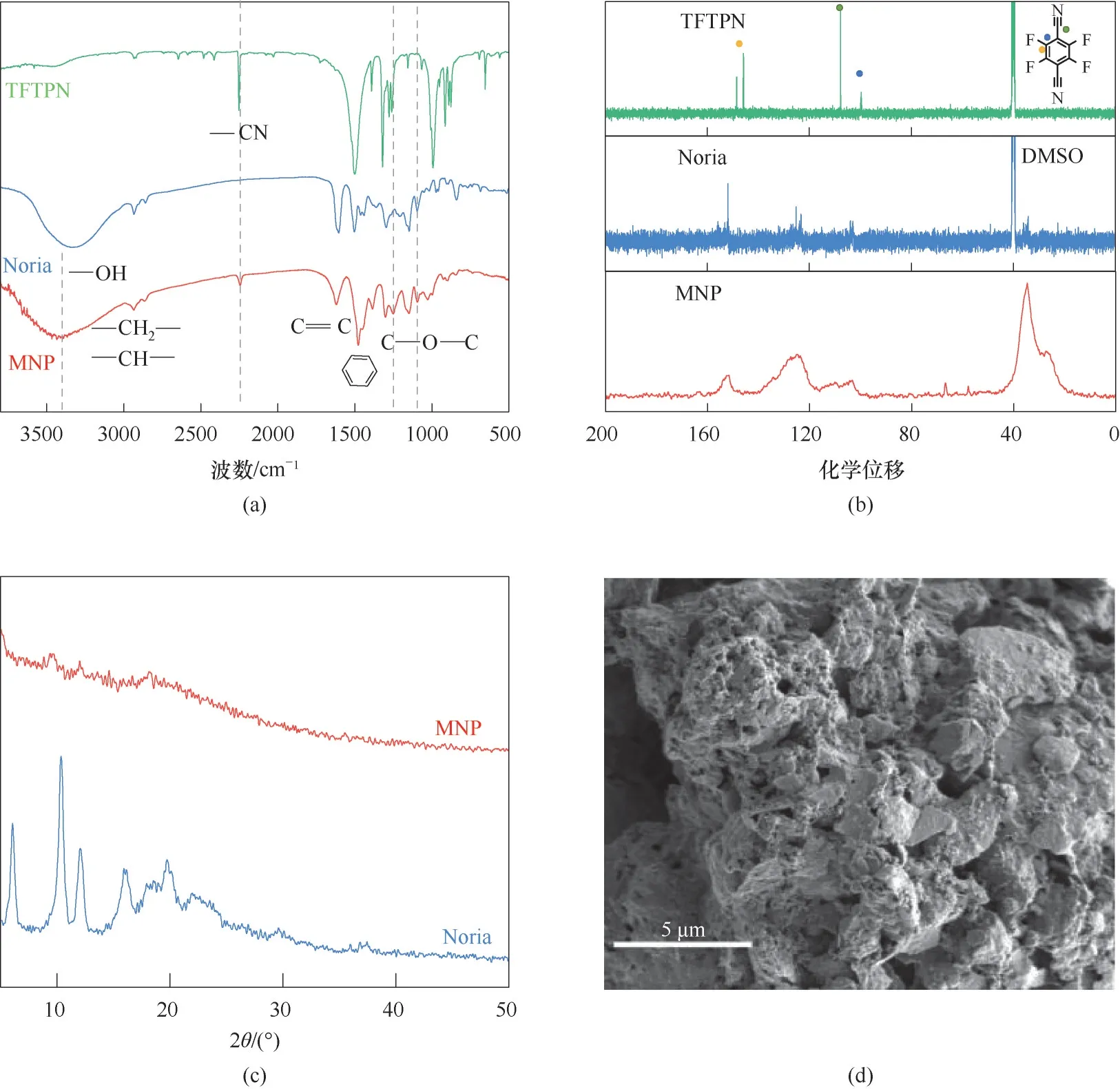
图2 (a) TFTPN、Noria和MNP的红外光谱图;(b)TFTPN和Noria的13C NMR谱图,以及MNP的13C CP/MAS固态NMR谱图;(c) Noria和MNP的PXRD谱图;(d) MNP的SEM图Fig.2 (a) FT-IR spectra of TFTPN, Noria and MNP; (b) 13C NMR spectra of TFTPN and Noria, and 13C CP/MAS solid-state NMR spectra of MNP; (c) Powder X-ray diffraction patterns of Noria and MNP; (d) SEM image of MNP
2.1.2 MNP 的孔结构表征 为了表征内部的孔结构,通过77 K 下的氮气吸附脱附等温线来测定Noria 和MNP 的比表面积和孔径分布。在图3(a)中,Noria 具有Ⅱ型吸附等温线的特征,在相对压力(P/P0)大于0.9 时,Noria 对气体的吸收略有增加,这主要来自颗粒间的空隙。相比之下,MNP 在低相对压力(P/P0<0.1)下具有Ⅰ型吸附等温线的高氮吸收特性,这表明了MNP 具有丰富的微孔结构。Noria 的Brunauer-Emmett-Teller(BET)比表面积(SABET)为238 m2·g-1,而MNP 的BET 比表面积高达847 m2·g-1,说明聚合反应形成了大量空腔和孔道结构,极大地增加了MNP 的比表面积。图3(b)中,通过非定域密度泛函理论(NLDFT)方法估算的孔径分布显示,Noria 和MNP 的孔径主要分布在0.5~0.75 nm 和1.1~1.4 nm 范围内,其中孔径在0.5~0.75 nm 范围内的微孔主要来自Noria分子的空腔[33]。

图3 (a) Noria和MNP在77 K下的N2吸脱附等温线;(b) 采用非定域密度泛函理论方法计算的Noria和MNP的孔径分布Fig.3 (a) N2 adsorption/desorption isotherms of Noria and MNP at 77 K; (b) The pore size distributions of Noria and MNP using the nonlocal density functional theory method
2.1.3 热稳定性能的表征 如图4的热失重曲线所示,在100~150℃的温度范围内,Noria 和MNP 都有2%的质量损失,主要源于孔中包覆的水分和溶剂的挥发。Noria 开始失重的温度是250℃,250~800℃间质量损失为68%。相比之下,MNP 具有更高的热稳定性,MNP 的聚合物链开始降解的温度在350℃左右,350~800℃间质量损失也仅有32%。这表明MNP 具有优异的热稳定性,在250℃下可稳定工作,满足工作环境要求。

图4 Noria和MNP在N2气氛下的热失重曲线Fig.4 Thermogravimetric analysis curves of Noria and MNP in N2 atmosphere
2.2 MNP二甲苯异构体的吸附动力学研究
图5(a)展示了MNP上单组分二甲苯吸附量随时间的变化,MNP 对二甲苯具有瞬吸性,OX 在1 min的吸附量已经达到平衡吸附量的90%,30 min 后三种二甲苯异构体均可达到吸附饱和。快速的吸附过程说明MNP 对二甲苯具有较强的吸附作用力,二甲苯分子以较快的速率扩散进孔中从而被吸附。值得注意的是,MNP 对OX 的平衡吸附量远远大于其他两种异构体的吸附量,说明MNP 对OX 具有更强的吸附作用力。
为进一步阐明三种二甲苯异构体在MNP 上的吸附动力学特征,本研究采用准一级动力学模型、准二级动力学模型和颗粒内扩散模型这三种动力学模型对图5(a)的吸附实验数据进行拟合,拟合参数如表1 所示。拟合结果表明:实验数据与准二级动力学模型的拟合相关度(R2)大于0.99,如图5(b);表1中的准二级动力学方程的拟合值Qe与实验测得的平衡吸附量的偏差较小,因此可以用准二级动力学吸附模型来描述三种二甲苯异构体在MNP 材料上的吸附过程。这也说明二甲苯异构体在MNP 上的吸附不是简单的扩散过程,其吸附速率受化学吸附机理的控制。

表1 MNP吸附二甲苯异构体的动力学拟合参数Table 1 Kinetic fitting results of xylene isomers adsorption on MNP

图5 (a) 单组分二甲苯在MNP上吸附量随时间的变化;(b) MNP的二甲苯吸附过程的准二级动力学模型拟合Fig.5 (a) Time-dependent adsorption of single-xylene isomer on MNP; (b) Fitting the adsorption of xylene isomers on MNP to pseudo second-order kinetic model
2.3 单组分二甲苯吸附等温线
图6(a)展示了25℃下单组分二甲苯在MNP上的平衡吸附量和溶液平衡浓度的关系。在低浓度(Ce<0.2 mol·L-1)阶段,吸附过程主要由浓度差控制,随着二甲苯溶液浓度的升高,三种二甲苯异构体在MNP 上的吸附量都显著提高。当溶液平衡浓度大于0.2 mol·L-1时,PX 和MX 平 衡 吸 附 量 随 溶 液 浓度的变化幅度缩小,逐渐趋于平衡状态,达到最大饱和吸附量,二甲苯的最大饱和吸附量受制于MNP 内有限的吸附位点。但OX 的平衡吸附量还随着平衡浓度的升高而升高,表明MNP 内OX 的吸附位点更多,MNP 对OX 的化学吸附能力更强。该结果从另一个角度证明了MNP 具有OX 优先吸附性能。
使用Langmuir 吸附等温方程和Freundlich 吸附等温方程对图6(a)的二甲苯吸附等温线进行模型拟合,拟合参数如表2所示。拟合结果表明:实验数据与Langmuir 吸附等温方程的相关系数均大于0.99,如图6(b)所示,说明二甲苯异构体在MNP 上的吸附为单分子层吸附,吸附材料上吸附位点均匀分布。拟合得到PX 最大吸附量131 mg·g-1,MX 最大吸附量118 mg·g-1,与实验测得的结果相近;而OX 的最大吸附量拟合值达344 mg·g-1,大于目前实验测定的吸附量,这是因为在OX 溶液平衡浓度0.9 mol·L-1时,还没有达到其最大饱和吸附量。
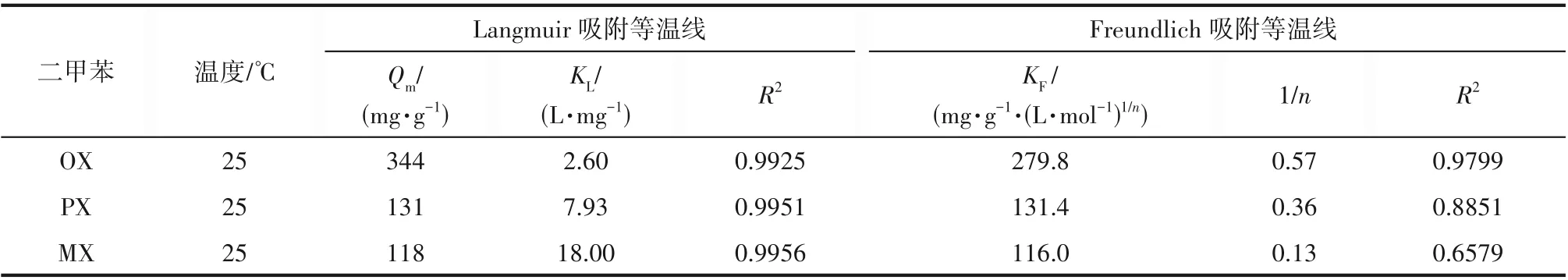
表2 单组分二甲苯在MNP上吸附的Langmuir等温线拟合参数和Freundlich等温线拟合参数Table 2 Parameters from fitting the adsorption isotherms of single-xylene isomer on MNP to Langmuir adsorption model and Freundlich adsorption model
为了探究温度对MNP 的二甲苯吸附性能的影响,测试了25、35 和45℃下的MNP 在1.0 mol·L-1的单组分二甲苯溶液中的吸附量,结果如图6(c)所示。随着温度升高,三种二甲苯的吸附量都呈下降趋势,证明二甲苯异构体的吸附是放热过程。这一特质使得MNP 更适合常温下的二甲苯吸附分离,与需要较高温度(120~250℃)来确保足够的传质速率的分子筛材料[11,34]相比,MNP 作为吸附剂具有更突出的节能优势。

图6 (a) 25℃下MNP的单组分二甲苯的吸附等温线;(b) MNP在25℃下吸附单组分二甲苯的Langmuir吸附等温线拟合;(c) 温度对MNP的单组分二甲苯吸附量的影响Fig.6 (a) Single-xylene isomer adsorption isotherms on MNP at 25℃; (b) Langmuir isotherms of single-xylene isomer adsorption on MNP at 25℃; (c) The effect of temperature on single-xylene isomer adsorption on MNP
2.4 多组分二甲苯竞争吸附性能
为了研究MNP 的二甲苯吸附分离能力,本研究分别进行了OX/PX 和OX/MX 二元液相竞争吸附实验。图7(a)展示了OX 和PX 二元液相吸附的吸附量和选择性。与预期相符,MNP 对OX 的吸附优先于PX,OX 和PX 的吸附量随溶液浓度增加而增加,但OX/PX 的选择性基本上不随溶液浓度的变化而变化,维持在1.7~1.9之间。图7(b)是OX 和MX 二元液相吸附的吸附量和选择性对比,同样地,MNP 对OX的吸附量更高。初始浓度小于0.6 mol·L-1时,OX 吸附量随浓度增加的增速比MX 更快,OX/MX 选择性也随浓度增加而提高,说明MNP 对OX 的吸附能力更强,OX 可以更快速地与吸附位点结合。初始浓度为0.6 mol·L-1时,OX/MX 的选择性最大,达到2.4。但当初始浓度为0.8 mol·L-1时,OX 吸附量接近饱和吸附量,吸附量随浓度增加的增速变慢,此时OX/MX的选择性略有降低,在2.0左右。
为了进一步研究MNP 对三组分二甲苯的吸附分离情况,本研究使用等摩尔三组分二甲苯溶液进行三元液相吸附实验。图7(c)中,随着溶液浓度的提升,OX 的吸附量迅速增加,而MX 和PX 的吸附量增加较缓慢,说明OX 比其他两种客体分子更容易进入吸附剂的通道。初始浓度为0.8 mol·L-1时,OX吸附量为142 mg·g-1,而PX 和MX 吸附量均为103 mg·g-1。由于MNP 中有限的吸附位点,多组分体系中OX 组分的吸附量低于单组分体系中的OX 吸附量。图7(d)显示OX/MX 和OX/PX 的选择性随浓度升高而降低,最后都稳定在1.4 左右,这是因为高浓度的PX 和MX 与吸附位点发生相互作用的概率增加,从而使OX 的竞争吸附减弱。三元液相吸附实验也证明了MNP在三组分二甲苯溶液中对OX具有选择性吸附的能力。
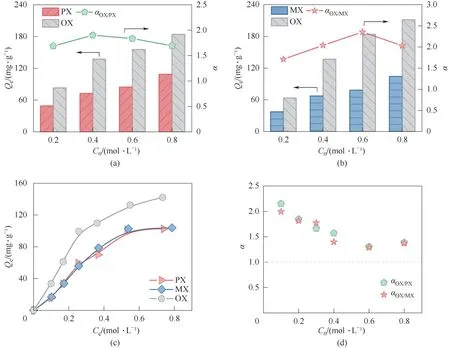
图7 (a) 25℃下MNP吸附分离OX和PX的二组分竞争性实验;(b) 25℃下MNP吸附分离OX和MX的二组分竞争性实验;(c) 25℃下MNP吸附分离二甲苯的三组分竞争性实验中的各组分吸附量;(d) 三组分竞争性实验中OX/PX和OX/MX选择性Fig.7 (a) Competitive batch adsorption experiments on MNP conducted with a binary mixture of OX and PX at 25℃; (b) Competitive batch adsorption experiments on MNP conducted with a binary mixture of OX and MX at 25℃; (c) The adsorption capacity of each isomer on MNP in the competitive batch adsorption experiments conducted with a ternary mixture of PX, OX and MX at 25℃; (d) OX/PX and OX/MX selectivity in the ternary competitive batch adsorption experiments
2.5 柱吸附分离性能
为了模拟实际状态下混合二甲苯的分离条件,本研究采用自制的柱吸附分离装置[图8(a)]来测试MNP的等摩尔三元液相动态穿透曲线。从图8(b)可以看出,PX 和MX 组分在6 min 时出现在洗脱液中,而OX 在8 min 时才出现,OX 可以被完全分离出来。MNP 可选择性吸附OX,这和静态吸附实验得到的结论一致。在柱吸附分离实验中,MNP 的吸附偏好为OX>MX>PX,OX/PX 的吸附选择性是1.3,而OX/MX 的选择性是1.2。动态穿透曲线的数据说明MNP 可以将OX 从三组分混合二甲苯溶液中分离出来,具有实际应用潜力。
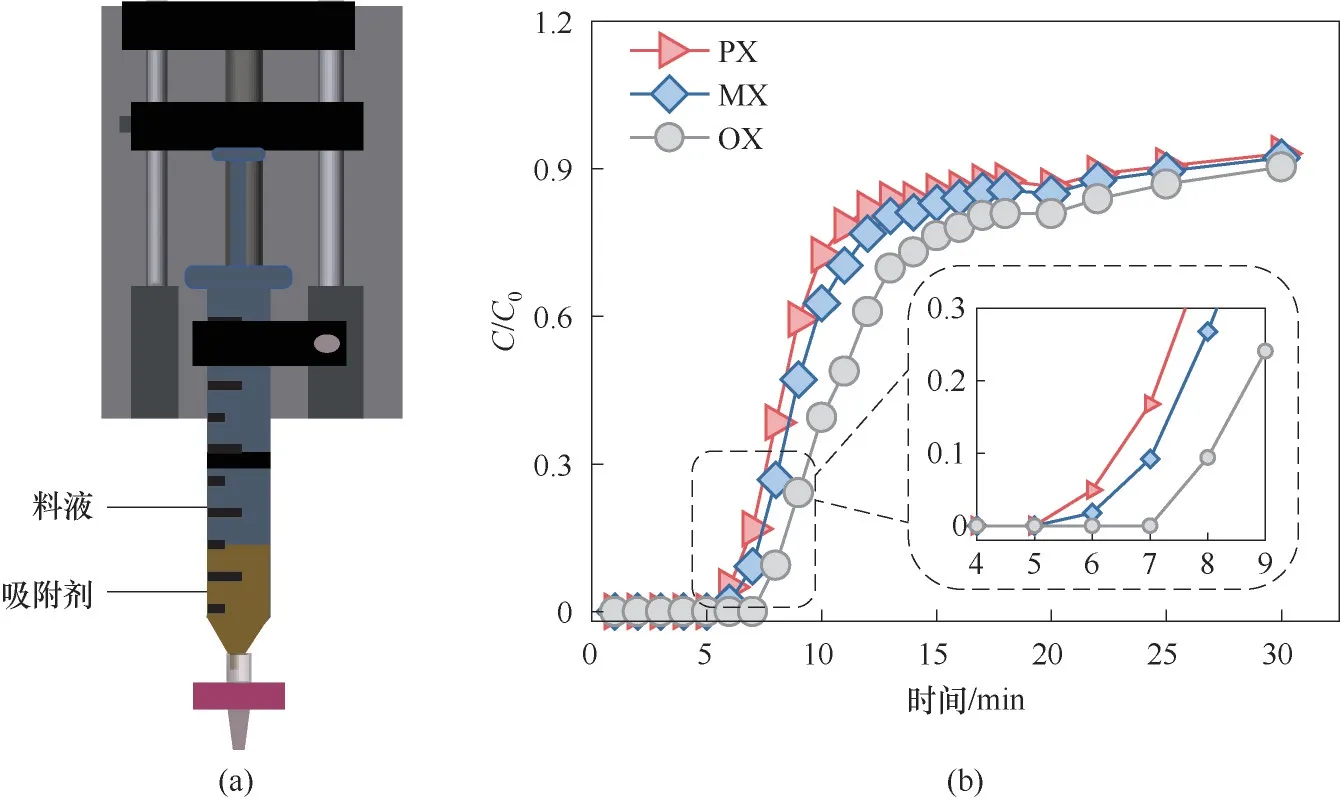
图8 (a) 柱吸附分离装置图;(b) 25℃下MNP吸附分离OX、PX和MX三组分柱吸附实验中的穿透曲线Fig.8 (a) Schematic representation of a homemade column separation device; (b) Breakthrough curves on MNP in the column adsorption experiment conducted with a ternary mixture of PX, OX and MX at 25℃
2.6 吸附机理研究
为了探究MNP 与二甲苯客体分子的吸附机理,对吸附二甲苯前后的MNP进行了FT-IR研究[12]。从图9可以看出,MNP 中的苯环骨架伸缩振动峰在吸附后发生蓝移,波数从初始的1660 cm-1变为1654和1653 cm-1。这表明主要的吸附位点是MNP 中的苯环,它与二甲苯的苯环形成π-π 堆积,也可以与二甲苯的甲基形成CH/π 相互作用[30],从而将客体分子吸附在空腔内部。MNP 分别吸附三种二甲苯异构体后,苯环骨架伸缩振动峰的位移大致相等,表明MNP 中的吸附位点与二甲苯异构体间的相互作用力并不是其OX 优先吸附性能的决定性因素。

图9 MNP吸附二甲苯前后的红外光谱图Fig.9 FT-IR spectra of MNP before and after adsorption of xylene isomers
为了进一步确定MNP的OX优先吸附性能的由来,对三种二甲苯异构体具体的分子尺寸进行了探究。如表3 所示,PX、MX 和OX 的分子长度分别为9.15、8.99、7.83 Å[14],且OX 的长宽比最小,接近1。由于长度熵效应[35],OX 分子具有更高的填充率。Noria分子内部是柱状的空腔,与OX的形状更接近。且空腔尺寸6~8 Å,更长的PX 和MX 分子会因为旋转运动的限制而更难进入空腔,所以MNP 对OX 客体分子具有形状选择性[22]。

表3 二甲苯异构体的性质Table 3 Properties of xylene isomers
3 结 论
本文采用Noria 和TFTPN 制备了具有高比表面积的MNP,并研究了MNP对二甲苯异构体的吸附分离能力,结论如下。
(1)MNP 的二甲苯吸附动力学符合准二级动力学模型,说明其吸附速率受化学吸附机理的控制;其吸附等温线符合Langmuir 吸附等温方程,说明二甲苯在MNP 上的吸附是单分子层吸附,OX 最大吸附量达344 mg·g-1。此外,MNP 对二甲苯的吸附是放热过程,适合在较低温度下使用,节省能耗。
(2)静态的竞争吸附实验表明,MNP 对OX/PX的选择性在1.7~1.9 之间,而OX/MX 的选择性最高达到2.4。动态穿透曲线也表明了MNP 可从三组分二甲苯混合溶液中分离出OX,证明其具有实际应用的潜力。
(3)MNP 的微孔结构使其具有优异的吸附能力。Noria分子内部空腔与OX形状尺寸相近,对OX客体分子具有形状选择性,从而MNP 对OX 具有吸附选择性。
(4)MNP 合成方法简单,热稳定性好且吸附性能优异,具有实际应用的潜质。这种由自具空腔的大环分子交联组成的微孔有机聚合物,为开发新型二甲苯分离材料提供了新方向。

