基于UPLC-QTOF-MS的单增李斯特菌复方新诺明耐药性菌株代谢组学分析
周继福,王 娉,郭 佳,3,陈 颖*
(1 中国检验检疫科学研究院 北京 100176 2 南京财经大学食品科学与工程学院 南京 210023 3 天津科技大学食品科学与工程学院 天津 300457)
单增李斯特菌(Listeria monocytogenes)是一种革兰氏阳性、局部厌氧的短杆菌。菌株感染引起的李斯特菌病严重危害着人类健康[1]。轻度感染会导致伴有发烧、呕吐和腹泻的肠胃炎,而重度感染则会导致脑膜炎、败血症、脑炎和孕妇流产等严重的李斯特菌病[2]。对于李斯特菌病的治疗,通常推荐β-内酰胺类抗生素(氨苄西林和青霉素)与氨基糖苷类抗生素单独或联合使用[3-4]。然而,疾病治疗中部分患者对青霉素的过敏反应会造成休克或死亡[5],对于青霉素表现过敏的患者,复方新诺明(Trimethoprim-sulfamethoxazole,SXT)作为常选的替代药物被使用。此外,复方新诺明在临床上也是治疗中枢神经退行性疾病和脑膜炎最好的口服替代药物[6-7]。然而,抗生素的过度使用,已造成多种类食品及临床标本中发现复方新诺明耐药株。在1 份临床和食品分离的李斯特菌耐药性统计中发现,菌株对复方新诺明的耐药率为40.9%,远超庆大霉素的23.0%和青霉素的11.1%[8]。在鱼类及鱼加工工厂中分离的单增李斯特菌,对复方新诺明的耐药率为47.1%[9]。从我国南京即食肉类食品中分离的33 株单增李斯特菌展现出100%的复方新诺明耐药性[10]。鉴于复方新诺明在临床上的用药地位和极高的耐药率,有必要探究单增李斯特菌复方新诺明相关耐药性的形成原因。
代谢组学是一种解释复杂生物系统的综合性研究方法,主要研究菌株细胞某一时刻所有代谢产物的集合,获得细胞代谢轮廓并对细胞生物学功能进行阐释[11-12]。代谢组学技术已在一些病原菌抗生素耐药性研究中得到应用[13-15]。目前对于单增李斯特菌的耐药性研究主要集中在植物提取物[16-17]和微生物多肽[18]的抗菌机制方面。Zhao 等[16]利用NMR 研究抗菌多肽和葡萄籽提取物 (Grape seed extract,GSE)对单增李斯特菌的抑菌作用,结果发现使用前、后,菌株的三羧酸循环(TCA)、能量代谢和氨基酸生物合成被阻断,从而展现出抗菌效果,然而尚未见在单增李斯特菌抗生素耐药性研究中应用的报道。面对日益严峻的抗生素耐药现状,了解菌株受抗生素作用产生的细胞代谢反应,可为药物作用靶标的寻找、耐药机制研究及开发新型抗生素提供研究基础。
本研究基于非靶标代谢组学方法,利用超高效液相色谱-四极杆飞行时间质谱联用技术(Ultrahigh performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-QTOFMS)对菌株胞内代谢产物进行分离、检测,分析菌株代谢轮廓存在的显著性差异,并对菌株耐药代谢途径进行富集分析,探究菌株代谢特征和耐药性之间的关联性。
1 材料与方法
1.1 材料与试剂
试验菌株为本实验室分离获得,食品分离基质包括即食食品,生、熟肉,40 株菌株信息见表1。

表1 食品分离株主要信息Table 1 Main information of L.monocytogenes
脑心浸液肉汤(Brain heart infusion,BHI)、脑心浸液琼脂(Brain heart infusion agar,BHIA),英国OXOID 公司;甲醇(质谱纯),乙腈(质谱纯),美国Thermo Fisher 公司;甲酸,美国Honeywell 公司;Milli-Q 纯水,德国默克集团;Kinetex 反相C18液相色谱柱,美国飞诺美(phenomenex)公司;聚四氟乙烯微孔过滤器,上海安谱实验科技股份有限公司。
1.2 仪器与设备
高速冷冻离心机(D-37520),德国Osterode 公司;小型迷你台式恒温摇床(XHZ-03),上海堪鑫仪器设备有限公司;超声波清洗仪(SB5200D),宁波新芝生物科技股份有限公司;真空离心浓缩仪(Concentrator plus),德国Eppendorf 公司;四极杆飞行时间串联质谱仪(Triple TOF 6600)、超高效液相色谱仪(ExionLC AD),美国AB SCIEX 公司。
1.3 方法
1.3.1 菌株活化和培养 将磁珠保藏菌株接种于BHI 培养基中,37 ℃下恒温摇床培养16~18 h。取出后用无菌接种环蘸取一环菌液划线接种于BHIA 平板上进行二次活化培养,37 ℃恒温培养16~18 h,进行菌株药敏试验。取200 μL 第1 次纯培养物,按照体积比1∶100 加到新鲜的BHI 培养基中扩大培养,取对数生长期菌液进行胞内代谢物提取。
1.3.2 菌株药物敏感性试验 使用微量肉汤稀释法测定菌株的抗生素敏感性。阳性对照质控菌株为金黄色葡萄球菌(ATCC 25923)。根据菌株的最小抑菌浓度 (Minimum inhibitory concentration,MIC) 值对照临床实验室标准化研究所(Clinical and Laboratory Standards Institute,CLSI)M100-S24-2014 标准对菌株耐药性进行判读[19](表2),当质控菌株药敏结果符合标准时,认为药敏试验结果真实可靠。
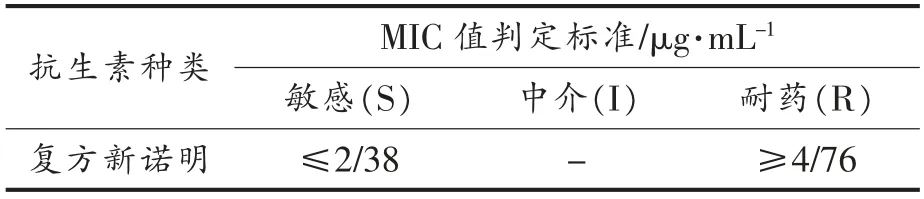
表2 临床实验室标准化研究所复方新诺明M100-S24-2014 标准Table 2 M100-S24-2014 standard of institute of clinical laboratory standardization
1.3.3 菌株淬灭及代谢产物的提取、浓缩 菌株胞内代谢产物的提取参照Singh 等[20]的方法,略作修改。试验中,加入40%冷甲醇水(4 ℃)淬灭溶液的体积为1.5 mL;室温下在细胞碎片中加入无菌超纯水的体积为1.5 mL,其余步骤参照文献[20]进行。真空离心浓缩仪用于菌株胞内代谢物的离心浓缩,对旋干后的浓缩产物加入100 μL 超纯水进行复溶。涡旋混匀后的胞内代谢产物用0.22 μm聚四氟乙烯微孔过滤器过滤。将样品置于带有内衬管的螺纹口自动进样瓶中,-80 ℃保存。每个菌株样品做4 次生物学平行试验。每个样本取同等体积 (10 μL) 代谢提取物混匀,作为质量控制(Quality control,QC)样品,对试验仪器的稳定性和重复性进行监测。
1.3.4 非靶标代谢组学分析 采用超高效液相色谱系统(ExionLC AD,AB SCIEX)对菌株胞内代谢产物进行分离。色谱柱使用C18 反相色谱柱(2.6 μm,100 A,100 mm×2.1 mm)。液相色谱系统参数设定:流动相:A 相:含0.1%甲酸的水溶液;B相:含0.1%甲酸的乙腈溶液。流动相使用前进行超声脱气。流动相洗脱梯度如表3所示,色谱柱温度40 ℃,进样量3 μL。

表3 流动相洗脱梯度Table 3 Mobile phase elution gradient
胞内代谢产物的检测采用联用电喷雾电离(ESI)的四极杆飞行时间串联质谱仪(Triple TOF 6600),分别在正、负离子电离模式下采集数据。使用全扫(Full-Scan)和信息依赖扫描模式(Informa-tion dependent acquisition,IDA),动态背景扣除(DBS),对一级、二级谱图进行采集。离子源参数设定:正离子模式下的喷雾电压(Ion spray voltage floating,ISVF),5 000 V;负离子模式下的喷雾电压(ISVF),-4 500 V。一级质谱的扫描范围m/z 100~1 000,保留时间0.250 s;二级质谱扫描范围m/z 50~1 000,保留时间0.05 s,模式选用高分辨模式(High resolution),碰撞电压(Collision energy,CE)为35 eV,碰撞能量叠加(Collision energy spread,CES)为15 eV。为保证高分辨质谱在数据采集过程中的高质量灵敏度,使用自动校准装置系统(Calibration device system,CDS)加注专用CDS 校准液用于系统校正[21]。
1.4 数据分析
1.4.1 数据处理和分析 使用MarkerView 1.3.1软件(AB SCIEX)实现对所有进样样品的峰检测、峰比对、峰积分和数据归一化等数据预处理。利用SIMCA15.0.2 软件对预处理的矩阵数据进行化学计量学分析,分析中权重(Weighting)设为佩尔托标度(Pareto scaling,par)、转化(Transformation)为log 转化。试验建立有监督的正交偏最小二乘分析(Orthogonal partial least squares discriminant analysis,OPLS-DA)模型。模型的拟合参数(R2Y 和Q2)用于直观评判模型的质量,当R2Y 和Q2值大于0.9 时,认为建立的模型有非常优秀的可靠性和预测度。参数R2和Q2的差值最好处于0.2~0.3之间。试验中使用置换检验模式对模型进行检验,模型参数直观表示为R2的截距小于0.3 并接近于0,Q2的截距小于0.05[22]。
1.4.2 差异代谢物的定性 差异化合物的筛选遵循单维变量统计分析和多维变量统计分析相结合的方式。使用SIMCA 软件建立OPLS-DA 模型,根据模型输出变量重要性投影值 (Variable importance in projection,VIP),结合显著性统计值进行潜在差异化合物的筛选。试验中设定的差异化合物定性标准为“VIP≥1.5 & P <0.05”。潜在差异化合物的初步筛选使用PeakView 2.2 软件(AB SCIEX)中的Formular Finder 插件,选择质量误差在±5×10-6u 以内的化学式进行数据库检索和物质鉴定。差异化合物的对比确证使用人类代谢组数据库(Human metabolome database,HMDB)(http://www.hmdb.ca)、MassBank(https://massbank.eu/MassBank) 和在线软件MS-DIAL(http://prime.psc.riken.jp/compms/msdial/ main.html)[23-24]。
1.4.3 差异代谢物可视化分析和代谢通路分析GraphPad Prism 8.0.2.(263)软件用于差异化合物火山图绘制。MetaboAnalyst 5.0 在线数据处理软件 (https://www.metaboanalyst.ca) 中的Statistical Analysis 模块用于差异化合物层次聚类分析,软件的Pathway Analysis 模块结合京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)(https://www.kegg.jp)用于代谢通路富集分析。
2 结果与分析
2.1 菌株药物敏感性试验
基于CLSI 判别标准,对40 株单增李斯特菌进行9 种常见抗生素药物敏感性测定。测定结果(表4)表明:所有菌株对庆大霉素、氨苄西林、青霉素、万古霉素、红霉素、利福平、四环素等7 种抗生素均表现为敏感。菌株对复方新诺明和环丙沙星有耐药现象,耐药率分别为30%(12/40)和100%(40/40)。单增李斯特菌对环丙沙星的耐药分析研究将在其它试验中开展。

表4 单增李斯特菌常见抗生素药敏性结果Table 4 Results of drug sensitivity to common antibiotics of L.monocytogenes

(续表4)
2.2 化学计量学分析
基于UPLC-QTOF-MS,在正、负离子模式下对单增李斯特菌胞内代谢产物进行分离、检测。在MarkerView 软件输出的数据矩阵中,选择单同位素峰用于后续化学计量化学分析。根据总离子流图结果(图1),正、负离子模式下Markerview 软件峰提取时间分别设置为0.6~5.0 min 和0.6~6.0 min。在正、负离子模式下,分别获得3 795 个和4 174 个峰,化学计量学中用这些峰来说明SXT耐药株和敏感株的差异代谢特征[25]。


图1 SXT 耐药株和敏感株的UPLC-QTOF-MS 总离子流图Fig.1 UPLC-QTOF-MS total ion chromatogram of SXT-resistant strains and sensitive strains
使用SIMCA 软件进行化学计量学分析。根据菌株复方新诺明药敏试验结果,将试验菌株分为SXT 耐药株和敏感株,根据分组建立OPLS-DA 模型。如OPLS-DA 得分图所示(图2a,3a),SXT 耐药株和敏感株的样本点距离较远,并有明显的聚集趋势,说明耐药株和敏感株在代谢轮廓上存在差异。为直观表示模型拟合程度,OPLS-DA 在正、负离子模式下的拟合参数分别为:正离子模式下,R2Y=0.991;Q2=0.981,负离子模式下,R2Y=0.992;Q2=0.988,2 种电离模式下的模型参数指标均接近于1,说明模型OPLS-DA 具备很强的解释和预测能力,能有效区分SXT 耐药株和敏感株。
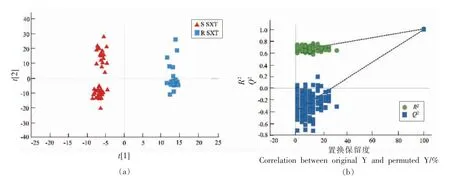
图2 正离子模式下SXT 耐药株和敏感株OPLS-DA 得分图(a)及置换检验图(b)Fig.2 OPLS-DA score plot (a) and permutation test (b) of SXT-resistant strains and sensitive strains in positive ion mode

图3 负离子模式下SXT 耐药株和敏感株OPLS-DA 得分图(a)及置换检验图(b)Fig.3 OPLS-DA score plot (a) and permutation test (b) of SXT-resistant strains and sensitive strains in negative ion mode
为验证建立的OPLS-DA 模型的预测能力和解释能力,选择置换检验进行验证。200 次迭代循环的置换检验结果如图2b 和3b 所示,正、负离子模式下的原始模型Q2检验结果分别为-0.385 和-0.397,数值均小于0.05。这说明建立的OPLS-DA模型能够用于单增李斯特菌复方新诺明耐药株和敏感株的鉴别,试验数据可用于菌株代谢特征分析。
2.3 差异化合物分析
根据差异化合物筛选标准实现潜在差异化合物的筛选。通过查阅相关文献和HMDB 对化合物的描述,最终确定耐药SXT 菌株和敏感株的胞内差异化合物有21 种(表5)。耐药前、后的化合物变化显著,主要以氨基酸、核苷和核苷酸为主。比较耐药株和敏感株的差异倍数(Fold change,FC)值发现,相比于敏感株,耐药株中包括4-氨基丁酸、亮氨酸和色氨酸在内的14 种化合物表现为上调【log2(FC)>0】,而腺苷二磷酸核糖和4-羟基肉桂酸等7 种物质表现为下调【log2(FC)<0】。根据VIP 值分析发现,氨基酸类物质的VIP 值更大,说明菌株受到SXT 作用产生耐药性后,氨基酸类物质的变化更为明显,更能表现SXT 耐药株和敏感株间的差异(图4)。

图4 复方新诺明耐药株和敏感株差异代谢物火山图Fig.4 Volcano map of the differential metabolites between SXT-resistant and sensitive strains

表5 复方新诺明耐药株和敏感株差异化合物信息表Table 5 Overview of differential compounds in L.monocytogenes SXT-resistant and sensitive strains
为表示差异化合物丰度水平在SXT 耐药株和敏感株之间的聚类程度,采用聚类热图进行可视化分析。如图5所示,R SXT 和S SXT 分别代表SXT 耐药株和SXT 敏感株。聚类结果表明40株单增李斯特菌被明显地区分为2 簇,说明代谢组学数据可将SXT 耐药株和敏感株区分开。热图中色标(2 至-2)表示SXT 作用菌株后细胞内差异化合物代谢水平由高到低的变化趋势。根据色标值的变化,包括亮氨酸、异亮氨酸、4-氨基丁酸、鸟苷、尿苷二磷酸葡萄糖和尿苷二磷酸半乳糖等15种化合物在SXT 耐药株中有较高的代谢水平,相反,这些物质在敏感株中的代谢水平较低。明显的代谢物丰度差异表明差异化合物可用于后续耐药株和敏感株的代谢通路富集分析[26]。

图5 SXT 耐药株和敏感株差异代谢产物热图Fig.5 Heatmap of differential metabolites between SXT-resistant strains and sensitive strains
2.4 差异代谢通路研究
为确定菌株受到复方新诺明作用产生耐药性前、后的相关代谢通路,基于KEGG 数据库结合Metaboanalyst 软件对定性的差异化合物进行代谢通路富集分析。分析发现,SXT 耐药株和敏感株的代谢途径一共有19 条(表6)。其中含2 个或2 个以上差异化合物的代谢途径有6 条,通过归类分析发现,6 条代谢途径分为氨基酸代谢(2 条)、碳水化合物代谢(2 条)、核苷酸代谢(1 条)和遗传信息的处理、翻译(1 条)。与差异化合物相关的主要代谢途径如图6a 所示。

表6 SXT 耐药株和敏感株代谢通路富集结果Table 6 Enrichment results of metabolic pathways of SXT-resistant strains and sensitive strains
为分析SXT 引起菌株耐药性和敏感性的显著性差异代谢途径和重要代谢途径,根据P<0.05筛选耐药株和敏感株的显著性差异代谢途径,结果发现分别属于核苷酸代谢和遗传信息处理、翻译的嘌呤代谢(a)和氨酰基tRNA 生物合成(b)代谢途径。根据响应值(Impact)≥0.10 筛选,结果发现受到SXT 作用严重影响的4 条代谢途径,分别为核黄素代谢(c),氨基糖和核苷酸糖代谢(d),甘油磷脂代谢(e),丙氨酸、天冬氨酸和谷氨酸代谢(f),归类表明代谢途径分别属于氨基酸代谢、碳水化合物代谢和脂质代谢。根据代谢途径在代谢通路中的相关关系设定图6b 的代谢网络。

图6 SXT 耐药株和敏感株代谢通路富集分析Fig.6 Enrichment analysis of metabolic pathways of SXT-resistant strains and sensitive strains
3 结论与讨论
本文基于超高效液相色谱-四极杆飞行时间质谱联用的非靶标代谢组学技术,研究单增李斯特菌复方新诺明耐药株和敏感株之间的代谢物差异。据文献报道,复方新诺明作用时细菌的二氢蝶呤合成酶和四氢叶酸的生物合成受阻,进而抑制核酸、蛋白质的合成,最终导致细菌生长繁殖障碍[27]。试验中,差异化合物在代谢途径中的调控变化表明:在氨酰基tRNA 的生物合成途径中,亮氨酸和色氨酸在SXT 耐药株中表达上调,而亮氨酸用于维持细胞渗透稳定,这说明菌株细胞难以抵抗SXT 的作用而生存菌株的抗性因亮氨酸的上调而降低[28-29]。色氨酸能够提高细胞氧化活性,菌株可以通过调节氧化应激来增强抗性。腺苷用于酸化激活氨基酸,产生的氨酰基腺酸转移至核糖核酸,从而生成氨酰基tRNA[30]。试验中鉴定的核苷酸类化合物(如腺苷)在SXT 耐药株中表现为下调,这说明菌株受SXT 作用后,菌株的能量供应和氨基酸生物合成受到影响。甘油磷脂作为微生物细胞的膜脂类物质,控制着细胞的调控转运、蛋白功能和信号转导[31]。试验中菌株在SXT 作用下,菌株细胞的甘油磷酸胆碱表达下调,说明SXT对细胞的作用使得细胞调控转运、蛋白功能和信号转导发生变化,从而影响菌株对抗生素的耐药性[32]。此外,试验分离的单增李斯特菌株对环丙沙星的耐药性非常高,值得关注,将在后续研究中分析。

