耐受性评估干预对胃癌术后病人胃肠不耐受及机体康复的影响
张丽丽,孟 冉,索珊珊,王文芳
胃癌手术病人术后机体处于高分解、高代谢状态,且病人无法进食,容易造成水电解质和营养素的丢失,不利于预后。肠内营养是该类病人比较常见营养支持方式,一般于术后24~48 h进行[1],其能维持肠道黏膜功能,改善病人的营养状况,减少并发症的风险[2]。但胃癌病人在肠内营养支持期间容易出现恶心呕吐、腹胀、腹痛等胃肠不耐受现象。据相关文献报道,胃癌手术病人喂养不耐受的发生率为30.5%[3]。胃肠不耐受的发生可直接影响肠内营养支持的效果,导致营养不良、住院时间延长以及死亡率增加[4]。因此,积极预防胃肠不耐受的发生十分重要。本研究选取我院2020年7月—2021年6月收治的87例术后进行肠内营养支持的胃癌病人为研究对象,探讨耐受性评估干预的实施效果。
1 资料与方法
1.1 一般资料 本研究选取我院2020年7月—2021年6月收治的87例术后进行肠内营养支持的胃癌病人为研究对象,将2020年7月—2020年12月收治的42例胃癌手术病人设为对照组,将2021年1月—2021年6月收治的45例胃癌手术病人设为观察组。纳入标准:①经病理学确诊,符合胃癌的诊断标准[5];②年龄18~75岁,择期手术;③符合肠内营养指证,首次进行肠内营养;④术前未行放化疗;⑤术前无幽门梗阻及出血;⑥知情同意参与本研究;⑦术后循环稳定;⑧临床资料完整。排除标准:①凝血功能障碍、免疫系统疾病;②严重的心肺功能障碍;③既往行消化道重建手术;④残胃癌及胃癌转移;⑤术前合并有重度营养不良;⑥合并肠道器质性疾病或功能性疾病。对照组:男23例,女19例;年龄(55.62±15.21)岁;体质指数(21.45±3.12)kg/m2;肿瘤大小<5 cm 22例,≥5 cm 20例;病理分期Ⅰ期4例,Ⅱ期14例,Ⅲ期24例;全胃切除12例,远端胃切除26例,近端胃切除4例。观察组:男24例,女21例;年龄(56.23±14.12)岁;体质指数(21.78±3.34)kg/m2;肿瘤大小<5 cm 25例,≥5 cm 20例;病理分期Ⅰ期6例,Ⅱ期16例,Ⅲ期23例;全胃切除11例,远端胃切除28例,近端胃切除6例。两组病人一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 干预方法 所有病人均由同一位手术医生于全身麻醉下行腹腔镜胃癌根治术治疗,手术配合护士资质均衡。术前将鼻肠管缓缓沿病人的一侧鼻孔插入,术中手术医生在直视下调整鼻肠管长度,需超过吻合口远端的20~30 cm,缓慢撤出引导钢丝,封闭鼻肠管。对照组采用常规护理,观察组在对照组的基础上采用耐受性评估干预,具体如下。
1.2.1 常规护理 ①术后第1天经鼻肠管滴注生理盐水,若无不适,第2天开始肠内营养液滴注。营养液为能全力肠内营养悬浊液,采用肠内营养泵及输注管滴入。根据病人的体质指数、病情给予基本热能需要量,最多不超过1 500 mL。营养液的泵入按照由慢至快、由少至多、由淡至浓的原则进行,温度控制在36~39 ℃,采用肠内营养支持泵24 h匀速泵入,热量不足者由肠外营养补充。②采用复方氯己定含漱液进行口腔护理,每隔6 h 1次。喂养前做好翻身、咳痰、叩背等处理,保持呼吸道通畅。每次鼻饲后保持床头抬高30°~45°及左侧卧位30 min,防止反流误吸。③定时监测病人胃残留量,视情况调节病人的肠内营养速度,当胃残留量>200 mL或肠鸣音消失时停止鼻饲(测量胃残留量时停止肠内营养,然后用注射器从鼻胃管抽吸胃内容物)。每隔4 h采用温开水冲洗1次鼻饲管,防止管道堵塞和细菌滋生[6]。定时采用抽吸的方式清洗病人的胃部,避免病人出现恶心、呕吐等症状。交接班时确认胃管的刻度,记录24 h出入量。④观察病人在肠内营养支持的过程中有无腹痛、腹胀、恶心、呕吐、腹泻等症状的发生及频次,一旦发生及时通知医生,给予对症处理。肠内营养支持期间对胃肠动力较差的病人遵医嘱肌肉注射10 mg甲氧氯普胺。病人肛门排气后拔除鼻肠管,开始经口进食。
1.2.2 耐受性评估干预 采用耐受性评估表对病人术后肠内营养耐受的情况进行评估,每隔6 h评估1次,然后根据具体情况给予相应的干预措施。
1.2.2.1 耐受性评估 耐受性评估表共包括5项内容,分为恶心、呕吐、腹痛、腹泻、肠鸣音、腹胀。①腹痛:无痛计0分,轻微疼痛计1分,引起不适的疼痛计2分,产生窘迫感的疼痛计3分,严重的疼痛计5分,剧烈疼痛计9分。②腹胀:无腹胀计0分,轻度腹胀计1分,中度腹胀计2分,重度腹胀计3分,剧烈腹胀计9分。③肠鸣音:正常计0分,1 min>5次或<4次计1分,亢进(1 min>10次)或消失计3分,无肠鸣音影像学确定为肠梗阻计9分。④恶心、呕吐:无恶心、呕吐计0分,轻度恶心有腹部不适但无呕吐计1分,明显恶心但无呕吐计2分,严重呕吐或内容物及胃液吐出计5分。⑤腹泻:大便正常计0分,轻度腹泻(量<500 mL,每天次数<4次计1分,中度腹泻(大便不成形,较湿,量500~1 000 mL,每天次数4~6次)计2分,重度腹泻(稀便或水样便,量>1 000 mL,每天次数≥7次)计3分,剧烈腹泻(伴随血流动力学改变)计9分。耐受性评估量表的Cronbach′s α系数为0.943,内容效度指数为0.910[7]。
1.2.2.2 耐受性护理干预 若5项总分≤4分,按照原计划行肠内营养,循序渐进增加量;若 5项总分5~7分,维持或酌情减慢肠内营养液泵入速度,给予胃肠动力药物;若 5项总分8~12分,减慢营养液泵入速度,2 h后再次评估;若 5项总分≥13分(或任意2项评分≥9分),停止肠内营养,通知医生给予相应处理,症状改善后再次评估。除此之外:①对于发生恶心、呕吐的病人,减慢输注速度的同时检查鼻饲管的位置,条件允许的情况下指导病人早期活动,并遵医嘱用药。②对出现中度腹胀的病人,指导其进行早期活动、功能锻炼,减慢滴注速度,尽早安排腹部平片,排除肠梗阻,并遵医嘱使用胃肠动力药物,6 h后再次评估;重度和剧烈腹泻者停止肠内营养,评估肠梗阻情况。③重度、剧烈腹泻者通过鼻饲管给予止泻药,减慢输注速度,检查大便常规,同时给予抗生素治疗。④对无肠鸣音、肠鸣音亢进者停止肠内营养,遵医嘱给予药物治疗,2 h再次评估。对肠鸣音1 min>5次或<4次者保持或增加输注速度。在调整营养液输注速度时递增和递减以10 mL为宜,对年龄>70岁的病人每次递增幅度为5 mL。
1.3 观察指标
1.3.1 胃肠不耐受 参照相关文献[8],胃肠不耐受包括恶心(上腹部不适、紧迫预吐)、呕吐(胃内容物流出口腔)、腹胀(腹部较硬、局部隆突)、腹泻(排便次数每天3次以上,肠鸣音活跃,粪便不成形,水分占总粪便比≥85%)、腹痛。
1.3.2 术后恢复 ①营养指标:于术前1 d、术后5 d采集病人的清晨空腹外周静脉血,检测指标包括血清白蛋白(ALB)、血红蛋白(Hb),采用全自动生化分析仪检测,于我院检验科抽血、化验。②恢复时间:统计病人术后肠鸣音恢复时间、首次肛门排气时间、首次排便时间、恢复经口进食时间、住院时间。

2 结果

表1 两组病人胃肠不耐受情况比较 单位:例(%)
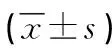
表2 两组病人营养指标比较
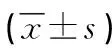
表3 两组病人术后机体恢复时间比较
3 讨论
3.1 胃癌病人术后的胃肠不耐受性 胃癌是消化系统最常见的恶性肿瘤,发病率占全身恶性肿瘤的第4位[9]。近年来,受饮食结构的变化、环境污染的加重等因素的影响,胃癌的发病率有逐渐上升的趋势。目前手术是治疗胃癌的主要方法,其辅以放化疗能够有效控制残留的肿瘤细胞,延长病人的生存期。但胃癌手术病人术后受手术创伤、消化道生理结构改变、围术期禁食等影响,容易出现营养不良。因此,充分有效的营养支持是胃癌病人术后治疗的重要环节。研究证实,肠内营养支持不仅能够改善胃癌病人术后的营养状况,而且能够保护胃肠道黏膜,促进胃肠道激素分泌和肠蠕动,纠正病人负氮平衡,降低腹腔感染和切口感染发生率[10]。相关研究表明,胃癌病人胃肠功能普遍受损,进行肠内营养支持治疗时容易出现不耐受的现象[11]。临床上针对肠内营养支持不耐受现象的处理措施主要有观察胃肠道并发症、主观询问等方式评价耐受性,使用促胃动力的药物、集束化管理等[12],尚缺乏对肠内营养耐受性评价的规范、系统、适宜的方法。
3.2 耐受性评估干预减少了胃癌病人术后的胃肠不耐受性 为了减少胃癌手术病人术后肠内营养支持不耐受的发生,本科室使用肠内耐受性评估表,并针对评估的结果采取有针对性的护理措施。结果显示,与常规护理相比,耐受性评估干预组的病人恶心、呕吐、腹胀、腹痛等胃肠不耐受发生率明显降低(P<0.05)。许多学者认为,胃癌术后病人应早期行肠内营养支持,但胃肠不耐受是影响肠内营养支持顺利进行的主要障碍[13],本研究对照组中有26.19%的病人出现不耐受。朱丽等[14]研究指出,对胃癌病人进行肠内耐受性评估,可提高病人术后肠内营养支持的耐受性。孙蓉蓉[15]研究发现,肠内营养耐受性评估可促进胃癌术后胃肠功能的恢复,减少并发症。但临床上尚缺乏针对肠内营养耐受性有效评估与干预的系统性研究。本研究将5项常见胃癌肠内营养支持不耐受指标作为评估的主要内容,并量化相应的分值。护理人员根据各自症状的分值以及总分情况给予相应的护理,这在一定程度上提高了护理人员对胃肠耐受评估及处理的准确性,避免了主观陈述造成的评估效果的差异。同时客观耐受性的评估具有动态化、连续性,使护理对策的实施更有依据,护理人员根据病人耐受性的不同调节肠内营养液的输注速度、使用胃肠动力药物,促进了护理措施的规范化、标准化,提高了肠内营养支持护理的质量,减少了胃肠不耐受的发生。
3.3 耐受性评估改善了胃癌病人术后的营养状况 本研究结果还显示,与常规护理相比,耐受性评估干预组的营养支持第5天的Hb,ALB水平更好,而且胃肠功能恢复相关时间更短(P<0.05)。陈国庆等[16]研究结果表明,为危重病人进行肠内营养耐受性评估,不仅能减少胃肠不耐受症状,而且能进一步改善肠内营养支持的营养效果,如提升Hb,ALB等,与本研究结果一致。多项研究表明,胃肠不耐受可导致病人达不到营养目标,影响临床结局[17-18]。而耐受性评估干预通过并赋予胃癌肠内营养支持病人对应等级和护理,大大减少了胃肠不耐受的发生,使病人能够顺利地进行肠内营养支持,改善术后的营养状态,同时也在一定程度上促进了胃肠功能的恢复,有利于实现病人术后的快速康复[19]。
综上所述,耐受性评估干预能够显著减少胃癌病人术后肠内营养胃肠不耐受的发生,有利于促进病人机体康复。

