β-蜕皮甾酮对MPTP 诱导的帕金森病的体内保护研究
渠丽丽 张英博 董海影 刘得水 陈培培 张晓杰
齐齐哈尔医学院,黑龙江齐齐哈尔 161006
帕金森病(Parkinson’s disease,PD)是常见的神经退行性疾病,其特征是黑质多巴胺能神经元退化,纹状体多巴胺显著减少[1]。PD 最明显的症状表现为震颤、僵硬、动作迟缓、姿势不稳和行走困难[2]。研究显示,活性氧的过度产生、氧化应激[3]和线粒体功能障碍[4-5]是PD 发病的原因。因此,寻找可以缓解PD 症状及预防多巴胺能神经元变性的新药对于PD 的治疗很重要。近年来,中药及其中药单体成分对PD 的治疗或辅助治疗越来越受到人们的关注[6]。牛膝是一种传统的中草药,其水煎液具有抗氧化药理活性[7-8]。β-蜕皮甾酮是牛膝等几种中草药的主要成分。研究发现,β-蜕皮甾酮可清除自由基发挥抗氧化效应[9-10],具有抑制脑组织脂质过氧化损伤的作用[11-12]。而激活PI3K/AKT 通路具有一定的抗氧化作用[13]。本研究拟采用MPTP 构建小鼠PD 模型,探讨β-蜕皮甾酮通过调节PI3K/Akt 通路保护多巴胺能神经元并减弱细胞凋亡机制。
1 材料与方法
1.1 材料
购买42 只C57BL/6 雄性小鼠,月龄8 周,体重为(20±2)g[辽宁长生生物,许可证号:SCXK(辽)2020-0001]。MPTP(美国SIGMA);β-蜕皮甾酮(MCE);司来吉兰(芬兰orion corporation);PI3K(Affinit,批号:AF6241);TH、P-PI3(CST,批号:58844S;4228T);AKT、P-PAKT、BAX 及BCL-2(武汉三鹰,批号:60203、66444、50599、12789);蛋白酶抑制剂、磷酸酶抑制剂、二抗(博士德,AR1192、AR1183、BA1054、BA1050);BCA蛋白定量试剂盒(碧云天生物技术;批号:P0012S);eECL 显影液(康为世纪,批号:CW0049S);全自动凝胶成像系统(美国ABI);实时荧光定量PCR 仪(美国ABI)。
1.2 实验方法
1.2.1 动物分组 按随机区组法对小鼠称重进行分组,后用随机数字表法将42 只小鼠分为正常组(A 组)、模型组(B 组)、司来吉兰组(10 mg/kg)(C 组)、β-蜕皮甾酮高(30 mg/kg)(D 组)、中(10 mg/kg)(E 组)、低(3 mg/kg)(F 组)剂量组,每组7 只,各治疗组于造模前分别用相应剂量药物进行灌胃,持续14 d,正常组与模型组分别用等量生理盐水灌胃。
1.2.2 模型制备 给予治疗药第10 天起,小鼠腹腔注射MPTP(30 mg/kg)[14],连续注射5 d。造模后可见小鼠出现震颤、竖毛、弓背、后脚伸直、流涎等表现。
1.2.3 组织取材 小鼠处死,冰上快速取脑。
1.2.4 行为学观察 将小鼠固定在杆顶部,记录其从头到尾下落时间,每只小鼠测3 次,取平均值。将小鼠前爪放在电线中间,后肢悬空。评分标准:双后肢抓住绳索为0 分,一只后肢抓住绳索为1 分,双后肢均抓不住绳索为2 分。检测时间1 min,连测3 d 取平均值。
1.2.5 Western blot 取小鼠黑质,加裂解液冰上匀浆,涡旋混匀,离心(13 500 r/min,离心半径7.5 cm)吸上清。BCA 法测定蛋白浓度,于沸水中变性。取蛋白样品用10%SDS-PAGE 凝胶分离,转至PVDF 膜。5%脱脂牛奶封闭2 h,一抗孵育过夜,二抗孵育2 h,TBST 漂洗后显影。
1.2.6 RT-qPCR Trizol 法提取总RNA,逆转录试剂盒将总RNA 逆转录为cDNA,配置RT-qPCR 体系:SYBR Green 预混液10.4 μl,cDNA 2 μl,正反向引物各0.8 μl,灭菌水补足20 μl 体系。反应条件:预变性95℃30 s,40 个循环(95℃5 s,60℃31 s,95℃15 s)。置于荧光定量PCR 仪进行扩增。比较CT 法用于计算经GAPDH 标准化的基因表达变化。引物序列见表1。

表1 引物序列
1.3 统计学方法
采用SPSS 26.0、Origin 2021 软件对所得数据进行统计分析。符合正态分布的计量资料以均数±标准差()表示,采用t 检验或方差分析。以P <0.05 为差异有统计学意义。
2 结果
2.1 各组行为学检测比较
B 组小鼠爬杆时间长于A 组,C、D、E 组小鼠爬杆时间短于B 组,差异有统计学意义(P<0.05);F 组爬杆时间与B 组比较,差异无统计学意义(P>0.05)。B 组小鼠悬挂评分高于A 组,C、D、E 组小鼠悬挂评分低于B 组,差异有统计学意义(P<0.05);F 组悬挂评分与B 组比较,差异无统计学意义(P>0.05)。见图1。
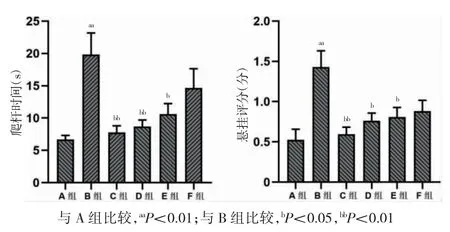
图1 各组行为学检测比较(n=7)
2.2 β-蜕皮甾酮对蛋白表达的影响
2.2.1 TH 蛋白表达B 组TH 表达低于A 组,C、D、E 组TH 表达高于B 组,差异有统计学意义(P<0.05);F 组TH 表达与B 组比较,差异无统计学意义(P>0.05)。见图2。

图2 Western blot 检测小鼠黑质内TH 蛋白含量(n=7)
2.2.2 β-蜕皮甾酮通过PI3K/AKT 通路减弱MPTP致PD 小鼠的细胞凋亡B 组P-PI3K/PI3K 及P-PAkt/Akt比值低于A 组,C、D、E 组P-PI3K/PI3K 及P-PAkt/Akt比值高于B 组,差异有统计学意义(P<0.05);F 组P-PI3K/PI3K 及P-PAkt/Akt 比值与B 组比较,差异无统计学意义(P>0.05)。B 组抑凋亡蛋白BCL-2表达低于A 组,促凋亡蛋白BAX 表达高于A 组,差异有高度统计学意义(P<0.01);C、D、E 组BCL-2蛋白表达高于B 组,BAX 蛋白表达低于B 组,差异有统计学意义(P<0.05);F 组BCL-2、BAX 蛋白表达与B 组比较,差异无统计学意义(P>0.05)。见图3~4。
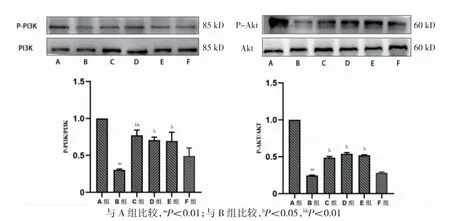
图3 Western blot 检测小鼠黑质内P-PI3K、PI3K、P-Akt、Akt 蛋白含量(n=7)
2.3 BCL-2、BAX mRNA 的表达
B 组BCL-2 mRNA 表达量低于A 组,C、D、E 组BCL-2 mRNA 表达量高于B 组,差异有统计学意义(P<0.05)。B 组BAX mRNA 表达量高于A 组,C、D、E组BAX mRNA 表达量低于B 组,差异有统计学意义(P<0.05);F 组BCL-2 及BAX mRNA 表达量与B 组比较,差异无统计学意义(P>0.05)。见图5。

图4 Western Blot 检测小鼠黑质内BCL-2、BAX 蛋白含量(n=7)

图5 PCR 检测小鼠黑质内BCL-2、AX mRNA 含量(n=7)
3 讨论
PD 是一种进行性神经退行性疾病,具有运动迟缓、静息性震颤和强直等症状[15]。PD 发病与环境、衰老和遗传因素有关,氧化应激和线粒体功能紊乱是散发型和家族型PD 多巴胺能神经元死亡的发病机制[16]。目前,PD 的主要药物治疗是通过左旋多巴补充多巴胺[17]。而多巴胺补充剂只能缓解疾病症状,不能减缓PD 进展,长期使用左旋多巴会导致致残波动和运动障碍[18]。
体外实验证实β-蜕皮甾酮对MPP+诱导的PD模型具有神经保护作用[19],但体内经PI3K/Akt 通路是否有助于缓解PD 尚未阐明。此研究中,MPTP 体内诱导PD 小鼠模型,拟找出β-蜕皮甾酮对PD 治疗的影响。司来吉兰用作阳性对照药物评估β-蜕皮甾酮的相对治疗效果[20]。行为学实验中爬杆和悬挂实验是测量PD 小鼠运动迟缓、评估肌肉力量的有效方法,结果显示,β-蜕皮甾酮以剂量依赖式缓解PD 小鼠的运动迟缓和肌强直等症状。TH 一种合成多巴胺的限速酶,且研究表明TH 在PD 发病机制中起关键作用[21]。研究采用Western blot 检测TH 蛋白表达,结果显示,β-蜕皮甾酮以剂量依赖式上调TH 蛋白表达。研究发现激活PI3K/Akt 通路可减弱MPTP 诱导的氧化应激反应[22],且经证实其可调节下游Nrf-2 信号[23]。Nrf-2 抗氧化反应调节因子,活化入核后可诱导下游超氧化物歧化酶、谷胱甘肽转移酶等Ⅱ相抗氧化解毒酶转录[24],继而对抗氧化应激诱导的细胞凋亡和神经元坏死。促凋亡蛋白Bax 和抑凋亡蛋白Bcl-2 之间的平衡在调控细胞凋亡中起着重要作用[25],研究显示,MPTP 可扰乱了Bax 和Bcl-2 之间的平衡[26]。本研究显示,中、高剂量β-蜕皮甾酮治疗减弱MPTP 引起的PI3K 和Akt 磷酸化的下调,并显著抑制促凋亡蛋白,增强抑凋亡蛋白表达。RT-qPCR 结果中各组小鼠Bcl-2与BAX mRNA 表达量进一步证实β-蜕皮甾酮以剂量依赖式改善由MPTP 诱导的PD 小鼠的细胞凋亡。
综上所述,β-蜕皮甾酮以剂量依赖式激活PI3K/Akt 通路改善MPTP 致PD 小鼠的神经元损伤并减弱细胞凋亡,继而保护多巴胺能神经元免受MPTP诱导的神经毒性。

