埋地钢质管道阴极保护的研究进展
温宁华, 吴广春, 张 瑶, 赵芸黎, 兰 旭, 王修云,3
(1. 安科工程技术研究院(北京) 有限公司, 北京 102200;2. 塔里木油田分公司油气运销部, 新疆 库尔勒 841000;3. 北京科技大学新材料技术研究院, 北京 100083)
0 前 言
阴极保护是目前公认的一种有效抑制埋地钢质管道腐蚀的电化学防护技术,在世界范围内有着广泛的应用,其与防腐涂层联合使用是目前埋地钢质油气管道外腐蚀防护领域最常用的防护手段[1-6]。 阴极保护有着悠久的研究历史,最早可追溯至19 世纪初期Volta等对于铜金属腐蚀防护的研究[7]。 然而,相比于铜、锌,铁和低碳钢的阴极保护研究由于作用机制上的根本性差异滞后了许久[8,9]。 针对金属铁的阴极保护,最早的可追溯记载为1918 年Bauer 和Vogel 在不同电解质溶液中开展的腐蚀原电池测试研究[8],以期得到可以有效防止铁腐蚀的电流密度,研究结果表明,其所需的电流密度量级约为0.1 A/m2;1928 年,Kuhn[9]针对埋地铸铁管道阴极保护开展了大量的现场测试;1930年,Scholten 针对铁所需的保护电流密度开展了类似的研究[10]。 发展至今,埋地钢质管道阴极保护技术在理论模型、评价指标、检测技术等方面取得了长足的进步并在世界范围了得到了普及[11-13]。 遗憾的是,阴极保护机理一直未得到清晰阐述,阴极保护是通过减少腐蚀活性区域的数量和尺寸还是降低腐蚀活性区域的腐蚀速率(不影响其数量和尺寸)来达到防护效果也一直处于争论,在一定程度上限制了其在实际工程中的应用。 由于能源等基础设施的老化,腐蚀问题日益严重,权威统计数据显示,全球每年因腐蚀导致的经济损失可达1 万亿美元[14],腐蚀防护技术市场需求巨大。 系统地了解阴极保护技术的发展历程,有助于指导现场工程的腐蚀防护工作,提升腐蚀防护的效果和效益。 本文聚焦埋地钢质管道阴极保护作用机理的研究历程和工程应用面临的挑战,以为同行提供一定的参考。
1 均相腐蚀金属电极的阴极保护机制
阴极保护是通过使腐蚀金属阴极极化的方法将腐蚀速率降低甚至接近于停止的一种保护措施,腐蚀金属电极发生阴极极化时,金属的自腐蚀电流密度等于金属总的阳极溶解电流密度,其随金属电位负向移动而减小,金属腐蚀速率随之降低。 假设腐蚀金属电极的阳极溶解反应速率符合塔菲尔规律,塔菲尔斜率为βa,未施加阴极保护时的腐蚀电位为Ecorr,a,腐蚀电流密度为Jcorr,则金属电极阴极极化至Ep时的阳极溶解电流密度Ja满足式(1)函数关系[15],腐蚀速率的降低取决于塔菲尔斜率βa,如图1 所示。
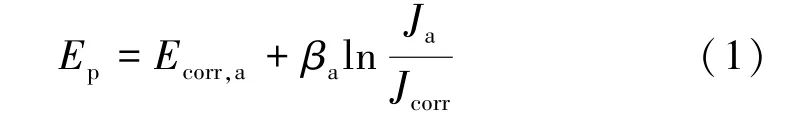

图1 均相腐蚀金属电极极化示意Fig. 1 Schematic diagram of homogeneous corrosion metal electrode polarization
由图1 可知,在不考虑时间对极化影响的情况下,阴极极化在降低阳极溶解反应速率的同时增大了阴极反应速率,电极表面溶液中溶解氧被逐渐消耗,氢氧根离子浓度增大,改变了电极表面溶液的化学成分和组成,阴极反应从受荷电粒子穿越双电层的放电步骤控制逐渐转变成受扩散过程控制,浓差极化开始占主导,腐蚀金属电极反应的热力学和动力学过程发生改变。Mccafferty[16]研究了电极表面溶液化学成分对碳钢腐蚀电位的影响,试验分为3 个阶段:(1)溶液充氮除氧阶段,使溶解氧含量降至0.17 mg/L,碳钢电位从-0.50 V(vs CSE)逐渐负移并稳定在-0.73 V(vs CSE);(2)向溶液中滴加NaOH 试剂,使溶液pH 值从6 增加至13,碳钢电位从-0.50 V(vs CSE)进一步负移至-0.84 V(vs CSE);(3)溶液充氧阶段,使溶解氧含量从0.17 mg/L逐渐增加至9.00 mg/L,碳钢电位从-0.84 V(vs CSE)逐渐正移并稳定在约-0.52 V(vs CSE),如图2 所示。利用Pourbaix 图分析其对电极腐蚀过程的影响,如图3所示,电极电位沿a→b→c→d 轨迹线改变,金属电极从腐蚀区逐渐过渡至钝化区,腐蚀得到抑制。

图2 溶解氧浓度和pH 值对电极电位的影响曲线Fig. 2 Influence curve of dissolved oxygen concentration and pH value on electrode potential

图3 Fe/H2O 系统Pourbaix 图(25 ℃,1.013×105 Pa)Fig. 3 The Pourbaix diagram of the Fe/H2O system(25 ℃,1.013×105 Pa)
从以上可知,利用外加电流使金属电极发生阴极极化时,阳极溶解反应速率降低和电极表面电解质溶液成分改变都会减缓其腐蚀,但是哪种机制占主导,即:阴极保护主要是通过极化金属电极至免蚀区还是促进其表面形成致密的氧化膜来抑制腐蚀,一直是阴极保护领域争论的一个问题[10,17]。 这可以从2 个方面来思考:
(1)所需的保护电流密度。 将Fe 金属电极极化至免蚀区时,极化电位应达到金属阳极溶解反应的平衡电位Ee,Fe,此时净阳极溶解电流密度等于0,腐蚀被完全抑制,按照布拜提出的准则:取铁离子的活度为10-6mol/L 时的平衡电位作为阳极溶解反应的平衡电位Ee,Fe。 由于免蚀区的电位区间负于析氢反应的平衡电位,因此在电位负移过程中会先发生析氢反应,假设析氢反应的塔菲尔斜率为120 mV,保护效果规定为金属的腐蚀速率降低至阴极保护前的1%,根据式(1)可计算得到需要的阴极保护电流密度约为99.5Jcorr,电流密度需求量巨大,同时还会导致严重的氢脆和防腐层剥离风险,显然在工业上是行不通的,这也是为什么在酸性溶液中一般不采用阴极保护来防护金属腐蚀的原因[15]。 Scully 等[18]分别测试了低碳钢试片在不同服役环境中(浸没海水、飞溅区、大气环境)所需的保护电流密度,如图4 所示。 从图4 可知,低碳钢极化至免蚀区所需的保护电流密度大于0.8 A/m2,同时伴随着较高的氢渗透率;而阴极保护所需的电流密度在5~10 mA/m2量级,需要指出的是Scully 等的研究忽略了试片面积和材质差异的影响,有待进一步的研究。 其他学者的研究也得到了类似的结果,低碳钢极化至免蚀区所需的保护电流密度在1 A/m2量级[19],在中性土壤中的阴极保护电流密度需求量约4.3~16.1 mA/m2[20]。当阴极电流密度位于5~10 mA/m2量级时,足以使电极表面电解质溶液的pH 值大于10,对应的极化电位负于-0.85 V(vs CSE)[21],如图5 所示,满足阴极保护标准要求。

图4 低碳钢试片保护电流密度-氢渗透率关系[18]Fig. 4 The relationship between protection current density and hydrogen permeation of mild steel coupons[18]

图5 保护电流密度-pH-极化电位关系曲线[21]Fig. 5 The relationship among protection current density,pH and IR-free potential[21]
(2)极化衰减时间。 施加阴极保护的埋地钢质管道在关闭阴极保护电源后,管道电位衰减至自腐蚀电位需要较长的时间,可达数天[7]。 早在1930 年,Kuhn就已经认识到阴极保护效果并不随外加电流的断开而立即消失[10],保护效果逐渐衰减是阴极保护技术的一个显著特点,而活化极化衰减的时间很短,在毫秒级别[22],浓差极化衰减由于离子(特别是OH-)在土壤环境中扩散速率较低则可能需要数小时至数天不等[7]。
从以上2 个方面可以推断,在不考虑长时间极化导致电极表面溶解氧浓度降低的情况下,阴极反应过程中产生的OH-促进电极表面钝化是阴极保护的主要机制[23],而电极表面电解质成分和浓度改变受介质环境类型(土壤、溶液)、温度、扰动、流态、化学反应(pH值缓冲、钙质沉积)等多个因素的影响。 因此,阴极保护缓解腐蚀是多个因素共同作用的结果,包括且不限于:阴极极化导致的阳极溶解反应速率降低;阴极反应速率增大导致电极表面OH-浓度增大,而土壤的静滞特性又限制了OH-的迁移扩散,导致电极表面OH-累积,pH 值增大;表面的溶解氧被阴极反应逐渐消耗;Cl-等电迁移至阳极区,电极表面Cl-浓度降低;碱性增大导致的电极表面钙质沉积起到了良好的屏蔽作用,减小了氧还原反应的极限电流密度[24]。
2 复相金属电极的阴极保护机制与挑战
埋地钢质管道实际服役过程中,往往由于防腐层破损点处局部服役环境的差异或材质因素(如夹杂、焊缝等)导致管道上分散着一定的阴极区和阳极区,形成局部腐蚀原电池,如图6 所示,防腐层破损点越多、尺寸越大,这种现象越易形成[25-27]。 此时,管道不再是前文所述的均相腐蚀金属电极系统,阴极保护过程变得更加复杂,对阴极保护技术的应用也提出了一些新的挑战。

图6 埋地管道局部腐蚀原电池示意Fig. 6 Diagram of local corrosion cell on buried pipeline
2.1 复相金属电极的阴极保护机制
对于复相金属电极,阴极保护主要是通过抑制阳极区的阳极溶解速率还是减少阳极区的数量和大小来缓解腐蚀,长期以来一直存在争论。 阳极溶解速率减缓机制由Mears 等[17]在1938 年提出,其原理如图7 所示。 施加阴极保护电流后,阳极电流Ia=阴极电流Ic-阴极保护电流ICP,当阴极电流Ic等于阴极保护电流ICP时,阳极电流Ia=0,腐蚀被完全抑制。 此时,电极系统电位极化至阳极平衡电位[15],如Mears 等指出“有必要将腐蚀电池中的阴极实施极化而达到局部阳极的开路电位,以获得完全的阴极保护”。 该机制有2 个理论前提:(1)认为阴极保护是活化控制过程,具有瞬时性,施加阴极保护电流后立即活化极化而降低阳极反应速率,阴极保护电流断开后保护效果立即消失,忽略了表面电解质化学成分和浓度改变对阴极保护过程的影响;(2)假设阴极保护过程中,阴极区和阳极区的数量和大小不发生改变[10,15]。

图7 阴极保护系统等效电路[17]Fig. 7 Equivalent circuit diagram of cathodic protection system[17]
阳极区域减少机制由Laque 和May[10]在1965 年提出,他们认为复相金属电极系统的阴极保护具有一定的时效性,阴极反应产生的OH-扩散和迁移使得阳极区域的面积逐渐减小,从而达到保护效果,如图8 所示。需要注意的是,在该机制下,如果阴极保护电流不足以完全消除阳极区,则可能会导致严重的局部腐蚀,部分学者在其研究中也观测到该现象,如:Funk 等[28]通过现场埋设腐蚀检查片观测腐蚀行为时发现,即使试片的阴极保护水平都满足标准要求,试片的腐蚀速率分布依旧存在明显的分散性,局部腐蚀速率明显大于平均腐蚀速率,最高可达0.03 mm/a,且试片面积越大,腐蚀敏感性和不均匀性越显著;Barlo[29]开展的现场测试也发现了类似的现象,即使试片的极化电位负于-1.10 V(vs CSE),依旧存在局部腐蚀现象,局部腐蚀速率可达0.10 mm/a;我们在芜湖地区埋设的6.5 cm2腐蚀检查片,各检查片的极化电位均位于-1.02~-1.10 V(vs CSE),埋设1 a 后取出酸洗后发现,各检查片的表面腐蚀形貌存在一定的差异,1,3,4,5 号检查片呈现均匀腐蚀形貌,2 号和6 号则呈现明显的局部腐蚀形貌,最大局部腐蚀速率分别为0.06,0.04 mm/a。

图8 阳极区域减少机制原理Fig. 8 Schematic diagram of anodic electrode surface area reduction mechanism
如前文所述,复相金属电极的阴极保护机制还不明了,其理论物理化学模型还未得到清晰地建立,在一定程度上阻碍了其在实际工程中的应用,也面临着一些挑战,如:极化电位的准确测量、阴极保护有效性准则的选取等,有待进一步深入研究。
2.2 复相金属电极的阴极保护应用挑战——极化电位的准确测量
管道工程中,常采用断电电位(Voff)来测试表征管道的极化电位(VIR-free),通过对阴极保护系统实行通断处理来获取断电电位,其等效性和有效性有待商榷。一方面,常规的通断处理,仅能消除外加保护电流所引起的电压降,而对于复相金属电极系统内局部腐蚀原电池引起的平衡电流导致的电压降并不能有效消除,从而导致极化电位的测量误差。 GB/T 21246-2020[30]和BS EN ISO 15589-1:2017[31]针对平衡电位给出了相应的断电电位加强测量方法,适用于防腐层破损点多的管段的断电电位的修正测量,其测试原理如图9 所示。 通过在垂直管道方向距离参比电极A 10 m 位置处放置另外一个参比电极B,测量AB 间的通电和断电电位梯度,通过式(2)修正断电电位,测量过程较为复杂,人工和时间成本较高。

图9 加强测量法测量示意Fig. 9 Schematic diagram of intensive measurement technique

式中:VIR-free为A 测量点修正后的断电电位,V;Von为A测量点的通电电位,V;Voff:A 测量点的断电电位,V;ΔVon为通电状态下,AB 间的直流电位梯度,V;ΔVoff为断电状态下,AB 间的直流电位梯度,V。
另一方面,极化电位包含2 部分:活化极化和浓差极化部分。 日常断电电位测试过程中,为了避免通断瞬间产生的冲击电压的影响,一般会在断电后0.5~1.0 s 内采集数据[32],然而相关的研究表明,活化极化衰减的时间在10-1~10-3s 量级,甚至更短[22,33],因此在日常测试过程中,利用采集的断电电位来表征管道的极化电位,其等效性和准确性是值得商榷的,其中一个原因就是采集断电电位时,活化极化已经衰减。 我们利用高频率数据采集仪对现场埋设的阴极保护检查片的断电电位进行了测试采集,如图10 所示,发现1 号和2号试样的脉冲峰持续时间(AB 时间段)分别为100 和76 ms,断电电位采集时间点C 处的电位相比于极化电位真实值(时间点B 处对应的电位)分别衰减了96 和40 mV,这可能与活化极化的衰减有关。
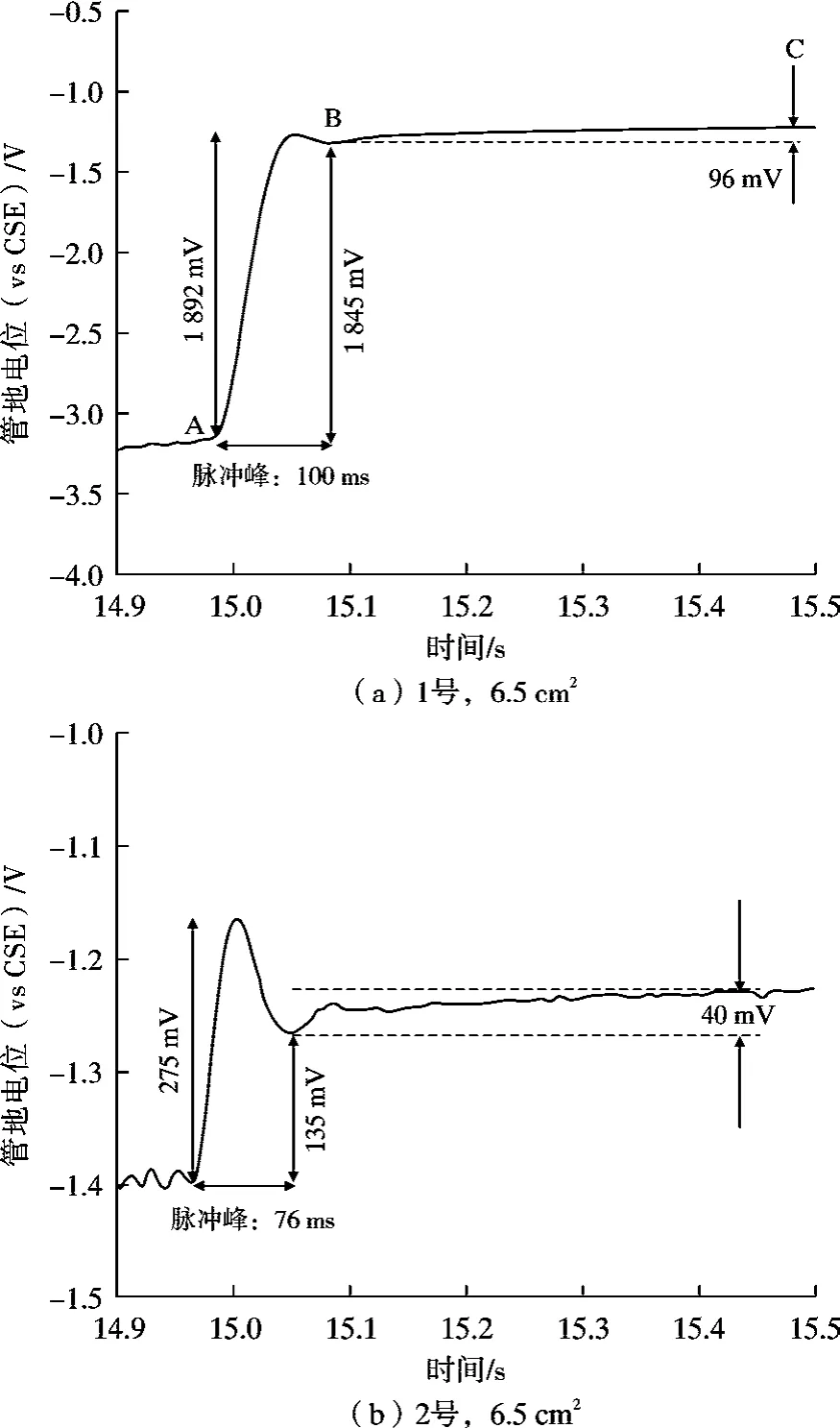
图10 断电电位-时间分布Fig. 10 Off-potential-time distribution diagram
此外,阴极保护作用过程中,电极表面阴极极化反应生成的OH-和土壤环境中离子扩散及迁移受阻的特性,使得电极表面和土壤本体间存在pH 值梯度区间,在溶液环境中这个梯度区间的范围约1 mm 级别,而在土壤中可达cm 量级[34],pH 值梯度区间导致参比电极和防腐层破损点间存在一个扩散电势[35,36],有时可达120 mV[37],且往往大于IR降,而在实际测试过程中,该扩散电势往往会被计入断电电位,从而导致严重的极化电位测量误差,如图11 所示。

图11 pH 值梯度区间示意Fig. 11 Schematic diagram of pH gradient interval
2.3 复相金属电极的阴极保护应用挑战——阴极保护有效性准则
如前文所述,电极表面OH-的积累、扩散和迁移对阴极保护效果有着至关重要的作用,在管道实际服役环境中,面临2 种情况:(1)管道回填质量高,土壤颗粒密实,OH-扩散和迁移受阻,OH-在防腐层破损点表面积聚导致表面pH 值显著升高,如图12a 所示;(2)回填质量较差,土壤颗粒间缝隙较大,OH-易扩散和迁移,表面pH 值无显著变化,如图12b 所示。 2 种情况下,阴极保护的机制有所差异,图12a 情况下主要通过OH-积聚促进极化来抑制腐蚀;图12b 情况下主要通过极化至免蚀区缓解腐蚀,所对应的阴极保护有效性准则相应地会有所差异,Angst 等[38]给出了相应的准则:
图12a 情形:极化电位负于-0.85 V(vs CSE);或通电电位负于-1.00 V(vs CSE);
图12b 情形:极化电位负于-0.95 V(vs CSE);或通电电位负于-1.00 V(vs CSE)。

图12 电极表面OH-分布示意[38]Fig. 12 Schematic diagram of OH- distribution on the electrode surface[38]
北美、澳大利亚和欧洲超过1 600 个案例的测试结果[29,39],通过现场测试腐蚀速率,以腐蚀速率0.01 mm/a 作为评价基准,对比分析了常用的阴极保护有效性准则的安全性和保守性,如图13 所示。 从图13 可知,-0.85 V(vs CSE)极化电位准则和-0.85 V(vs CSE)通电电位准则接近于准确性,但是极化电位测试的难度和复杂度远高于通电电位;而100 mV 极化偏移准则的有效性相对较低。

图13 常用阴极保护准则有效性对比(以腐蚀速率0.01 mm/a 作为评价基准)Fig. 13 Reliability of different CP protection criteria
科学的阴极保护有效性准则建立在清晰的阴极保护理论模型基础上,复相金属电极的阴极保护机制的不明了限制了阴极保护有效性准则的建立,有待于进一步的深入研究。
3 结束语
本文总结了均相金属腐蚀电极和复相金属电极的阴极保护机制的研究历程,同时指出了复相金属电极阴极保护技术在实际工程应用中面临的挑战,科学系统的阴极保护理论模型迄今未得到清晰的参数和建立,在一定程度上限制了其工程应用,其中一个很重要的方面就是有效阴极保护准则的选取,同时受制于极化电位的准确测量技术,阴极保护准则的有效性验证也同样面临挑战,这些都有待于更进一步地深入研究。

