SDS脱细胞处理猪气管黏膜后的异种移植的初步研究
张海祥,崔鹏程,王晋平(陕西省人民医院中心实验室,西安 70068;空军军医大学唐都医院耳鼻喉科;陕西省人民医院耳鼻喉头颈外科;通讯作者,E-mail:06070789@qq.com)
气管缺损多是由肿瘤、外伤、长时间插管和先天性疾病等所致,通常6 cm以内的气管缺损可通过断端吻合完成修复,但修复大于6 cm的气管缺损就比较棘手。目前气管移植被认为是修复大面积气管缺损的理想方法,临床上已有同种异体气管移植成功的报道[1]。但移植后患者需终身应用免疫抑制剂,会增加肿瘤复发和机会性感染的概率,对于患者显然是不适用的。前期研究[2]已成功应用十二烷基硫酸钠(sodium dodecyl sulfate, SDS)脱细胞方法在同种异体移植中,在不使用免疫抑制剂的情况下,进行了同种异体气管的移植。由于目前供体资源紧缺,开发异种移植迫在眉睫。猪气管作为一种极好的异种源性气管移植物,是组织工程气管重建的主要来源,尤其是基因敲除猪的问世,更是给异种气管移植带来了光明[3]。然而它经过SDS脱细胞处理后能否在不使用免疫抑制剂的情况下,应用于异种移植中尚无报道。本研究探讨在不使用免疫抑制剂的情况下应用SDS脱细胞方法处理后的异种气管能否移植成功,以期为组织工程方法治疗气管疾病提供实验依据。
1 材料与方法
1.1 实验材料
实验采用健康家猪9只,体质量50~60 kg,雌雄不限。9只健康成年比格犬,体质量11~14.5 kg,雌雄不限(实验所选用家猪均由西安惠品肉业有限公司提供,比格犬均为第四军医大学动物实验中心所提供,许可证号20191009)。
1.2 方法
1.2.1 供体猪气管的收集 准备装有高渗枸橼酸盐嘌呤溶液(器官保存液)的玻璃瓶和冰块的转运箱。将新鲜宰杀的9只家猪每只取喉以下隆突以上的颈段气管(约12 cm),去除净周围组织后,立即放入装有器官保存液的玻璃瓶,转运箱即刻运回实验室。
1.2.2 供体气管去黏膜处理 将9段猪气管随机分为3组,即1%SDS处理组、3%SDS处理组和3%SDS内外处理组。①1%SDS供体气管内去黏膜处理:在超净台内进一步详细去除气管周围的组织,将其浸泡在安尔碘中1 min消毒灭菌处理,之后反复用生理盐水(约2 500 ml)冲洗干净。在气管一端塞入胶塞,并用丝线固定。管腔内放置一根无菌细木棒,以维持气管直立状态。将其放入一个大试管中,气管腔内用移液枪注入1%SDS溶液,不能溢出。腔外注满器官保存液,不能流入管腔内。放入4 ℃冰箱,每日更换气管内外的溶液,并每日取一气管环进行甲醛固定。于84 h后,将去黏膜处理后的猪气管埋植于比格犬的背部。②3%SDS供体气管内去黏膜处理:同上,消毒灭菌并清洗后在气管腔内注入3%SDS溶液进行去黏膜处理,14 ℃低温保存,每日更换相应溶液并取一气管环固定待检,于96 h后行气管异体埋植。③3%SDS供体气管内外去黏膜处理:同上,消毒灭菌并清洗后气管腔内外均充满3%SDS溶液进行去黏膜处理,14 ℃低温保存,隔日更换溶液并取一气管环固定待检,于120 h后行气管异体埋植。
1.2.3 去黏膜气管埋植前准备 脱细胞后的气管放入盛有生理盐水的密闭容器中,在震荡床以120次/h的速度振荡20 min。振荡完毕后,用2 500 ml生理盐水反复冲洗气管,至冲洗液清亮无泡沫。气管两端各去除3环(防止两端有未完全浸泡SDS的气管组织)后,并取一环行组织学检测,剩余气管长约6 cm。在气管环间做约1.5 cm的横行切口,切开软骨环间的韧带。将与埋植气管长度相等的硅胶管,交错对称剪菱形的小口。将硅胶管置于气管腔内,丝线缝合固定。
1.2.4 异种异位气管埋植 将受体动物比格犬,体质量约11~14.5 kg左右;使用地西泮和陆眠宁(陆眠宁和地西泮均按0.1 mg/kg分别臀部注射,40 min后可按0.05 mg/kg分别追加剂量)肌肉注射比格犬臀部,完全麻醉后,将其俯卧位固定于动物手术台;剃去背部毛发,备皮;碘伏消毒后铺无菌手术单。于犬背部行L型切口,逐层切开,掀起背阔肌筋膜;将与硅胶管固定好的气管用筋膜包绕;逐层缝合固定。
1.2.5 埋植术后 比格犬麻醉清醒后,将其送回动物房。先少量进食水,待完全清醒后,再正常喂犬饲料,术后注意观察伤口有无裂开、破溃、渗出以及全身的免疫排斥反应。
1.2.6 埋植后气管取材 将发生排斥反应的实验动物运回实验室,使用地西泮和陆眠宁(剂量同1.2.4)肌肉注射比格犬臀部,将其侧卧位固定于动物手术台。观察切口情况后,碘伏消毒后铺无菌手术单,于气管埋植处切开皮肤、皮下组织,筋膜层,暴露埋植的气管。观察气管的形态,并用相机拍照。
1.2.7 组织学检测 切取的气管环置于10%中性福尔马林缓冲液中,室温固定24 h。固定后,用蒸馏水洗涤,梯度酒精脱水,石蜡包埋,切片厚度4 μm。切片用苏木精和伊红染色后,观察埋植后气管组织结构、细胞组成、细胞外基质的排列等情况。
2 结果
2.1 气管的组织学检查
使用1%SDS及3%SDS脱细胞后的气管,不间断地采集气管环标本,行HE染色。通过观察,可以发现在相同的时间内浓度高的处理组脱细胞效果更彻底。1%SDS处理组7 d时在气管黏膜层仍有少许腺体存在(见图1A)。3%SDS处理组4 d时气管黏膜层已经几乎没有腺体结构,上皮细胞无正常结构;在第7天时,整个黏膜下层水肿明显,黏膜层已没有正常的细胞及腺体结构(见图1B)。3%SDS内外处理组隔日换液和取样检查,结果显示,在处理4 d时气管黏膜层腺体结构消失,上皮细胞也无正常结构;第6天时,出现整个黏膜下层严重水肿,完全没有正常的细胞结构(见图1C)。
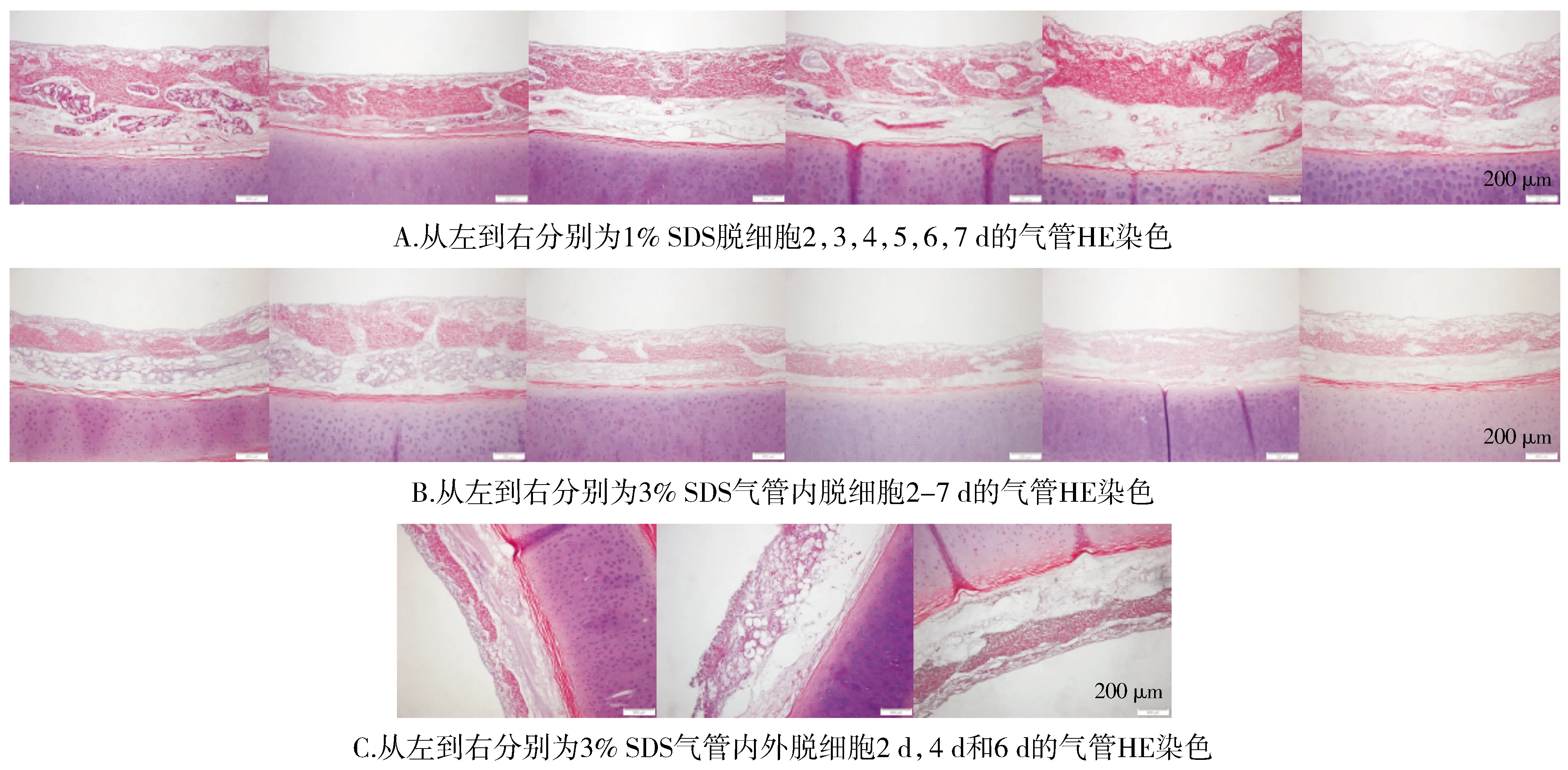
图1 气管SDS脱细胞后HE染色结果 (×100)Figure 1 HE staining of tracheal after SDS decellularization (×100)
2.2 埋植后大体观察
结合脱细胞情况,选取合适的时间点进行异种埋植,所有受体动物在埋植后,均出现不同程度精神、食欲差,全身乏力。伤口局部破溃,瘘口形成,脓性分泌物的渗出,埋植气管的移位等情况,具体情况如下。
2.2.1 1%SDS气管内去黏膜处理后异种埋植情况 猪气管去黏膜处理后异种埋植犬均于术后第2天伤口局部肿胀明显,术后第4天左右,伤口局部有破溃,可见混浊的脓性分泌物排出(见图2A),1只犬于术后第7天取材,气管软骨环明显软化,部分被吸收。其余的于术后第11天取材,气管形态完全消失,只见软骨碎片(见图2B,C)。
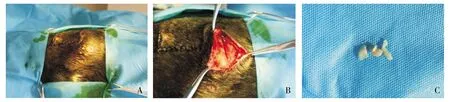
A.埋植部位下方皮肤局部破溃,且有脓性分泌物流出;B.切开后只看到硅胶管,气管形态完全消失,移位明显;C.只见到软骨碎片图2 1%SDS气管内去黏膜处理后埋植气管11 d的情况Figure 2 The general situation in 11 d after tracheal implantation in 1% SDS treatment group
2.2.2 3%SDS气管内去黏膜处理后异种埋植情况 猪气管去黏膜处理后异种埋植犬,其中1只于术后第2天不明原因死亡,其余的术后第2天伤口局部无明显肿胀;术后第5天背部埋植的气管向下滑落,且有瘘口形成,有脓性分泌物流出(见图3A);术后第11天取材,见埋植气管已变成小碎片(见图3B,C)。
2.2.3 3%SDS气管内外去黏膜 猪气管去黏膜处理后异种埋植犬,其中1只于术后第3天不明原因死亡,另1只术后第4天埋植部位下方破溃(见图4A),于第7天时气管被排出(见图4B);另1只于术后11 d取材,发现埋植气管形态较前两种方法要好,但同样没有完整的气管形态(见图4C)。
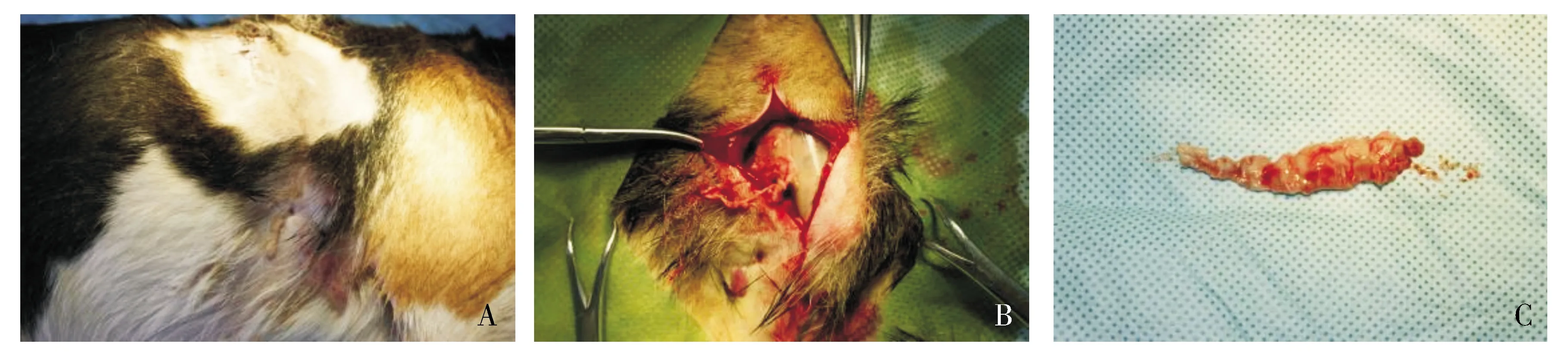
A.埋植气管向下方移位,且有瘘口形成,局部有脓性分泌物流出;B.切开后已无气管形态,只见硅胶管;C.埋植的气管已成碎片图3 3%SDS气管内去黏膜处理后埋植气管11 d的情况Figure 3 The general situation in 11 d after tracheal implantation in 3% SDS treatment group
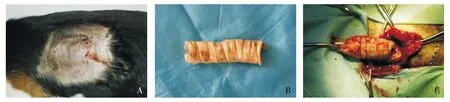
A.埋植部分下方破溃,流脓;B.被排出的气管;C.11 d取材时无完整的气管形态,但气管环部分存在图4 3%SDS气管内外去黏膜处理后埋植气管11 d的情况Figure 4 The general situation in 11 d after tracheal implantation in 3% SDS internal and external treatment group
3 讨论
随着人类寿命的不断延长,慢性疾病和终末期器官衰竭的患者越来越多。那么如何拯救这些终末期器官衰竭的患者呢?器官移植目前被认为是最有效的途径。然而,人体器官供需不平衡一直是临床移植的瓶颈。根据美国政府关于器官捐赠和移植的信息,截至2019年1月,超过11.3万名候选者在等待器官移植,而2018年仅进行了36 528例移植。在中国,有超过30万人在等待移植,但每年只有1.6万个器官可供使用[4]。因此,异种移植可能是填补器官、组织和细胞供求差距的一种有前途的替代方法。
异种移植最早在1667年从羔羊到人的异种输血中被提到[5]。动物器官的临床异种移植是从1905年兔肾移植到人身上开始记载的[6]。由于非人类灵长类动物(NHPs)在进化上比其他物种更接近人类,从20世纪20年代到20世纪90年代,研究人员进行的几项涉及NHPs肾脏、心脏和肝脏的异种移植试验发现,NHPs并不适合用于临床异种移植[7,8],原因包括伦理方面的考虑、跨物种感染传播给人类的高风险、繁殖困难、器官大小差异等等因素[9]。从20世纪90年代以来,研究人员一直试图将猪作为异种移植的源动物,猪目前被认为是最合适的候选物种。选择猪作为异种移植器官的原因有猪产仔数较大,成熟期较短,猪的大小和生理上与人相似,异种人畜共患病的风险较低,以及基因工程技术易于应用于生产抗排异的猪器官[10]。然而,猪和人之间的遗传差异导致了异种移植的障碍,包括免疫排斥和异种人畜共患病的风险。其中免疫障碍是临床异种移植的限制因素。由于基因编辑工具和免疫抑制疗法的进步,以及在猪-非人类灵长类模型中延长了异种移植存活时间,临床异种移植变得更加可行。
由于气管与其他器官相比具有非常低的免疫原性[11,12],而且研究发现它的免疫原性主要位于气管的黏膜层,软骨仅具有轻微的免疫原性[13]。前期研究结果证实,SDS处理的气管在全程未使用免疫抑制剂的情况下,同种异体埋植是成活的,埋植半年的气管力学特性与新鲜气管相比,无统计学差异[14]。同时,SDS作为大鼠全心灌注脱细胞的主要药物[15],还可以在鼠前臂[16]、猪角膜[17]、猪心肌[18]、猪心脏瓣膜[19]、猪小肠[20]、猪肾[21]、人体静脉[22]、鼠、猪和人类肺[23,24]及人类心脏[25]中达到脱细胞的标准。而且脱细胞支架由于其微小的抗原潜能,增加了异种移植和异体移植的通用性[26]。但是将此脱细胞方法应用于气管异种移植的报道几乎没有。因此本研究首次尝试将此方法应用于气管异种移植。
本研究采用1%SDS溶液,与同种异体埋植相同的脱细胞方式[2]对猪气管上皮层进行了处理,然后行异种埋植。在术后第2天埋植动物的伤口局部肿胀明显;术后第4天左右伤口局部有破溃,可见混浊的脓性分泌物排出;1只犬于术后第7天取材,气管软骨环明显软化,部分被吸收。其余的于术后第11天取材,气管形态完全消失,只见3个软骨碎片。由于SDS脱细胞的程度与其浓度是相关的,本研究尝试增加SDS的浓度,但在浓度超过3%时,SDS溶液会有晶体析出,影响脱细胞效果。研究尽管也调整了气管SDS脱细胞的方式,从气管黏膜层局部浸润到全气管的浸润,但是实体动物异种埋植试验证明,单一的脱细胞方法无法达到异种移植免疫排斥的要求。另外,术后出现脓性分泌物考虑可能是发生急性排斥反应的同时发生了炎症反应。异种移植有3种排斥反应:超急性排斥反应(hyperacute rejection,HAR)、急性体液性排斥反应(acute humoral xenograft rejection, AHXR)和急性细胞性排斥反应。异种移植物在几分钟到几小时内被迅速破坏,这一过程被称为超急性排斥反应(HAR);急性体液性异种移植排斥反应(AHXR),也称为延迟异种移植排斥反应[27]。AHXR是一种由体液和细胞免疫反应、活化的内皮和炎症共同引起的现象。急性细胞性排斥反应与整个器官移植和细胞移植都有关。它会导致移植后几天到几周的排斥反应[28]。除了免疫排斥外,炎症反应和凝血功能失调也变得更加突出,进而导致异种移植失败[29]。
依据多年来在SDS脱细胞喉及气管组织方面积累的经验,研究主要以HE染色结果对脱细胞的效果进行预判。脱细胞的目的是将有免疫原性的细胞成分从组织中去除,同时不损伤细胞外基质支架。但是要想达到这种理想的状态可能性非常小,因为任何一种脱细胞的方法在去除免疫原性细胞的过程中都不可避免地会损伤到细胞外基质(ECM)。研究能做的只是采取某种脱细胞方法,单一的或联合的,使其在脱细胞过程中尽可能减少对ECM的损伤[30]。即便是残留在ECM中的少部分细胞成分也会对埋植后的受体有排斥作用,判断脱细胞有效性的方法之一就是HE染色,当然还有更进一步的生化及生物力学等指标。本研究从应用出发,根据HE染色结果,在大动物体内进行试验,这样更有现实的指导意义。
由于气管的免疫原性主要位于气管的黏膜层,软骨仅具有轻微的免疫原性,在同种异体移植中,软骨仅表现轻微的免疫原性,并且软骨的轻微免疫原性可以忽略不计。因此,通过脱细胞处理后,在不需要任何免疫抑制剂的情况下,同种异体移植是成活的。然而本实验中异种移植的免疫排斥反应较同种移植的免疫排斥反应更强烈。可能与软骨的免疫原性在同种异体移植物中表现不明显,但在异种移植中可能会产生强烈的排斥反应有关,这需要今后进一步深入研究。

