药用植物内生真菌的分离及拮抗菌的筛选与鉴定
王占斌,周 暄,马鑫博,王靖琳
(东北林业大学林学院,哈尔滨 150040)
0 引言
简便高效的各类农药越来越多地应用于农林植物的生产防治中,但是由于对环境的破坏与植物病原菌抗药性的出现,人们不得不寻找其他可替代的、毒副作用小、安全有效的防治手段来防治植物病害,例如生物防治手段,而内生菌的发现为人们提供了崭新的研究方向[1]。植物内生菌(endophyte、endophytic fungal或fungal endophyte)是植物病害生物防治的一种天然资源真菌[2],不仅具有广泛的理论研究价值和应用前景,也影响着植物的生长发育[3]。Gopane认为大多数药用植物具有抗菌活性,并寄生了大量的内生真菌,用于防御病原体的攻击,并且这一发现掀起了植物内生菌研究的热潮[4]。但至今内生真菌的概念仍有争议,人们普遍认为植物内生真菌是指那些在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部的真菌[5-6],被感染的宿主植物(至少是暂时)不表现出外在病症,可通过组织学方法或从严格表面消毒的植物组织中分离或从植物组织内直接扩增出微生物DNA的方法来证明其内生[7]。近些年来国内外对于内生菌的分离鉴定及拮抗作用的研究也在逐渐增加,VanAnh Ngo等[8]从越南中部高地黑胡椒(Pipernigrum)90个样本中分离到了352株内生菌株,对其进行抑菌活性测定,发现47株菌株对疫霉菌具有拮抗作用,通过16SRNA基因测序、构建系统发育树鉴定的6种内生细菌均属于芽孢杆菌属。Nguyen等[9]从越南中部高地的黑胡椒的根中筛选出4个内生菌株,发现它们对土壤肥力有明显的改善作用。李永丽等[10]采用稀释分离法和组织分离法从新疆野苹果枝干中分离出内生菌株,通过平板对峙试验筛选出显著抑菌效果的菌株,结合形态学、生理生化特征及16SrDNA序列分析,鉴定M-m7等菌株为芽孢杆菌,接种试验证明这些生防菌株对苹果枝条不具致病性。Qian等[11]从番荔枝健康叶和树皮中分离出具有明显抗菌活性的内生真菌。Nischitha等[12]采用马铃薯葡萄糖琼脂(PDA)、麦芽提取物琼脂(MEA)和湿润吸盘法研究了双角洋芋(Digitaria bicornis)和黄拟兰(Papalidium flavidum)内生真菌的发生情况。Khiralla[13]从苏丹药用植物苦杏仁(Vernonia amygdalina)中分离得到一种内生真菌,经鉴定为曲孢菌(Curvularia papendorfii)。Li等[14]通过真菌菌落形态观察和分子生物学鉴定,认为薏苡仁内生真菌为青霉(Penicillium)、曲霉(Aspergillus)和镰刀菌(Fusarium)。内生真菌是植物病害生防菌株的重要来源,其主要抑菌机制有产生次生代谢产物、营养竞争作用、重寄生作用及抗生作用[15],内生真菌的拮抗作用对于植物病害的防治研究有着一定的价值。而杨树是一种分布广泛且适应性较强的物种,其主要在北半球温带、寒温带等区域分布,不仅可以起到防沙固土与改善环境的作用,而且其木材也是制造纤维板、刨花板、细木工板以及造纸纸浆的优良材料,因此杨树具有很高的社会、生态和经济效益。但是杨树也是一种病害发生较多的树种,其中杨树叶枯病是一项主要病害。杨树叶枯病病斑可危害毛白杨、小叶杨、小青杨、银白杨、北京杨等多种杨树,对杨树苗木及幼林造成严重危害[16],是近年来引起人们重视的病害。黄毅[17]研究了杨树叶栖真菌的群落结构,并利用所分离到得真菌筛选出了具有生防价值的拮抗菌株。笔者研究6种药用植物的内生真菌对杨叶枯病的拮抗作用,以期筛选出有价值的生防内生拮抗真菌,从而提高对杨树叶枯病的综合防治。
1 材料与方法
1.1 材料
1.1.1 药用植物 2009年7月在东北林业大学帽儿山实验林场采集健康的药用植物连钱草(Glechoma longituba)、小 白 酒 草 (Conyza canadensis)、毛 茛(Ranunculus japonicus)、土三七(Gynura segetum)、唐松草(Thalictrum aquilegifolium)、白屈菜(Chelidonium majus)。
1.1.2 病原菌 杨叶枯病(Alternaria alternate)病原菌0918在发病杨树苗木上分离获得。
1.1.3 培养基 马铃薯葡萄糖培养基(PDA)包含马铃薯(去皮)200 g,葡萄糖20 g,琼脂10~12 g,水1000 mL。先将马铃薯洗净去皮称取200 g,切成块,置于沸水锅中煮20~30 min,然后用纱布过滤澄清液,再向澄清液中加入称量好的葡萄糖和琼脂,不断搅拌,全部溶解后补足所蒸发的水分至1000 mL,分装,置于灭菌锅中121℃灭菌30 min备用。
1.2 方法
1.2.1 内生真菌的分离与纯化 在无菌条件下,将健康植株的叶片与茎段分别切成1 cm×1 cm的小块,置于75%的酒精中消毒5 min,无菌水冲洗后2~3次,再置于0.1%的升汞中漂洗10~30 s,无菌水冲洗4~5次,用滤纸吸取多余的水分后置于马铃薯固体平板培养基上,25℃培养一段时间后周围长出少量菌丝。根据菌落形态、颜色和生长时间的差异,分别接种到固体平板上培养,长出新的菌落后再挑取其尖端菌丝培养,如此反复纯化多次后即可得到一个纯菌株。为了检查材料表面消毒的效果,将上述同样表面消毒的一部分不做剪切,直接放置于PDA平板上作对照处理。结果对照材料周围均无任何菌落长出,证明表面消毒彻底,从而保证所得到的真菌是植物的内生真菌而不是空气中的或组织块表面附生的微生物[18]。
1.2.2 内生拮抗菌菌株抗菌活性的测定 采用平板对峙法测定拮抗菌株对杨树叶枯病原菌的拮抗作用。用直径为5 mm的打孔器分别在培养好的病原菌的菌落边缘取菌块,并接种到PDA平板中,然后把拮抗菌接种到距离病原菌一定距离的点上,每个处理3次重复。置于25℃恒温箱中培养,对峙培养7天左右出现不同程度的抑菌圈,观察菌落的生长情况,定期测量并记录菌落生长直径的大小,计算抑菌率[19-20],如式(1)。

1.2.3 内生拮抗菌的分子生物学鉴定 为进一步鉴定试验分离得到的拮抗菌菌株,将部分内生真菌(MY1、TJ2、BY1)扩大培养提取DNA,利用真菌通用引物ITS1、ITS4对其rDNA-ITS序列进行PCR扩增反应,由上海生工生物工程有限公司将PCR扩增得到的片段进行测序,并通过BLAST序列对比找到相似序列,最后通过MEGA软件进行系统进化树构建并进行种类鉴定。进化树所利用的同源性分析参考用序列的信息如表1。

表1 同源性分析参考用序列信息
2 结果与分析
2.1 药用植物内生真菌的分离
6种药用植物的茎与叶共分离得到16种内生真菌,其中连钱草5株、小白酒草2株、毛茛4株、土三七2株、唐松草1株、白屈菜2株,将其编号,菌落生长情况如表2。
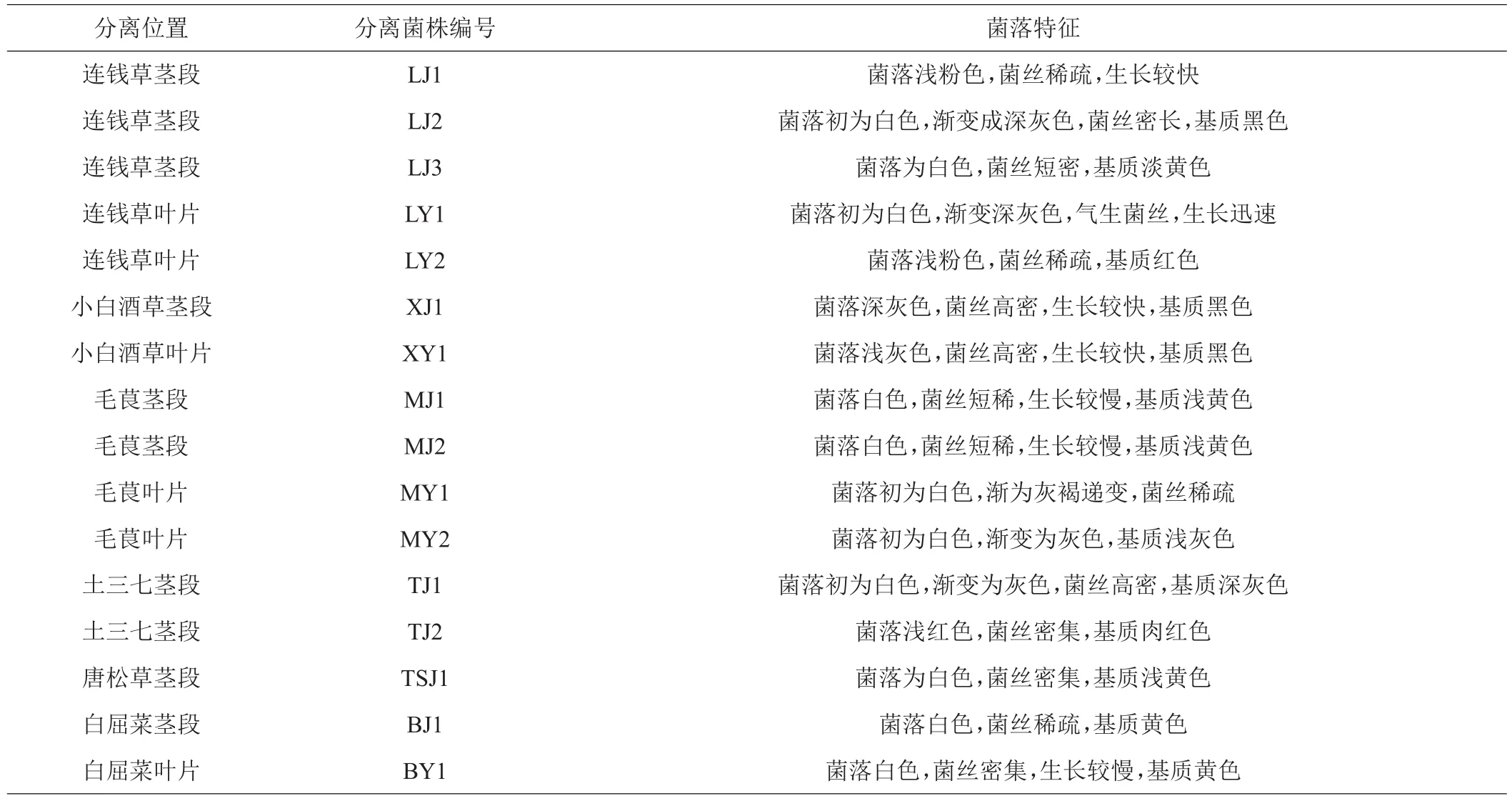
表2 药用植物内生真菌的分离
2.2 内生菌抑制杨叶枯病的测定分析
采用平板对峙法测定16种内生真菌与杨树叶枯病拮抗作用,发现不同拮抗菌株对杨树叶枯病菌丝生长有不同的抑制作用。各内生真菌对指示菌的抑制作用测定结果见表3。按抑菌圈直径将拮抗菌分为强(>10 mm)、中(5~10 mm)、弱(< 5 mm)3类。
药用植物内生真菌的拮抗机制有竞争作用、重寄生作用、抗生作用、溶菌作用等,由于其作用机制不同效果也不同。由表3可知,对杨叶枯病抑制效果较强的有LJ3、MJ2、MY1、TJ1、TJ2、BJ1、BY1,抑制效果中等的有LJ2、MJ1、TSJ1,抑制效果较弱的有LJ1、LY2、XJ1、XY1、MY2。对测试菌的抑制率比较结果表明,MJ2对杨叶枯病的抑制率最高,可达56.47%;其次为BYI,抑菌率达到54.94%。LJI对杨叶枯病没有明显的拮抗效果,LY1生长迅速,较短时间内即可抑制杨叶枯病的生长,但是没有抑菌圈,这是由于LY1的生长迅速并且营养吸收较快,导致与杨树叶枯病病菌形成竞争作用,杨树叶枯病病原菌的生长被抑制(图1)。分离得到的杨叶枯病原为半知菌的链格孢菌(Alternariaalternate)。分生孢子梗多数丛生,少数单生,暗橄榄黄至淡橄榄褐色,有隔,直立或弯曲,分枝或不分枝;分生孢子通常形成链,一般由10个或10个以上孢子组成,孢子具纵横隔(图2)。观察菌落发现,大多数靠近生长边缘的菌丝不能向外扩张,利用显微镜检查菌丝体,发现其生长扭曲且不规则,菌丝顶端或中间膨大,孢子畸形或表面不光滑。这是由于拮抗菌的抑菌作用导致杨树叶枯病病原菌生长受到抑制。
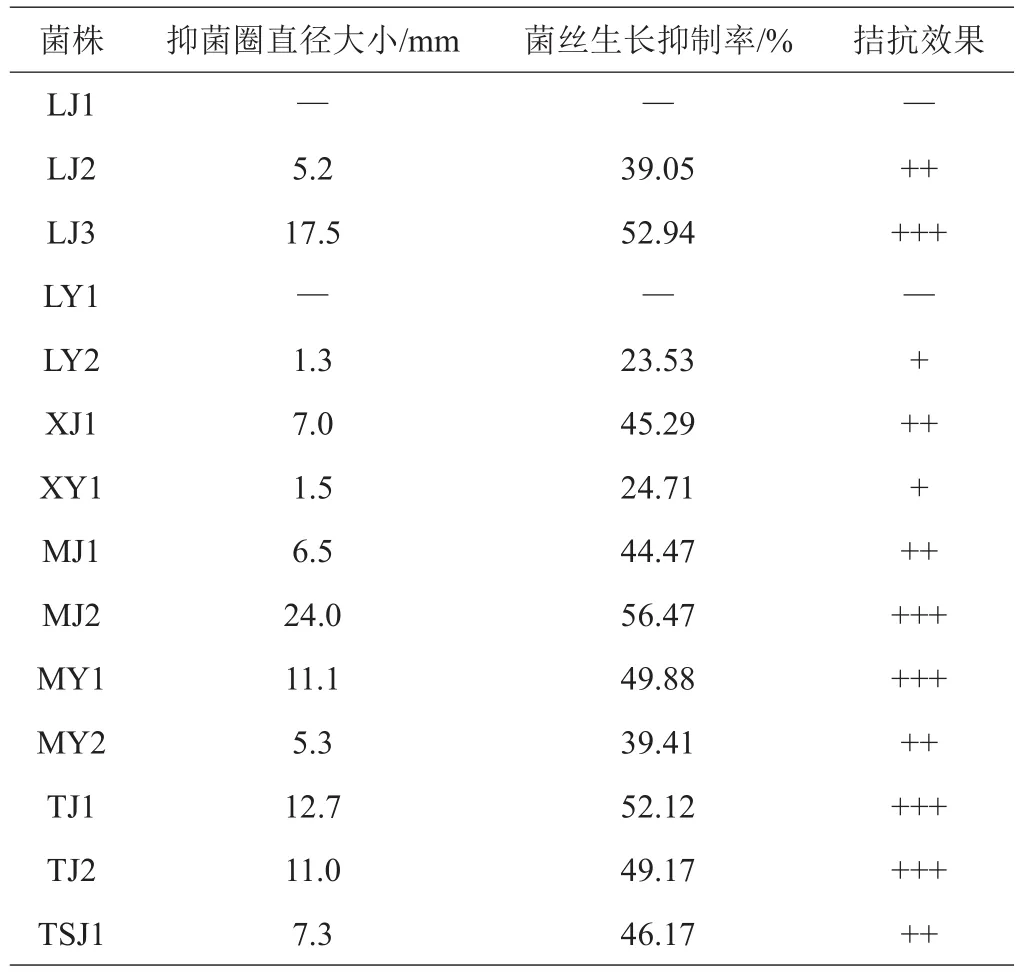
表3 药用植物内生真菌拮抗活性

续表3

图1 分离拮抗菌对杨树叶枯病的拮抗效果

图2 杨叶枯病病原菌孢子
2.3 拮抗菌分子生物学鉴定结果
(1)经测定,土三七内生真菌TJ2序列总长为540bp,序列为TGGGGGAGTTTCCGGAGGATCACTCCCAACC CCTGTGACATACCTTAATGTTGCCTCGGCGGATCAGC CCGCGCCCCGTAAAACGGCCCGGCCCGCCAGAGGAC CCAAACTCTAATGTTTCTTATTGTAACTTCTGAGTAA AACAAACAAATAAATCAAAACTTTCAACAACGGATC TCTTGGTTCTGGCATCGATGAAGAACGCAGCAAAAT GCGATAAGTAATGTGAATTGCAGAATTCAGTGAATC ATCGAATCTTTGAACGCACATTGCGCCCGCTGGTATT CCGGCGGGCATGCCTGTTCGAGCGTCATTTCAACCCT CAAGCCCCCGGGTTTGGTGTTGGGGATCGGCTCTGC CTTCTGGCGGTGCCGCCCCCGAAATACATTGGCGGT CTCGCTGCAGCCTCCATTGCGTAGTAGCTAACACCTC GCAACTGGAACGCGGCGCGGCCATGCCGTAAAACCC CAACTTCTGAATGTTGACCTCGGATCAGGTAGGAAT ACCCGCTGAACTTAAGCATATCAATAAGCGGAG GAA。经分析可知,各碱基数分别为136A、122T、150C、132G,利用MEGA分析软件将目标序列与GenBank上收录的相近序列进行比对分析并制作系统进化树[21-24]。结果(图3)显示,该菌与GenBank登录号为MK934343.1的Fusarium tricinctum在同一分支上,同源性大于99%。Landeweert等[25]认为,真菌通过ITS区域比对,序列相似性≥99%,鉴别为相同种;序列相似性>95%且<99%,鉴别为相同属;序列相似性≤95%,鉴别为相同科。因此,土三七内生真菌TJ-2鉴定为三线镰刀菌(Fusarium tricinctum)。

图3 TJ2系统进化树
(2)经测定,毛茛内生真菌MY1序列总长为544 bp,序列为GGGGATTCGGAGCTAAACTCCCAACCCATGT GAACATACCTATTGTTGCTTCGGCGGGATTGCCCCG GGCGCCTCGTGTGCCCCGGATCAGGCGCCCGCCTAG GAAACTTAACTCTTGTTTTATTTTGGAATCTTCTGAG TAGTTTTTACAAATAAATAAAAACTTTCAACAACGG ATCTCTTGGTTCTGGCATCGATGAAGAACGCAGCGA AATGCGATAAGTAATGTGAATTGCAGAATTCAGTGA ATCATCGAATCTTTGAACGCACATTGCGCCCGCCAG TATTCTGGCGGGCATGCCTGTCTGAGCGTCATTTCAA CCCTCATGCCCCTAGGGCGTGGTGTTGGGGATCGGC CAAAGCCCGCGAGGGACGGCCGGCCCCTAAATCTAG TGGCGGACCCGTCGTGGCCTCCTCTGCGAAGTAGTG ATATTCCGCATCGGAGAGCGACGAGCCCCTGCCGTT AAACCCCCAACTTTCCAAGGTTGACCTCAGATCAGG TAGGAATACCCGCTGAACTTAAGCATATCAATAAGC GGAGGAA。经分析可知,各碱基数分别为132A、129T、143C、140G,利用MEGA分析软件将目标序列与GenBank上收录的相近的序列进行对比,制作系统进化树如图4。结果显示,该菌与GenBank登录号为MT447494.1与FJ025201.1的Clonostachys rosea在进化树上同枝,同源性大于99%,与粉红粘帚霉[26]的其他菌株同源性大于98%~100%,因此将毛茛内生真菌MY1确定为Clonostachys rosea的不同菌株。

图4 MY1系统进化树
(3)经测定,白屈菜内生真菌BY1序列总长为543bp,序列为GGGGGATCGAGCTAACTCCCAACCCATGT GAACATACCTATTGTTGCTTCGGCGGGATTGCCCCG GGCGCCTCGTGTGCCCCGGATCAGGCGCCCGCCTAG GAAACTTAACTCTTGTTTTATTTTGGAATCTTCTGAG TAGTTTTTACAAATAAATAAAAACTTTCAACAACGG ATCTCTTGGTTCTGGCATCGATGAAGAACGCAGCGA AATGCGATAAGTAATGTGAATTGCAGAATTCAGTGA ATCATCGAATCTTTGAACGCACATTGCGCCCGCCAG TATTCTGGCGGGCATGCCTGTCTGAGCGTCATTTCAA CCCTCATGCCCCTAGGGCGTGGTGTTGGGGATCGGC CAAAGCCCGCGAGGGACGGCCGGCCCCTAAATCTAG TGGCGGACCCGTCGTGGCCTCCTCTGCGAAGTAGTG ATATTCCGCATCGGAGAGCGACGAGCCCCTGCCGTT AAACCCCCAACTTTCCAAGGTTGACCTCAGATCAGG TAGGAATACCCGCTGAACTTAAGCATATCAATAAGG CGGAGGAA。经分析可知,各碱基数分别为131A、143C、141G、128T,利用MEGA分析软件将目标序列与GenBank上收录的相近序列进行比对,制作系统进化树如图5。经过比对分析,该菌与GenBank登录号为KU350706.1的Clonostachys rosea同源性大于99%,仅有2个碱基的差异,与粉红粘帚霉的其他菌株同源性大于97%~100%。经分析,将白屈菜内生真菌BY1确定为Clonostachys rosea的不同菌株。

图5 BY1系统进化树
3 结论
通过分离纯化6种药用植物连钱草、小白酒草、毛茛、土三七、唐松草、白屈菜的内生真菌,获得对杨树叶枯病原真菌抑制作用较强拮抗菌株7株,分别为LJ3、MJ2、MY1、TJ1、TJ2、J1、BY1。其中MJ2对杨叶枯病的抑制率最高,可达56.47%;其次为BYI,抑菌率达到54.94%。通过显微观察与18S rDNA序列比对及系统发育分析,鉴定MY1与BY1为粉红粘帚霉(Clonostachys rosea),是目前已发现的拮抗微生物中极具潜力的生防因子之一;TJ2为镰孢霉属(Fusarium)的一个菌株。
4 讨论
内生真菌广泛分布在植物中,从植物的叶鞘、种子、花、茎、叶片和根等中都已分离到内生真菌[27]。在内生真菌的研究中,由于培养基的限制,不能保证所有生活在植物组织中的内生真菌都能被分离,有些可能不能在人工培养基上生长,而有些生长缓慢的真菌往往被快速生长的物种覆盖,这些物种也不能被分离。真菌具有易培养、易控制、生长繁殖迅速、不受季节、气候和地域的限制、生产成本低、生长快等优点,并可通过诱变育种、细胞融合基因工程等手段来提高菌种性能,所以大规模工业生产容易实现,对于植物来源的拮抗菌的开发具有十分重要的经济及生态效益[28]。
目前对于杨树叶枯病等杨树病害的防治大多停留在营林措施与化学防治阶段。利用农药防治不但费时费力而且污染环境,利用有效的生防拮抗菌种会解决许多由于化学防治带来的环境问题,使用得当更会省时省力。本研究采用连钱草、小白酒草、毛茛、土三七、唐松草,白屈菜6种药用植物的健康叶片和茎段进行分离筛选出16种内生真菌,得到其中对杨叶枯病抑制效果较好的7种内生真菌。由于本试验着重于具有拮抗作用内生菌的分离,因此对于筛选出的内生真菌有必要在今后试验中就拮抗的机制等方面进行更为深入的研究。

