蛋白质纳米聚合物泡沫体系的研究进展
刁云春,张燕鹏,*,张维农,胥 伟,胡志雄
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.武汉轻工大学 大宗粮油精深加工教育部重点实验室,湖北 武汉 430023)
蛋白质经一定的诱导改性后会因其分子结构发生改变而发生聚集行为,从而使其功能特性得到改善[1-4]。有研究证明蛋白质在酸性条件下经长时间加热后,致密的原丝纤维会扭曲而形成纤维状纳米聚合物。纤维状纳米聚合物形成的机理为蛋白质空间构象在酸热条件下发生改变,经过展开和水解产生多肽片段,多肽片段随后发生横向平行的β-折叠堆积以形成原丝纤维,其主要作用力为氢键和疏水相互作用。随着加热时间的延长,原丝纤维逐渐伸长并通过液晶相互作用彼此并排对齐,然后通过相互缠绕形成紧密扭曲的纤维状纳米聚合物,此过程的主要驱动力为空间位阻和静电相互作用,前者提供扭曲的方向,后者再将扭曲力度进一步扩大[5-6]。而在靠近蛋白质等电点的条件下经短时间加热后可形成直径较大的球状纳米聚合物,其形成过程分为4 个阶段:第1阶段为蛋白质在加热条件下发生解离和变性,疏水基团和游离巯基暴露出来,形成更具柔性的结构;第2阶段为变性的蛋白质由于等电点环境下的静电斥力较低而易通过二硫键发生相互作用,形成低聚合物;第3阶段为低聚合物进一步通过聚集行为形成初级聚合物;第4阶段为当初级聚合物的浓度超过临界值时则形成较大的团簇状聚合物,通过透射电子显微镜可观察到所形成的聚集体为球形[7-9]。上述这些蛋白质聚合物可使蛋白质的理化性质和功能特性发生变化,比如聚合物粒径的变小导致蛋白质溶液的起泡能力增强和黏度增加,泡沫的排液作用减弱,从而改善蛋白质泡沫的稳定性[10-11]。
目前,研究者对蛋白质纳米聚合物的研究主要集中在蛋白质二级、三级和四级等空间结构[12-14],以及微观样貌的表征[15-17],然而对蛋白质纳米聚合物形成的泡沫体系的深入研究,以及纳米聚合物与泡沫体系的相互影响机理尚鲜有报道。本文探讨了蛋白质纳米聚合物对泡沫体系影响的相关机理,并阐述了蛋白质纳米聚合物的相关制备方法,旨在为精准调控构建蛋白质纳米聚合物以获得理想泡沫体系特征的食品提供理论技术支持,探索其在泡沫类食品加工领域的应用。
1 泡沫体系的形成机理
泡沫是一种由液膜分割的气泡所组成的分散体系,其中液体为连续相,气体为分散相。泡沫形成方法主要有搅拌法、摇晃法和起泡法,均是将气体注入到蛋白质溶液或表面活性剂溶液中以形成泡沫。搅拌法和摇晃法是通过快速运动使溶液掺入空气,而起泡法是通过高压将大量的气体注入到溶液,压力释放时气体剧烈喷出而形成气泡。泡沫体系的形成主要依靠表面活性,当气体加入到蛋白质溶液或表面活性剂溶液中时,蛋白质或表面活性剂就会开始吸附于气泡的界面以降低气-液界面的表面张力,保持界面液膜的稳定性从而形成泡沫分散体系。
2 泡沫体系的稳定机理
泡沫体系形成后的动力学稳定性则是一个极其复杂的过程。首先,气-液界面的高自由能导致蛋白质泡沫表面非常不稳定,气泡薄膜开始排液导致其不稳定,随后膜破裂和气体扩散引发最终的失稳。泡沫的排液是指在重力作用下,气泡薄膜间的液体渗出使得气泡与液体分离,与其相关的表征指标是泡沫的持水率,即泡沫中液体的体积在泡沫体积中的占比。泡沫的持水率对泡沫结构有很大影响,在正常的状况下,气泡的结构可以是有序的,也可以是无序的,持水率较高的气泡接近于球形,由于重力作用泡沫开始不断从顶部往下排液,经过一段时间的排水后变成多面体形。Indrawati等[18]的研究结果指出,当上层泡沫的持水率小于0.26时,泡沫结构呈现多面体形状,而下层泡沫持水率大于0.26时呈现出近球形。当两个相邻气泡薄膜的破裂时会造成相邻气泡的合并,这种现象称为膜破裂,主要是由于在表面活性剂分子的排斥力和马朗戈尼效应作用下流动性不足,导致两个气泡合并[19]。此外,泡沫中气体的相互扩散也是导致泡沫不稳定的因素之一,而这种相互扩散存在一定规律。根据拉普拉斯方程,气泡内外的压强差与气泡半径成反比,因此气体会自动从较小的气泡扩散到较大的气泡,直至较小的气泡消失,留下较大的气泡,这种气体扩散的现象被称为奥斯瓦尔德熟化,也叫歧化或者粗化。但值得注意的是,除非泡沫体系平衡时间特别长,否则气体在泡沫间扩散的速度要远小于泡沫排液的速度[20-21]。泡沫排液、膜破裂和气体扩散在泡沫体系中同时存在,又互相关联,当排液发生时,液膜间的液体流动影响着气泡间的气体扩散,同时膜破裂和气体扩散导致泡沫平均直径增大,加快了泡沫的排液,但无论哪种机制占据优势,泡沫体系的最终平衡态都会分离成独立的液相和气相。蛋白质纳米聚合物改善泡沫体系的机理均是建立在上述3 种泡沫失稳机制的基础上,如减少泡沫的排液量、抑制膜破裂和减缓气体的扩散等。
3 泡沫的微观结构
观察并分析泡沫的微观结构对研究泡沫体系的稳定性具有重要的意义。在各个气泡的平衡过程中,由两个气泡组成一个液膜,由3 个液膜组成一个液膜间夹角为120°的类似三角形通道,称之为普拉特奥边界(图1A),而4 个气泡组成一个三维形态的普拉特奥边界交汇点,相邻的两个边界之间夹角为109.5°,称为节点(图1B),这些微观结构在泡沫排水过程中起着渠道和储存的作用[22]。因为在普拉特奥边界的曲率半径大于泡沫液膜处(平面)的曲率半径,导致边界的压力小于液膜处的压力,因而产生了一种边界吸力,也称毛细抽吸力(表面张力与曲率半径的比值),于是液膜通过从四处相邻的普拉特奥边界排水而逐渐变薄。同时由于重力作用,液体不断从上层的普拉特奥边界流向下层,导致上层边界不断缩小,曲率半径变小,下层边界不断扩大,曲率半径也随之变大,上层边界吸力比下层的大,从而形成了从下往上的吸力梯度(图2)。这种吸力梯度会抵消重力作用,边界吸力会平衡液膜各处的压力,而气体的扩散可以通过纳米聚合物或者表面活性剂消除,直至泡沫体系达到平衡,最终形成顶部泡沫层-中部气液分散层-底部液体层的状态(图3)[23]。
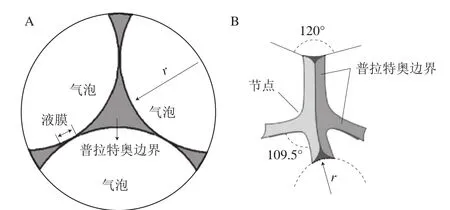
图1 普拉特奥边界(A)和节点(B)示意图Fig.1 Schematic diagram of plateau border (A) and node (B)
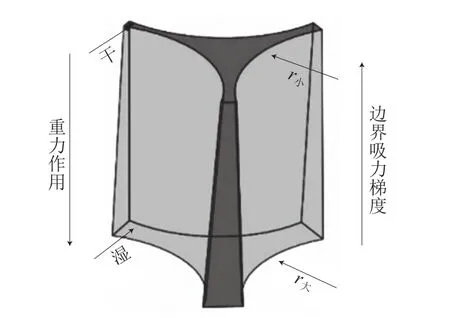
图2 上-下边界通道示意图Fig.2 Schematic diagram of upper-lower border passage
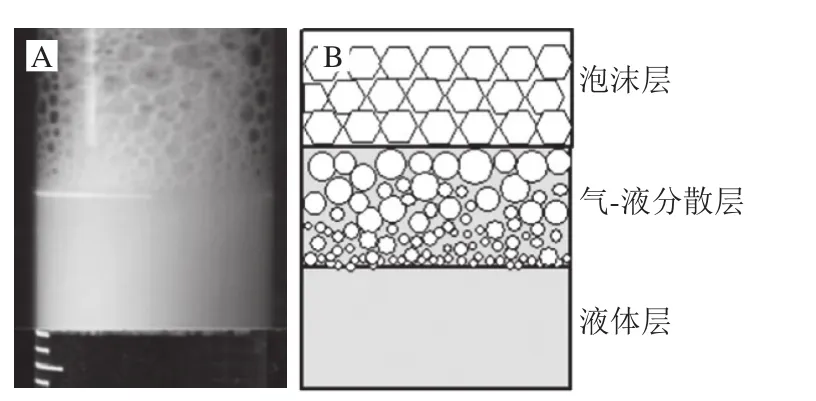
图3 泡沫最终平衡体系(A)及示意图(B)Fig.3 Foam final equilibrium system (A) and schematic diagram (B)
4 蛋白质纳米聚合物性质对泡沫体系的影响
4.1 蛋白质纳米聚合物的粒径对泡沫体系的影响
聚合物的粒径影响着蛋白质溶液的起泡特性,一般而言,粒径越小,蛋白质溶液的起泡特性越好。Morales等[24]采用加热与超声波组合处理大豆分离蛋白,结果表明大豆分离蛋白原溶液的粒径大约为120 nm,热处理使大豆分离蛋白的平均粒径减小至约100 nm,热处理和超声组合处理使其平均粒径减小至约63 nm,而它们的起泡能力却逐渐增大,表明蛋白质纳米聚合物的起泡能力与其粒径成反比。此外,有研究发现,β-乳球蛋白在pH 5.8时可形成水力学半径约150 nm近似球体的纳米聚合物,在低pH值环境时可形成水合直径10~30 nm、水合长度1 400~2 500 nm的纤维状聚合物,结果表明纤维状聚合物比球状纳米聚合物具有更好的泡沫稳定性[2]。
4.2 蛋白质纳米聚合物表面净电荷对泡沫体系的影响
蛋白质的表面净电荷量会影响纳米聚合物颗粒之间的相互作用,因而会影响蛋白质溶液的起泡特性。研究发现,ζ电位绝对值越高,纳米聚合物颗粒之间的静电斥力越强,这有利于改善蛋白质溶液的分散性和溶解性,从而使纳米聚合物体系的起泡能力得到改善[25],例如当β-乳球蛋白形成纳米聚合物时,分子中带电荷的氨基酸暴露出来,因此表面电荷发生变化,等电点也随之改变,导致纳米聚合物比天然β-乳球蛋白具有更好的泡沫稳定性。还有相关研究发现当大豆蛋白被加热形成可溶性聚集体时,其ζ电位由-34.4 mV降低至-36.4 mV,这使得纳米聚合物体系之间的静电斥力更大,所形成的泡沫体系也更加稳定[1-2]。
4.3 蛋白质纳米聚合物形态对泡沫体系的影响
纳米聚合物的形态与外部环境有着密切的联系,如在不同的pH值环境下蛋白质纳米聚合物主要呈现3 种形态:纤维状、球形颗粒和不规则形聚集体(图4)[26],其中目前被深入研究的主要是球形纳米颗粒与纤维状纳米聚合物。球形纳米颗粒又被称为微凝胶,通常由交联的聚合物网络组成,内部由共价键或其他强大的分子内力将动力学稳定的结构结合在一起。纤维状纳米聚合物结构的核心是交叉的β-折叠结构,连续的β-折叠结构通过氢键堆积在垂直于纤维长轴的方向上,然后多股缠绕形成最终的纤维状结构。
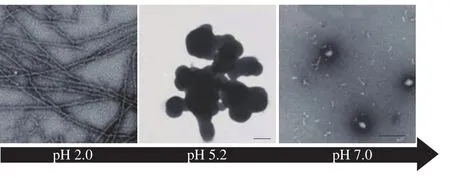
图4 不同pH值下的纳米聚合物形态[26]Fig.4 Nano-polymer morphology at different pH levels[26]
关于纳米聚合物的形态对泡沫体系的影响,Lazidis等[27]认为天然的蛋白质有助于泡沫的产生,因为它们在泡沫产生过程中可以快速扩散并吸附在表面,而经变性所形成的纳米聚合物对泡沫的稳定性则有显著影响,因为其能够稳定吸附在气-液界面,增加了界面薄膜的黏弹性。有关蛋白质纳米聚合物颗粒形态对泡沫体系影响的进一步分析结果表明,在油-水或气-水界面,球状纳米聚合物与纤维状纳米聚合物在液滴或者气泡之间的稳定机理如图5所示[28]。球状纳米聚合物在两个相邻气泡间的分散方式有双层堆积(图5A1)、单层堆积(图5A2)和随机堆积(图5A3)3 种类型,其中双层堆积在实际中很难以实现,可能是受实际界面吸附的限制,而当以单层堆积的方式吸附在界面上,其自身体积的大部分处于流动相中,剩下的则处于分散相中[29]。除单层堆积和双层堆积外,在实际实验中观察发现大部分球状纳米聚合物则呈现出一种无定形的弱聚集形态,这意味着纳米聚合物不会像前两种方式迅速吸附形成单层膜或双层膜,所以出现了一种更厚且无序的随机堆积的稳定方式,相比前两种,随机的聚集增大了界面处的黏度,更能减缓薄膜地排液。另外,在表面粗糙度相似的情况下,与球状纳米聚合物相比,具有高长径比的纤维状纳米聚合物(图5B)更能稳定泡沫,因为它对泡沫提供的保护面积更大。上述4 种稳定方式,其机理都是在增大泡沫的表面强度,同时促进气泡薄膜处溶液黏度的增大,一方面有助于蛋白质膜的耐冲击作用;另一方面也有助于减缓气泡薄膜的排液作用。
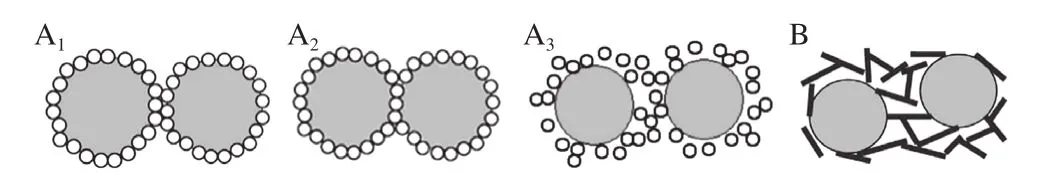
图5 球状纳米颗粒(A)和纤维状纳米颗粒(B)稳定气泡示意图[29]Fig.5 Schematic diagram of stable bubbles of spherical nanoparticles (A)and fibrous nanoparticles (B)[29]
4.4 蛋白质纳米聚合物界面特性对泡沫体系的影响
蛋白质可以较容易地吸附在不同相之间的界面上,除了可以降低表面张力外,还可以形成黏弹性较高、稳定性较强的蛋白质膜。表面张力的降低可以用来解释蛋白质的最佳起泡条件,但并不能解释泡沫的稳定性,如乙醇、庚烷、苯等一些纯有机液体,它们的表面张力比纯水低,与表面活性剂溶液的表面张力接近,却并不能起泡。因此,需要引用蛋白质的黏弹性膜对泡沫的稳定性进行解释,只有当液体表面能够形成具有一定强度的蛋白质膜,其具有的低表面张力才有助于泡沫的稳定。然而,在食品体系中通常被用作发泡剂的蛋白质成分并不足以达到形成刚性蛋白质膜的条件,而蛋白质纳米聚合物颗粒可以紧紧吸附于泡沫的液膜上以形成一层具有黏弹性的界面薄膜,能够使泡沫体系保持较好的稳定性[30-32],例如Jung等[33]研究了β-乳球蛋白两种不同长度的纤维状聚集体在油-水界面的界面膜流变学性质,并与天然β-乳球蛋白界面膜进行对比,发现纤维状聚集体吸附至界面时间更短,且其蛋白质膜具有更高的黏弹性模量;Gao Zhiming等[34]通过研究发现,与天然β-乳球蛋白相比,其纤维聚集体可以有效提高界面活性,增强界面上蛋白质分子间的相互作用。因此,蛋白质纳米聚合物对泡沫稳定性的影响不仅与界面张力有关,还取决于对气-液界面流变特性的影响[32]。另外,当蛋白质纳米聚合物吸附至界面后会在气-液界面形成一定结构的蛋白质膜以增大界面处蛋白质溶液的黏度,从而减缓泡沫的排液作用,这有利于泡沫体系稳定性的提高。
5 蛋白质纳米聚合物的制备方法
5.1 酸热诱导法
酸热诱导法作为一种物理改性方法,是制备蛋白质纳米聚合物最常见的方法,其原理是蛋白质分子受热时,其空间结构发生去折叠并舒展开。变性之后的蛋白质在不同的pH值环境下通过非共价作用力发生聚集,如离子键、范德华力和疏水相互作用等,从而导致纳米聚合物的产生。通常这些纳米聚合物的形成与性质主要受pH值和加热温度的影响。van der Linden等[35]研究β-乳球蛋白在80 ℃加热条件下其聚集体结构随pH值的变化,结果显示,在低离子浓度下,当pH值远离β-乳球蛋白等电点时会形成较透明的线性聚合物;而在接近β-乳球蛋白等电点时,分子间静电斥力较弱导致较浑浊的团簇形聚合物形成,其原理示意图如图6所示。而不同的加热温度也影响着蛋白质变性形成聚合物的过程,如在β-乳球蛋白变性过程中存在着连续的反应和不同的产物,当暴露在60~85 ℃环境中时,β-乳球蛋白的球状折叠结构打开,开始部分伸展,形成较大的聚合物;当加热温度进一步升高至85~105 ℃时,此时β-乳球蛋白的巯基暴露出来,在分子间形成二硫键重新折叠,从而形成较小的聚合物;当温度加热到105 ℃以上时,聚合物中的二硫键断裂,β-乳球蛋白分子会进一步继续伸展[36]。胡静[2]通过调节天然β-乳球蛋白的pH值和温度制备出了β-乳球蛋白的纳米聚合物,其中在pH 2.0、80 ℃条件下搅拌加热16 h制得了长度为500~700 nm的纤维状纳米聚合物,在pH 5.8、85 ℃条件下搅拌加热15 min则制备出了粒径为350 nm的纳米颗粒状聚合物。Zhang Yehui等[37]通过对米糠蛋白进行酸热处理发现,在pH 2.0、90 ℃下加热2 h后,米糠蛋白形成了纤维状聚合物,且纤维状聚合物的形态呈线状或柔韧性,而在pH 7.0时其聚合物形态变为团簇状。总的来说,酸热处理改变了天然蛋白质的空间结构,在一定程度上改善了蛋白质的理化性质,使其功能特性优于天然蛋白质[38]。
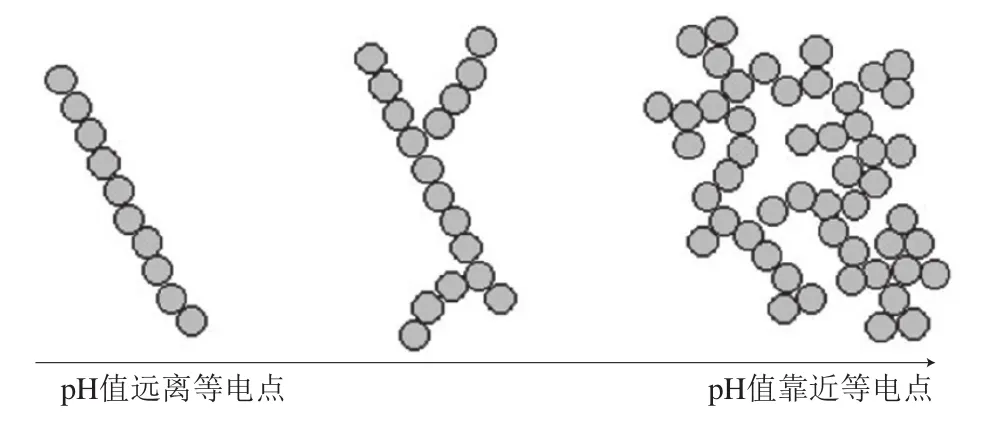
图6 pH值对蛋白质纳米聚合物形成的影响示意图[35]Fig.6 Schematic diagram of the effect of pH on the formation of nano-polymers[35]
除此之外,采用不同的酸处理对形成的蛋白质纳米聚合物体系也存在影响,如有研究发现,使用HCl溶液酸化时,由于酸化过程中氢离子分散不均匀,pH值变化较快,易使蛋白质颗粒迅速发生聚集。D-葡萄糖酸-δ-内酯(D-glucose-δ-lactone,GDL)在水解的过程中可缓慢释放葡萄糖酸,逐渐降低溶液的pH值,与HCl溶液酸化处理的纳米聚合物相比,采用GDL酸化制备的蛋白质纳米复合物颗粒粒径更小、分布更均匀[39-40]。
5.2 蛋白质-多糖复合法
蛋白质与多糖的复合物中最具代表性的是蛋白质的糖基化产物。糖基化反应是蛋白质与多糖发生美拉德反应而形成蛋白质-多糖共聚物,其中蛋白质上的氨基和还原糖的羧基相互结合,对蛋白的功能特性有着重要的修饰作用。通常,糖基化反应主要包括干热法和湿热法,其中干热法最早使用,也是最主要的糖基化法,其方法操作简单、反应易受控制、反应产物接枝度高,但反应时间较长。Liu Gang等[41]将麦芽糖糊精与乳清分离蛋白在80 ℃下进行了干热法糖基化处理2 h,结果发现改性后的乳清分离蛋白表现出良好的透明分散状态。湿热法则与之相反,由于是基于液相进行蛋白质的糖基化改性,其反应迅速,反应耗时短,但是该方法存在反应不完全、接枝度低、反应物复杂且难以控制等问题。王松等[42]利用湿热法将葡萄糖和大豆分离蛋白进行糖基化处理,处理后大豆分离蛋白的乳化性、溶解性和凝胶性均得到较大的改善。除糖基化处理外,也存在其他的方法来制备蛋白质-多糖纳米复合聚合物,如Li Hao等[43]通过采用简单的抗溶剂沉淀法在pH 4.0条件下制备了玉米醇溶蛋白-可溶性大豆多糖复合纳米颗粒,其稳定的玉米醇溶蛋白纳米颗粒在pH 2.0~8.0时都没有聚集和沉淀,即便在较高的离子强度和温度下,它们也比较稳定。除了玉米醇溶蛋白和可溶性大豆多糖的复合纳米颗粒之外,Li Juan等[44]发现使用玉米醇溶蛋白和阿拉伯胶以质量比为1∶1.5制备出的蛋白质-多糖纳米复合物最为稳定,其在pH 3.0~9.0的范围内具有较高的ζ电位。Wang Lei等[45]将抗溶剂沉淀法和热处理工艺相组合,可制备出颗粒粒径更小、分布更均匀的球形玉米醇溶蛋白-多糖纳米颗粒。总之,蛋白质与多糖反应的最终目的是改善蛋白质的理化和功能性质,糖基化作为一种使蛋白质-多糖复合的方法,能在温和、安全的条件下进行,且除了糖和蛋白质之外,没有其他化学试剂,同时赋予了接枝产物优良的功能特型,因此具有一定的发展潜力。
5.3 酶法制备
酶法制备主要利用生物学手段,结合不同目的而选择适当的生物酶对蛋白质进行改性,使蛋白质氨基酸残基和多肽链发生变化,导致其理化性质也随之改变,从而获得较好的功能特性蛋白质的过程。研究者采用谷酰基肽链内切酶水解乳清蛋白发现,乳清蛋白水解后产生许多短肽链的亲水性多肽,增强了乳清蛋白的亲水性。另一方面,疏水性多肽的暴露和一定程度上水解导致的分子间静电斥力减弱,使得不同溶解度的多肽之间主要通过疏水相互作用引发聚集,从而形成聚集体[46-47]。然而,过度的水解并不能总是促进蛋白质功能特性的改善,反而会失去某些天然蛋白质原有的功能特性,这主要取决于蛋白质的结构和酶的种类[48]。另外,酶交联也是酶法制备蛋白质纳米聚合物的一种方式,其机理是通过蛋白质水解和共价交联来增强蛋白质的功能和营养特性。酶交联法主要是利用转谷氨酰胺酶(又称谷氨酰胺转胺酶,是一种催化酰基转移反应的转移酶)可以催化蛋白质分子内或分子间的交联、蛋白质和氨基酸之间的连接以及蛋白质分子内谷氨酰胺基水解,能够聚合蛋白多肽之间形成共价聚合物,从而通过改善蛋白质的结构和功能特性来提高蛋白质的应用范围[49]。Meng Shi等[50]选择木瓜蛋白酶、菠萝蛋白酶和无花果蛋白酶3 种酶对花生蛋白进行水解后,再用转谷氨酰胺酶对其进行交联,结果发现与花生蛋白相比,交联后产物的分子质量增大,有较大的团聚物形成,起泡性和乳化性均得到了改善,但经无花果蛋白酶水解后交联对起泡性和乳化性的改善效果稍差些,是因为无花果蛋白酶对花生蛋白水解产生大量短肽,短肽更难以与较大的聚合物交联。于殿宇等[51]采用转谷氨酰胺酶对米糠蛋白进行改性,发现经酶交联处理后的米糠蛋白的溶解度增大,起泡特性和乳化特性均有所提高。孙佳等[52]使用转谷氨酰胺酶对乳清分离蛋白进行酶交联,制备出了分子质量为120 kDa的大分子聚合物,且生成聚合物的量随着超声处理时间的延长而增加,酶交联后其表面疏水性与荧光强度均得到增加,表明蛋白空间结构发生改变,并与超声处理时间呈正相关,但酶交联使乳清分离蛋白粒径增大,而超声处理则使其粒径变小,更有利于生成致密、均匀的网络状聚合物。蛋白质的酶交联法能够通过专一改善蛋白质的分子肽键制备蛋白质纳米聚合物,具有效率高、产物品质高、毒副作用低以及酶交联条件温和等优势,是一种绿色健康的蛋白质改性方式。
5.4 其他方法
除了最常见的酸热诱导法、蛋白质-多糖复合法以及酶法制备外,还出现了一些比较新的蛋白质纳米聚合物制备方法。例如,Sui Xiaonan等[53]利用超声处理卵磷脂和大豆分离蛋白形成的复合物,发现经150 W、24 min的超声处理后,复合物的乳化性和乳化稳定性得到显著改善,但是当超声功率增加至450 W时,超声处理反而增加了复合物颗粒的尺寸,同时降低乳化稳定性和复合物的电荷,表明超声处理引发了大豆分离蛋白-卵磷脂复合物的结构变化。同样地,采用高强度低频超声(high intensity low-frequency ultrasound,HIU)协同热处理大豆分离蛋白,发现HIU处理改变了大豆分离蛋白聚合体的空间结构,减小了颗粒尺寸,增加了可溶性聚集物和游离巯基的含量,提高了其溶解性,增强了表面疏水性,形成了更密集的蛋白质网络[54-55]。另外,利用小分子化合物对蛋白质进行修饰也可以形成纳米复合物,主要的作用力包括共价作用和非共价作用,共价作用主要是二硫键,非共价作用包括氢键、疏水相互作用、范德华力和静电相互作用等,但在聚合过程中后者的作用很低,共价作用占主导[56]。李扬等[57]利用花青素修饰大豆分离蛋白,结果表明形成的大豆分离蛋白-花青素复合物比天然大豆分离蛋白表现出更好的乳化性和起泡性;Li Ting等[58]研究了水稻蛋白与花青素络合后的功能性质和结构变化,结果表明水稻蛋白结构发生变化导致分子谱图强度的增加和酰胺带的谱移,其聚合物主要由氢键和疏水相互作用形成,并且在pH 3时表现出优越的起泡特性。Wu Weiguo等[59]使用茶多酚修饰卵清蛋白,研究了其对卵清蛋白起泡性能、凝胶性能以及热变形温度的影响,结果表明1%(终质量分数,后同)的卵清蛋白与0.25%的茶多酚混合处理10 min后,起泡性和泡沫稳定性达到了最大值,同时随着茶多酚添加量的增加,卵清蛋白-茶多酚复合物的凝胶强度增大,热变性温度降低,表明蛋白质空间结构发生改变。此外,球磨处理也是一种改善蛋白质结构的新型技术,其原理是球磨处理过程中,碰撞、摩擦和剪切产生综合作用,促使蛋白分子结构改变而影响其功能特性[60]。谭文等[61]对蛋清蛋白进行球磨处理后发现,蛋白分子之间表面电荷数下降,表面疏水性降低,蛋白分子柔性增加,有助于调整分子结构更好地分布于泡沫表面,从而改善了蛋清蛋白的起泡特性。这表明球磨处理破坏了蛋清蛋白的天然结构,促使蛋白结构重新折叠或聚集[62-63]。
不同蛋白质聚合物制备方法所基于的原理和所涉及的蛋白质分子间的作用力不同,因此应当考虑制备方法本身的特点和蛋白质分子的结构特性,选择合适的蛋白质纳米聚合物制备方式,以达到改善蛋白质溶液起泡特性的目的。几种常见的蛋白质纳米聚合物制备方法的原理及特点如表1所示。

表1 不同蛋白质纳米聚合物制备方法的原理与优缺点Table 1 Principles, advantages and disadvantages of different preparation methods for protein nano-polymers
6 结 语
在食品工业中,蛋白质作为一种两亲性物质可通过在不同环境下的改性来引发蛋白质聚集行为以形成纳米聚合物。蛋白质纳米聚合物的粒径、表面净电荷、形态、界面特性等将直接影响其溶解性和起泡特性,进而在一定程度上影响到食品的品质。因此,控制好蛋白质的聚集行为,了解蛋白质纳米聚合物与泡沫体系之间的关联性,对指导泡沫类食品行业的发展具有重要作用。随着对蛋白质聚集行为和蛋白质纳米聚合物制备方法的不断创新研究,蛋白质纳米聚合物功能特性的研究在食品加工中依旧是今后的主要热点方向。未来针对蛋白质纳米聚合物泡沫体系的研究可以集中于建立“蛋白质分子-纳米聚合物-泡沫体系”的关系模型,阐明三者之间的影响机理,旨在精准调控蛋白质纳米聚合物从而获得理想的泡沫体系,为泡沫类食品在食品工业中的应用提供理论基础。

