基于细菌群体感应淬灭机制的食品保鲜应用研究进展
李香澳,温荣欣,吕懿超,孔保华,王雯萱,周雅菲,陈 倩*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
细菌可通过一种称为群体感应(quorum sensing,QS)的密度依赖机制进行交流,这种机制能够释放信号分子,以此调节细菌群落的代谢和行为活动[1]。QS首次发现于海洋细菌费氏弧菌(Vibrio fischeri)中[2],它是一种革兰氏阴性菌,能够利用自身合成的化学物质调节荧光相关基因的表达。通常而言,微生物产生并释放信号分子,信号分子浓度与微生物密度成正比,当信号分子累积达到阈值水平时,开始通过激活并结合其受体蛋白来启动相关基因的表达,如调控细菌代谢次级产物、形成孢子和生物膜等[3-4]。信号分子作为细菌间交流的“语言”,在不同种类的细菌中有所不同。常见的信号分子类型主要包括以下几种:1)革兰氏阳性菌分泌的自诱导肽类信号分子(autoinducing peptides,AIPs)[5];2)革兰氏阴性菌QS系统的自诱导因子N-乙酰-L-高丝氨酸内酯(N-acyl homoserine lactones,AHLs)[6];3)革兰氏阳性菌及革兰氏阴性菌共同利用的呋喃硼酸二酯类信号分子自诱导物-2(autoinducer-2,AI-2)[7];4)其他信号分子:铜绿假单胞菌产生的喹诺酮类信号分子(喹诺酮类和二酮哌嗪类)[8]、扩散信号因子(diffusible signaling factor,DSF)[9]等。细菌间无时无刻不在进行“交流”,这使得QS与很多领域有着密切的联系。医学上对QS的研究有助于控制患者的细菌感染,规避传统抗生素的耐药性问题;农业上对QS的研究有望调控作物表型,提高作物抗病能力,增加作物产量;在食品行业对QS的研究可以解决长久以来困扰人们的食品保鲜问题等,因此细菌QS现象已逐渐成为各相关领域的研究热点。本文针对不同类型的QS系统及淬灭机制进行了详细介绍,揭示了淬灭技术应用于食品保鲜上的巨大潜力。
1 群体感应系统
QS系统一般由信号分子、特异性受体蛋白和下游调控蛋白3 个部分组成,根据信号分子种类的不同,可将其主要分为三大类:即革兰氏阳性菌的双组分QS系统、革兰氏阴性菌的LuxI/LuxR QS系统、革兰氏阴性菌和革兰氏阳性菌共用的LuxS/AI-2 QS系统。这3 种QS系统调控机制示意图如图1所示。

图1 3 种QS系统调控机制示意图[10]Fig.1 Schematic diagram of three QS system regulation mechanisms[10]
1.1 革兰氏阳性菌的双组分群体感应系统
大多数革兰氏阳性细菌都依赖于双组分QS系统进行交流,由寡肽类信号分子AIPs介导。AIPs体积小、稳定性高,具有特异性和多样性;它们是核糖体合成的前体肽,翻译后修饰形成活性AIPs信号分子[11]。AIPs分子不能自由穿入细胞膜,需要经过ABC转运蛋白的运输或者其他的膜通道蛋白作用到达细胞外行使功能。信号分子的浓度随菌体密度的增加而不断升高,当达到特定阈值时,信号分子转移至细胞膜上与受体结合,使受体发生自磷酸化,磷酸基团激活调控蛋白与启动子结合,信号分子AIPs通过进一步修饰达到成熟状态,开启基因的表达[12]。金黄色葡萄球菌(Staphylococcus aureus)是利用双组分QS系统的典型例子(图2),这种细菌毒力因子的表达和通讯交流受到由RNA II和RNA III两种转录体组成的Agr位点的调控[13]。金黄色葡萄球菌的自诱导物AIPs的前体为AgrD,可以被膜蛋白AgrB加工,进行硫代内酯环化修饰并被运输到细胞外,AIPs浓度达到阈值时会与细胞外受体AgrC结合,随后激活agrB、agrD、agrC、agrA操纵子的转录,形成正反馈,完成金黄色葡萄球菌由低密度状态向高密度状态的生理行为转变[14]。对于AIPs,可通过超高效液相色谱与电喷雾质谱结合,依靠其独有的分辨率和精度定量检测信号分子AIPs[15]。

图2 金黄色葡萄球菌的agrBDCA系统[16]Fig.2 agrBDCA system of Staphylococcus aureus[16]
1.2 革兰氏阴性菌的LuxI/LuxR群体感应系统
在革兰氏阴性菌中,通常利用AHLs完成细胞间的交流与信息传递[17]。信号分子AHLs是一类酰基高丝氨酸内酯分子,具有高丝氨酸内酯环结构。革兰氏阴性菌QS系统基于LuxI和LuxR介导,LuxI是一种自诱导合成酶,可催化S-腺苷甲硫氨酸(S-adenosyl-L-methionine,SAM)与酰基载体蛋白(acyl carrier protein,ACP)间的相互作用,从而合成AHLs。当AHLs浓度达到阈值时可与受体结合,激活转录调控因子LuxR,形成LuxI-LuxR蛋白复合体,激活基因的启动子转录,从而触发基因表达。黏质沙雷氏菌(Serratiamarcescens)中的SmaIR基因[18-19]、紫色杆菌(Chrornobacteriurn violaceurn)中的CviIR基因[20-21]、耐盐单胞菌(Halomonas anticariensis)中的hanIR基因[22]表达都是基于LuxI/LuxR QS系统,但其AHLs的碳链长度和第3位羰基碳取代基略有不同。革兰氏阴性菌中除了典型的LuxI/LuxR型的QS系统外,根据AHLs酞基侧链的不同,还有LasI/LasR和AbaI/AbaR型等QS系统,分别调控细菌的毒力因子表达和生物膜的形成等[13]。
目前细菌生物感应器是检测AHLs的一种有效手段,该方法简便快捷,不受设备限制。常用的两种细菌生物感应器是基于紫色杆菌(Chromobacterium violaceum)和根癌农杆菌(Agrobacterium tumefaciens)的细菌生物感应器。当二者联合使用时,可以明显扩大检测范围。此外,通过薄层层析与细菌生物感应器相结合、β-半乳糖苷酶活性检测法也可以达到检测AHLs的效果[23]。还有研究表明,可通过在Fe3O4颗粒表面涂覆碳量子点掺杂的分子印迹聚合物层来制备磁性荧光探针,用于检测鱼肉汁和牛奶中的AHLs,相对标准偏差小于5.1%,这为制造AHLs荧光探针提供了一种新颖的策略,具有在农业食品中广泛应用的巨大潜力[24]。
1.3 革兰氏阳性菌及革兰氏阴性菌共同采用的LuxS/AI-2群体感应系统
革兰氏阳性菌和革兰氏阴性菌共用的QS系统中涉及到信号分子AI-2的产生,因此AI-2可以被称为细菌种间交流的媒介。AI-2是呋喃酮衍生的信号分子,具有上下对称的双五元环结构。在革兰氏阳性菌和革兰氏阴性菌中,AI-2的生成首先基于SAM向S-腺苷同型半胱氨酸(S-adenosyl homocysteine,SAH)的转化,随后在pfs编码的SAH核苷酶作用下,SAH被水解为腺嘌呤和S-核糖同型半胱氨酸(S-ribose homocysteine,SRH),SRH在luxS基因编码的SRH核苷酶的作用下,可转化为4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD)和同型半胱氨酸。其中,DPD可自发排列形成AI-2,而同型半胱氨酸可接受甲基,生成SAM,继续参与甲硫氨酸循环。
由于信号分子AI-2不稳定、浓度低,因此很难利用高效液相色谱法和气相色谱(gas chromatography,GC)等常规方法进行检测。当前最常见的检测方法是生物学检测法:利用哈维氏弧菌BB120(Vibrio harveyiBB120)的定向突变菌株哈维氏弧菌BB170(Vibrio harveyiBB170)作为报告菌株,因其仅对AI-2信号分子发生反应并发光,AI-2的活性可用荧光强度来表示。此外,还可通过气相色谱-质谱联用(gas chromatographymass chromatography,GC-MS)检测法、液相色谱-串联质谱检测法对AI-2前体物质DPD进行直接分析从而准确定量[25]。另外,环境因素对此类信号分子活性有较大影响。例如,酸胁迫会导致基于LuxS系统的乳杆菌(包括Lactobacillus rhamnosusGG、Lactobacillus acidophilusNCFM、Lactobacillus johnsoniiNCC533)的信号分子AI-2活性提高[26];低温胁迫会抑制屎肠球菌8-3(Enterococcus faecium8-3)和发酵乳杆菌2-1(Lactobacillus fermentium2-1)信号分子AI-2的分泌,且低温和高温下均对相关基因(LuxS和pfs)的转录水平起上调作用[27]。
2 群体感应淬灭的机制
群体感应淬灭(quorum quenching,QQ)是通过抑制或干扰生物细胞间的QS系统,阻断细胞间的信息交流,抑制毒力基因表达从而防御致病菌感染的一种手段[28]。与传统抗生素直接杀死细菌不同,QQ通常不会抑制细菌的生长,不易造成选择压力和耐药性,因此有期望成为代替抗生素的新型生物防治手段。QQ的机制如图3所示,主要有以下3 种:1)抑制信号分子生成;2)阻碍信号分子与受体蛋白结合;3)降解信号分子。前两种方法通常利用一些小分子抑制剂阻止信号分子的产生和感知利用。对于第3种方法信号分子的降解,目前酶促降解的应用研究最为广泛。
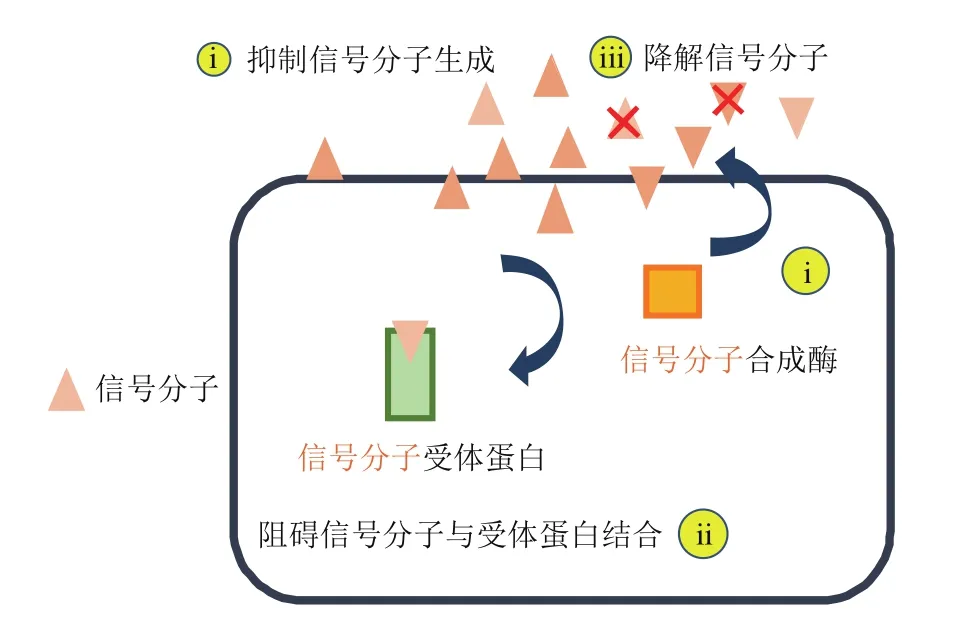
图3 QS淬灭机制示意图[29]Fig.3 Schematic diagram of quorum quenching mechanism[29]
2.1 抑制信号分子生成
QS系统的调控离不开信号分子的作用。以革兰氏阴性菌QS系统为例,在典型的LuxI/LuxR QS系统中,QS系统通过AHLs起作用。其分子结构以一个高丝氨酸内环为头部和一个酰基侧链为尾部,酰基侧链的长度和取代基的不同决定了AHLs的特异性[30]。AHLs的合成不仅需要LuxI合成酶,还需要ACP和SAM的共同作用。因此,通过抑制酶活性、消除底物、抑制信号分子前体合成或添加前体物质类似物等任一方法均可阻断信号分子合成,进而阻断QS进程。例如,一些SAM类似化合物,如SAH和西尼霉素可以抑制AHLs合成[31]。Chang等[32]通过分子对接手段发现,肉桂醛可通过与信号分子合成酶底物结合位点作用,抑制铜绿假单胞菌(Pseudomonas aeruginosa)QS系统关键基因lasB、rhlA和pqsA表达,进而对生物膜的形成造成影响。肉桂醛衍生物也可以通过降低LuxR的DNA结合能力,干扰各种弧菌中基于AI-2的QS系统,导致一些明显的表型变化,如毒性降低、对环境胁迫的敏感性增加[33]。对于革兰氏阴性菌和革兰氏阳性菌共用的LuxS/AI-2 QS系统而言,抑制具有催化SAH水解功能的SAH核苷酶的活性可阻碍AI-2生成,进而抑制QS通路[34]。在革兰氏阳性菌的双组分QS系统中,AgrB和SpsB两种酶参与AIPs的生物合成。AgrB参与环状AIPs的生物合成,而SpsB是参与Sec和Tat依赖性蛋白分泌的I型信号肽酶,是具有蛋白酶活性的加工酶,抑制这些有催化功能的酶类可阻断QS进程[35]。例如,真菌次生代谢物Ambuic酸可以通过抑制信号分子合成酶AgrB的活性来抑制AIPs的生物合成,降低其毒力因子的表达[36]。
2.2 阻碍信号分子与受体蛋白结合
QS信号分子与受体蛋白结合后,活化受体蛋白,进而激活下游的转录调控因子。因此,降低受体蛋白活性或利用与信号分子结构相似的类似物竞争信号分子结合受体蛋白的活性位点,可以对QS进程造成影响。由海洋红藻产生的卤代呋喃酮是最早发现的天然QS抑制剂,它可以通过干扰信号分子AHLs与受体蛋白LuxR结合,从而影响革兰氏阴性菌的QS系统[37-38]。吡罗昔康(piroxicam)和美洛昔康(meloxicam)能与lasR和pqsE两种蛋白质的活性位点很好地相互作用,因此可用作控制铜绿假单胞菌QS系统和生物膜形成的潜在抑制剂,在铜绿假单胞菌QS机制中起重要作用[39]。在革兰氏阴性菌和革兰氏阳性菌共用的LuxS/AI-2 QS系统中,信号分子AI-2是一类没有特定定义结构的分子,其线性前体DPD可以在溶液中环化形成各种异构体。因此,这为其类似物和配体的合成带来了挑战。Lowery等[40]合成了一组DPD/AI-2类似物,并评估了它们对各种细菌的AI-2类QS系统的影响,通过对比lsr基因表达量,证明丙基-DPD和丁基-DPD对沙门氏菌的QS系统抑制作用最大。在革兰氏阳性菌的双组分QS系统中,一些AIPs类似物在半抑制浓度下稳定,并可以抑制人体内微生物的致病作用[35]。
2.3 降解信号分子
目前对信号分子降解的研究主要集中于革兰氏阴性菌的AHLs系统上。通过降解信号分子使其在胞外达不到临界阈值浓度,不能与LuxR蛋白结合形成具有转录调节激活作用的多聚合物,以此达到淬灭的效果。一般可通过一些有降解活性的化学物质、降解菌和淬灭酶达到降解信号分子的目的。化学降解主要是在碱性条件下内酯环打开,使AHLs信号活性丧失。但内酯环可以重新环化,AHLs信号的活性在酸性条件下可以逆转。芽孢杆菌属[9]和假单胞菌属[41]等都可作为降解菌阻断QS通路。目前已发现的具有降解QS信号分子能力的酶主要包括内酯酶(lactonases)、酰基转移酶(acylases)和氧化还原酶(oxidoreductases)[42]。内酯酶和酰化酶分别通过打开内酯环和切割分子的侧链起作用[43-44]。氧化还原酶能将信号分子中的羰基还原成为羟基,从而使信号分子的结构改变而不被降解。信号分子结构变化会导致其特异性和识别功能受到影响,从而导致细菌表型改变[45]。此外,许多生物体产生的乳酯酶或环化酶也可降解AHLs信号分子[46-47]。革兰氏阳性菌的双组分QS系统,其自然干扰是基于抑制性次级代谢物或细菌产生的竞争性抑制肽[48-49]。对于革兰氏阴性菌和革兰氏阳性菌共用的LuxS/AI-2 QS系统而言,将LsrK(AI-2激酶)和ATP引入细菌培养物中可以实现信号分子AI-2的降解,从而使AI-2在细胞外磷酸化,并显著减少细菌间的交流[34]。例如,大肠杆菌产生的抗菌肽LsrK可以磷酸化病原细菌中的AI-2,并抑制沙门氏菌和哈维氏弧菌生物膜的形成[50]。尽管人们已经证明了淬灭酶可有效降低动植物病原体的毒性,但仍需要更详细地讨论底物特异性、催化效率、稳定性、酶传递以及潜在的副作用等问题,以开发具有保护或治疗作用的淬灭酶。因此,大多数方法仍处在研究阶段,在农业、工业以及临床环境中的实际应用仍然稀少。
3 群体感应淬灭在食品保鲜中的应用
食品腐败问题是制约我国食品产业发展的一个重要因素,探究QS与食品腐败的关系,从QS的角度延缓、抑制食品腐败对我国食品工业未来的蓬勃发展有着重要意义。微生物活动是引起食品腐败的重要原因之一,细菌中的QS调节与食品腐败的典型表现有关,如果胶分解、脂肪分解、蛋白水解和几丁质分解以及生物膜形成。研究表明,许多与食品腐败相关的革兰氏阴性菌可产生AHLs,如铜绿假单胞菌、变形斑沙雷氏菌(Serratia proteamaculans)、蜂房哈夫尼菌(Hafnia alvei)等[3]。通过对QS信号分子的抑制、降解,干扰QS进程,阻碍特定基因的表达,可以延缓食品的腐败进程。此外,致病菌感染会对人类的健康造成威胁。因此,QS淬灭技术为食品防腐保鲜提供了可行的新思路。
3.1 乳及乳制品
乳及乳制品营养价值极高,富含蛋白质、脂肪、乳糖、矿物质、维生素等物质,因此成为人们日常生活中必不可少的食品。从原料乳到产品的每一个加工步骤的操作不当,都可能引起微生物污染,导致产品品质下降。引起乳及乳制品腐败的微生物主要是革兰氏阴性菌(例如假单胞菌属、沙雷氏菌属等),其腐败特性均受QS控制[51]。这些细菌在自然环境中广泛存在,且抵抗不良环境能力较强,因此乳及乳制品易受此类细菌污染。在变形沙雷氏菌B5菌株中,胞外脂肪酶和蛋白水解酶活性均受QS系统调节,且信号分子为AHLs,因此可以认为乳的腐败变质与QS机制密切相关。假单胞菌是一种能在冷藏条件下大量生长的腐败菌,Shobharani等[52]采用薄层色谱、GC以及GC-MS方法鉴定出了发酵乳中假单胞菌属的QS系统内包含两种不同的信号分子AHLs,分别为丁酰高丝氨酸内酯和己基高丝氨酸内酯。在添加2(5H)-呋喃酮的培养基中生长的假单胞菌菌株,其产量均低于对照菌株,并且能有效延长发酵乳的货架期至9 d,证明了2(5H)-呋喃酮对假单胞菌属信号分子AHLs的抑制作用。除了添加外源QS抑制剂可达到淬灭效果外,有研究表明QS淬灭抑制活性也与食品自身化学成分有关。例如,牛奶对紫色杆菌CV026(Chrornobacteriurn violaceurnCV026)信号分子AHLs产生的抑制效果优于骆驼奶[53],这可能是乳的化学成分不同,特别是脂肪含量不同造成的。牛奶对QS信号的自然抑制作用可能为控制食源性病原体和减少微生物腐败提供一种独特的手段。
3.2 畜禽肉制品
畜禽肉制品的安全性备受生产者和消费者关注,食用微生物过度污染的产品对人体健康有极大危害。假单胞菌属、芽孢杆菌属可以分解肉中的蛋白质,无色杆菌属可以分解肉中的脂肪,这些菌属是造成肉及肉制品发生腐败变质的主要微生物。目前,已从牛肉、鸡肉、猪肉、火鸡肉[54]等畜禽肉的腐败变质过程中检测出不同种类的信号分子。Mohan等[55]发现丁香酚和肉桂能有效控制鸡肉中的腐败微生物,且能有效降解鸡肉中AHLs。在4 ℃的贮藏温度下,改良的气调辅助香料浸渍包装能将鸡肉的货架期延长25 d。这些结果表明,香料可以作为QS淬灭剂,通过减少AHLs的产生来降低腐败率。畜禽肉的生产销售过程都极易受金黄色葡萄球菌污染而导致腐败变质。金黄色葡萄球菌作为一种常见的食源性致病菌,其引起的食物中毒是世界性的公共卫生问题。研究表明,金黄色葡萄球菌受信号分子AIPs的调控[10],AIPs通过抑制其QS过程,从而抑制其繁殖,对食品防腐和延长食品保质期具有重大的意义。此外,禽肉中的一些的脂肪酸如亚油酸、油酸、棕榈酸和硬脂酸对AI-2活性有很强的抑制作用,未来可能成为控制食源性病原体和减少微生物腐败的一种方法[56]。由此可见,QS参与了畜禽肉的腐败变质过程,调控微生物的QS进程是延长畜禽肉货架期的新思路。
3.3 水产品
水产品中水分含量相对较高,肌肉结构疏松,有较多的不饱和脂肪酸和可溶性蛋白,并且自溶酶活性也较高,在捕捞、运输和保藏过程中易受污染发生腐败,造成大量经济损失。微生物代谢也是水产品腐败的主要原因。在水产品的贮藏过程中对其特定腐败菌的生长进行控制可有效延长其贮藏时间。研究表明,低温冷藏鱼类的主要腐败菌有腐败希瓦氏菌属、假单胞菌属、气单胞菌属等[57],这些微生物可通过产生溶解酶从而对虾和鱼类的细胞组织造成损害。朱耀磊等[58]采用基因敲除的方法构建了QS基因LuxRI缺失型菌株,此基因缺失后,并不影响分离自腐败即食海参的蜂房哈夫尼菌H4(Hafnia alveiH4)的生长,但却使其失去分泌AHLs的能力,且该菌生物膜的形成和泳动能力也显著减弱,证明了QS对水产品腐败的重要调控作用。沙门氏菌作为养殖鱼类的常见病原体,可引起鱼类的疖病和其他相关疾病[59]。Liu Li等[60]在变质的大黄鱼中分离出具有AHLs活性的沙门氏菌AE03(Aeromonas salmonicidaAE03),检测到AHLs为主要的信号分子。为了证实asaI为高丝氨酸内酯合成酶的功能基因,构建了敲除asaI基因的突变体。结果表明,其突变体泳动能力优于野生株,且torA、cadA、fliR以及转录调节因子asaR基因的转录水平显著上调,但成熟的生物膜量减少。补充外源信号分子可恢复突变体中腐败代谢物、蛋白酶的产生和生物膜的形成,表明AHLs可能参与腐败相关酶和鞭毛的调节。但仍然需要进一步对asaI突变体的转录和蛋白质组进行研究分析来阐明AHLs的分子调控机制。部分乳酸菌因具有良好的抗菌活性和安全性,从而可以作为一种新型的生物防腐手段。植物乳杆菌AB-1(Lactobacillus plantarumAB-1)和干酪乳杆菌(Lactobacillus casei)共培养可以使植物乳杆菌AB-1的抗菌活性、QSluxS基因和细菌素调节操纵子(plnB和plnC)的转录水平显著提高。两者共同接种于凡纳滨对虾时,能够显著抑制虾中的腐败生物的生长,提高虾中AI-2的活性[61]。因此,乳酸菌的种间互作和细菌素的产生可能受AI-2/LuxS系统的调控,植物乳杆菌AB-1和干酪乳杆菌的共接种可以作为一种贮存虾的有效策略。由此说明,针对有益菌和腐败菌的QS系统采取不同的处理手段,发挥其最大的效能以应用于食品保鲜防腐是未来的研究方向。
3.4 果蔬
果蔬的腐败主要由革兰氏阴性菌引起,革兰氏阴性菌会释放细菌酶导致植物组织软烂,破坏细胞壁结构[62]。研究表明,导致果蔬腐败的主要细菌是欧文氏菌和假单胞菌。胡萝卜欧文氏菌黑腐亚种(Erwinia carotovorasubsp.atroseptica)是一种能够引起马铃薯茎和块茎黑斑病和软腐病的植物病原体,其毒力基因(pelC、pehA、celV和nip)受QS调控。当粉蝶霉素A或葡糖基杀粉蝶菌素存在时,4 种毒力基因的转录水平显著降低,表明它们具有作为马铃薯块茎软腐病抑制剂的潜力[63]。此外,土壤中分离的芽孢杆菌可作为QS淬灭菌,其可产生AHL内酯酶,灭活AHLs信号分子,对胡萝卜欧文氏菌胡萝卜亚种(Pectobacterium carotovorumsubsp.carotovorum)有一定的生物防治功能[64]。在腐败豆芽中可分离出产生AHLs的细菌(主要是肠杆菌科和假单胞菌)。与野生型菌株相比,AHL阴性突变体菌株的蛋白酶和果胶酶活性明显降低,证明QS系统可以调控豆芽软腐进程;在添加外源信号分子N-3-氧-己酰高丝氨酸内酯后蛋白酶活性又增加,说明抑制QS进程在一定程度上能够抑制果蔬腐败进程[65],为未来使用QS抑制剂靶向保护食物提供了理论支持。此外,一些致病菌能够附着在原材料、加工设备等表面并形成生物膜,特别是食用未经加工的新鲜果蔬可增加消费者患食源性疾病的风险。研究表明,柑橘类水果中的柠檬苦素依赖QS机制抑制大肠埃希氏菌(Escherichia coli)的生物膜形成[66];新鲜黄瓜中的致病菌和沙门氏菌属形成的生物膜可被有机酸(如乳酸、乙酸和柠檬酸)有效抑制,其QS进程也可被有机酸延缓,可用作潜在的QS抑制剂[67],从而提高食品安全性,理论上可以在食品行业进行实际应用,以控制食源性疾病的暴发。
4 结 语
综上所述,QS与食品腐败之间存在着紧密的联系。随着研究的不断深入,QQ可作为一种对抗细菌的有效方式,为生物防治QS依赖的细菌侵染提供可能的途径,有望广泛应用于食品、医药、农业、环境等各个领域中。目前通过人工合成和自然界获取已发现多种绿色、安全的QS抑制剂和淬灭酶,可有效干扰食品中腐败微生物间的QS过程,延缓腐败进程,为食品保鲜、延长其货架期提供新的思路。但目前QQ技术仍未广泛应用于实际生产中。对此仍需在以下方面进行深入研究,以便能够更好地开发QS淬灭技术潜力:1)明确不同种类信号分子的化学组成及其QS调控机制;2)结合多种检测技术,寻求普遍、快速、准确的信号分子定性和定量方法;3)食品腐败过程有多种微生物共同参与,应着重从QS及其相关基因的转录水平角度探究微生物间的互作关系;4)目前仅有少数微生物的QS特征及其调控作用被明确研究,也应当从微生物种类(如细菌-细菌、细菌-真菌、真菌-真菌等)的角度探究QS的多种互作机制;5)利用多组学技术探究QS对微生物生长及其代谢的影响;6)部分细菌自身没有信号分子合成基因,但具有QS转录调节蛋白,在共存体系中它们可获取其他微生物所分泌的共用物质,如QS信号分子、铁载体、蛋白酶等[68-69],从而“享受”QS所带来的“生长利益”;此外,这些细菌还会破坏种群之间原有的合作关系,消耗共用物质加速自身生长代谢,干扰微生物生态体系[70];因此,应着重加强这一部分机制的研究。关于QS及其淬灭的研究任重道远,随着研究的不断深入,有望利用这一途径解决长久以来困扰人们的食品保鲜问题。

