连作对云南典型烟区植烟土壤细菌群落多样性的影响
敖金成,李博,阎凯,李永梅*
(1.云南农业大学植物保护学院,昆明 650201;2.云南农业大学资源与环境学院,昆明 650201)
受耕地资源短缺及种植其他非烟经济作物的影响,云南烤烟连作现象极为严重。连作引起连作障碍[1-4]。近年来,关于烤烟连作障碍导致的烟叶品质和耕地质量下降问题已引起广泛关注。在众多连作障碍成因中,有研究认为根际微生态系统失调可能是发生连作障碍的主要原因[5]。烤烟连作破坏了微生物种群的平衡,抑制土壤酶活性[6],降低了土壤微生物的种群多样性和功能多样性[7],致使烟田土壤细菌群落结构趋于简单[8]。土壤细菌是土壤养分循环重要的驱动者[9],具有重要的生态功能[10-12]。烤烟黄壤连作5 年后,其土壤细菌群落多样性和丰度开始下降,并在连作12 年时降至最低[13],连作条件下土壤细菌多样性明显低于轮作[14]。王佩雯等[15]的研究认为,连作植烟土壤细菌群落易受环境变化的影响,表现出一定的时间差异性。在实际生产中,不同区域相同连作年限地块作物的发病率、田间长势等也存在差异,但这种差异是否与土壤细菌群落演化有关鲜见报道。因此,了解连作烟田土壤细菌群落的区域特征,对进一步理解土壤微环境对连作的响应机制具有重要意义。
以往传统的土壤微生物研究方法,如微生物平板培养法、生物标记法、Biolog鉴定系统法等[16]很难客观全面地反映土壤微生物的群落结构组成。高通量测序技术有效避免了传统方法通量低、操作复杂和准确率低等缺陷[17],实现了大规模土壤微生物基因直接测序[18],在土壤微生物物种多样性、结构多样性、功能多样性、遗传多样性研究中被广泛应用[15,19-20]。基于此,本研究以云南省曲靖市、红河州、文山州3 个典型烟区不同连作年限土壤为研究对象,旨在了解不同生态区连作烟田土壤细菌群落特征,加深对连作条件下土壤微生物演替规律的认识,为制定连作障碍消减措施提供理论依据。
1 材料与方法
1.1 连作土壤采集区概况
试验于2020 年3—4 月烤烟移栽前,在云南省曲靖市(103°23′10″E,25°20′20″N)、红河州(103°52′26″E,24°40′03″N)、文山州(104°31′23″E,23°48′56″N)3 个典型烟区分别选取2、4 a 和8 a 及以上连作地块,按梅花形五点法取耕作层(0~20 cm)土壤,对照(连作0 a)为同区域撂荒2 a 及以上土壤。取样时轻轻拨开表土,去除根系等杂物,将混合土样分为2 份,一份用于土壤化学性质检测,常温风干后备用,另一份装入无菌密封袋,并及时置于-20 ℃冰盒,快速带回实验室置于-80 ℃冰箱待用。每个生态区每种连作年限烟田随机取5个混合样,共计60个土样。曲靖采样点土壤类型为黄壤,红河和文山采样点土壤类型为红壤。土壤基础化学性质见表1。试验烟田均为不同农户自己栽种,植烟历史可考证。3 个生态区主栽烤烟品种均为云烟87。
云南曲靖烟区地处滇东高原烤烟区,地势较为平坦,烤烟栽培历史悠久,是我国重要的烟叶产区,烤烟产量约占云南的1/3、全国的1/10。栽烟地海拔1 500~2 100 m,年均气温为13.3~15.1 ℃,烤烟大田生育期降水量为740.0~810.0 mm。云南红河、文山烟区同属滇南低山丘陵烤烟区,地势平缓,多数栽烟地海拔在1 100~1 600 m 之间,热量条件优越,降水充沛,年均温为16.0~18.0 ℃,烤烟大田生育期降水量为1 000.0 mm 左右。红河州为云南主要核心烟叶产区之一,烤烟栽培历史悠久,烟叶颇受喜爱。文山州烟区多为近年来新开发的烟区。
1.2 检测项目及方法
1.2.1 土壤化学性状
土壤有机质、碱解氮、有效磷、速效钾含量和pH值的测定参照文献[21]方法进行。
1.2.2 土壤细菌DNA的提取、测序及生信分析
样品由广州基迪奥生物科技有限公司平台检测(https://www.omicsmart.com)。采用HiPure Soil DNA Mini Kit(Magen,中国,广州,cat#3412)进行土壤微生物DNA 提取。然后用1%琼脂凝胶电泳检测基因组DNA 的完整性。采用具有Barcode 标记的引物341F
‘CCTACGGGNGGTATCTAAT’、806R‘GGACTACHVGGGTACTAAT’对细菌进行16S rDNA V3~V4 区MiSeq 扩增子测序。PCR 采用TransStart Fastpfu DNA Polymerase 聚合酶,每个样本3 次PCR 重复,扩增后将PCR 产物混合后用2%琼脂糖凝胶电泳检测纯化效果。用AxyPreDNA 凝胶回收试剂盒(AXYGEN 公司)切胶回收PCR 产物,使用Tris-HCl 洗脱,并用2%琼脂糖凝胶电泳检测。然后用QuantiFluorTM-ST 蓝色荧光定量系统(Promega 公司)进行检测定量,按照每个样本的测序量要求,进行相应比例的混合,最后采用高通量Illumina Miseq 测序的方法,对不同连作年限烟田土壤细菌群落进行分析。从云南曲靖、红河、文山3 个典型产区60 个土壤样本中共获得5 846 101条有效序列,总碱基数为2 641 381 292 bp,平均长度为441 bp,共获得11 167个分类操作单元(OTUs)。
1.3 数据分析
采用Microsoft Excel 2016 进行数据处理,用IBM Statistics SPSS 20.0 进行方差分析。利用软件平台Usearch version 7.0 对相似度在97%条件下的OTU 进行质控拼接和Tag 聚类去嵌合体,获得OTU的丰度和OTU 代表序列。然后利用软件Mothur version v.1.30.1 计算反映群落丰富度(Community richness)的Sobs、Chao1、Ace 指数和反映群落多样性的Shannon、Simpson 指数[22-23]。利用R 语言工具进行群落柱状图的统计、绘制,以及冗余分析(Redundancy analysis,RDA)。
2 结果与分析
2.1 连作年限对烟田土壤化学性质的影响
云南3 个典型烟区不同连作烟田土壤有机质、碱解氮、有效磷、速效钾含量和pH 值检测结果见表1。从表1 可以看出,与对照相比,随连作年限的增加,曲靖烟区土壤pH 值极显著(P<0.01)降低,连作2、4 a和8 a 及以上pH 值分别降低0.7、0.4 和0.5 个单位,红河烟区土壤pH 值显著(P<0.05)降低(除连作2 a 土壤外),分别降低0.1、0.5、0.6个单位,文山烟区pH升高,分别上升0.1、0.4、0.5 个单位。曲靖烟区不同连作年限烟田土壤有机质含量差异不显著,对照最低,红河州烟区连作2、4、8 a及以上土壤有机质含量均极显著(P<0.01)高于对照,文山烟区连作2 a 土壤有机质含量显著(P<0.05)低于对照。土壤碱解氮含量整体呈增加趋势,相较于对照,曲靖烟区连作2 a 和8 a 及以上土壤碱解氮含量增幅分别为12.0%和44.0%,连作4 a土壤碱解氮含量降幅为10.0%,红河烟区增幅分别为86.7%、174.8%、171.8%,文山烟区连作4 a 和8 a 及以上增幅分别为32.8%、65.2%,连作2 a 土壤碱解氮含量降幅为17.2%。曲靖烟区连作8 a 及以上烟田土壤的有效磷含量均极显著(P<0.01)高于其他连作年限烟田土壤,红河和文山烟区连作4 a 烟田土壤有效磷含量均极显著(P<0.01)高于其他处理。相较于对照,3 个生态烟区的3 种连作年限烟田土壤速效钾含量均极显著(P<0.01)增加,曲靖烟区连作8 a及以上、红河烟区连作4 a、文山烟区连作2 a 土壤速效钾含量最高。以上结果说明,连作烟田土壤主要化学性质存在空间异质性。

表1 不同连作年限烟田土壤化学性质特征Table 1 Characteristic of soil chemical properties of tobacco fields with different continuous cropping years
2.2 连作对烟田土壤细菌OTU的影响
Venn 图能够反映组间或样品之间共有或特有OTU,能够直观地反映出组间或样品间OTU的重叠情况。由图1可知,与对照相比,曲靖烟区3种连作烟田土壤所获得的细菌OTU均增加,其中连作4 a和8 a及以上烟田土壤共有OTU数最多,连作2 a和4 a土壤共有OTU 数次之;红河烟区连作2 a 土壤细菌OTU 多于对照,连作4 a和8 a及以上烟田土壤共有细菌OTU数少于对照;随连作年限的增加,文山烟区烟田土壤细菌OTU呈增加趋势,连作4 a和8 a及以上土壤共有细菌OTU 数最多。与对照相比,曲靖烟区3种连作年限烟田土壤特有OTU 数整体呈增加趋势,增幅分别为23.3%、220.8%、39.4%;红河烟区3种连作年限烟田土壤特有OTU 数呈降低趋势,降幅分别为24.3%、53.9%、49.0%;文山烟区连作2 a 和4 a 的烟田土壤特有OTU 降幅分别为34.7%、9.3%,连作8 a及以上土壤特有OTU 数增加54.7%。说明不同生态区中,连作土壤细菌物种丰度及特有细菌丰度存在差异,整体表现为连作4 a和8 a及以上土壤共有细菌OTU数最多。

图1 不同生态烟区连作烟田土壤细菌Venn图Figure 1 Venn diagrams of bacterial community in continuous cropping tobacco soils of Yunnan Province
2.3 连作对烟田土壤细菌群落多样性的影响
不同生态区连作烟田土壤细菌群落多样性和丰富度存在差异(表2)。由表2 可知,曲靖烟区3 种连作年限烟田土壤Ace和Chao1指数均极显著(P<0.01)高于对照,连作4 a 土壤Shannon 和Simpson 指数均最高,其中Shannon指数极显著(P<0.01)高于0、2 a和8 a及以上烟田土壤,处理间Simpson 指数和Sobs 指数差异不显著(P>0.05),但均高于对照;红河烟区连作2 a烟田土壤细菌Sobs、Ace 和Chao1 指数均极显著(P<0.01)高于对照和连作4、8 a 及以上土壤,对照和连作2 a土壤细菌的Shannon和Simpson指数明显高于连作4 a 和8 a 及以上土壤;文山烟区连作8 a 及以上烟田土壤的Sobs、Ace 和Chao1 指数均极显著(P<0.01)高于对照和连作2、4 a 烟田土壤,整体呈现出随连作年限增加而升高的趋势。文山烟区连作4、8 a及以上年限土壤细菌的Shannon 指数极显著(P<0.01)高于对照和连作2 a 土壤,Simpson 指数则达到显著水平(P<0.05)。
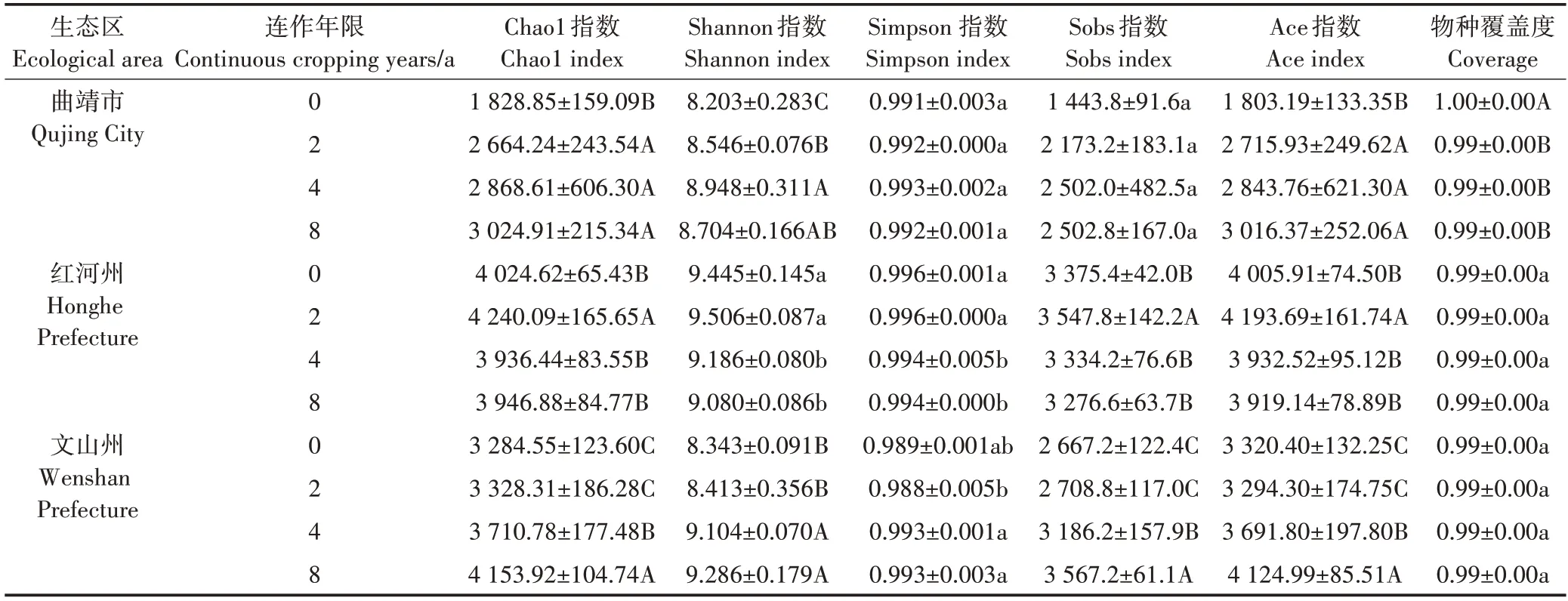
表2 不同连作年限烟田土壤细菌群落丰富度和多样性Table 2 Community richness and diversity of soil bacterial community in tobacco field with different continuous cropping years
2.4 连作对烟田土壤细菌群落组成的影响
从图2可以看出,门水平上,云南3个典型烟区不同连作年限土壤样本中检出10 个主要细菌门类(94.32%~99.31%)。曲靖烟区土壤细菌相对丰度前10 的优势菌门分别为变形菌门(Protecobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、装甲菌门(Armatimonadetes);红河烟区土壤细菌相对丰度前10 的优势菌门分别为放线菌门、变形菌门、芽单胞菌门、酸杆菌门、绿弯菌门、浮霉菌门、拟杆菌门、疣微菌门、装甲菌门、厚壁菌门;文山烟区土壤细菌相对丰度前10 的优势菌门分别为变形菌门、放线菌门、绿弯菌门、酸杆菌门、芽单胞菌门、浮霉菌门、疣微菌门、拟杆菌门、厚壁菌门、装甲菌门。

图2 在门水平上连作烟田土壤细菌群落组成和相对丰度Figure 2 Composition and relative abundance of continuous cropping soil bacteria community at the phylum level
从表3 可知,随连作年限的延长,曲靖烟区烟田土壤绿弯菌门、酸杆菌门群落相对丰度整体呈减少趋势,芽单胞菌门、浮霉菌门、厚壁菌门和装甲菌门群落相对丰度整体呈增加趋势,其中连作4 a和8 a及以上烟田土壤绿弯菌门群落相对丰度均显著(P<0.05)低于对照和连作2 a 烟田土壤;红河烟区对照土壤放线菌门、酸杆菌门和装甲菌门群落相对丰度均极显著(P<0.01)高于3 种连作土壤。随种植年限的延长,红河烟区烟田土壤芽单胞菌门群落相对丰度呈极显著(P<0.01)增加趋势,连作2 a和4 a烟田土壤的放线菌门、变形菌门、浮霉菌门、装甲菌门群落相对丰度变化规律不明显;随连作年限的延长,文山烟区烟田土壤放线菌门、芽单胞菌门、浮霉菌门群落相对丰度整体呈明显增加趋势,其中,绿弯菌门、酸杆菌门和装甲菌门群落丰度则整体呈降低趋势。

表3 在门水平上土壤细菌群落组成差异分析(%)Table 3 Composition and relative abundance of bacteria community at the phylum level(%)
2.5 连作烟田土壤化学性质与细菌群落关联分析
从图3a 可以看出,属水平上,第一排序轴贡献率为56.10%,第二排序轴贡献率为30.02%,累积解释变异量达到86.12%,说明排序轴很好地反映了土壤细菌群落结构和土壤化学性质之间的关系。从图3a 中可以看出,pH 值和速效钾含量与连作土壤细菌物种分布呈正相关,有机质和有效磷含量与土壤细菌物种分布呈负相关,碱解氮与土壤细菌物种分布无相关性。从图3b可以看出,在门水平上,皮尔森(Pearson)相关性分析表明,土壤pH 值与放线菌门、变形菌门、绿弯菌门、芽单胞菌门、浮霉菌门、拟杆菌门、棒状杆菌门(Rokubacteria)、硝化螺旋菌门、迷踪菌门(Elusimicrobia)群落分布呈极显著正相关(P<0.01)。有机质含量与浮霉菌门和棒状杆菌门群落分布呈极显著负相关(P<0.01),与放线菌门群落分布呈显著负相关(P<0.05)。碱解氮仅与硝化螺旋菌门(Nitrospirae)群落分布呈显著相关。有效磷含量与芽单胞菌门、厚壁菌门群落分布呈极显著负相关(P<0.01),与疣微菌门、装甲菌门、棒状杆菌门和硝化螺旋菌门群落分布呈显著负相关(P<0.05)。速效钾含量与放线菌门、拟杆菌门、硝化螺旋菌门群落分布呈极显著负相关(P<0.01),与绿弯菌门和迷踪菌门群落分布呈显著负相关(P<0.05)。

图3 环境因子与土壤细菌群落的冗余分析和相关性热图分析Figure 3 RDA and correlation heat map analysis of environmental factors and soil bacterial community
3 讨论
3.1 连作对烟田土壤细菌群落结构多样性的影响
研究表明,长期连作严重影响了土壤理化性状,进而显著降低了土壤细菌群落和组成多样性[13]。本研究中,云南3 个典型烟区连作土壤细菌多样性及丰富度特征存在空间异质性和时间异质性。曲靖烟区连作4 a、红河烟区连作2 a、文山烟区连作8 a 及以上土壤细菌群落的丰富度和多样性最高,说明不同生态区连作烟田土壤样本组成表现出不同的聚集性。胡元森等[24]、王佩雯等[15]的研究认为,土壤细菌群落是一个相对稳定的系统,连作或施肥等条件很可能只影响某些种群的丰度。施肥很可能是从细菌群落的丰度上影响群落,进而影响土壤微生物的富集,而没有改变群落种类[15]。本试验中,烤烟连作烟田土壤细菌群落丰富度均高于对照土壤,说明连作导致某些土壤病原菌的积累,或者可能与实际生产中烟农补充外源菌以及施肥水平等管理因素有关,因此连作土壤细菌群落丰富度和多样性提高可能是多种因素共同作用的结果,有待进一步验证。
3.2 连作对烟田土壤细菌群落组成的影响
王佩雯等[15]的研究认为,连作植烟土壤细菌群落易受环境变化的影响,表现出一定的时间差异性。连作土壤的细菌菌群在大田期变化较大,致病菌增多[25]。这可能是连作土壤细菌群落相对丰度提高的主要原因之一。本研究结果表明,在门水平上所检出的前10 位的细菌门类(相对丰度94.32%~99.31%)中,曲靖、红河、文山3 个生态烟区烟田土壤细菌门类表现出空间上的异质性,相同生态区不同连作年限烟田土壤优势菌群相对丰度也存在异质性。曲靖烟区和文山烟区变形菌门群落相对丰度最高,红河烟区放线菌门群落相对丰度最高。变形菌门是最为普遍的细菌菌门[26],同时包含了大量的动植物致病菌[27]。绝大多数放线菌为腐生菌,但少数寄生性放线菌能引起某些动植物的病害[28]。随着连作年限的延长,曲靖烟区烟田土壤绿弯菌门群落相对丰度显著(P<0.05)减少,酸杆菌门群落相对丰度整体呈减少趋势,芽单胞菌门、浮霉菌门、厚壁菌门和装甲菌门相对丰度整体呈增加趋势;红河烟区烟田土壤芽单胞菌门相对丰度呈极显著(P<0.01)增加趋势;文山烟区烟田土壤放线菌门、芽单胞菌门、浮霉菌门相对丰度整体呈极显著(P<0.01)增加趋势,绿弯菌门和酸杆菌门细菌相对丰度则整体呈显著(P<0.05)降低趋势,表现出明显的时间异质性。尤垂淮等[29]的研究认为,重茬导致土壤酚酸物质富集,进而促进了以酚酸为底物的微生物生长,因而病原微生物增加。说明连作导致细菌群落组成发生变化,但连作土壤细菌群落结构区域异质性是否与施肥、气候等因素有关有待进一步研究。
3.3 连作土壤主要理化性质对土壤细菌群落结构的影响
土壤为细菌群落的生长繁殖提供重要的微环境,种植模式会改变其微环境,间接影响土壤细菌群落结构的组成。JAN 等[30]认为RDA 可以分析解释变量和多个响应变量之间的关系。研究结果表明,在几种主要的理化因子中,pH 值对细菌物种分布影响最大,磷素影响次之,而氮素无相关性。这与NACKE 等[31]的研究结论一致,该研究发现土壤pH 值是影响土壤细菌群落结构和多样性的主要因子。这可能与连作土壤出现磷素积累,反而成为限制因子有关。试验中,与对照土壤相比,曲靖烟区和红河烟区连作烟田土壤pH 值均随连作年限延长而降低,这与娄翼来等[32]的研究结论一致,该研究发现随着植烟年限的延长,表层和次表层土壤的pH 值均呈现不同程度的下降趋势,重茬5 年后表层土壤酸化明显。而与对照土壤相比,文山烟区pH值则呈小幅增加趋势,这可能与该烟区习惯施用生石灰有关。土壤酸碱度决定土壤细菌丰度和多样性,因为pH 值对某些土壤细菌表现出生理限制,而有些细菌则能更好地适应土壤酸化带来的胁迫[33],也有可能是由于土壤的酸碱度虽不能直接改变细菌群落,但可以作为一种整体的综合变量,推动微生物区系组成的变化[34]。生产实践中可通过添加生石灰,增加农家肥、有机肥的施用量调控土壤pH值和磷素水平,从而改良连作土壤细菌群落结构,改善连作土壤微环境。
4 结论
(1)云南3 个典型烟区连作烟田土壤细菌群落相对丰度、多样性及群落组成存在空间异质性和时间异质性。
(2)随着连作年限的延长,土壤细菌群落发生不同程度的结构性变化。
(3)在连作烟田土壤改良时加强土壤pH 值和有效磷含量调控是关键。

