Curcumin协同ABT-737对肝癌细胞上皮间质转化的抑制作用及相关机制初步研究
郑锐年 孙成晖 贾筠 林顺欢 林钦雄 刘淳 郝艳艳 潘学兵 何宇 邵俊伟
肝癌是我国最常见的恶性肿瘤之一[1]。虽然肝癌研究在诊断、治疗和基础研究方面均取得了长足的进步,但肝癌的预后并没有得到显著的改善,易出现转移复发[2-3]上皮-间质转化(epithelial-mesenchymal transition, EMT)在肿瘤转移的多个步骤发挥了重要的作用[4]。在肝癌细胞转移过程中,转录因子如Snail、Slug、ZEB、Twist通过下调E-cadherin等黏附分子,并上调一系列金属基质硫蛋白酶MMP,促进肝癌转移[5]。Wnt/beta-catenin信号通路是肝癌发生过程中所需的关键信号通路之一[6]。在肝癌中,beta-catenin 的活化可使得Wnt/beta-catenin信号异常活化[7-8]。活化的beta-catenin/TCF信号在肝癌细胞生长,迁移和转移中都有重要功能[9]。ABT-737作为抗凋亡蛋白的小分子抑制剂,对肝癌细胞有一定的杀伤作用。姜黄素Curcumin是一种植物提取物,对多种肿瘤细胞均有抑制效果,其中包括肝癌。在前期研究中,笔者发现Curcumin可以协同ABT737激活JNK信号途径,促进肝癌细胞的凋亡,从而抑制肝癌细胞HepG2的生长[10]。本研究以肝癌7404细胞为对象,并建立的肝癌动物模型(Alb-Cre;P53f/f;Ras),探讨Curcumin协同ABT-737作用对肝癌细胞上皮间质转化的影响,并探讨JNK-beta-catenin信号通路是否参与EMT转化的影响,初步阐明Curcumin协同ABT-737对肝癌细胞上皮间质转化的抑制作用,以期为肝癌的靶向治疗提供一个新的方式。
资料与方法
一、一般资料
胎牛血清购自美国Gibco公司;青霉素和链霉素购自北京中山生物公司生物技术有限公司;RPMI 1640培养液购自美国Gibco公司;Curcumin(分子式C21H20O6,相对分子质量368.4,纯度≥99%)购自美国Sigma生物试剂公司;ABT-737购自美国Sigma-Aldrich公司;苯甲基磺酰氟(phenylmethanesulfonyl nuoride,PMSF)购自上海浩然生物技术有限公司;ⅪPA裂解液和考马斯亮蓝G250购自北京索莱宝科技有限公司;兔抗人Vimentin、N-cadherin、ZEB1、E-cadherin、p-beta-catenin、p-JNK、Snail、Twist和GAPDH多克隆抗体以及辣根过氧化物酶标记的羊抗兔二抗、DAB显色试剂盒均购自Biotechnology公司;Matrigel基质胶购自北大医学部细胞生物学实验室。
二、研究方法
(一) 细胞、细胞培养及实验动物 肝癌7404细胞由中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室惠赠。
8只4~6周龄肝癌动物模型(Alb-Cre;P53f/f;Ras)小鼠购自中国科学院上海实验动物中心,生产许可证号:SCXK(沪)2003-0003,平均体质量为18~22 g。
(二) 细胞实验分组及细胞形态学的改变 取对数生长期的7404细胞接种于6孔培养板中(2×105个/孔细胞)进行常规培养,次日细胞融合度达50%~70%时进行实验。7404细胞实验分4组:1% DMSO溶剂对照组、2 μmol/L Curcumin作用组、5 μmol/L ABT-737作用组和2 μmol/L Curcumin + 5 μmol/L ABT-737作用组。收集药物处理48 h后的各组细胞,在倒置显微镜下观察各组7404细胞的生长状态及形态学改变,并对其进行定量。
(三)细胞划痕实验检测各组细胞的迁移能力 7404细胞接种于6孔培养板中(2×105个/孔细胞)进行常规培养24 h,细胞融合度达90%时,移液枪头在直尺的协助下做划痕,PBS洗涤3次,划痕处未脱落细胞,随后在显微镜下对划痕进行拍照(0 h)。根据分组情况,加入相应的培养基,将培养板置于培养箱中培养24 h后再次置于显微镜下对划痕进行拍照。计算各组划痕面积修复率(%)=[划痕创伤面积(0 h)-划痕创伤面积(24 h)]/划痕创伤面积(0 h)×100%,并实验重复3次,计算平均值。以对照组划痕面积修复率为100%,获得各组细胞的相对迁移能力。
(四) 蛋白质印迹法检测各组细胞E-cadherin、Vimentin、N-cadherin和ZEB1蛋白的表达
(1)细胞样品100 μL含PMSF的RJPA裂解液,摇匀后在冰上放置30 min;离心后收集上清液,用考马斯亮蓝G250结合法测定蛋白质浓度。
(2)取总蛋30 μg/孔上样,进行SDS-PAGE,转膜,封闭2 h。
(3) 洗涤后与特异性一抗:E-cadherin抗体、Vimentin抗体、N-cadherin抗体、ZEB1抗体和GAPDH内参37 ℃反应2 h后,4℃过夜;二抗孵育室温2 h,DAB显色。
(4)结果用TotalLab 2.0软件进行灰度值分析,以目的蛋白条带的灰度值/GAPDH蛋白条带的灰度表示目的蛋白的相对表达水平,重复4次。
(五)蛋白质印迹法检测各组细胞p-beta-catenin、p-JNK、Snail 和 Twist蛋白的表达
(1)细胞样品100 μL含PMSF的RJPA裂解液,摇匀后在冰上放置30 min;离心后收集上清液,用考马斯亮蓝G250结合法测定蛋白质浓度。
(2)取总蛋30 μg/孔上样,进行SDS-PAGE,转膜,封闭2 h。
(3) 洗涤后与特异性一抗:p-beta-catenin抗体、p-JNK抗体、Snail抗体、Twist抗体和GAPDH内参37 ℃反应2 h后,4 ℃过夜;二抗孵育室温2 h,DAB显色。
(4)结果用TotalLab 2.0软件进行灰度值分析,以目的蛋白条带的灰度值/GAPDH蛋白条带的灰度表示目的蛋白的相对表达水平,重复4次。
(六)肝癌动物模型(Alb-Cre;P53f/f;Ras)的建立 通过将Alb-Cre工具鼠与P53f/f;Ras小鼠杂交形成。在Ras基因的前面有一个终止密码子。在该终止密码子作用两侧有两个Loxp位点。在Alb-Cre作用下,剔除P53 的表达,同时激活Ras的表达,由此诱导肝癌的发生。在小鼠4月龄时,通过灌胃的方式,对小鼠进行处理。小鼠分为两组,每组4只,分别接受Curcumin协同ABT737[40 mg/(kg·d)+40 mg/(kg·d)]、以及对照生理盐水药物处理,共处理30 d。3个月后,处死小鼠,收集小鼠的肝组织,进行HE染色,检测肿瘤数量,采用液基薄层制片(TCT)计算肝转移瘤数量。
三、统计学分析
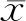
结 果
一、Curcumin协同ABT-373抑制7404细胞迁移
在倒置显微镜下观察发现,1% DMSO溶剂对照组、2 μmol/L Curcumin作用组、5 μmol/L ABT-737作用组的7404细胞拉长,由多边形向长梭形转变,细胞间隙增宽,细胞梭形化明显;2 μmol/L Curcumin + 5 μmol/L ABT-737作用组的7404细胞间隙增宽,有些细胞皱缩,细胞内颗粒增多,折光性降低,细胞碎片增多。与1% DMSO溶剂对照组(290.25±13.23)、2 μmol/L Curcumin作用组(278.75±5.12)、5 μmol/L ABT-737作用组(269.00±8.83)比较,2 μmol/L Curcumin + 5 μmol/L ABT-737作用组(152.00±11.05)7404细胞梭形化明显减少(P<0.05) (图1 A)。在细胞划痕实验中,2 μmol/L Curcumin + 5 μmol/L ABT-737作用组较其他三组细胞的迁移能力显著降低(P<0.05) (图1 B)。
A:Curcumin协同ABT-373抑制7404细胞迁移,并对其进行定量;B:Curcumin协同ABT-373抑制7404细胞对划痕面积的修复,并对其进行定量
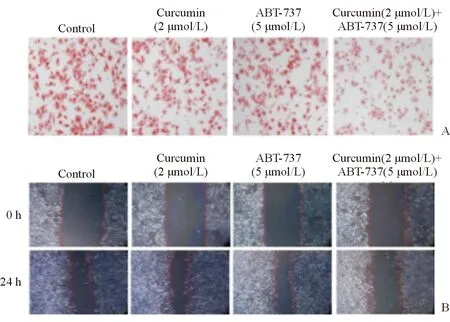
二、 Curcumin协同ABT-373抑制原发性肝癌细胞肝内转移
给药治疗30次后,取出肝脏,苏木精伊红染色并计数肝转移瘤数量,Curcumin + ABT-737治疗组(7.25±4.03)肝癌动物模型(Alb-Cre;P53f/f;Ras)中肝转移瘤数量明显小于对照组(25.25±6.40),差异有统计学意义(P<0.05)(图2)。
Curcumin协同ABT-373抑制原发性肝癌细胞体内转移,并对在肝脏形成的转移灶进行数量统计
三、 Curcumin协同ABT-737调控EMT相关分子的表达
蛋白质印迹法检测结果显示,相比1% DMSO溶剂对照组、2 μmol/L Curcumin作用组、5 μmol/L ABT-737作用组,2 μmol/L Curcumin + 5 μmol/L ABT-737作用后,7404细胞中E-cadherin蛋白的表达水平明显上调,Vimentin、N-cadherin、ZEB1蛋白的表达水平明显下调,差异有统计学意义(P<0.05)(图3 ,表1)。
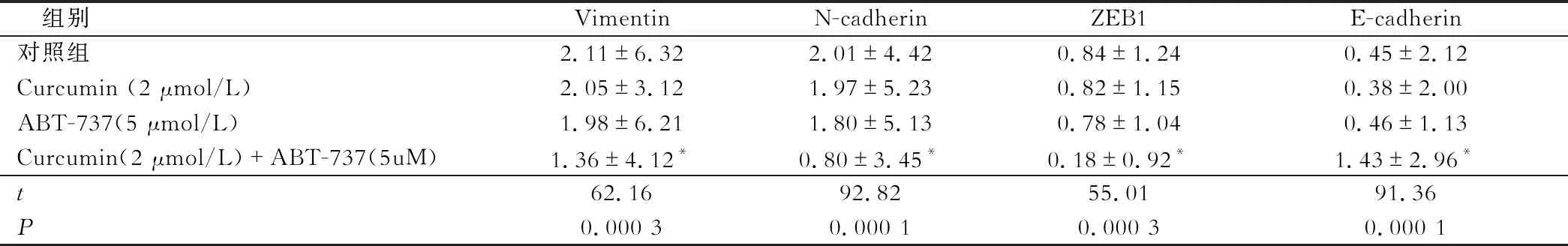
表1 Curcumin,ABT-737对EMT相关蛋白的影响
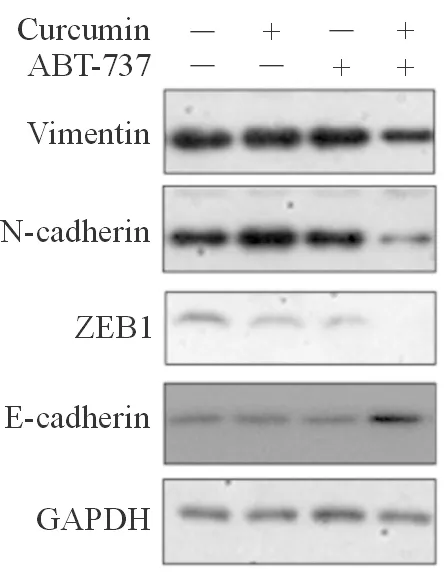
2 μmol/L Curcumin协同5 μmol/L ABT-373在7404细胞中抑制间质细胞标记分子Vimentin、N-cadherin、ZEB1的表达,上调上皮细胞的标记分子E-cadherin的表达。
四、 Curcumin协同ABT-737上调JNK1的磷酸化水平、beta-catenin的磷酸化水平,抑制Snail、Twist的表达
蛋白质印迹法检测结果显示,相比1% DMSO溶剂对照组、2 μmol/L Curcumin作用组、5 μmol/LABT-737作用组,2 μmol/L Curcumin + 5 μmol/L ABT-737作用后,7404细胞中JNK1和beta-catenin的磷酸化水平明显上调,Snail、Twist蛋白的表达水平明显下调,差异有统计学意义(P<0.05)(图4 ,表2)。
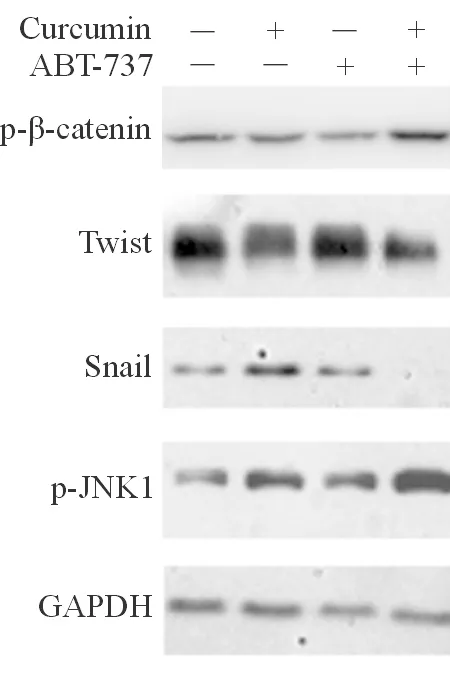
2 μmol/L Curcumin协同5 μmol/L ABT-373在7404细胞中抑制beta-catenin下游靶基因Snail、Twist的表达,上调beta-catenin和JNK的磷酸化水平。
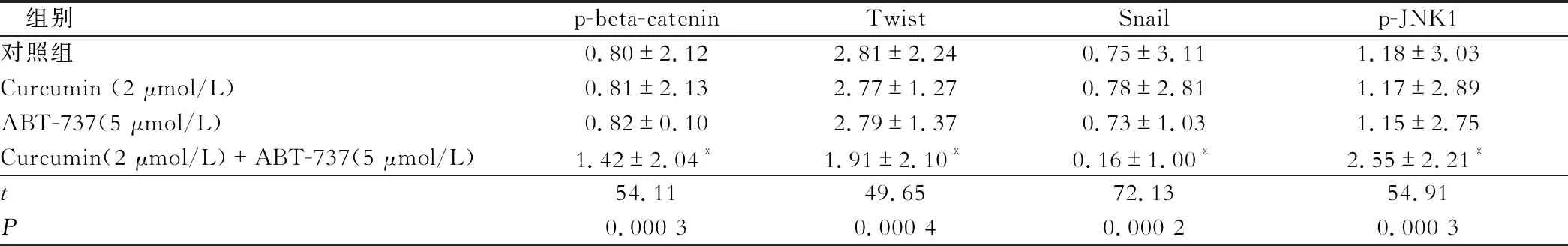
表2 Curcumin,ABT-737对beta-catenin和JNK的磷酸化水平的影响
讨 论
肿瘤细胞易发生侵袭和转移,其可以从原发灶脱落,侵袭基底膜,进而侵入血管、淋巴管或体腔形成微小转移灶[11]。多项研究证实,EMT在肿瘤的侵袭和转移过程中扮演着重要角色,参与并促进肿瘤细胞的浸润和转移过程。
EMT是指上皮细胞在正常生理和特定病理情况下向间充质细胞转化的现象。发生EMT后,细胞极性丧失,排列变得紊乱;另外,上皮细胞标记物如E-cadherin、ZO-1、claudin-1等表达下调,而间质细胞标记物如N-cadherin、Vimentin等表达升高。处于相对静止的细胞变得活跃,并且常伴有穿透细胞外基质的能力增强,提高了细胞的侵袭、转移能力[12]。本研究结果显示,相比2 μmol/L Curcumin作用组、5 μmol/L ABT-737作用组,2 μmol/L Curcumin + 5 μmol/L ABT-737作用后,7404细胞梭形化明显减少(P<0.05),细胞迁移能力显著降低(P<0.05),Vimentin、N-cadherin、ZEB1蛋白的表达水平明显抑制(P<0.05),E-cadherin蛋白的表达水平明显上调(P<0.05),而且,Curcumin + ABT-737治疗组肝癌动物模型(Alb-Cre;P53f/f;Ras)中肝转移瘤数量明显小于对照组,差异有统计学意义(P<0.05),说明Curcumin协同ABT-737能抑制肝癌细胞上皮间质转化。
最新的研究表明,肿瘤细胞通过EMT还能获得肿瘤干细胞的特性,而肿瘤干细胞的存在是化疗耐药及化疗后肿瘤复发的的根本原因之一[13]。EMT过程主要通过调控Snail、Slug、ZEB、Twist等转录因子实现,这些转录因子通过下调E-cadherin等黏附分子,与肝癌转移的密切相关[14]。本研究结果显示,2 μmol/L Curcumin + 5 μmol/L ABT-737处理后,Snail、Twist,Vimentin、N-cadherin、ZEB1蛋白的表达水平明显下调,而E-cadherin蛋白的表达明显上升,而单独处理这两种药物,这些蛋白的表达并没有明显改变,说明两种药物的联用可以显著抑制肝癌7404细胞上皮间质转化。
在前期研究中,笔者发现Curcumin可以协同ABT-737抑制肝癌细胞HepG2的生长,与JNK信号途径的激活有关。本研究结果表明,2 μmol/L Curcumin + 5 μmol/L ABT-737作用后,7404细胞中JNK1和beta-catenin的磷酸化水平明显上调,说明Curcumin协同ABT-737激活JNK-beta-catenin信号途径,下调Snail、Twist蛋白的表达,进而上调E-cadherin蛋白的表达,且下调Vimentin、N-cadherin、ZEB1蛋白的表达,导致肝癌7404细胞上皮间质转化抑制,进而说明JNK-beta-catenin可能参与EMT转化的抑制。
综上所述,Curcumin协同ABT-737能抑制肝癌细胞上皮间质转化,JNK-beta-catenin可能参与EMT转化的抑制。本研究结果为肝癌靶向EMT的治疗提供了一种新的方式。

