慢性乙型肝炎患者外周血CD8+CD25+FoxP3+调节性T细胞比例的变化及临床意义*
高夕雷,赵广春,张雷鸣,于建秀
1.江苏省盐城市滨海县第二人民医院传染科,江苏盐城 224500;2.江苏省盐城市滨海县人民医院检验科,江苏盐城 224500;3.江苏省盐城市滨海县人民医院传染科,江苏盐城 224500
慢性乙型肝炎病毒(HBV)感染是全球面临的严重公共卫生问题之一。据估计,在2.57亿慢性HBV感染者中,约30%患有慢性乙型肝炎(CHB)和存在病毒复制,部分患者可发生急性和慢性肝功能衰竭或发展为肝硬化和肝细胞癌[1]。CHB是HBV复制与宿主免疫系统相互作用的结果,CHB患者全身免疫耐受导致HBV持续慢性感染[2]。研究表明,CD8+CD25+FoxP3+调节性T细胞(Treg)是维持免疫抑制的核心细胞,可通过抑制机体抗病毒免疫应答参与疾病发生、发展过程[3-4],其在感染性疾病(如结核病和丙型肝炎等)、自身免疫性疾病(如系统性红斑狼疮和多发性硬化症等)和肿瘤等疾病的发生、发展过程中发挥重要作用[5],但CD8+CD25+FoxP3+Treg在HBV感染患者疾病进展中的作用尚不明确。本研究通过检测CHB患者外周血CD8+CD25+FoxP3+Treg比例,并分析其与血清细胞因子的相关性,以探讨其在CHB疾病进展中的作用。
1 资料与方法
1.1一般资料 选取2018年3-11月在滨海县第二人民医院传染科诊治的无症状HBV携带者28例为携带组,CHB患者28例为CHB组。同时选取28例年龄、性别匹配的健康体检者作为对照组。CHB的诊断参照《慢性乙型肝炎防治指南(2015更新版)》[6]。纳入标准:至少1年未接受过核苷酸类似物、干扰素或免疫调节药物的治疗。排除标准:急性乙型肝炎、其他肝炎病毒感染、人类免疫缺陷病毒感染、酒精性肝炎、脂肪肝、自身免疫性疾病或肿瘤。各组研究对象年龄、性别比较,差异无统计学意义(P>0.05)。见表1。

表1 各组一般资料比较
1.2仪器与试剂 异硫氰酸荧光素(FITC)鼠抗人-CD3单克隆抗体(mAb)、叶绿素蛋白偶联物(PerCP-cy5.5)鼠抗人-CD8 mAb、别藻青蛋白(APC)鼠抗人-CD25 mAb、藻红蛋白(PE)鼠抗人-叉头状转录因子P3(FoxP3) mAb及同型对照、红细胞裂解液及流式细胞仪均购自美国BD公司;血清细胞因子白细胞介素(IL)-10、IL-35和转化生长因子(TGF)-β1检测试剂盒购自美国Bio-Rad公司;cDNA反转录试剂盒及ABI 7300实时荧光定量PCR分析仪购自美国ABI公司;Trizol试剂购自美国Invitrogen公司;Ficoll-HyPaque分离液购自上海恒信试剂有限公司;AU2700全自动生化分析仪及配套试剂购自日本奥林巴斯公司;Luminex 200流式荧光检测仪购自美国Luminex公司。
1.3方法
1.3.1肝功能相关指标及HBV-DNA检测 采集3组研究对象外周血4 mL置于分离胶管,离心,收集上层血清用于检测。采用奥林巴斯AU2700全自动生化分析仪检测总胆红素(TBIL)、直接胆红素(DBIL)、丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)水平。采用ABI 7300实时荧光定量PCR分析仪检测HBV-DNA水平。
1.3.2外周血CD8+CD25+FoxP3+Treg比例检测 采用流式细胞仪进行检测。具体步骤如下,取肝素抗凝静脉血100 μL,加入 FITC鼠抗人-CD3 mAb、PerCP-cy5.5鼠抗人-CD8 mAb、APC-鼠抗人CD25 mAb及同型对照各10 μL,避光孵育30 min。加红细胞裂解液1 mL破坏红细胞,经磷酸盐缓冲液(PBS)洗涤,离心弃上清液。每管加入250 μL 1×Fix/Perm buffer涡旋约3 s,避光孵育40 min,加入300 μL 1×Perm/wash buffer洗涤,离心弃上清液。用100 μL Perm/wash buffer重悬细胞,加入10 μL PE鼠抗人-FoxP3 mAb,室温避光孵育40 min,洗涤离心,弃上清液。最后加入400 μL PBS重悬细胞,上机检测。以淋巴细胞设门,先分选CD3+CD8+T细胞,再分选CD8+CD25+T细胞,最终分析CD8+CD25+FoxP3+Treg占外周血淋巴细胞的比例。
1.3.3RNA提取及RT-PCR检测FoxP3 mRNA 采集3组研究对象外周血置于肝素钠抗凝管中,用等量Hank′s液稀释全血;取10 mL玻璃管3支,每管加3 mL比重为1.007的淋巴细胞分离液(Ficoll-HyPaque分离液),然后将稀释的全血6 mL慢慢加在分离液面上,液层界面不能打乱。2 000 r/min离心20 min,离心后液体分为3层,上中下层分别为血浆和Hank′s液、淋巴细胞分离液、粒细胞和红细胞,在上层与中层交界处,有1层白膜即为目标细胞。毛细吸管慢慢插入白膜层,轻轻抽吸外周血单个核细胞(PBMC),放入另一管中,再加10 mL Hank′s液,1 500 r/min离心10 min,离心3次,洗去抗凝物质、血小板和分离介质。用Trizol试剂提取总RNA。用cDNA反转录试剂盒进行cDNA合成,用QuantiTect SYBR Green PCR试剂盒进行扩增。引物序列:FoxP3上游引物5′-CACAACATGCGACCCCCTT TCACC-3′;,下游引物5′-AGGTTGTGGCGGATGGCGTTCTTC-3′;β-actin上游引物5′-TGGCACCCAGCACAATGAA-3′,下游引物5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。热循环条件:95 ℃ 15 min,95 ℃ 15 s,40个循环,72 ℃ 30 s。根据2-ΔΔCt法计算标本中FoxP3 mRNA相对表达水平。
1.3.4血清细胞因子水平检测 采用Luminex液相芯片检测血清细胞因子水平。采集研究对象外周血3 mL,1 500 r/min离心5 min,收集血清,储存于-80 ℃冰箱,避免反复冻融。按试剂盒说明书检测IL-10、IL-35和TGF-β1水平,每份标本检测两次,结果取均值。

2 结 果
2.13组肝功能相关指标及HBV-DNA水平比较 CHB组ALT、AST、TBIL、DBIL水平均高于携带组与对照组,HBV-DNA水平高于携带组,差异均有统计学意义(P<0.05)。见表2。

表2 3组肝功能相关指标及HBV-DNA水平比较
2.23组外周血CD8+CD25+FoxP3+Treg比例及PBMC中FoxP3 mRNA水平比较 与对照组相比,携带组、CHB组外周血CD8+CD25+FoxP3+Treg比例及PBMC中 FoxP3 mRNA水平均明显升高,且CHB组均高于携带组,差异有统计学意义(P<0.05)。见表3。

表3 3组外周血CD8+CD25+FoxP3+Treg比例及PBMC中FoxP3 mRNA水平比较
2.3CHB患者外周血CD8+CD25+FoxP3+Treg比例与PBMC中FoxP3 mRNA水平的相关性 CHB患者外周血CD8+CD25+FoxP3+Treg比例与PBMC中FoxP3 mRNA水平呈正相关(r=0.568,P<0.05)。见图1。
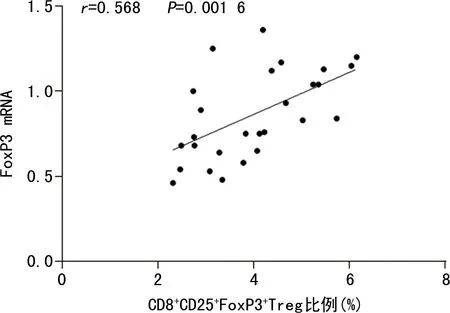
图1 CHB患者外周血CD8+CD25+FoxP3+Treg比例与PBMC中FoxP3 mRNA水平的相关性分析
2.43组血清细胞因子水平比较 与对照组相比,CHB组和携带组血清IL-10、TGF-β1和IL-35水平明显升高,且CHB组高于携带组,差异有统计学意义(P<0.05)。见表4。

表4 3组血清细胞因子水平比较
2.5CHB患者外周血CD8+CD25+FoxP3+Treg比例与血清细胞因子水平的相关性 CHB患者外周血CD8+CD25+FoxP3+Treg比例与血清IL-10、TGF-β1及IL-35水平均呈正相关(r=0.537、0.377、0.484,P<0.05)。见图2。
2.6CHB患者外周血CD8+CD25+FoxP3+Treg比例与肝功能相关指标及HBV-DNA水平的相关性 CHB患者外周血CD8+CD25+FoxP3+Treg比例与TBIL、HBV-DNA、ALT水平呈正相关(r=0.536、0.570、0.443,P<0.05);与DBIL、AST水平无相关性(r=0.302、0.343,P>0.05)。见图3。

注:A为外周血CD8+CD25+FoxP3+Treg比例与血清IL-10水平的相关性分析;B为外周血CD8+CD25+FoxP3+Treg比例与血清TGF-β1水平的相关性分析;C为外周血CD8+CD25+FoxP3+Treg比例与血清IL-35水平的相关性分析。
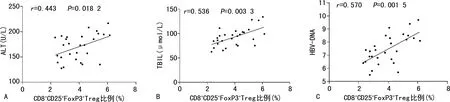
注:A为外周血CD8+CD25+FoxP3+Treg比例与ALT水平的相关性分析;B为外周血CD8+CD25+FoxP3+Treg比例与TBIL水平的相关性分析;C为外周血CD8+CD25+FoxP3+Treg比例与HBV-DNA水平的相关性分析;HBV-DNA水平为实际值取log10。
3 讨 论
HBV感染慢性化的机制主要与机体免疫应答能力低下有关,抑制性T细胞受体、免疫调节细胞和细胞因子等多种免疫抑制因子参与CHB患者的免疫应答降低,另一方面,抗病毒T细胞缺失或凋亡导致机体抗病毒免疫功能下降[1]。T细胞根据功能和表面标志物不同可分为Treg、细胞毒性T细胞和辅助性T细胞等,其中Treg属于免疫调节细胞,可以通过抑制树突状细胞和自然杀伤细胞(NK细胞)等多种免疫细胞的增殖和功能来调节免疫反应[7]。Treg根据表面标志物不同分为CD4+Treg和CD8+Treg两种主要细胞亚型,两者有相似的免疫抑制功能。较多研究证实CHB患者CD4+Treg明显增多[1-2,8],导致患者体内形成免疫抑制微环境,从而参与CHB的免疫耐受过程。
CD8+CD25+FoxP3+Treg可降低机体对病原体的免疫应答能力,从而防止机体因对病原体产生免疫应答而引起组织损伤,同时,这也导致了病原体的免疫逃逸。结核分枝杆菌感染患者外周血CD8+CD25+FoxP3+Treg在结核分枝杆菌增殖过程中处于较高水平,能够抑制辅助性T细胞的增殖[9]。本研究发现,CHB患者外周血CD8+CD25+FoxP3+Treg比例明显升高。FoxP3是Treg的关键转录因子,FoxP3表达对Treg发育和功能的发挥起着关键作用。本研究发现,CHB组患者PBMC中FoxP3 mRNA水平明显升高,且与外周血CD8+CD25+FoxP3+Treg比例呈正相关(r=0.568,P<0.05)。此外,CHB患者外周血CD8+CD25+FoxP3+Treg比例与TBIL、HBV-DNA、ALT水平也呈正相关(r=0.536、0.570、0.443,P<0.05)。
CD8+CD25+FoxP3+Treg可通过释放可溶性细胞因子发挥免疫抑制作用[5,10]。TGF-β1是一种多功能细胞因子,可抑制免疫细胞的增殖、分化和激活,在调节病毒复制和宿主对病原体的反应中起双重作用。TGF-β1通过刺激Treg的分化诱导针对HBV抗原的免疫耐受,在肝癌和肝硬化发生、发展中发挥重要作用。有研究表明,TGF-β1可以通过调节肝细胞中微小RNA的表达改变肝细胞功能,并下调NK细胞中NKG2D/DAP10和2B4/SAP的表达,从而介导HBV持续感染[11]。本研究也发现,CHB组血清TGF-β1水平明显高于携带组与对照组,且与外周血CD8+CD25+FoxP3+Treg比例呈正相关(r=0.377,P<0.05)。IL-35是一种新发现的细胞因子,属于IL-12家族,是Treg分泌的主要效应细胞因子之一,具有诱导免疫耐受的作用。在病毒感染性疾病中,如甲型流感病毒感染可导致PBMC中IL-35的表达增加[12]。IL-35在慢性丙型肝炎病毒感染中具有免疫抑制作用,在维持病毒持续性感染和抑制炎性反应方面发挥着相反的作用[13]。本研究发现,与对照组相比,CHB组血清IL-35水平明显升高,与ZHOU等[14]的研究结果一致。此外,本研究还发现血清IL-35水平与外周血CD8+CD25+FoxP3+Treg比例呈正相关(r=0.484,P<0.05)。IL-10是重要的免疫调节细胞因子,具有抑制免疫应答的能力,对肝脏疾病的预后有重要影响[15]。研究表明,IL-10参与HBV感染的免疫耐受过程,导致机体对HBV的免疫应答能力降低[16]。IL-10通过抑制宿主的抗HBV活性,使HBV在体内持续复制和表达。IL-10水平的升高与HBV表达水平和肝脏炎症程度相关[17]。本研究发现,CHB组血清IL-10水平明显高于携带组及对照组,并与外周血CD8+CD25+FoxP3+Treg比例呈正相关(r=0.537,P<0.05)。
综上所述,CHB患者外周血CD8+CD25+FoxP3+Treg比例升高,并与HBV感染过程中Treg相关免疫抑制细胞因子(IL-10、TGF-β1、IL-35)、肝功能相关指标(TIBL、ALT)及HBV-DNA呈正相关。外周血CD8+CD25+FoxP3+Treg可能通过抑制机体对HBV的特异性免疫应答,造成机体的免疫反应低下,从而导致HBV感染的持续存在。因此,调控CHB患者外周血CD8+CD25+FoxP3+Treg比例,可能是防治乙型肝炎慢性化的新途径。

