骆驼刺化学成分及药理活性研究进展
贾月梅,石明辉,夏提古丽·阿不利孜,贾晓光,潘 兰
(1.新疆维吾尔自治区市场监督审核评价中心,新疆乌鲁木齐830011;2.新疆维吾尔自治区中药民族药研究所,新疆乌鲁木齐830002;3.新疆医科大学中医学院,新疆乌鲁木齐830017)
骆驼刺(AlhagisparsifoliaShap.)为豆科骆驼刺属AlhagiGagneb半灌木植物,该属植物约5种,主要生长于干旱半干旱区域,分布在我国西北、土库曼斯坦、巴基斯坦、乌兹别克斯坦等地[1-3],常见于内蒙古、甘肃、青海和新疆等地荒漠地区的沙地、河岸、农田边。骆驼刺由于具有发达的根系,优良的再生能力和抗逆性,因此常作为防风固沙物种[4]。骆驼刺的花期较长,是新疆荒漠区优良的野生蜜源[5];同时花期粗蛋白含量高达12.56%,是骆驼的优质食物之一[6];骆驼刺的种子中亚油酸含量丰富(67.99%)[7],可作为优良的保健资源。此外,它还具有重要的药用价值,根、花、茎、叶等部位均可入药,治疗腹痛腹胀、痢疾腹泻[8]。目前对该植物的研究主要涉及生态、化学、药理方面,文献查阅发现以往的综述对其化学成分和活性总结不全面具体,且近几年学者们在其化学成分和生物活性方面的研究有了新的突破[9-16]。本文对近几年该植物的化学成分及生物活性研究概况进行了综述,这将为骆驼刺在医药、保健食品等领域的进一步开发利用提供科学依据。
1 化学成分研究
目前,骆驼刺的化学成分研究主要集中于地上部分,对花、种子、茎的研究较少,未见对根的研究报道。从中分离得到的化学成分类型多样,有黄酮、生物碱、萜类、酚类等。
1.1 黄酮类化学成分
石磊岭等[17]对骆驼刺中总黄酮的提取方法进行了优化,发现不同产地的骆驼刺中总黄酮的含量不同,高达1.82%。目前研究者从该植物分离到的黄酮包括异黄酮、二氢黄酮、黄烷及其二聚体等类型,化合物有isorhamnetin(1)[10],isorhamnetin-3-Oglucoside(2)[12],isorhamnetin-3-O-rutinoside(3)[12-13],isorhamnetin-3-O-robinobioside(4)[14],quercetin(5)[10],quercetin-3-O-β-D-glucopyranoside(6)[13],quercetin-3-O-(2-β-D-xylopyranosylrutinoside(7)[13],typhaneoside(8)[13],quercetin-3-O-(2′′,6′′-diO-α-L-rhamnopyranosyl)-β-D-glucopyranoside(9)[13],rutin(10)[13],kaempferol(11)[10],kaempferol-3-O-D-galactopyranoside(12)[10],kaempferol-3-Oβ-D-glucopyranoside(13)[10],kaempferol 3-O-β-Drutinoside(14)[10],kaempferol-7-O-β-D-glucopyran‑oside(15)[10],3′,7-dihydroxyl-4′,8-dimethoxyliso‑flavone(16)[13],formonoetin(17)[13],3′,7-dihydroxyl-4-methoxylisoflavone(18)[13],3′,4′,7-trihydroxyli‑soflavone(19)[13],3′,7-dihydroxyl-4′,6-dimethoxyli‑soflavone(20)[13],butin(21)[9],4′-O-methylorobol(22)[14],genistein(23)[10],genistin(24)[10],syringetin(25)[10],(-)-epicatechin(26),(-)-epigallocatechin(27)[11],(-)-epigallocatechin gallate(28)[11],(+)-catechin(29)[11],(+)-gallocatechin(30)[11],proantho‑cyanidin B-2(31)[11],(-)-epigallocatechin-(4β-8)-(-)-epicatechin(32)[11],epigallocatechin gallate-(4β-8)-(-)-epicatechin(33)[11],proanthocyanidin B-1(34)[11],(-)-epicatechin-(4β-8)-gallocatechin(35)[11]。各化学成分结构见图1。
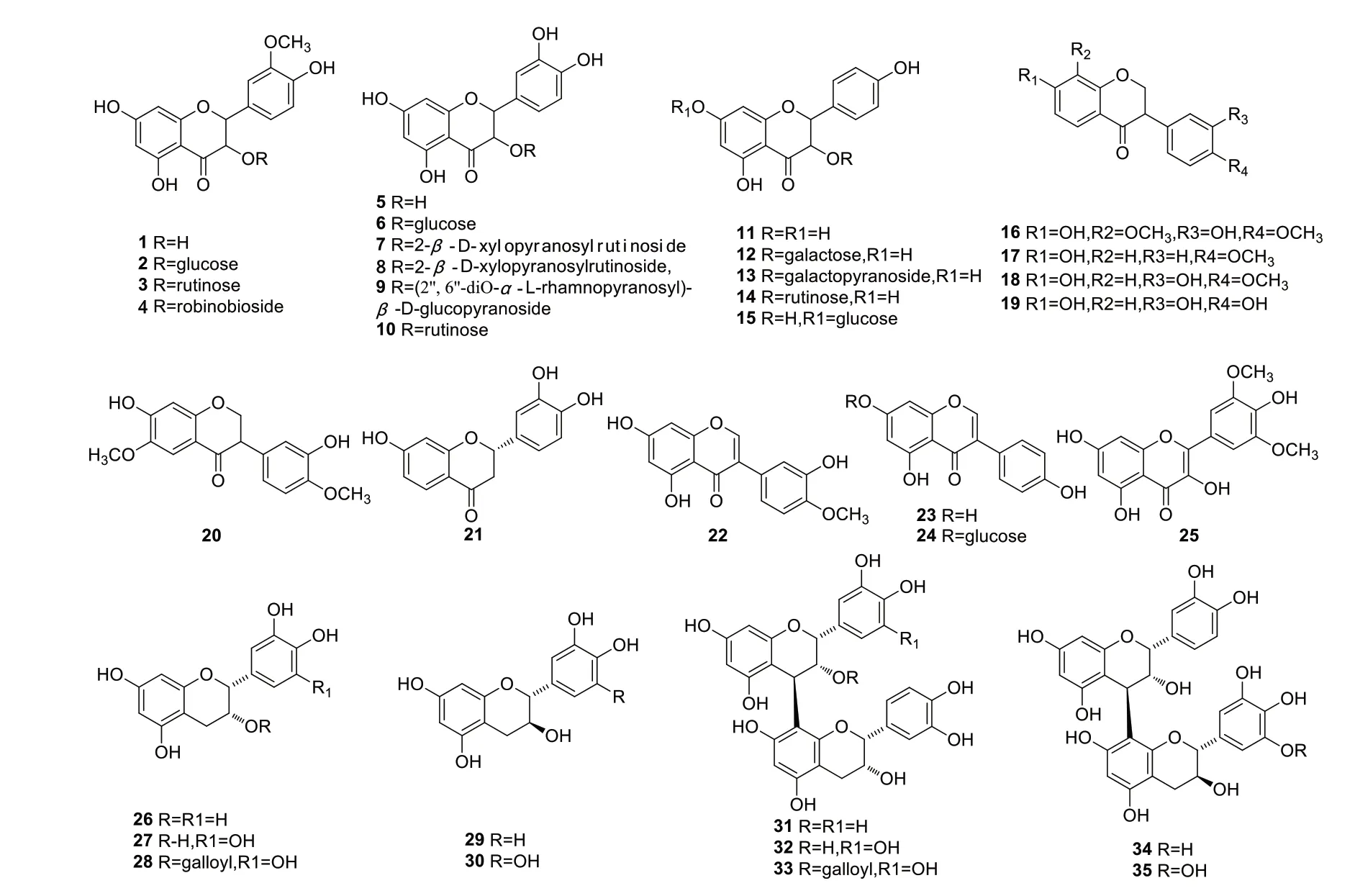
图1 骆驼刺中黄酮类化合物结构式Fig.1 Structures of flavonoids in A.sparsifolia
此外,赛那瓦尔·芒思尔[18]采用95%乙醇回流提取,硅胶柱层析,凝胶柱Sephadex LH-20以及高效液相制备等方法从骆驼刺中制备了对照品异鼠李素-3-O-β-D芸香糖苷。陈良等[19]对不同产地的骆驼刺的不同部位中芦丁含量进行了测定,发现根中的含量最低(约10μg·g-1),地上部分的含量最高,为根部的100倍左右,且不同产地的样品含量差异较小。
1.2 木脂素类化学成分
Zhou等[13]和欧阳芬等[14]从新疆产的骆驼刺地上部分和茎的乙醇提取物中,分离得到了7个木脂素,为syringgaresinol(36)[13],(+)tortoside A(37)[13],(-)tortoside A(38)[13],pinoresinol(39)[13-14],pin‑oresinol-4-O-β-D-glucopyranoside(40)[13-14],bomba‑sinol A(41)[13],liriodendrin(42)[13]。各化学成分结构见图2。
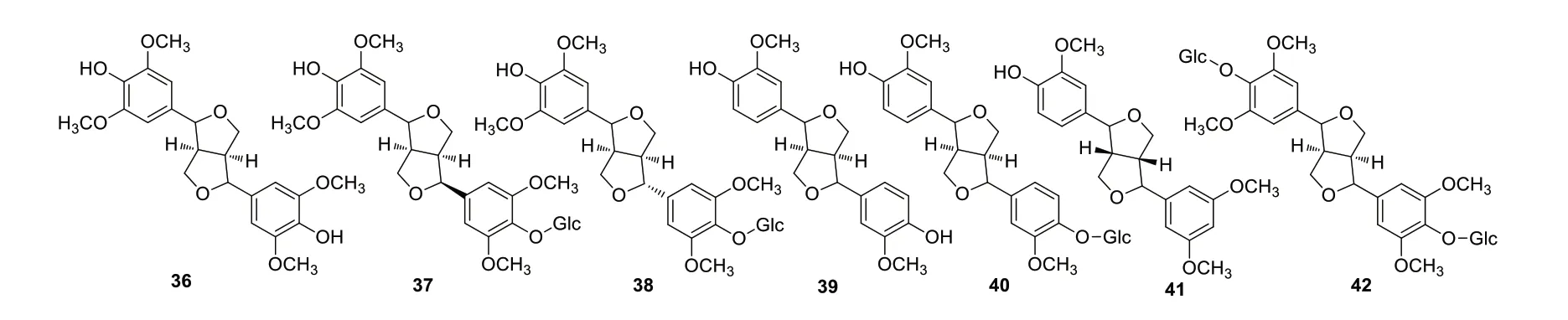
图2 骆驼刺中木脂素类化合物结构式Fig.2 Structures of lignans in A.sparsifolia
1.3 生物碱类化学成分
Zou等[15]从骆驼刺中发现了一种新的生物碱al‑hagifoline A(43),并利用高分辨质谱HR-ESI-MS,一维核磁1H-NMR、13C-NMR,二维核磁1H-1H CO‑SY、HSQC、HMBC等现代技术手段确定了其结构,同时pyrrolezanthine(44)和pyrrolezanthine-6-methyl ether(45)也首次从中被发现。
Zhou等[13]从骆驼刺的地上部分还得到了生物碱 类 化 合 物aurantiamide(46),aurantiamide ace‑tate(47)。

图3 骆驼刺中生物碱类化合物结构式Fig.3 Structures of alkaloids in A.sparsifolia
1.4 有机酸类化学成分
有机酸类也是骆驼刺重要的化学成分之一,目前从中分离鉴定的有gentisic acid(48),nicotinic acid(49)[14],abscisic acid(50)[13],gallic acid(51),isova‑nillic acid(52),p-hydroxybenzoic acid(53)[14],me‑thoxyphenyl acetic acid(54)[13],ferulic acid(55)[14],它们的结构见图4。
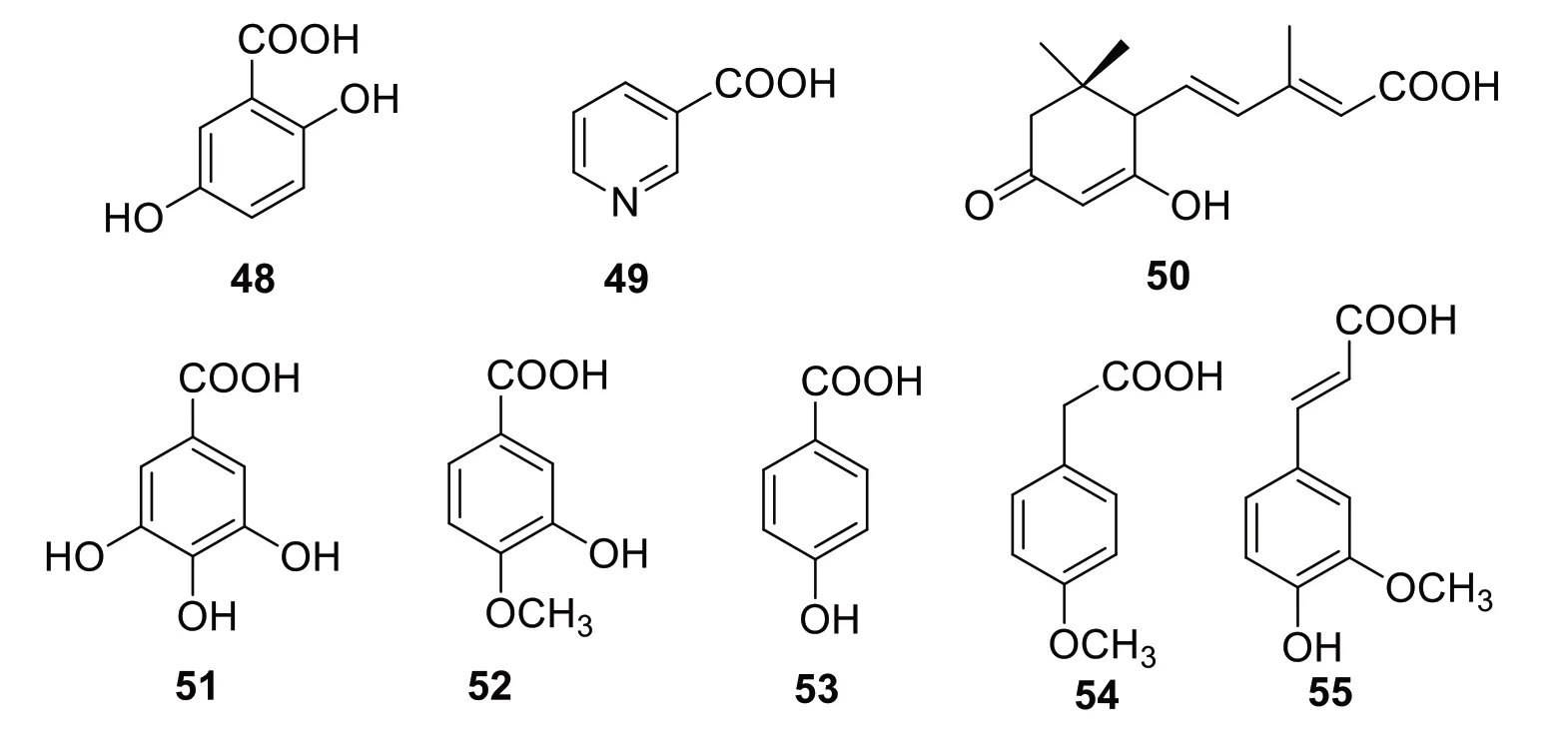
图4 骆驼刺中有机酸类化合物结构式Fig.4 Structures of organic acids in A.sparsifolia
1.5 其他化学成分
研究者还从骆驼刺中分离得到了萜类、醛类等成分(图5)。2018年欧阳芬等[14]从骆驼刺茎的提取物中分离得到了4个萜类化合物,(3S,5R,6R,7E,9S)-megastigman-7-ene-3,5,6,9-tetrol3-O-β-Dglucopyranoside(56),(3S,5R,6R,7E,9S)-megastig‑man-7-ene-3,5,6,9-tetrol 9-O-β-D-glucopyrano‑side(57),(1R)-4-(3R)-3-hydroxybutyl]-3,5,5-trimethylcyclohex-3-enyl-O-β-D-glucopyranoside(58)、(1R)-3-[(4R)-4-hydroxybutyl]-2,6,6-tri‑methylcyclohex-1-methy-propyl-O-β-D-glucopy‑ranoside(59);以及苯乙醇类化合物2-(2-hydroxy‑phenyl)ethanol-O-β-D-glucopyranoside(60)。此外,还从中分离得到了9个其他类化合物:4,6-dihy‑droxy-2-O-β-D- glucopyranosyl acetophenone(61)[14],methyl-α-D-fructofuranoside(62)[14]、proto‑catechualdehyde(63)[13-14],4-ethenyl-3-methoxyphe‑nol(64)[13],p-hydroxybenzaldehyde(65)[14],vanillin(66)[14],blumenol A(67)[13],3-hydroxyl-4-methoxy‑benzyl alcohol(68)[13],1,3,3,4-tetramethyl-cyclo‑pentene(69)[13]。

图5 骆驼刺中其他化学成分结构式Fig.5 Structures of other compoundsin A.sparsifolia
2 生物活性研究
2.1 抗肿瘤
马晓玲等[16](2015年)用乙醇对骆驼刺进行了提取,并采用大孔树脂进行纯化得到骆驼刺提取物,同时在体内和体外水平研究了骆驼刺提取物对肿瘤细胞的作用。结果表明,当给予骆驼刺提取物400 mg·kg-1时,小鼠CT26结肠癌体内的肿瘤重量降低;荷瘤小鼠体内的IL-2水平升高;同时体外活性测试表明,样品对HepG2,HT-29,BGC-823,Eca-109这几种肿瘤细胞的增殖均有抑制作用。
马晓玲等[20]制备了骆驼刺的不同极性部位,并从中获得了部分单体化合物,并将这些极性部位和单体化合物进行了人宫颈癌Hela细胞的增殖测试,结果发现骆驼刺的乙酸乙酯部位(IC50=20.0μg·mL-1)和正丁醇部位(IC50=16.9μg·mL-1)在P<0.01水平上均具有较强的抑制作用,抑制效果与给药浓度密切相关;同时化合物紫铆素、原儿茶醛、torto‑side A、4-乙烯基-3-甲氧基苯酚对人宫颈癌Hela细胞的增殖表现出明显的抑制作用,IC50分别为44.7,23.1,91.2,41.2μg·mL-1。刘雪松等[21](2019年)考察了5-氟尿嘧分别与紫铆素、原儿茶醛联合用药对人宫颈癌Hela细胞增殖的影响,联合用药后人宫颈癌Hela细胞增殖抑制效果相加或增强,为协同增效。马晓玲等[22]还进一步研究了骆驼刺的极性部位及获得的单体化合物对肿瘤细胞HT-29、HepG2、BGC-823、KB等的影响。结果表明,化合物4-乙烯基-3-甲氧基苯酚、tortoside A、紫铆素、原儿茶醛、以及1,3,3,4-四甲基-环戊烯对这些细胞的增殖均具有抑制作用。
2.2 抗炎
Zhou等[13]采用LPS诱导的N9小胶质细胞模型进行了骆驼刺对神经炎症的影响,发现骆驼刺的乙酸乙酯部位和正丁醇部位能抑制小胶质细胞NO的生成。与阳性药米诺环素相比,黄酮类化合物isorh‑amnetin、quercetin、3′,7-dihydroxyl-4′-methoxyliso‑flavone、3′,7-dihydroxyl-4′,6-dimethoxylisoflavone,木脂素类化合物syringgaresinol和bombasinol A,生物碱类化合物aurantiamide,以及醇酮类化合物1,3,3,4-tetramethylcyclopenten均能显著抑制小胶质细胞NO的生成,并呈剂量依赖性,且抗神经炎症效果较阳性药更优,说明骆驼刺对抗神经炎症是多种成分协同作用的结果。
2.3 改善腹泻型肠易激综合征
马晓玲等[23]和刘雪松等[24]研究了骆驼刺70%乙醇提取物对腹泻型肠易激综合征(IBS-D)的效果并初步阐明了其作用机制。研究采用束缚应激刺激与高乳糖饮食建立的腹泻型肠应激综合征模型,测定了大鼠腹壁肌电活动情况、血清中NO的含量,以及血浆中胃肠激素血管活性肠肽(VIP)、5-羟色胺(5-HT)、P物质(SP)和胃动素(MTL)的水平。与模型组相比,给药后大鼠腹部收缩反射的容量阈值明显增加,腹壁肌电活动显著降低,血浆中的VIP、5-HT、SP、MTL在P<0.05水平显著降低,说明骆驼刺提取物可能通过降低血清中的NO含量以及血浆中的VIP、5-HT、SP、MTL含量,来改善IBS-D大鼠的胃肠运动和内脏敏感性而达到治疗腹泻的作用。
2.4 双重调节小肠运动
米克热木·沙衣布扎提等[25]研究了骆驼刺水提物对小鼠小肠运动的影响,发现骆驼刺水提物不仅能促进小鼠小肠,也能拮抗阿托品对小肠运动的抑制,即骆驼刺对便秘和腹泻有双重影响。
3 结论和讨论
骆驼刺化学成分及药理活性研究进展总结表明,其化学成分类型丰富,主要有黄酮、木脂素、有机酸、生物碱、萜类等。现代药理研究表明,骆驼刺在抗肿瘤、抗炎、改善腹泻型肠应激综合征、双向调节小肠推进方面具有较好的作用。但目前对骆驼刺研究尚不深入,开发利用也不充分,后期可加强其在保健食品、药理药效、化学、质量评价等方面的研究,以丰富骆驼刺的研究资料库,为该资源的开发利用提供理论支撑。在国外,骆驼刺属的多种植物均有药用历史的记载,而我国只有骆驼刺分泌的糖(刺糖)作为维吾尔族传统用药载入了《中华本草》(维吾尔药卷)[26],其性甘、酸、温,可涩肠,止痛;而茎、叶、花常作为民间药使用,或单独使用,亦或作为复方用药,内服外用均可[8]。虽然骆驼刺在民间应用较多,但现代的药理研究却比较薄弱,多集中于药效学的研究,深层次的作用机制未有涉及,有待于进一步研究和阐释。
骆驼刺的种子不仅蛋白质含量丰富[6],且不饱和脂肪酸的含量也很高[7],而不饱和脂肪酸是人体不可缺少的脂肪酸,能保持细胞膜的相对流动性,保证细胞的正常生理功能;降低血液粘稠度,改善血液微循环;提高脑细胞的活性,增强记忆力和思维能力等,当人体缺乏时易发生心血管疾病,诱发老年痴呆等[27]。因此,骆驼刺种子可作为人体不饱和脂肪酸膳食来源的潜在资源。
综上,骆驼刺的化学成分类型丰富,主要有黄酮、木脂素、有机酸、生物碱、萜类等。现代药理研究表明,骆驼刺在抗肿瘤、抗炎、改善腹泻型肠应激综合征、双向调节小肠推进方面具有较好的作用。但目前对骆驼刺研究尚不深入,开发利用也不充分,后期可加强其在保健食品、药理药效、化学、质量评价等方面的研究,以丰富骆驼刺的研究资料库,为该资源的开发利用提供理论支撑。

